转AtNHX1基因马铃薯田间盐胁迫下的生理反应及耐盐性的综合评价
2017-07-19李丽霞刘玉汇张俊莲
李丽霞,刘玉汇,王 丽,余 斌,张俊莲,王 蒂,3
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃农业大学园艺学院/甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院, 甘肃 兰州 730070; 3.甘肃农业大学农学院, 甘肃 兰州 730070)
转AtNHX1基因马铃薯田间盐胁迫下的生理反应及耐盐性的综合评价
李丽霞1,刘玉汇1,王 丽2,余 斌1,张俊莲1,王 蒂1,3
(1.甘肃省作物遗传改良与种质创新重点实验室/甘肃农业大学园艺学院/甘肃省干旱生境作物学重点实验室, 甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院, 甘肃 兰州 730070; 3.甘肃农业大学农学院, 甘肃 兰州 730070)
以转AtNHX1基因的8个马铃薯株系(1、2、4、6、8、15、18、19)和未转基因的“甘农薯2号”(CK)为材料,在正常地以及全盐含量分别为0.56%、0.29%的高盐和中盐地上种植,分析其生长和生理指标的变化,通过隶属函数法、相关分析和聚类分析等方法综合评价耐盐性。结果表明:随着盐浓度的增加,转基因株系的株高、叶面积扩展率、单株产量、叶绿素的含量、超氧化物歧化酶(SOD)活性以及脯氨酸含量的上升幅度均高于对照植株(为对照的1.17~3.96倍)。而丙二醛(MDA)、相对电导率显著低于对照植株,为对照的63.07%~78.4%和82.7%~86.35%。根据生长和生理指标综合评价各株系的耐盐性,筛选出1个强耐盐株系和3个较强耐盐株系,各株系耐盐性由强至弱为:19>15>8>4>18>2>1>6>CK,AtNHX1的导入显著提高了大田马铃薯植株的耐盐性,利用耐盐性综合评价方法有助于耐盐株系的筛选。
马铃薯;AtNHX1基因;盐胁迫;生理参数;耐盐性评价
土壤盐碱化是一个世界性的问题,是影响植物生长发育的主要原因之一。马铃薯(Solanumtuberosum)作为四大粮食作物之一,属于盐敏感型作物,其在盐渍化土地上生长发育受阻。我国是马铃薯生产大国,种植面积和产量均占世界的23%~28%,均居世界第1位[1]。盐胁迫下作物吸水困难,使细胞组织的水分外渗,种子萌发和幼苗的生长受到抑制;由于作物体内水分亏缺,进而光合作用下降,能耗增加,衰老加速,生长量降低,更为严重者导致植株死亡[2]。随着分子生物学与基因工程技术的日趋成熟和迅猛发展,通过基因工程手段改良作物的耐盐性已被广泛关注和重视。
拟南芥AtNHX1基因是克隆得到的第一批植物Na+/H+逆向转运蛋白基因之一,其具有将Na+区隔化于液泡的功能,起到细胞质Na+解毒、调节渗透压和平衡离子的作用[3]。研究表明将AtNHX1基因转化至番茄[4],小麦[5]、棉花[6]、大豆[7]等农作物以及杨树[8]等乔木,可显著增强转基因植株在盐逆境胁迫下的抗盐能力。在转AtNHX1马铃薯的耐盐性研究中,王丽[9]运用农杆菌介导法成功地将AtNHX1导入马铃薯,证明AtNHX1基因整合到马铃薯的基因组中并进行转录,之后崔炎森[10]对8个转AtNHX1株系进行了盆栽耐盐性鉴定,发现转基因植株的耐盐性显著强于对照。许多研究从马铃薯生长指标如株高、叶面积、块茎产量以及叶绿素、脯氨酸、丙二醛等生理指标作为鉴定评价马铃薯耐盐性,但是单项指标难以全面、准确地评价耐盐性,尤其对于如何综合评价田间马铃薯耐盐性尚未见报道。本研究以大田种植的转AtNHX1基因马铃薯和未转基因马铃薯为材料,将相关生长与生理指标通过隶属函数法、相关性分析法、聚类分析法来综合评价耐盐性,以期为马铃薯的改良及耐盐性的综合评价提供依据。
1 材料与方法
1.1 实验材料
供试材料为马铃薯栽培品种“甘农薯2号”(CK)和以该品种为受体材料的转AtNHX1基因的8个株系,其编号为1、2、4、6、8、15、18、19。
1.2 试验处理
1.2.1 土样分析 以甘肃省景泰县条山农场的盐碱地作为试验田。试验区采用五点法取土样(0~20 cm深)。土壤pH值和全盐量由甘肃省农科院测试分析室采用pHS-25型酸度计和DDS-12A数显电导率仪进行测定。测定结果:高盐地、中盐地、正常地全盐量分别为0.56%、0.29%、0.17%;pH值分别为8.52、8.32、8.08。
1.2.2 种植方法 大小一致(约40~50 g)的健康转基因植株和对照植株的薯块,随机播种于高盐、中盐和正常地的试验区中,每个株系在各试验区内种植120株,重复3次。栽培管理措施遵循当地管理方法。
1.3 指标的测定及其方法
植株生长至50 d时测定其株高、叶面积、叶绿素、相对电导率、丙二醛(MDA)、超氧化物歧化酶(SOD)、脯氨酸。生长90 d后测定单株产量。
1.3.1 生长指标测定 每处理选取10株测定植株高度;叶面积利用方格法,叶面积扩展率=叶面积/天数(d);单株产量采用称重法。
1.3.2 生理生化指标测定 叶绿素含量采用丙酮乙醇混合提取法[11],脯氨酸含量测定采用茚三酮比色法[12-13];相对电导率采用电导法,丙二醛(MDA)含量测定采用硫代巴比妥酸法以及超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法[12]。
1.4 数据处理及分析
所得数据采用Microsoft Excel 和SPSS13.0软件进行统计分析。
利用如下公式分别计算单项指标耐盐系数、综合耐盐系数、耐盐指数、隶属函数值、耐盐性量度值:
单项指标耐盐系数PI=(不同浓度处理下的平均测定值/对照测定值)
(1)
综合耐盐系数
(2)
耐盐指数
(3)
隶属函数值
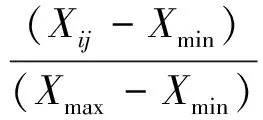
(4)
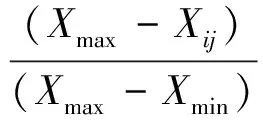
(5)
标准差系数

(6)
权重系数

(7)
耐盐性量度值
(8)
2 结果与分析
2.1 盐胁迫对马铃薯株系生长特性的影响
盐胁迫下马铃薯株系生长受到抑制(图1A)。随着盐浓度的升高,转基因植株和CK植株株高均呈下降趋势,但转基因植株下降程度较小。正常条件下,转基因株系株高较对照平均升高了19.83%,其中15、18和19号株系与对照间差异显著(P<0.05)。中盐条件下,1、4、6、15和19号转基因株系株高均显著(P<0.05)高于CK。高盐胁迫下转基因株系平均株高为CK的1.5倍,除1号、6号和15号转基因株系,其它株系均与CK呈显著差异(P<0.05)。

图1 盐胁迫下生长指标的变化
盐胁迫下马铃薯各株系叶面积扩展率也随着盐浓度的升高而降低(图1B)。在同一盐胁迫下,大部分转基因株系与CK间的差异显著(P<0.05)。中盐条件下,转基因株系较正常处理平均下降了19%,但其叶面积平均扩展率(除1和6号株系外)是CK的2.55倍,差异达到极显著(P<0.01)水平。高盐胁迫时,转基因植株的叶面积扩展率是CK的1.75~3.73倍。
盐胁迫对单株产量影响较大(图1C)。正常条件和中盐胁迫条件下,转基因植株单株平均产量均显著(P<0.05)高于CK,较CK分别提高了39.28%~79.77%和61.97%~103.58%,高盐胁迫下,平均产量较CK提高了48.24%~254.67%,其中2、4、15和19号株系单株产量较CK显著增加2.17%、1.83%、1.48%和2.55%(P<0.05)。
2.2 盐胁迫对马铃薯株系生理指标的影响
随盐浓度的增加,对照和转基因株系中叶绿素含量均明显降低,但转基因株系下降幅度明显小于对照(图2A)。正常地中,转AtNHX1植株的叶绿素含量显著高于CK(P<0.05);中盐胁迫下,转基因株系叶绿素含量较CK高35.59%~75.57%,其中19号株系的叶绿素含量是CK的1.76倍(P<0.05);高盐胁迫下,对照植株的叶绿素含量由1.35 mg·g-1下降至0.99 mg·g-1,下降幅度达34.71%,而转基因株系较未胁迫时平均下降了11.71%,其中4、18和19号株系叶绿素含量为1.69 mg·g-1、1.57 mg·g-1和1.66 mg·g-1,分别是对照的1.68倍、1.57倍和1.66倍,说明外源AtNHX1基因的导入,减弱了对叶绿素含量的影响,其中株系4,18和19的耐盐性强。
盐胁迫下脯氨酸含量随着盐浓度的升高而升高(图2B)。正常地中转基因植株脯氨酸含量较CK低12.61%~52.7%,中盐条件下各株系脯氨酸含量均显著(P<0.05)增高,但各株系间差异不显著;高盐胁迫下,对照脯氨酸含量为转基因株系的1.14~1.49倍,且高盐下的脯氨酸含量均显著高于中盐下的处理。尽管转基因株系脯氨酸含量低于对照,但较正常处理下,中盐和高盐胁迫下转基因株系脯氨酸含量的上升幅度分别为66.28%~214.3%和175.14%~288.49%,而对照植株脯氨酸的上升幅度为54.07%和173.4%,说明转基因植株在盐胁迫下脯氨酸积累快。
盐胁迫使马铃薯叶片细胞膜结构受到损伤,膜通透性增加,相对电导率增加。随着盐胁迫的程度加剧,不同马铃薯株系相对电导率增加的幅度差异较大。结果显示,转基因马铃薯细胞膜损伤程度较小,相对电导率增加的速率低于未转基因植株(图2C)。膜结构的损伤引起膜脂过氧化反应加剧,过氧化产物MDA积累。如图2D,马铃薯各株系中MDA含量随着盐浓度的升高积累量增多。在正常与中盐条件下,大部分转AtNHX1株系中MDA含量与CK达到显著性差异(P<0.05);高盐胁迫时,转基因株系和CK的MDA积累量较正常地分别增加了47.44%和15.80%,与CK呈显著性差异(P<0.05)。由图2E可知随盐浓度升高马铃薯植株的SOD活性均呈上升趋势。在同一处理下转AtNHX1植株内SOD活性均高于CK,中盐和高盐条件下转AtNHX1植株的SOD酶活性分别是CK的1.15~1.40倍和1.09~1.19倍。
2.3 转AtNHX1马铃薯的耐盐性评价
2.3.1 盐胁迫下马铃薯株系各指标的耐盐性分析 对照与8个转基因株系的单项指标耐盐系数如表1。结果显示,马铃薯株系间各项指标的耐盐系数变化趋势并不一致,如CK的丙二醛的耐盐系数最大,而转基因株系4号叶绿素的耐盐系数最高,18号SOD的耐盐系数最大。这种差异程度说明仅用单项指标难以准确地进行马铃薯耐盐性评价,运用多指标进行综合评价才更加科学合理,从而能够综合评价出耐盐性较强的株系。如表1所示,尽管单一指标下耐盐系数不同,但转基因株系的综合耐盐系数均高于CK,说明转AtNHX1株系的耐盐性强。
尽管单项指标难以真正地反映植株的耐盐性,但其在植株耐盐逆境生长中占据着重要作用。为了解各指标对耐盐性的敏感性,参照连续变数的次数分布统计方法,将测试各性状的耐盐系数以组距为0.25分成7个组区间,制作成次数分布表。由表2可看出,在同一组区间各性状的耐盐系数分布次数相差较大,如100%的叶面积扩展率和叶绿素含量的耐盐系数PI[0.75,1),88.9%的MDA和SOD耐盐旱系数PI[1,1.25),66.7%的脯氨酸的耐盐系数PI>2,说明各指标对盐胁迫的敏感程度不同,株高、单株产量、叶绿素以及脯氨酸含量等对盐胁迫非常敏感。
进一步以各指标的耐盐系数为依据,对其进行标准化处理,以欧式距离的平方为相似尺度,采用离差平方和法对数据进行聚类分析,结果如图3所示。根据聚类结果,可将马铃薯各株系的耐盐性分为5大类。第一类为转基因19号,耐盐性最强;第二类转基因株系8号、18号、15号耐盐性也较强;第三类为中等耐盐性转基因株系2号和6号;第四类是具有耐盐性弱的转基因株系1号和4号;第五类是未转基因株系CK,耐盐性差。由此可以看出,转基因株系间耐盐性强弱存在较大差异,但是转AtNHX1基因的8个株系的耐盐性均强于对照CK。

图2 盐胁迫下生理生化指标的变化
2.3.2 隶属函数和标准差系数赋予权重法分析马铃薯各株系的耐盐性 运用模糊数学隶属函数公式对各指标进行标准化处理,并且利用标准差系数赋予权重法对各指标赋予权重从而定量地比较株系间的耐盐能力。根据公式(3)~(8)计算相应的隶属函数值,耐盐性量度值,综合耐盐指数;根据耐盐指数与权重计算加权耐盐指数(表3)。可看出各株系综合评价指标的变化趋势并不一致,但19号转基因株系的各项指标都最高,CK最低,总体上转基因株系的各项值都高于对照CK,表明转基因株系的耐盐性强。表中的耐盐性量度值D代表了各株系的耐盐性,以其对各株系进行耐盐性排序,结果可知各株系耐盐性19>15>8>4>18>2>1>6>CK。这与聚类分析的结果存在差异,也许是各指标的权重不同所造成的。权重结果见表4。

表1 盐胁迫下综合评价指标的耐盐系数
注:**、*分别表示0.01和0.05水平差异显著性。
Notes: **, * indicate significant difference atP<0.01 andP<0.05 level, respectively.
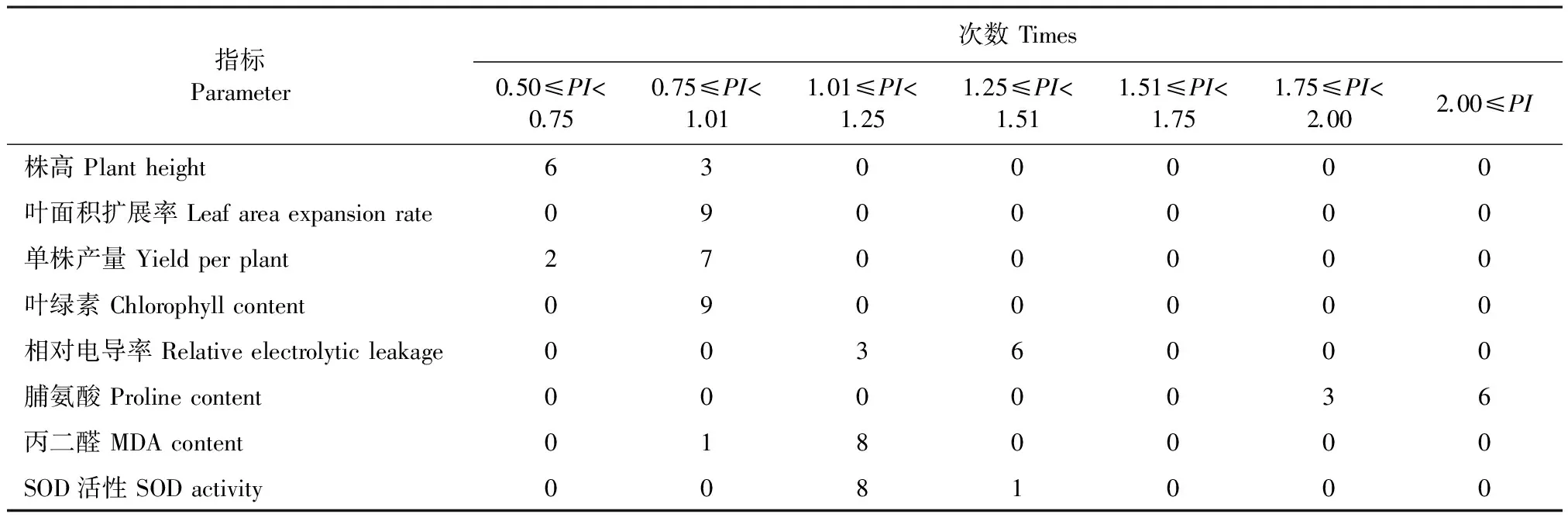
表2 供试材料各性状指标的耐盐系数在不同区间的分布
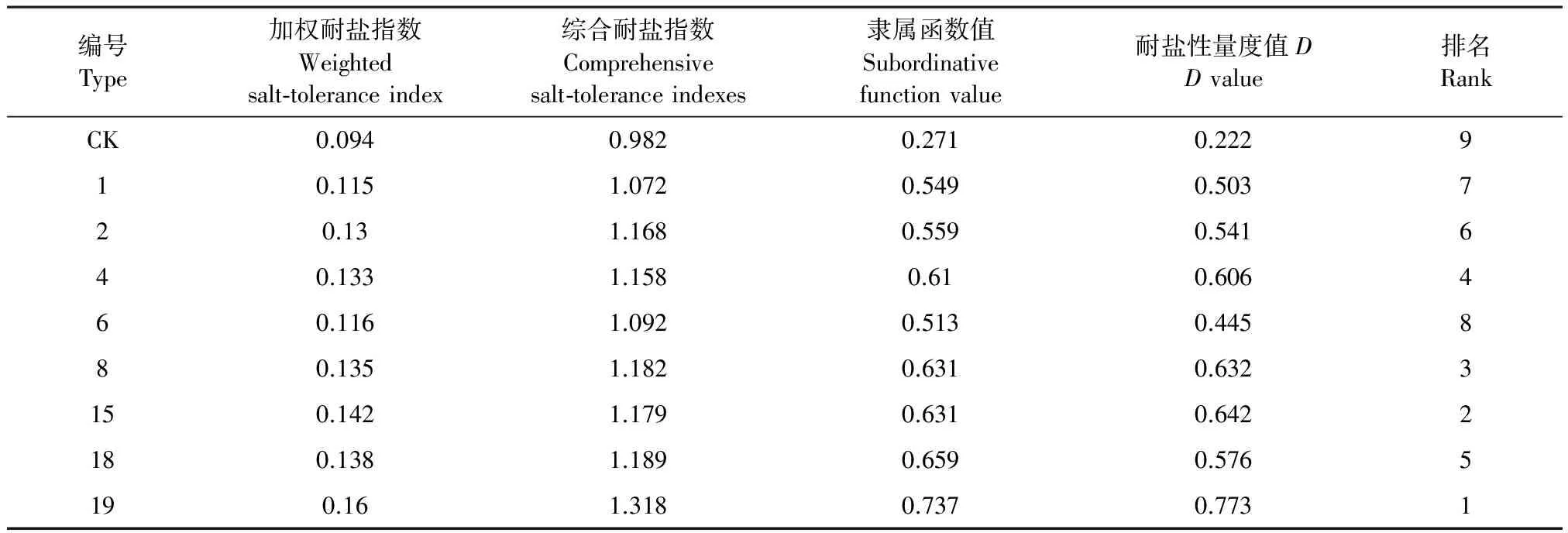
表3 耐盐性综合评价

图3 聚类分析
进一步对耐盐性量度值D和各指标的耐盐系数的隶属函数值进行相关分析。分析结果以及各指标的权重如表4所示。结果显示耐盐性量度值D与株高,叶面积扩展率、单株产量、叶绿素含量、相对电导率耐盐系数隶属函数值的相关性均达到极显著水平,与MDA、SOD间的在5%的水平上达到显著差异性。耐盐性量度值D既考虑各指标的重要性,又考虑了各指标间的相互关系,因此,用耐盐性量度值综合评价耐盐性较为全面和准确,可全面反映各株系的耐盐性。

表4 各指标隶属函数与耐盐性度量值D相关分析以及各指标的权重
3 讨 论
3.1 马铃薯耐盐性的评价指标
作物的抗逆性不仅是一个受多种因素影响的复杂的数量性状,且不同品种的抗逆机制也不尽相同,从而使不同品种在逆境条件下对某一具体指标的反应也不相同[14]。形态变化是植物受到逆境胁迫最直接的反映[15]。植株在盐胁迫下由于碳同化量减少、渗透调节能耗和维持生长能耗增加等原因,导致植株生长量减少[16]。本研究中,马铃薯各株系的株高、叶面积扩展率以及单株产量均随着盐胁迫程度的加剧而下降,转AtNHX1马铃薯株系的生长指标均高于未转基因CK株系。耐盐性综合分析中相关分析表明,株高、叶面积扩展率以及单株产量均与耐盐性的综合度量值D达到极显著相关性。
植物在盐胁迫下盐敏感性不同表现出不同的生理变化[17]。叶绿素作为绿色植物进行光合作用的主要色素,其含量的稳定有利于植株在胁迫下维持正常的光合作用,从而增强植株对盐胁迫的耐受能力[18]。本研究表明,马铃薯各株系中的叶绿素的含量随着盐浓度的增加而下降,但是转基因株系中的叶绿素含量普遍高于CK,因此在盐胁迫下转基因株系中叶绿素的合成没有受到抑制或抑制性较弱,其含量相对较稳定,进而使得转基因马铃薯株系耐盐性较强。脯氨酸在盐害条件下的积累起到了胞质渗透压调节剂的作用,保护膜与酶的结构,缓解盐胁迫压力[19-20]。周广生、李源等研究发现脯氨酸的积累量与植株耐盐性呈负相关[20-21],且李源等研究认为脯氨酸含量积累的高低不能反映植株的耐盐程度,而脯氨酸积累的快慢能体现其对盐胁迫的敏感程度,可作为植物耐盐性鉴定的评价指标[21]。本研究结果显示随盐浓度的增加,马铃薯各株系脯氨酸含量均上升,但是在中盐和高盐胁迫下,转基因株系中脯氨酸含量的上升幅度分别是对照植株脯氨酸积累幅度的1.23~3.96倍和1.17~1.66倍。说明盐胁迫下转基因株系细胞通过快速积累脯氨酸来调节细胞内的渗透势,维持水分平衡,保护细胞内代谢所需的酶活性,其耐盐性强于对照植株。
盐胁迫后,植物体内活性氧产生和清除的动态平衡被破坏,活性氧水平上升导致MDA大量积累,造成膜脂的过氧化和脱脂化作用,膜蛋白受损,细胞结构损伤[22-23]。SOD是活性氧清除反应过程中第一个发挥作用的抗氧化酶,在氧化酶类中处于核心地位[24]。而SOD作为植物内源自由基清除剂,是一种重要的抗氧化剂,在逆境中SOD酶活性增强或维持较高的水平,可清除活性氧自由基,维持细胞膜的稳定性和完整性,从而提高植物在逆境中生存能力[25]。且有学者认为在逆境条件下,植物的抗性与植物体内能否维持较高的SOD的水平有关,SOD水平的高低在一定程度上反映了植物耐逆本领的强弱[24,26]。夏民旋等[26-27]认为利用SOD与逆境胁迫的关系,对不同植物进行不同的逆境胁迫试验,可了解不同植物对逆境的反映,进一步对培育新品种以及农业生产提供参考。本研究表明盐胁迫下MDA的积累量、相对电导率以及SOD均随着盐浓度的增加而增加,其中在同一条件下转基因株系中MDA与相对电导率均低于CK,而SOD在转基因株系中显著高于未转基因植株。由此可知导入AtNHX1基因可维持细胞膜的稳定性,增强SOD活性,减弱膜脂过氧化,使马铃薯植株维持正常的生长代谢状态。
3.2 马铃薯耐盐性评价方法
植物的耐盐生理过程复杂,对任何单项机理的研究都不能全面、准确地评价植物耐盐性[28]。本研究结果显示,参试马铃薯各株系的各项指标的耐盐系数变化趋势并不一致,不同株系某一具体指标的耐盐性反应也不一定相同。因此,用单一指标难以全面、准确地反映参试株系耐盐性的强弱。目前隶属函数法、相关分析以及聚类分析等方法将各指标相结合的耐盐性综合评价已在植株抗逆性评价中应用较多[29]。模糊数学隶属函数法消除了单一指标带来的片面性,使参试株系间的耐盐性差异具有可比性,是一种比较可靠的评价方法。用隶属函数法、相关分析法得到耐盐性度量值D值不仅考虑了各指标间的相互关系,又考虑到各指标的重要性,根据D值的大小可以较准确地评价马铃薯的耐盐性。加权耐盐指数也可从多个指标中筛选出最重要的指标,对不同指标根据其权重大小衡量品种耐盐性。本研究通过聚类分析、隶属函数和标准差系数赋予权重法、相关分析相结合的方法将8个生长和生理指标进行分析,并且筛选出参试马铃薯各株系的耐盐性强弱关系:19>15>8>4>18>2>1>6>CK。并从表2和表4可以看出,与生长指标相同,叶绿素、脯氨酸、相对电导率、MDA、SOD与马铃薯耐盐性具有显著相关性(P<0.05),其中叶绿素、脯氨酸、相对电导率与马铃薯耐盐性呈极显著相关性(P<0.01),并且这些指标在盐胁迫下均具有敏感性,能够很好地反映材料间的耐盐性,因此可直接作为耐盐评价的鉴定。
综上所述,AtNHX1作为液泡膜Na+/H+逆向转运蛋白表达基因,其能够显著提高田间马铃薯植株的耐盐性,所获得的高耐盐转基因株系将为今后马铃薯耐盐育种提供种质资源。
[1] 罗其友,刘 洋,高明杰,等.中国马铃薯产业现状与前景[J].农业生产展望,2015(3):35-40.
[2] 张景云,缪南生,赵 萍.等.马铃薯耐盐性的研究进展[J].植物生理学报,2011,47(11):1047-1052.
[3] 吕慧颖,李银心,孔凡江,等.植物Na+/H+逆向转运蛋白研究进展[J].植物学通报,2003,20(3):363-369.
[4] Zhang H X, Blumwald E. Transgenic salt-tolerant tomato plants accumulate salt in foliage but not in fruit[J]. Nature Biotechnology, 2001,19:765-768.
[5] Xue Z Y, Zhi D Y, Xue G P, et al. Enhanced salt tolerance of transgenic wheat(TritivumaestivumL.)expressing a vacuolar Na+/H+antiporter gene with improved grain yields in saline soils in the field and a reduced level of leaf Na+[J]. Plant Science, 2004,167:849-859.
[6] He C X, Yan J Q, Shen G X, et al. Expression of an Arabidopsis vacuolar sodium/proton antiporter gene in cotton improves photosynthetic performance under salt conditions and increases fiber yield in the field[J]. Plant and Cell Physiology, 2005,46:1848-1854.
[7] Li T X, Zhang Y, Liu H, et al. Stable expression ofArabidopsisvacuolar Na+/H+antiporter geneAtNHX1, and salt tolerance in transgenic soybean for over six generations[J]. Chinese Sci Bull, 2010,55:1127-1134.
[8] 姜超强,郑青松,刘兆普,等.转AtNHX1基因杨树Tr品系的耐盐性研究[J].植物生态学报,2010,34(5):563-570.
[9] 王 丽.农杆菌介导的拟南芥液泡膜Na+/H+逆向转运蛋白基因(AtNHX1)转化烟草和马铃薯的研究[D].兰州:甘肃农业大学,2006.
[10] 崔炎森.转不同启动子驱动的拟南芥AtNHX1基因马铃薯的获得及耐盐性分析[D].兰州:甘肃农业大学,2007.
[11] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000,(7):258-261,167-169.
[12] 邹 琦,赵世杰,王 忠,等.植物生理学实验指导[M].北京:中国农业出版社,2000,(7):161-162.
[13] 李寒暝,白灯莎·买买提艾力,等.新疆棉花品种的耐盐性综合评价[J].核农学报,2010,24(1):160-165.
[14] 李 彦,张英鹏,孙 明,等.盐分胁迫对植物的影响及植物耐盐机理研究进展[J].中国农学通报,2008,24(1):258-263.
[15] 罗庆云,於丙军,刘友良.大豆苗期耐盐性鉴定指标的检验[J].大豆科学,2001,20(3):177-182.
[16] 裴怀弟,李忠旺,张艳萍,等.马铃薯转GhABF2转录因子苗耐盐性研究[J].干旱地区农业研究,2015,33(5):90-95.
[17] 王素平,李 娟,郭世荣,等.NaCl胁迫对黄瓜幼苗植株生长和光合特性的影响[J].西北植物学报,2006,26(3):455-461.
[18] Ashraf M, Foolad M R. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environmental and Experimental Botany, 2007,59:206-216.
[19] Demral T, Turkan I. Comparative lipid peroxidation, antioxidant defense systems and proline content inroots of two rice cultivars differing salt tolerance[J]. Environmental and Experimental Botany, 2005,53:247-257.
[20] 周广生,梅方竹,周竹青,等.小麦不同品种耐湿性生理指标综合评价及其预测[J].中国农业科学,2003,36(11):1378-1382.
[21] 李 源,刘贵波,高洪文,等.紫花苜蓿种质资源耐盐性综合评价及盐胁迫下的生理反应[J].草业学报,2010,19(1):79-86.
[22] 汪月霞,孙国荣,王建波,等.NaCl胁迫下星星草幼苗MDA含量与膜透性及叶绿素荧光参数之间的关系[J].生态学报,2006,26(1):122-129.
[23] 汪本勤.植物SOD的研究进展[J].河北农业科学,2008,12(3):6-9.
[24] 董 亮,何永志,王远亮,等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报,2013,15(5):53-55.
[25] 张 欣.超氧化物歧化酶(SOD)及其研究进展[J].内蒙古石油化工,2013(16):14-15.
[26] 夏民旋,王 维,袁 瑞,等.超氧化物歧化酶与植物抗逆性[J].分子植物育种,2015,13(11):2633-2646.
[27] 丁在松,王春艳,关东明,等.旱稻×稗草杂交后代YF2-1光合作用气体交换、叶绿素荧光和抗氧化酶系统对渗透胁迫的响应[J].作物学报,2011,37(5):876-881.
[28] 刘海卿,孙万仓,刘自刚.等.北方寒旱区白菜型冬油菜抗寒性与抗旱性评价及其关系[J].中国农业科学,2015,48(18):3743-3756.
[29] 段九菊,张 超,郑梅梅,等.万寿菊不同品种的耐盐性综合评价[J].核农学报,2015,29(7):1406-1418.
Acomprehensiveevaluationofsalt-toleranceandphysiologicalresponseoftransgenicpotatotosaltstressinfieldbytheintroductionofAtNHX1gene
LI Li-xia1, LIU Yu-hui1, WANG Li2, YU Bin1, ZHANG Jun-lian1, WANG Di1,3
(1.GansuKeyLaboratoryofCropGeneticandGermplasmEnhancement/CollegeofHorticulture/GansuKeyLaboratoryofAridlandCropScience,Gansu,Lanzhou730070,China; 2.CollegeofLifeSciencesandTechnology,GansuAgriculturalUniversity,Gansu,Lanzhou730070,China; 3.CollegeofAgronomy,GansuAgriculturalUniversity,Gansu,Lanzhou730070,China)
This study investigated the morphological and physiological traits of eight transgenic potato (SolanumtuberosumL.) lines carryingAtNHX1 gene and one non-transgenic control “Gannongshu No.2” grown on normal soil and saline land at 0.56% salt and 0.29% salt concentration. The salt tolerance of transgenic potato was evaluated using a comprehensive evaluation method including subordinate function, correlation analysis and cluster analysis. The result showed that with the increase of salt concentration the plant height, leaf area expansion rate, yield per plant, chlorophyll content, activity of SOD and the rising range of proline content of transgenic lines were higher 1.17~3.96 times than that of the control. However, the increasing degree of MDA, relative conductivity of transgenic lines was significant lower than that of control, only 63.07%~78.4% and 82.7%~86.35% of the control. A transgenic potato line with highest salt tolerance and three transgenic lines with higher salt tolerance were screened out according to the comprehensive evaluation on the morphological, physiological and biochemical parameters. The transgenic lines with different degree of salt tolerance were as follows: 19>15>8>4>18>2>1>6>CK. The result concluded that the salt tolerance of transgenic potato grown in field can be improved by introducingAtNHX1 gene, and the comprehensive evaluation method can be used to screen out transgenic potato with high salt tolerance.
potato;AtNHX1 gene; salt stress; physiological parameter; comprehensive evaluation of salt tolerance
1000-7601(2017)03-0130-08doi:10.7606/j.issn.1000-7601.2017.03.21
2016-04-27
:2017-03-28
:国际科技合作专项项目(2014DFG31570);甘肃省农业生物技术研究与应用开发项目(GNSW-2015-15);国家现代农业产业技术体系建设项目(CARS-10-P18);甘肃省高等学校基本科研业务费(GSKYYWF-1)
李丽霞(1990—),女,甘肃定西人,硕士研究生,研究方向为蔬菜生理与栽培技术。 E-mail:867463408@qq.com。
刘玉汇,女,甘肃临潭县人,主要从事马铃薯遗传育种及栽培生理研究。 E-mail:lyhui@aliyun.com。 张俊莲,女,山西代县人,主要从事马铃薯遗传育种及栽培生理研究。 E-mail:zhangjunlian77@163.com。
S532
: A
