短时水分胁迫对水稻叶片光合作用的影响
2017-07-19李俊周乔江方李梦琪杜彦修赵全志
李俊周,乔江方,李梦琪,杜彦修,赵全志
(河南粮食作物协同创新中心/河南省水稻生物学重点实验室/河南农业大学农业部黄淮海作物生理生态与耕作重点实验室, 河南 郑州 450002)
短时水分胁迫对水稻叶片光合作用的影响
李俊周,乔江方,李梦琪,杜彦修,赵全志
(河南粮食作物协同创新中心/河南省水稻生物学重点实验室/河南农业大学农业部黄淮海作物生理生态与耕作重点实验室, 河南 郑州 450002)
为揭示水分胁迫下水稻叶片光合特性下降的生理原因,以水培的水稻幼苗为材料,测定30% PEG-6000模拟水分胁迫150 min过程水稻叶片光合特性、荧光参数和光合机构关键酶活性的变化。结果表明:短时水分胁迫处理0~60 min气孔导度快速下降,胞间CO2浓度、净光合速率、蒸腾速率和荧光参数均降低;60~120 min气孔导度缓慢下降,RuBP羧化酶活性开始快速下降,胞间CO2浓度开始上升,非光化学猝灭仍然是上升趋势,其它光合荧光参数持续降低。120 min后,非光化学猝灭出现下降趋势,RuBP羧化酶活性和胞间CO2浓度分别保持下降和上升趋势,其它光合荧光参数持续降低。短时胁迫处理结果暗示,光合作用0~60 min主要受气孔限制,60~120 min受气孔限制和非气孔限制共同作用,120 min后主要受非气孔限制。
水稻;短时水分胁迫;光合荧光特性;非气孔限制;气孔限制
水分胁迫是限制作物生长和产量的主要环境因子之一。水分胁迫对产量的影响主要是通过影响植物叶片的光合机构,以降低其光合性能[1]。薛崧等[2]研究认为水分胁迫对作物光合色素有显著影响,会造成叶绿素合成速率降低、叶绿素(Chl)分解和类胡萝卜素(Caro)含量减少,引起Chla/b和Chl/Caro值的改变,进而影响原初反应和激发能的传递,导致光能吸收效率的降低。赵丽英等[3]通过PEG-6000处理发现水分胁迫对小麦幼苗叶绿素荧光参数影响较大,证实严重水分亏缺或长时间水分亏缺植物叶片的光合机构会受到破坏。PEG-6000胁迫处理两天会使敏旱玉米品种类囊体膜受损、叶绿体超微结构遭受破坏[4]。卢从明等[5]采用自然失水法进行不同程度的水分胁迫,发现轻度水分胁迫对叶片光合电子传递速率影响较小,严重水分胁迫会对明显抑制光合电子传递活性,环式与非环式光合磷酸化活性受抑程度更大。RuBP羧化酶对净光合速率起着决定性的影响,是光合碳同化的关键酶。王仁雷等[6]通过研究水分胁迫条件下水稻的光合特性,发现随着NaCl胁迫时间和浓度的加大,净光合速率、PSⅡ光化学效率(Fv/Fm)和RuBP羧化酶活性下降,气孔导度和胞间CO2浓度减小。前人关于水分胁迫处理后水稻叶片光合特性及关键酶活性的研究主要集中于长时间胁迫处理后的变化,长时间胁迫处理后的结果受植株自身调节的影响。而水稻叶片光合特性及光合机构对短时水分胁迫的影响还不是很清楚,本研究采用PEG-6000模拟水分胁迫处理,研究短时胁迫处理对光合特性及光合机构的影响,探讨短时胁迫影响水稻叶片光合作用下降的的内在机理。
1 材料与方法
1.1 试验设计
试验在河南农业大学室内人工气候室进行。供试水稻品种为籼型杂交稻两优培九、粳型常规稻豫粳六号和738。种子消毒后,在培养皿中发芽,秧苗3叶1心时移栽至水培液中,营养液采用国际水稻研究所吉田昌一的配方,氮素浓度一直维持在40 mg·L-1。水培箱的长、宽和深分别为33 cm、23 cm和10 cm,每箱移栽9株。秧苗移栽前先在清水中处理4 d,以使植株间差异趋于一致,以后开始营养液处理。每7 d更换营养液一次,pH保持5.0~5.3。试验设置3次重复。
1.2 试验方法
水稻生长至9叶1心,选取生长一致的水稻苗进行测定,水分胁迫采用PEG-6000模拟水分胁迫,PEG浓度设定为30%,水势比正常水分下降了1.25 MPa。PEG处理0、30、60、90、120、150 min进行各性状的测定,每重复测定3株。
光合特性采用光合测定系统(LI-6400,Li-cor company,Nebraska,USA)进行测定。采用开放式气路,在10∶00—12∶00时采用人工红蓝光源,光强设定为1 000 μmol·m-2·s-1。测定的指标包括净光合速率Pn、气孔导度Gs、胞间CO2浓度Ci、蒸腾速率Tr和羧化效率CE(羧化效率为Pn/Ci)。
叶绿素荧光测定采用FMS2型便携调制式叶绿素荧光仪(Hansatech, 英国)。测定前,植株均在PAR=600 μmol·m-2·s-1、Ta=25℃条件下适应1 h,然后用叶夹夹住叶片(暗适应)15~30 min。测定时,荧光仪按预先设定的程序首先以弱测量光(<0.05 μmol·m-2·s-1)照射叶片,测量出F0。然后以饱和脉冲光(12 000 μmol·m-2·s-1)照射,给出Fv、Fm以及Fv/Fm。最后以AL(光化光,180 μmol·m-2·s-1)持续照射3 min后测定ΦPSⅡ。其它叶绿素荧光动力学参数如电子传递速率、qP(光化学猝灭系数)、NPQ(非光化学猝灭系数)等同时给出。
RuBP羧化酶活性测定采用加入RuBP底物反应的方法[7],取水稻叶1 g,冲洗干净晾干,加入5 ml预冷的提取介质,在冰浴上研磨至匀浆,经4层纱布过滤,滤液于4℃下20 000 g离心15 min,弃沉淀;上清液即粗酶提取液置0℃保存备用。吸取Tris 0.3 ml,MgCl 20.3 ml,ATP 0.3 ml,DTT 0.3 ml,NADH 0.3 ml,KHCO30.1 ml,EDTA 0.3 ml,蒸馏水0.8 ml。取RuBP羧化酶液0.1 ml于试管,30℃保温10 min,然后加入0.1 ml的三磷酸苷油酸激酶/三磷酸苷油酸脱氢酶,在分光光度计340 nm测定光吸收E0,最后加0.1 ml的RuBP,立刻于340 nm每隔15 sec至30 sec间隔,测光吸收变化E1。
酶活力=(E0-E1)×Vt/(2×d×∮×△t×Vs)
式中,E0、E1分别为反应前、后反应液的A340;Δt为E0到E1的时间(min);∮为1 μmol NADH的吸光系数(6.22);d为比色杯的光径(cm);Vt为酶液总量(ml);Vs为反应液体积(ml);酶活力单位为(mmol·mm-1·ml-1);2表示每固定1 mol CO2有2 mol NADH被氧化。
1.3 统计分析
利用 Excel对数据进行处理及制图。数据分析采用DPS V9.50软件,样本平均数的差异显著性测验采用LSD法。
2 结果与分析
2.1 短时水分胁迫对水稻光合特性的影响
从图1可以看出,胁迫处理后150 min内水稻净光合速率呈现下降趋势,处理0~30 min下降速率较快,30~90 min下降相对平缓。胁迫后三个品种叶片气孔导度均呈现Z字型的变化趋势,处理0~30 min缓慢下降,30~60 min迅速下降,60 min后又缓慢下降,150 min水稻叶片气孔基本关闭。胁迫150 min两优培九、豫粳六号和738三个品种气孔导度分别下降86.74%、88.82%和87.52%,气孔导度下降的幅度较净光合速率大。叶片胞间CO2浓度胁迫后呈现倒抛物线的变化趋势,胁迫0~60 min胞间CO2浓度处于下降的变化趋势,60 min后又呈上升趋势。叶片蒸腾速率胁迫后都有不同程度的下降,处理0~60 min下降速率较快,60 min后下降速率有所降低。处理150 min两优培九、豫粳六号和738三个品种分别下降53.67%、70.89%和83.49%。叶片羧化效率胁迫后呈现下降的变化趋势,处理0~60 min变化程度较小,60 min后快速下降。处理150 min两优培九、豫粳六号和738三个品种羧化效率分别下降85.25%、75.29%和78.5%。
2.2 短时水分胁迫对水稻叶片荧光诱导动力学参数的影响
由叶片光化学效率Fv/Fm的变化可以看出(图2),胁迫0~30 min迅速下降,随后缓慢下降,但整体仍处于下降的趋势。胁迫150 min两优培九、豫粳六号和738分别下降23.96%、22.6%和27.62%。实际光化学效率胁迫后三个品种都存在明显的下降趋势,0~90 min平缓下降,90 min后迅速下降。胁迫150 min两优培九、豫粳六号和738叶片实际光化学效率分别下降34.92%、24.75%和21.35%。叶片光化学猝灭系数胁迫后三个品种均有不同程度的下降趋势,0~90 min缓慢下降,90 min后迅速下降。胁迫150 min两优培九、豫粳六号和738分别下降45.72%、33.74%和42.89%。随处理时间延长水稻叶片叶绿体原初反应电子用于光合电子传递的份额逐渐减小。叶片非光化学猝灭胁迫后三个品种呈现先上升而后下降的变化趋势,0~120 min缓慢上升,120 min两优培九、豫粳六号和738非光化学猝灭达最大值,分别比处理前上升48.19%、63.28%和63.16%。120 min后非光化学猝灭缓慢下降。水稻叶片电子传递速率胁迫后都有不同程度的下降,0~90 min平缓下降,90 min后迅速下降。胁迫150 min两优培九、豫粳六号和738叶片光合电子传递速率分别下降70.0%、61.13%和62.33%。

图1 短时水分胁迫水稻叶片光合特性的变化
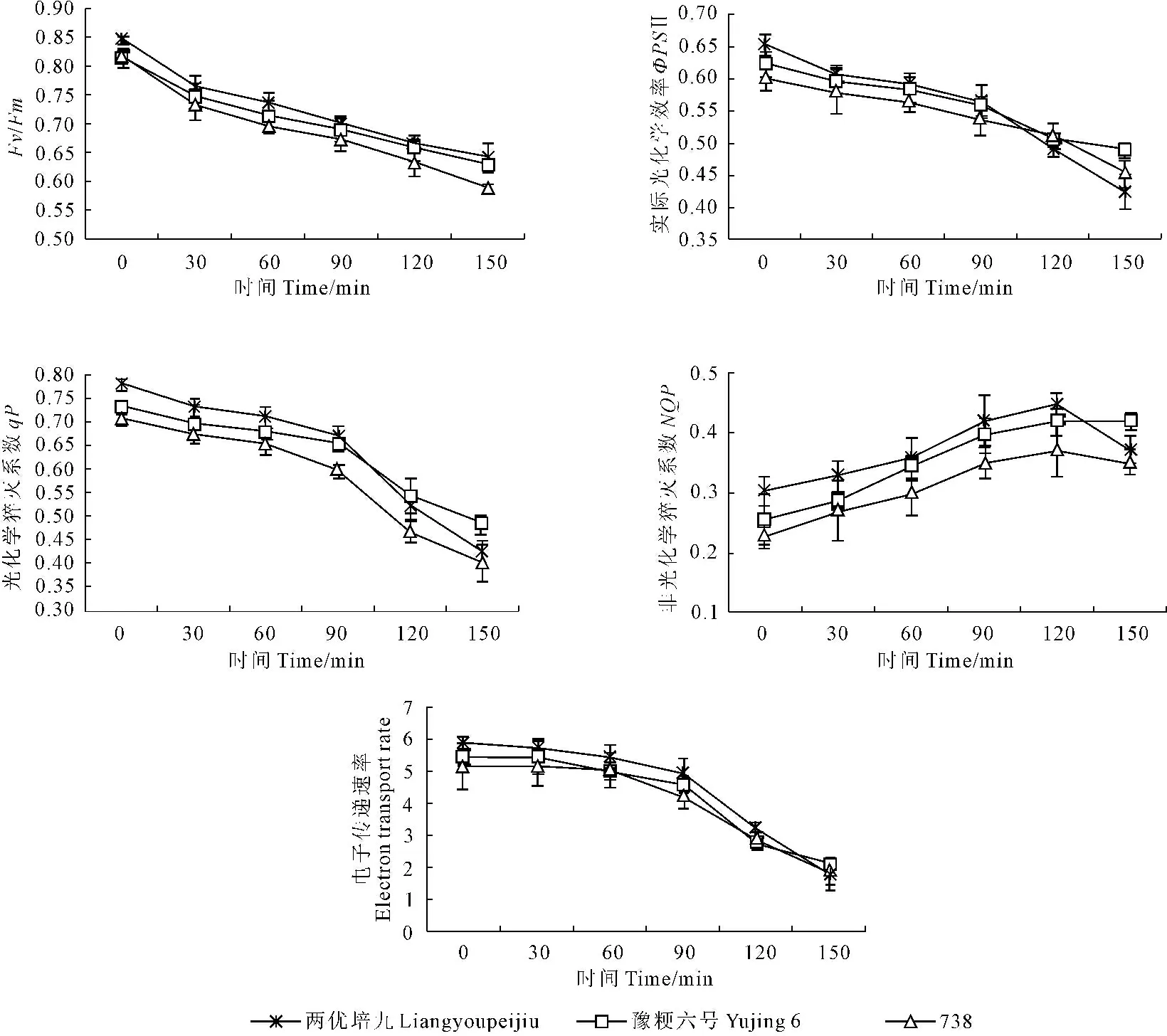
图2 短时水分胁迫水稻叶片叶绿素荧光特性的变化
2.3 短时水分胁迫对水稻叶片RuBP羧化酶活性的影响
RuBP羧化酶是光合作用光合碳循环中最初的CO2固定酶,是光合碳同化的关键酶,对净光合速率起决定性作用。从图3可以看出,胁迫后水稻叶片中RuBP羧化酶活性逐渐下降,处理0~30 min明显下降,随后30~120 min缓慢下降,120 min后迅速下降。150 min两优培九、豫粳六号和738分别下降67.29%、37.59%和65.43%。

图3 短时水分胁迫水稻叶片RuBP羧化酶活性的变化
3 讨 论
植物感知胁迫作用后,通常表现出光合作用下降。前人研究发现,PEG模拟短时水分胁迫后各种色素蛋白复合体含量都会出现不同程度的降低,其中LHCⅡ下降幅度最大,从而导致激发能从LHCⅡ向光系统Ⅱ传递的降低,表现出光系统Ⅱ荧光发射强度和Fv/Fm大幅下降,导致光合作用降低[8-10]。本试验30% PEG模拟水分胁迫150 min,光合电子传递速率降低,ATP和NADPH形成受阻,Rubisco的大幅下降直接影响了C3途径中CO2的固定,最终影响光合作用碳同化的进行,导致净光合速率大幅下降以及荧光参数F0、ΦPSⅡ、qP的降低,NPQ升高,这都表明光合系统已经受到严重影响,植物启动了相应的水分胁迫适应机制。
植物受到水分胁迫后,光合作用受到气孔限制和非气孔限制的双重调节[11]。轻度水分胁迫初期光合速率的降低是主要是通过气孔限制,即气孔关闭以减少蒸腾作用,进而阻碍CO2进入叶内;严重水分或者长时间水分处理,限制因素逐渐变为非气孔限制[12-13]。
表明随着植物叶片水势的降低,植物叶片光合器官遭受破坏和活性降低,光合速率下降从气孔限制逐渐向叶肉细胞光合活性限制进行转变,也就是向非气孔限制的转变[14-15]。本试验150 min PEG模拟水分胁迫过程中荧光诱导动力学参数的变化趋势较复杂,气孔导度0~30 min缓慢下降和30~60 min快速下降引起胞间CO2浓度、净光合速率和蒸腾速率的下降,以及各荧光参数的降低,此阶段主要是气孔限制起主要作用。60~120 min气孔导度缓慢下降,RuBP羧化酶活性和羧化效率呈现下降趋势,胞间CO2浓度开始上升,非光化学猝灭仍然是上升趋势,其它光合荧光参数持续降低。这暗示此阶段光合作用的下降不全部是由气孔关闭引起的,叶肉细胞光合活性降低的非气孔限制也开始起作用。120 min后,非光化学猝灭表现出下降趋势,RuBP羧化酶活性出现快速下降趋势,胞间CO2浓度保持上升趋势,其他光合荧光参数持续降低,暗示光合器官与功能受到破坏,非气孔限制成为光合作用的主要限制因素。本研究也证明了轻度水分胁迫初期气孔限制起主要作用,长时间或者严重胁迫是以非气孔限制为主。因此,气孔限制和非气孔限制对光合作用的影响取决于水分胁迫的时间和程度。
[1] Teng K Q, Li J Z, Liu L, et al. Exogenous ABA induces drought tolerance in upland rice: the role of chloroplast and ABA biosynthesis-related gene expression on photosystem II during PEG stress[J]. Acta Physiol Plant, 2014,36:2219-2227.
[2] 薛 崧,汪沛洪,许大全,等.水分胁迫对冬小麦CO2同化作用的影响[J].植物生理学报,1991,18(1):1-7.
[3] 赵丽英,邓西平,山 仑.渗透胁迫对小麦幼苗叶绿素荧光参数的影响[J].应用生态学报,2005,16(7):1261-1264.
[4] Shao R X, Xin L F, Zheng H F, et al. Changes in chloroplast ultrastructure in leaves of drought-stressed maize inbred lines[J]. Photosynthetica, 2016,54(1):74-80.
[5] 卢从明,张其德,匡延云.水分胁迫对小麦光系统Ⅱ的影响[J].植物学报,1994,36(2):93-98.
[6] 王仁雷,华 春,刘友良.盐胁迫对水稻光合作用的影响[J].南京农业大学学报,2002,25(4):11-14.
[7] 高俊凤.植物生理学试验指导[M].高等教育出版社,2006.
[8] 卢从明,张其德,匡延云.水分胁迫对小麦叶绿体激发能分配的光系统Ⅱ原初光能转化效率的影响[J].生物物理学报,1995,11(1):82-86.
[9] Li J Z, Chen Y P, Teng K Q, et al. Rice leaf heterogeneity in chlorophyll fluorescence parameters under short-term osmotic stress[J]. Biol Plantarum, 2015,59:187-192.
[10] Zhang H, Ni Z, Chen Q, et al. Proteomic responses of drought-tolerant and drought-sensitive cotton varieties to drought stress[J]. Mol Genet Genomics, 2016:1-11.
[11] Earl H J. Stomatal and non-stomatal restrictions to carbon assimilation in soybean (Glycine max) lines differing in water use efficiency[J]. Environ Exp Bot, 2002,48(3):237-246.
[12] Cornic G. Drought stress inhibits photosynthesis by decreasing stomatal aperture-not by affecting ATP synthesis[J]. Trends Plant Sci, 2000,5(5):187-188.
[13] Parry M A J, Andralojc P J, Khan S, et al. Rubisco activity: effects of drought stress[J]. Ann Bot, 2002,89(7):833-839.
[14] Ramalho J C, Zlatev Z S, Leito A E, et al. Moderate water stress causes different stomatal and non-stomatal changes in the photosynthetic functioning ofPhaseolusvulgarisL. genotypes[J]. Plant Biol, 2014,16(1):133-146.
[15] Campos H, Trejo C, Pe†a-Valdivia C B, et al. Stomatal and non-stomatal limitations of bell pepper (CapsicumannuumL.) plants under water stress and re-watering: Delayed restoration of photosynthesis during recovery[J]. Environ Exp Bot, 2014,98:56-64.
Theeffectsofshort-termwaterstressonleafphotosynthesisinrice
LI Jun-zhou, QIAO Jiang-fang, LI Meng-qi, DU Yan-xiu, ZHAO Quan-zhi
(CollaborativeInnovationCenterofHenanGrainCrops/KeyLaboratoryofricebiologyandKeyLaboratoryofPhysiology/EcologyandGeneticsImprovementofFoodCropinHenanProvince,HenanAgriculturalUniversity,Zhengzhou450002,China)
In order to reveal the physiological mechanism of the reduction of photosynthesis under water stress, the change of photosynthetic and chlorophyll fluorescence characteristics and key enzymes activities of photosynthetic apparatus after 150 min 30% PEG-6000 stress were investigated using rice seedling under hydroponic culture. The result indicated that stomatal conductance decreased drastically, while intercellular CO2 concentration, net photosynthetic rate, transpiration rate, and chlorophyll fluorescence parameters decreased gradually by 0~60 min of stress. During 60~120 min of stress, stomatal conductance decreased slowly, RuBP carboxylase activity began to rapidly decreased, intercellular CO2concentration began to rise, non-photochemical quenching continued rise, other photosynthetic fluorescence parameters continued to drop. After 120 min of stress, non-photochemical quenching began to decline, RuBP carboxylase activity and intercellular CO2concentration showed a trend of declining and increasing respectively, while other photosynthetic fluorescence parameters declined. These results suggest that photosynthesis during 0~60 min of stress and 60~120 min of stress, and after 120 min of stress were regulated by stomatal limitation, combination of stomatal limitation and non-stomatal limitation, and non-stomatal limitation, respectively.
rice; short-term water stress; photosynthetic and chlorophyll fluorescence characteristics; non-stomatal limitation; stomatal limitation
1000-7601(2017)03-0126-04doi:10.7606/j.issn.1000-7601.2017.03.20
2016-03-20
:2017-03-24
:河南省重大科技专项(141100110600);河南省高校科技创新人才支持项目(16HASTIT016);郑州市节水农业重点实验室建设项目(112PYFZX185)
李俊周(1978—),男,河南开封人,博士,副教授,主要从事水稻抗旱遗传机理研究。 E-mail:lijunzhou199899@126.com。
S512.1+2;Q945.79
: A
