PI3K/Akt/FoxO3a/Bim信号通路介导硫化氢后处理对缺氧H9c2心肌细胞的保护作用
2017-07-19胡明珠
周 波,钱 坤,胡明珠,季 永
(1.江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221004;2. 江南大学附属医院无锡市第四人民医院麻醉科,江苏 无锡 214062)
PI3K/Akt/FoxO3a/Bim信号通路介导硫化氢后处理对缺氧H9c2心肌细胞的保护作用
周 波1,2,钱 坤2,胡明珠2,季 永1,2
(1.江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,江苏 徐州 221004;2. 江南大学附属医院无锡市第四人民医院麻醉科,江苏 无锡 214062)
目的 探讨硫氢化钠(NaHS)后处理是否通过PI3K/Akt/FoxO3a/Bim信号通路调节细胞凋亡发挥减轻心肌细胞缺氧/复氧(H/R)损伤的作用。方法 H9c2大鼠心肌细胞缺氧3 h/复氧6 h,建立缺氧/复氧损伤模型。将细胞随机分为5组:空白组(Control组)、缺氧/复氧组(H/R组)、硫氢化钠后处理组(H/R+NaHS组)、抑制剂LY294002组(H/R+LY组)、硫氢化钠后处理+LY294002组(H/R+NaHS+LY组)。分别在缺氧前、复氧末检测H9c2心肌细胞的存活率以及LDH释放;流式细胞术检测各组的细胞凋亡率;应用Western blot检测Akt、p-Akt、FoxO3a、p-FoxO3a、Bim蛋白的表达水平;免疫荧光检测FoxO3a的分布情况。结果 缺氧前各组心肌细胞存活率、LDH释放量差异无统计学意义(P>0.05)。复氧末,NaHS组与H/R组相比,心肌细胞存活率明显提高(P<0.05),LDH释放量与细胞凋亡率明显降低(P<0.05);p-Akt、p-FoxO3a蛋白表达水平升高,Bim表达降低,同时FoxO3a在细胞质的表达升高。LY294002 逆转了NaHS后处理产生的心肌细胞保护作用,使得H/R+NaHS+LY组的心肌细胞存活率降低(P<0.05)、LDH释放和细胞凋亡率升高(P<0.05),p-Akt、p-FoxO3a蛋白表达降低(P<0.05),Bim表达升高(P<0.05),FoxO3a在细胞质的表达水平降低。结论 硫氢化钠(NaHS)后处理通过PI3K/Akt/FoxO3a/Bim信号通路调控细胞凋亡,减轻心肌细胞缺氧/复氧(H/R)损伤。
缺氧/复氧损伤;硫化氢;心肌保护;PI3K/Akt;FoxO3a;Bim;后处理
近年来许多研究表明,硫化氢(hydrogen sufide,H2S)是一种能够在心血管系统发挥保护作用的气体信号分子[1-2]。本课题组前期研究表明,H2S后处理通过磷脂酰肌醇3激酶/蛋白激酶B(phosphatidyqinositol-3 kinase/protein kinase B,PI3K/Akt)减轻大鼠心肌细胞缺血/再灌注(ischemia/reperfusion, I/R)损伤[3-4],但其下游的具体机制尚未明确。有文献报道[5],叉头蛋白转录因子O3a(FoxO3a)参与缺血/再灌注损伤心肌的损伤过程,激活PI3K/Akt信号通路可以使得FoxO3a发生磷酸化并从细胞核转移到细胞质从而发挥减轻心肌细胞的凋亡作用,同时FoxO3a的下游靶分子凋亡调节蛋白Bim表达降低。然而,PI3K/Akt/FoxO3a/Bim信号通路是否参与外源性的H2S保护心肌细胞的I/R损伤过程尚未见报道。本研究通过H9c2大鼠心肌细胞建立缺氧/复氧(hypoxia/reoxygenation,H/R)损伤模型和PI3K/Akt 特异性抑制剂 LY294002来观察PI3K/Akt/FoxO3a/Bim信号通路在H2S后处理保护心肌H/R损伤中的作用。
1 材料与方法
1.1 材料与试剂 H9c2大鼠心肌细胞(中乔新舟公司, 上海);胎牛血清(依科赛生物,上海);DMEM培养基(Hyclone,美国);硫氢化钠、LY294002(Sigma,美国);乳酸脱氢酶(LDH)试剂盒(南京建成生物工程研究所);Annexin V-FITC/PI凋亡试剂盒(康为世纪,北京);p-Akt、FoxO3a、p-FoxO3a、Bim兔单克隆抗体(CST,美国);Akt兔多克隆抗体(万类生物,沈阳);辣根过氧化物酶标记的山羊抗兔二抗(北京中杉金桥公司);Alexa Fluor 488标记的山羊抗兔荧光二抗(微科曼得生物工程有限公司);CCK-8细胞活力检测试剂盒、SDS-PAGE 凝胶试剂盒、SDS-PAGE 蛋白上样缓冲液、超敏 ECL 化学发光试剂盒(碧云天生物技术公司)。
1.2 仪器 细胞培养箱(美国Thermo公司);倒置显微镜、荧光显微镜(日本 Olympus公司); 流式细胞仪 (美国 Becton Dickinso 公司)。
1.3 H9c2细胞的培养 H9c2细胞培养于含10%胎牛血清、1×105U·L-1青霉素、100 mg·L-1链霉素的DMEM高糖培养基中,在37 ℃、95%空气和5% CO2培养箱中,每2~3 d换液,待细胞长到85~90%时传代。
1.4 H9c2细胞H/R模型建立 参照文献[6],用95% N2和5% CO2饱和30 min的缺氧液(in mmol·L-1:5.37 KCl,0.44 KH2PO4,136.89 NaCl,4.166 NaHCO3,0.338 Na2HPO4,用乳酸调节pH为6.8)置换正常培养基,然后将细胞置于含95% N2和5% CO2的密闭容器中,一同放置于37℃培养箱中培养3 h,即为缺氧;然后用95% O2和5% CO2饱和30 min的复氧液(in mmol·L-1:5.0 KCl,0.9 NaH2PO4, 20.0 NaHCO3, 1.0 CaCl2, 1.2 MgSO4, 5.5葡萄糖, 20 HEPES, 129.5 NaCl, pH 7.4)置换缺氧液,置于95%空气、5% CO2、37℃继续培养6h,即为复氧。
1.5 分组与方法 将培养的H9c2细胞随机分为5组:① Control组, 将心肌细胞用复氧液培养9 h;② H/R组:细胞缺氧3 h后,用复氧液培养6 h;③ H/R+NaHS组:在复氧初给予100 μmol·L-1NaHS[6]处理30 min,然后用复氧液继续培养5.5 h;④ H/R+NaHS+LY组:在复氧前40 min给予20 μmol·L-1LY294002处理40 min,其余处理同H/R+NaHS组;⑤ H/R+LY组在复氧前40 min给予20 μmol·L-1LY294002处理40 min,其余处理同H/R组。
1.6 CCK-8检测细胞存活率 将H9c2心肌细胞以6×103密度接种于96孔培养板中,继续培养72 h后随机分组并按照上述方法处理后,于每孔加入10% CCK-8溶液继续培养1.5 h,用酶标仪(γ=450 nm)测定各孔吸光度OD值,细胞存活率/%=(实验组OD/对照组OD)×100%。
1.7 培养基中LDH释放检测 分别取缺氧前和复氧末培养液,按照试剂盒说明书检测培养液中的LDH水平。
1.8 流式细胞术 用Annexin V-FITC/PI凋亡试剂盒检测细胞凋亡,各组细胞按照实验方法处理后,收集细胞后用预冷的PBS洗涤两次并离心后弃上清,用250 μL Binding Buffer重悬细胞,调节其浓度为1×109·L-1,取100 μL加入5 μL Annexin V-FITC和10 μL PI 充分混匀,室温避光孵育15 min,再加入400 μL PBS,流式细胞仪检测细胞凋亡情况。
1.9 Western blot检测Akt、p-Akt、FoxO3a、p-FoxO3a、Bim蛋白的表达水平 将各组处理好的细胞用胰酶消化后,用PBS洗3遍,加入裂解液,冰上裂解30 min,12 000 r·min-1离心15 min后取上清,BCA法进行蛋白定量,加入5×上样缓冲液煮沸10 min。取30 μg蛋白进行SDS-PAGE电泳,然后将蛋白转移到PVDF膜上。用5%的脱脂奶粉室温封闭1 h,加入一抗(Akt,1 ∶1 000;p-Akt,1 ∶1 000;FoxO3a,1 ∶800; p-FoxO3a,1 ∶1 000;Bim,1 ∶1 000;GAPDH,1 ∶8 000),4℃摇床孵育过夜,TBST洗膜后加入HRP标记的二抗(1 ∶2 000),室温摇床2 h,采用ECL发光液曝光显色,用Image J对条带进行分析。
1.10 免疫荧光检测FoxO3a的表达 H9c2细胞于24孔板上细胞爬片,待细胞贴壁稳定,生长良好进行实验方案的处理。用PBS洗3次,在15%的多聚甲醛中固定15 min后,0.5% TritonX-100(PBS配制)室温通透20 min,吸水纸吸干,10%山羊血清封闭30 min。加一抗:FoxO3a(1 ∶200)于4℃过夜;加荧光二抗(1 ∶200)室温避光孵育1 h;DAPI染核10 min,封片剂封片。荧光显微镜观察并采集图像,Image J软件对荧光结果进行分析。
2 统计学分析

3 结果
3.1 硫氢化钠后处理能够减轻H9c2缺氧/复氧损伤 实验结果显示,在复氧末,与H/R组比较,100 μmol·L-1的NaHS能够减轻H/R造成的损伤,明显增加细胞的存活率,LDH的释放量明显降低,差异具有统计学意义(P<0.05);与NaHS后处理组相比,NaHS+LY组明显降低了细胞的存活率、增加了LDH的释放(P<0.05)。见Fig 1A、1B。
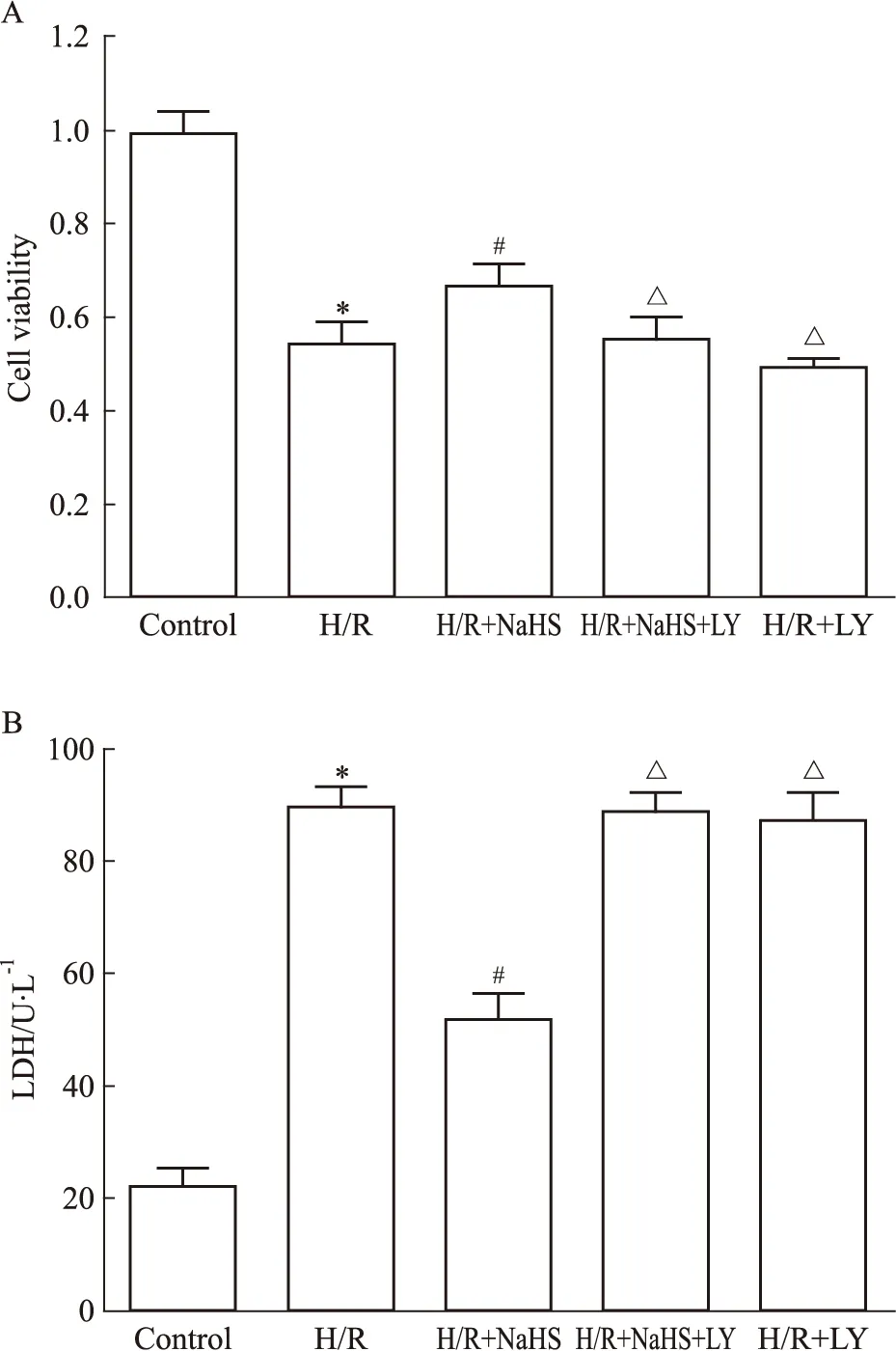
Fig 1 NaHS postconditioning inhibits the cytotoxicity by hypoxia/ reoxygenation(±s,n=5)
A: Cell viability of H9c2 cardiomyocytes; B: Release of LDH.*P<0.05vscontrol;#P<0.05vsH/R;△P<0.05vsH/R+NaHS
3.2 硫氢化钠后处理减轻H9c2细胞缺氧/复氧损伤导致的细胞凋亡 实验采用流式细胞术检测各组心肌细胞的凋亡情况,如Fig 2A、2B所示,和正常组(9.68±0.93)%相比,H/R组(20.50±2.48)%的凋亡率明显增加(P<0.05);而与H/R组相比,NaHS后处理组(13.80±1.73)%凋亡率明显增加(P<0.05),说明NaHS后处理减轻了H/R引起的细胞凋亡。与NaHS后处理组相比,NaHS+LY组的凋亡率(19.24±1.51)明显增加(P<0.05)。
3.3 硫氢化钠后处理对H9c2心肌细胞Akt、p-Akt、FoxO3a、p-FoxO3a、Bim蛋白表达水平的影响 Western blot 法分析结果见Fig 3A、3B和3C。H/R组与Control组相比,p-Akt、p- FoxO3a表达水平明显降低(P<0.05),Bim表达水平明显升高(P<0.05);与H/R组相比,NaHS后处理组的p-Akt、p- FoxO3a表达水平明显升高(P<0.05),Bim表达水平明显降低(P<0.05),而LY294002抑制了NaHS对Akt与FoxO3a的磷酸化作用(P<0.05)。

Fig 2 Effects of NaHS postconditioning on
A and B:Apoptosis rate detected by Annexin V/PI flow cytometry.*P<0.05vscontrol;#P<0.05vsH/R;△P<0.05vsH/R+NaHS
3.4 硫氢化钠后处理对H9c2细胞FoxO3a的细胞分布影响 实验应用免疫荧光方法检测FoxO3a的细胞分布,结果见Fig 4A、4B。与Control组相比,H/R组的FoxO3a在细胞质中的表达减少(P<0.05);NaHS后处理组细胞质FoxO3a也较H/R组明显升高(P<0.05);而NaHS+LY组的细胞质FoxO3a较NaHS后处理组明显降低(P<0.05)。
4 讨论
近年来,越来越多的研究证实,H2S在心血管系统的生理病理过程中发挥着重要的作用,本课题组前期的研究也表明,H2S后处理可以减轻大鼠心脏I/R损伤,对缺血心肌具有保护作用。


1:Control; 2:H/R;3:H/R+NaHS; 4:HR+NaHS+LY;5:H/R+LY; A,B and C:Protein levels of Akt,p-Akt,FoxO3a,p- FoxO3a and Bim tested by Western blot.*P<0.05vscontrol;#P<0.05vsH/R;△P<0.05vsH/R+NaHS
FoxO3a(forkhead box O3a,叉头转录因子O3a)是近年来发现的FoxO家族中的亚族,参与体内多种病理生理过程,包括调节凋亡、氧化应激、能量代谢等[7-8]。FoxO3a发生磷酸化可以抑制FoxO3a的活性和对靶基因的调控[5]。Bim是Bcl-2家族中BH3-only亚族的成员,是一种重要的促凋亡蛋白,很多研究证实,Bim是FoxO3a的下游基因,FoxO3a可以结合在Bim的启动子上促进Bim蛋白的表达,从而启动线粒体途径的细胞凋亡过程[12]。但是FoxO3a的磷酸化以及Bim是否参与H2S的抗心肌缺血作用还尚未知。本研究发现,p-FoxO3a在H/R组较Control组降低,而在NaHS后处理组升高,同时Bim表达以及细胞凋亡减少,认为FoxO3a的磷酸化在NaHS后处理保护心肌细胞H/R损伤中起重要作用。
本课题组前期研究表明PI3K/Akt通路参与H2S后处理保护大鼠缺血心肌细胞,可能与调节Sirt1的表达[9]以及调节Cx43蛋白的表达[10]有关。有文献报道[11],FoxO3a是PI3K/Akt信号通路的下游靶点,激活PI3K/Akt可以磷酸化FoxO3a。为了研究PI3K/Akt/FoxO3a通路在H9c2心肌细胞H/R损伤中的作用,本研究通过应用PI3K/Akt特异性抑制剂LY294002,观察各组细胞的存活率、凋亡率、LDH释放量、相关蛋白的表达水平,以及在FoxO3a在细胞中的分布情况。
研究结果发现,H9c2大鼠心肌细胞经过缺氧3 h,复氧6 h处理后,与H/R组相比较, H/R+NaHS组细胞存活率升高,LDH释放量和细胞凋亡率降低,同时p-Akt、p-FoxO3a的表达增加,Bim表达降低。而在加入PI3K/Akt通路抑制剂LY294002后,H2S后处理减轻H9c2细胞的H/R损伤的作用被逆转,p-Akt、p-FoxO3a的表达降低,细胞凋亡及Bim表达增加。提示PI3K/Akt/FoxO3a/Bim信号通路参与了H2S后处理对心肌 H/R损伤的保护作用。


A:FoxO3a and DAPI-stained nuclei were visualized by fluorescence microscopy. The representative pictures of each group are shown(400×);B:The percentage of cytoplasmic and nuclei FoxO3a for each group was quantified.*P<0.05vscontrol;#P<0.05vsH/R;△P<0.05vsH/R+NaHS
FoxO3a在正常情况下在细胞质和细胞核中均有表达,FoxO3a的表达受到多种翻译后加工的作用[13],其中磷酸化作用是最重要的一种, FoxO3a的磷酸化可以使FoxO3a从细胞核移出进入细胞质[14]。实验采用了免疫荧光方法对FoxO3a的定位进行研究,结果可以看出,Control组中FoxO3a在细胞质和细胞核中均有表达,H/R处理后,细胞质中的FoxO3a比例明显减少。而与H/R组相比,NaHS的后处理使得细胞质中FoxO3a的比例明显升高,提示NaHS可以使FoxO3a从细胞核移出,保护心肌细胞。但FoxO3a发挥作用的具体机制还有待进一步研究。
综上所述,本实验研究结果表明NaHS后处理通过PI3K/Akt信号通路增加Akt、FoxO3a的磷酸化,增加FoxO3a从细胞核移出和减少Bim的表达减轻H9c2大鼠心肌细胞H/R损伤导致的细胞凋亡。
(致谢:本实验研究主要在无锡市第四人民医院中心实验室完成,感谢季永教授、黄朝辉研究员给予实验的悉心指导和帮助!)
[1] Andreadou I, Iliodromitis E K, Rassaf T, et al. The role of gasotransmitters NO, H2S, and CO in myocardial ischaemia/reperfusion injury and cardioprotection by preconditioning, postconditioning and remote conditioning[J].BrJPharmacol, 2015, 172(6):1587-606.
[2] Zhao Y, Bhushan S, Yang C, et al. Controllable hydrogen sulfide donors and their activity against myocardial ischemia-reperfusion injury[J].ACSChemBiol, 2013, 8(6):1283-90.
[3] Ji Y, Pang Q F, Xu G, et al. Exogenous hydrogen sulfide postconditioning protects isolated rat hearts against ischemia-reperfusion injury[J].EurJPharmacol, 2008, 587(1-3):1-7.
[4] 于 水, 杨海扣, 米 琰,等. PI3K/Akt信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J]. 中国药理学通报, 2010, 26(6):759-64.
[4] Yu S,Yang H K,Mi Y,et al. The role of PI3K/Akt Signaling pathway in exogenous hydrogen sulfide postconditioninvitroof rats myocardial[J].ChinPharmacolBull, 2010, 26(6):759-64.
[5] Juhasz B, Thirunavukkarasu M, Pant R,et al. Bromelain induces cardioprotection against ischemiareperfusion injury through Akt/FOXO pathway in rat myocardium[J].AmJPhysiolHeartCircPhysiol, 2008, 294(3):H1365-70.
[6] Li H, Zhang C, Sun W, et al. Exogenous hydrogen sulfide restores cardioprotection of ischemic post-conditioning via inhibition of mPTP opening in the aging cardiomyocytes[J].CellBiosci, 2015, 5:43.
[7] Kim J, Choi H, Cho E G, et al. FoxO3a is an antimelanogenic factor that mediates antioxidant-induced depigmentation[J].JInvestDermatol, 2014, 134(5):1378-88.
[8] Samarin J, Wessel J, Cicha I, et al. FoxO proteins mediate hypoxic induction of connective tissue growth factor in endothelial cells[J].JBiologChem, 2010, 285(7):4328-36.
[9] 胡明珠, 周 波, 盛 琼,等. PI3K/Akt/Sirt1信号通路介导硫化氢后处理对大鼠缺血心肌的保护作用[J]. 中国药理学通报, 2016,32(2):268-73.
[9] Hu M Z, Zhou B, Sheng Q, et al. PI3K/Akt/Sirt1 signaling pathway mediated hydrogen sulfide postconditioning-induced protection against I/R injury[J].ChinPharmacolBull, 2016,32(2):268-73.
[10]Yong J I, Zhang K X, Mao H Y, et al. Protective effects of Cx43-mediated exogenous hydrogen sulfide postconditinoing on rat hearts[J].ChinPharmacolBull, 2013, 29(7):999-1003.
[11]Wang X, Chen W R, Xing D. A pathway from JNK through decreased ERK and Akt activities for FOXO3a nuclear translocation in response to UV irradiation[J].JCellPhysiol, 2012, 227(3):1168-78.
[12]Strasser A, Puthalakath H, Bouillet P, et al. The role of bim, a proapoptotic BH3-only member of the Bcl-2 family, in cell-death control[J].AnnNYAcadSci, 2000, 917(917):541-8.
[13]Obsil T, Obsilova V. Structure/function relationships underlying regulation of FOXO transcription factors[J].Oncogene, 2008, 27(16):2263-75.
[14]Sanphui P, Biswas S C. FoxO3a is activated and executes neuron death via Bim in response to β-amyloid[J].CellDeathDis, 2013, 4(5):e625.
PI3K/Akt/FoxO3a/Bim signaling pathway mediated hydrogen sulfide postconditioning-induced protection against H/R injury
ZHOU Bo1,2,QIAN Kun2,HU Ming-zhu2,JI Yong1,2
(1.JiangsuKeyLaboratoryofAnesthesiology,JiangsuKeyLaboratoryofAnesthsiaandAnalgesiaApplicationTechnology,XuzhouJiangsu221004,China;2.DeptofAnesthesiology,theAffiliatedHospitalofJiangnanUniversity(Wuxi4thPeople′sHospital),WuxiJiangsu214062,China)
Aim To explore the role of PI3K/Akt/FoxO3a/Bim pathway in H9c2 cardiomyocytes cardioprotection of hydrogen sulfide(H2S) postconditioning against hypoxia/reoxygenation(H/R) injury.Methods H9c2 cells were subjected to 3h hypoxia followed by 6h reoxygenation. Cells were divided into 5 groups: control group(Control),hypoxia/Reoxygenation group(H/R), NaHS postconditioning group(H/R+NaHS), NaHS with inhibitor LY294002 group(H/R+NaHS+LY) and LY294002 group(H/R+LY). The survival percentage of H9c2 cells and the release of LDH were detected at pre-hypoxia and reoxygenation 6 h.The flow cytometry was used to determine cell apoptosis at the end of reoxygenation. The expressions of Akt,p-Akt,FoxO3a,p-FoxO3a,Bim were detected by Western blot. Immunofluorescence staining was used to determine the expression of FoxO3a.Results There were no differences between each group before hypoxia(P>0.05). At the end of reoxygenation, cell viability in H/R+NaHS group was significantly improved (P<0.05),and the release of LDH and cell apoptosis rates were significantly decreased(P<0.05). Meanwhile, the expression of p-Akt,p-FoxO3a and cytoplasm FoxO3a was significantly improved, and Bim was significantly decreased. But LY294002 abolished the myocardial protection effects of NaHS, and significantly decreased p-Akt,p-FoxO3a and cytoplasm FoxO3a level, and increased Bim level.Conclusion PI3K/Akt/FoxO3a/Bim signaling pathway mediates hydrogen sulfide postconditioning-induced protection against H/R injury.
hypoxia/reoxygenation injury; hydrogen sulfide;myocardial protection;PI3K/ Akt;FoxO3a;Bim ;postconditioning
2017-02-15,
2017-05-06
无锡市医院管理中心医学科研面上项目(No YGZXM14017)
周 波(1988-),男,硕士生,研究方向:重要脏器功能衰竭的机制及预防,E-mail:zblxe@163.com; 季 永(1969-),男,博士,主任医师,硕士生导师,研究方向:心、肺、脑功能衰竭的机制及预防,通讯作者,E-mail:jiyong6941@163.com
时间:2017-6-7 19:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170607.1904.034.html
10.3969/j.issn.1001-1978.2017.07.017
A
1001-1978(2017)07-0971-06
R-332;R322.11;R329.25;R542.2;R845.22
