基于菊芋低聚果糖的酶解工艺研究
2017-07-18陈兴都翟丹云陈庆安赵莉莉董延虎李赟牛婕
陈兴都,翟丹云,陈庆安,赵莉莉,董延虎,李赟,牛婕
(甘肃省商业科技研究所,甘肃兰州730010)
基于菊芋低聚果糖的酶解工艺研究
陈兴都,翟丹云,陈庆安,赵莉莉,董延虎,李赟,牛婕
(甘肃省商业科技研究所,甘肃兰州730010)
以菊芋菊粉液为原料,采用内切型菊粉酶水解法生产低聚果糖。在单因素的基础上,选取加酶量、温度、时间、pH值为自变量,以转化率为响应值,通过Box-Behnken响应面设计对其酶解工艺参数进行优化。其最优工艺为:加酶量2.5 U/g,酶解时间6.0 h,酶解温度60℃,酶解pH值为6.0的条件下,低聚果糖的转化率可达到96.27%,与预测值之间的相对误差为1.91%。
菊芋;低聚果糖;菊粉酶;转化率;响应面设计
菊芋,学名 Helianthus tuberosus(L.1753),又叫洋姜、鬼子姜,菊科向日葵属草本植物,原产北美地区,经欧洲传入中国,具有适应性强、抗旱、耐寒的生长特点[1]。其富含碳水化合物,块根中菊粉含量达到70%[2]。
低聚果糖(Fructo-oligo-saccharide,FOS)是内切型菊粉酶作用于菊粉,切断菊粉分子内部的糖苷键,得到蔗果三糖、四糖和五糖等低聚果糖,属于果糖和葡萄糖构成的直链杂低聚糖[3-4]。
低聚果糖作为一种天然功能性食用多糖,具有水溶性膳食纤维和益生菌的功能[5-6],能够调节血糖血脂平衡、维持胃肠道功能、促进机体免疫排毒、预防糖尿病及心脑血管疾病[7-9]。
酶法降解具有高效性、专一性、产品纯度高,同时不影响低聚果糖的组织结构和生物活性[10-11],是当前研究的热点。本试验对菊芋菊糖液酶解工艺进行研究,获得低聚果糖酶解的工艺参数,为菊芋资源的充分利用和深加工提供技术支撑。
1 材料和方法
1.1 材料仪器
菊芋:市购,将菊芋筛土、清洗、切丝后,送至浸提罐70℃~90℃热蒸汽逆流提取3.0 h,滤过液经双碳酸和活性炭吸附法分离除去蛋白、胶体等杂质,即得菊芋菊粉液;S960型菊粉酶(20 000 U/g):上海耐今实业有限公司;3,5-二硝基水杨酸(DNS):武汉鸿睿康试剂有限公司;D-果糖(纯度>99%):宁波北仑雅旭化工有限公司。
TU-1800PC型紫外分光光度计:上海精密仪器仪表有限公司;HH-8型恒温水浴锅:常州市金坛区环宇科学仪器厂;不锈钢罐:温州市宏斌食品机械公司;AL204型电子天平:梅特勒-托利多仪器有限公司;PHS-3C型酸度计:上海科晓科学仪器有限公司。
1.2 方法
1.2.1 转化率测定
果糖含量采用DNS法,以D-果糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标制作标准曲线,建立线性回归方程y=0.026 3x-0.012 4(相关系数R2=0.996 3),根据方程确定样品中果糖含量[12]。低聚果糖的转化率计算公式如下:

1.2.2 酶解单因素试验
选择S960型菊粉酶降解菊芋菊粉液生产低聚果糖,以菊粉酶添加量、酶解温度、酶解时间、酶解pH值为试验因素,转化率为试验指标进行单因素试验,研究对低聚果糖酶解效果的影响。分别选择菊粉酶添加量为 0.5、1.5、2.5、3.5、4.5 U/g;时间为 2.0、4.0、6.0、8.0、10.0 h;温度为 20、30、40、50、60 ℃;pH 值为 4.0、5.0、6.0、7.0、8.0,反应后过滤,收集滤过液,备用[13]。
1.2.3 响应面试验设计
在单因素试验的基础上,以内切型菊粉酶S960的添加量、酶解温度、酶解时间以及酶解pH值为自变量,低聚果糖的转化率为因变量,通过中心旋转组合设计来筛选最优酶解工艺参数[14],因素水平如表1所示。
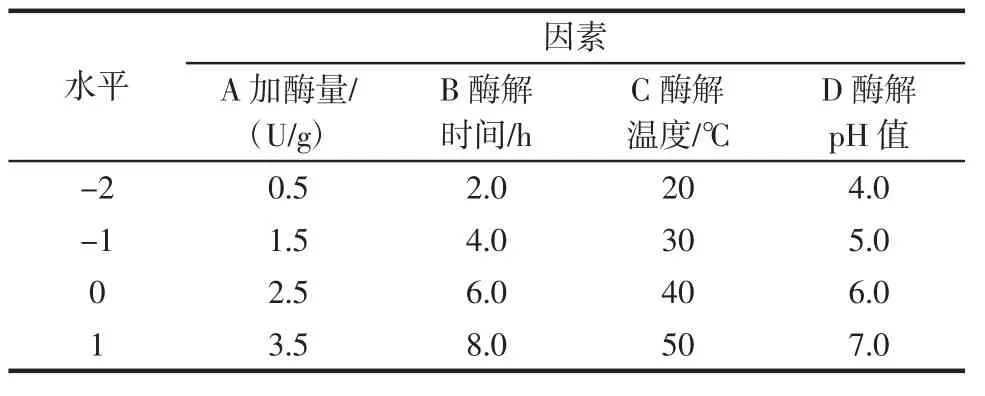
表1 响应面设计因素水平表Table 1 Factors and levels of response surface design
1.2.4 最佳工艺验证
利用响应面设计优化的最佳工艺参数,进行菊芋低聚果糖酶解工艺的验证。
2 结果与讨论
2.1 酶解工艺参数的确定
2.1.1 加酶量对酶解效果的影响
在酶解菊芋提取液的过程中控制体系温度50℃、时间6.0 h、pH值为5.0的酶解条件下,设置不同的加酶量,试验结果见图1。
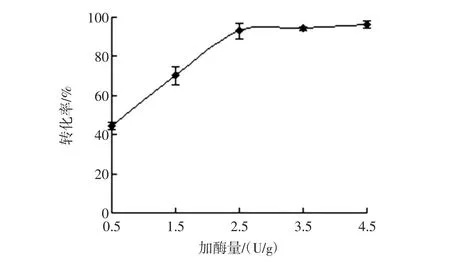
图1 加酶量对酶解效果的影响Fig.1 Effect of enzyme dosage on enzymolysis
随加菊粉酶量增大,滤过液中低聚果糖的转化率呈先上升后趋于不变的趋势,当加酶量为2.5 U/g时,低聚果糖的转化率达到93.01%,比加酶量1.5 U/g时高32.35%,比加酶量3.5U/g低1.22%,比加酶量4.5 U/g低3.34%。在适宜的条件下,提高酶液浓度,会扩大与菊芋果聚糖的接触面积,单位体积内反应物的活化分子数增多,反应速度加快,加速菊芋低聚果糖的溶出,转化率因而升高。若继续增大酶量,低聚果糖的转化率则不明显,可能原因是酶解过程的底物随反应逐渐减少。考虑到生产成本,因此,选取加酶量为2.5 U/g。
2.1.2 时间对酶解效果的影响
在酶解菊芋提取液的过程中控制体系加酶量2.5U/g、温度50℃、pH值为5.0的酶解条件下,设置不同酶解时间,试验结果见图2。
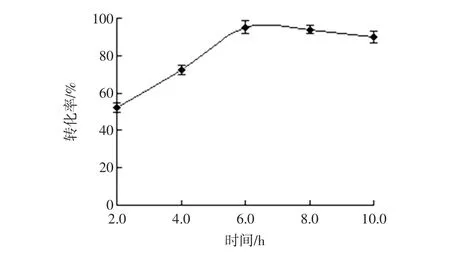
图2 时间对酶解效果的影响Fig.2 Effect of time on enzymolysis
随酶解时间的延长,酶解液中低聚果糖的转化率呈逐渐上升后略有下降的趋势,在酶解6.0 h时低聚果糖的转化率最高,为95.17%。在适宜的催化温度下,延长酶解时间酶促反应使菊芋果聚糖迅速溶出,当达到扩散的动态平衡后,单位体积内反应物的活化分子数逐渐减少,酶解液中低聚果糖会发生部分水解,因此,选取酶解时间为6.0 h。
2.1.3 温度对酶解效果的影响
在酶解菊芋提取液的过程中控制体系加酶量2.5 U/g、时间6.0 h、pH值为5.0的酶解条件下,设置不同酶解温度,试验结果见图3。
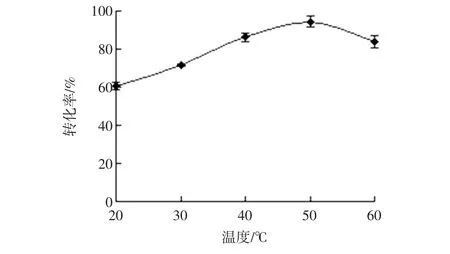
图3 温度对酶解效果的影响Fig.3 Effect of temperature on enzymolysis
随酶解温度升高,在菊粉酶的作用下,滤过液中低聚果糖的转化率呈逐渐升高后下降的趋势,在50℃时低聚果糖的转化率最高,达到94.43%。温度升高,会促使酶液分子受热扩散,增大与菊粉溶液的接触程度,单位体积内活化分子数增多,加速果聚糖的水解溶出,转化率不断升高,但温度过高,会抑制酶活性,甚至会引起酶失活变性,不利于酶解溶出,因此,选取酶解温度为50℃。
2.1.4 pH值对酶解效果的影响
在酶解菊芋提取液的过程中控制体系加酶量2.5 U/g、温度50℃、时间6.0 h的酶解条件下,设置不同酶解pH值,试验结果见图4。
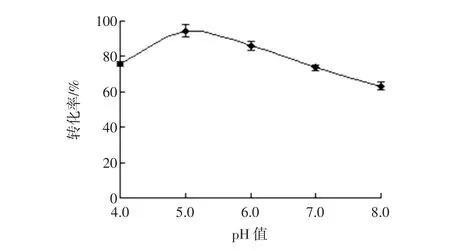
图4 pH值对酶解效果的影响Fig.4 Effect of pH on enzymolysis
随酶解液pH值的增加,滤过液中低聚果糖的转化率呈先上升后不断下降的趋势,在酶解pH值5.0时,低聚果糖的转化率最高,达到94.42%。可能原因是在最适酶解pH值下,菊芋果聚糖水解,低聚果糖迅速溶出,高于或低于最适pH值,均会使酶活性受到抑制,低聚果糖的溶出率会下降。综合考虑,选择酶解pH值为5.0。
2.2 响应面设计工艺参数优化
在菊芋菊粉液酶解单因素基础上,进行酶解工艺响应面设计优化,试验结果如表2所示。
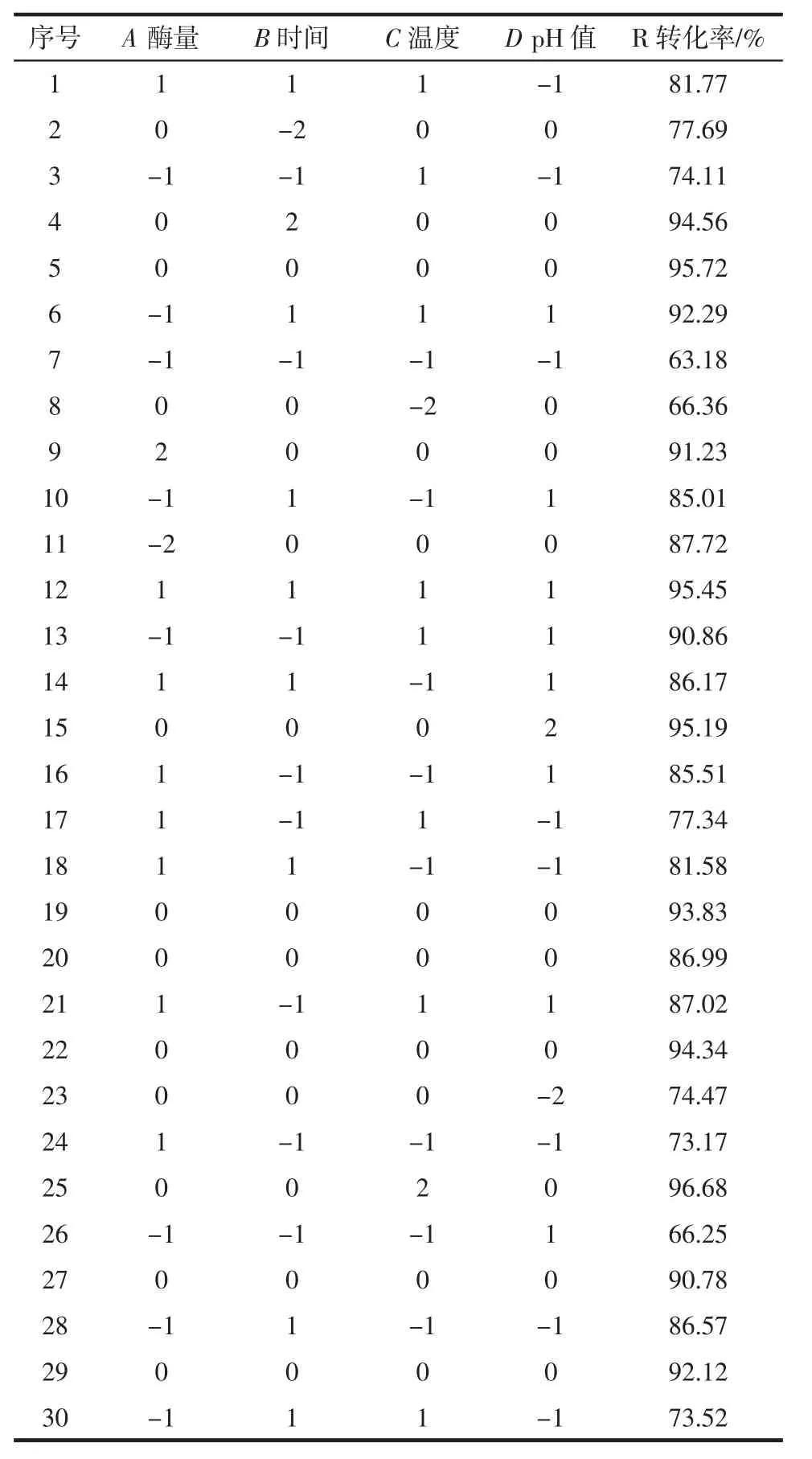
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken test
利用Design-Expert 8.06进行回归拟合,得到各酶解因素与低聚果糖转化率(R)的回归方程为:R=1.801 67A+4.110 83B+4.398 33C+4.948 33D-1.316 25AB-0.913 75AC+0.203 75AD-2.345BC-0.397 50BD+2.527 5CD-1.413 75A2-2.251 25B2-3.402 5C2-2.575D2+92.296 67
为确定响应面试验设计中4个试验因素对菊芋菊粉酶解效果的影响,以及各个因素的交互作用和显著性,进行方差分析见表3。
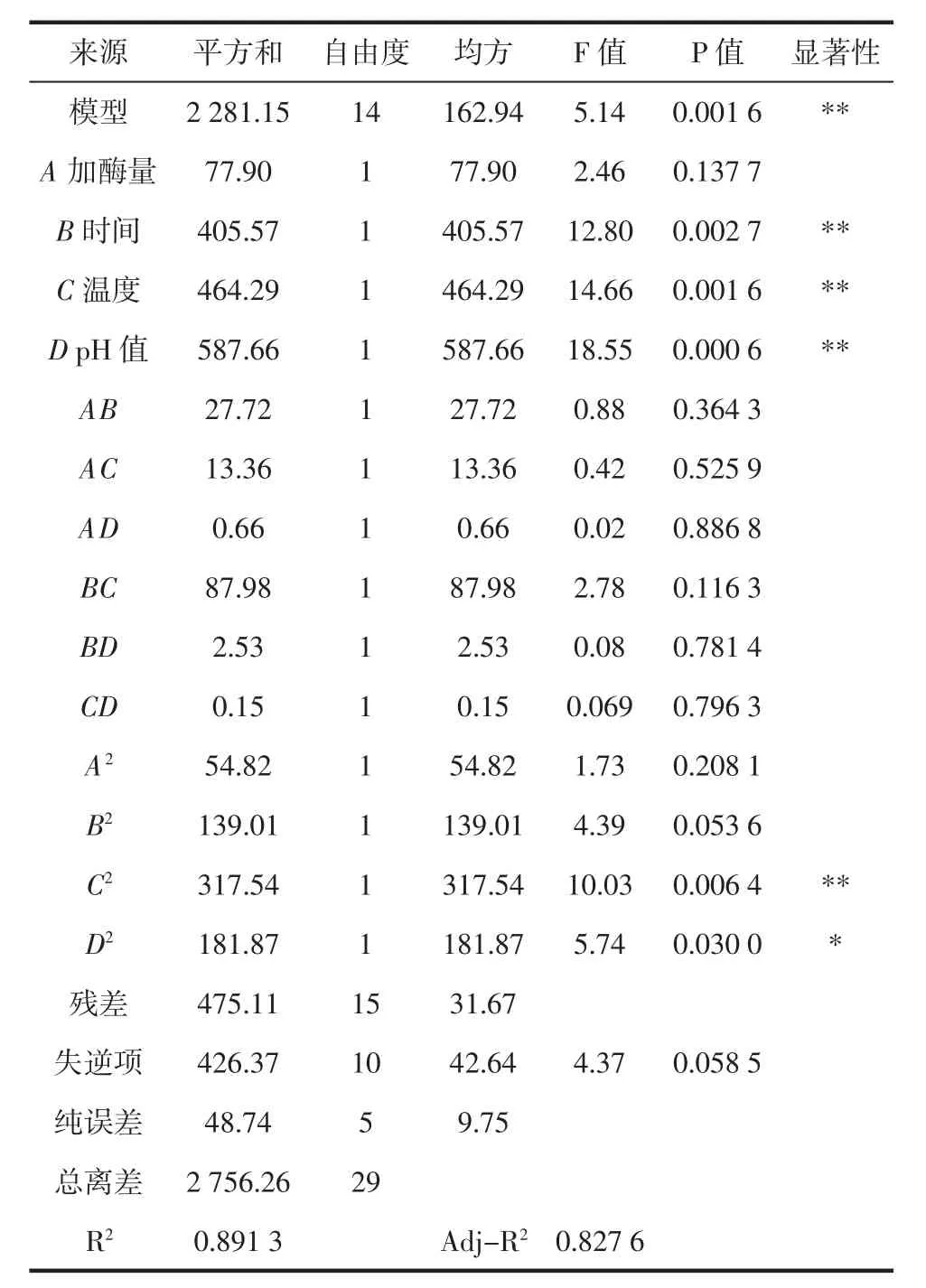
表3 方差分析结果Table 3 Results of variance analysis
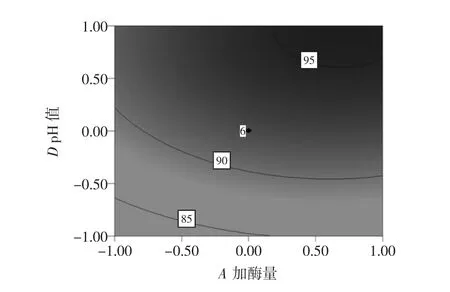
结果显示:模型P<0.01,相关系数R2为0.891 3,校正系数Adj-R2为0.827 6,响应变量高于0.80,模型回归极显著,各因素之间的交互作用不显著(见图5~10)。失拟项不显著(P>0.05),表明该回归方程对菊粉液的酶解试验拟合情况良好。通过模型系数显著性检验,得到酶解因素的主效应关系:D>C>B>A,即酶解pH 值>温度>时间>加酶量,其中 B、C、D、C2对酶解效果影响极显著,而因素D2对菊粉液酶解效果有显著影响。

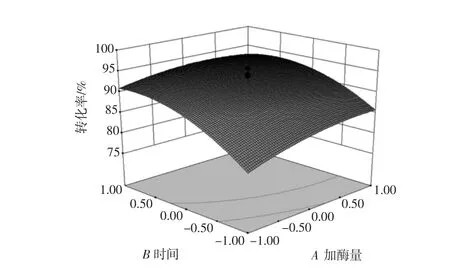
图5 加酶量和酶解时间对酶解效果的影响Fig.5 Effect of enzyme dosage and time on enzymolysis

图6 加酶量和酶解温度对酶解效果的影响Fig.6 Effect of enzyme dosage and temperature on enzymolysis
通过S960内切型菊粉酶对菊芋菊粉液的降解处理,响应面设计优化其酶解工艺参数为:加酶量2.5U/g、时间6.0h、温度60℃、pH值为6.0。对其最佳工艺进行验证,验证实测值为96.27%,与预测值之间的相对误差为1.91%。
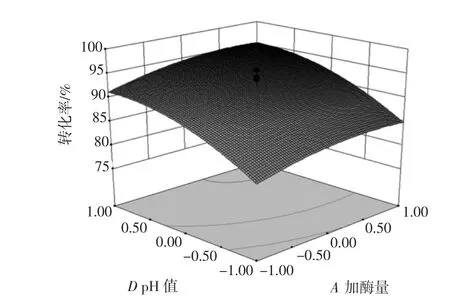
图7 加酶量和酶解pH值对酶解效果的影响Fig.7 Effect of enzyme dosage and pH on enzymolysis
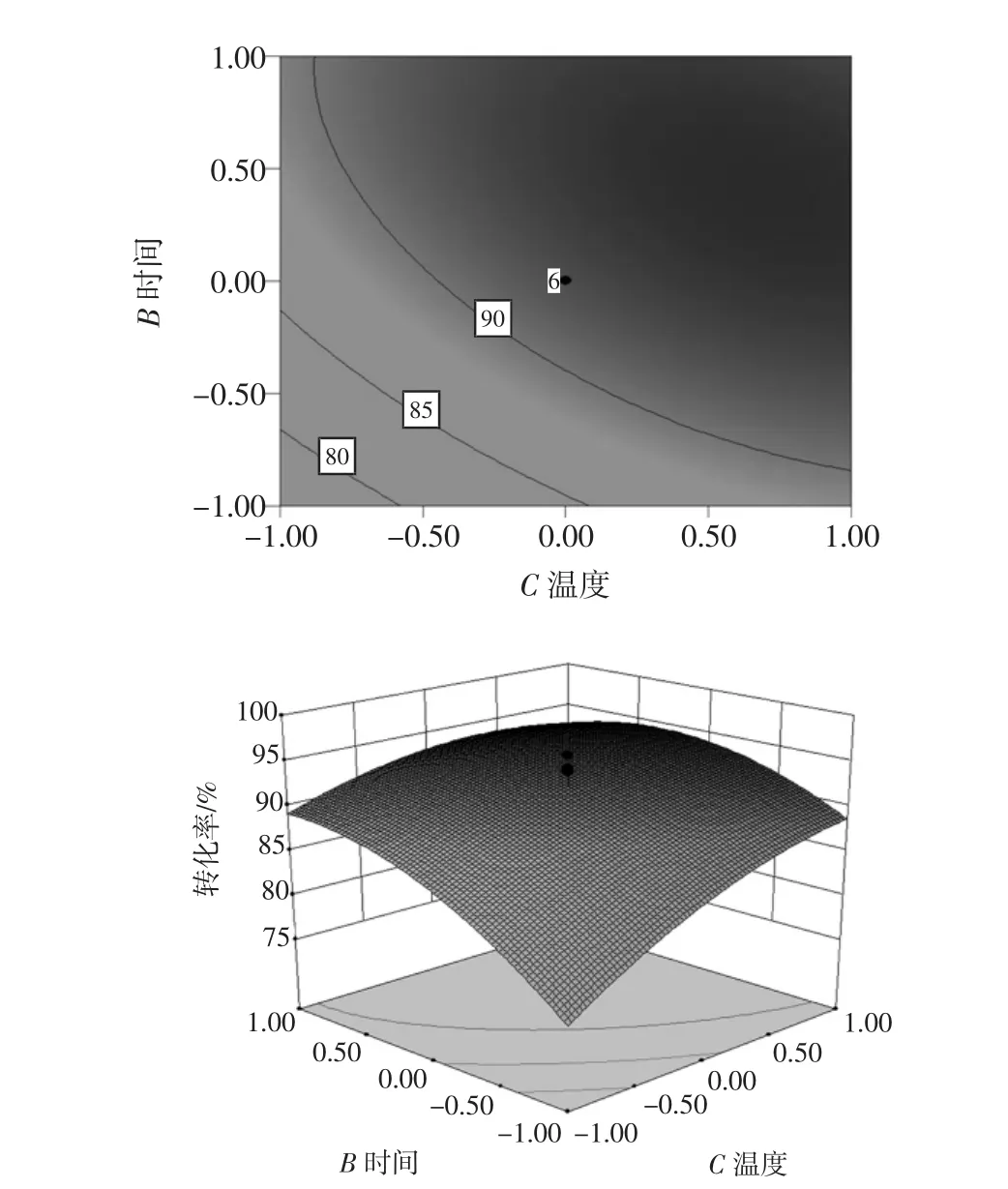
图8 酶解时间和温度对酶解效果的影响Fig.8 Effect of temperature and time on enzymolysis
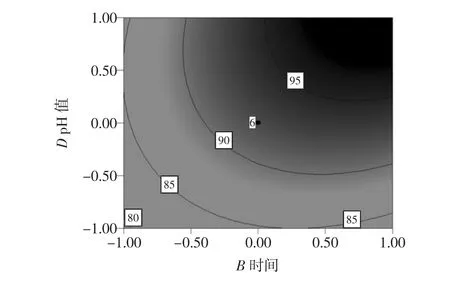
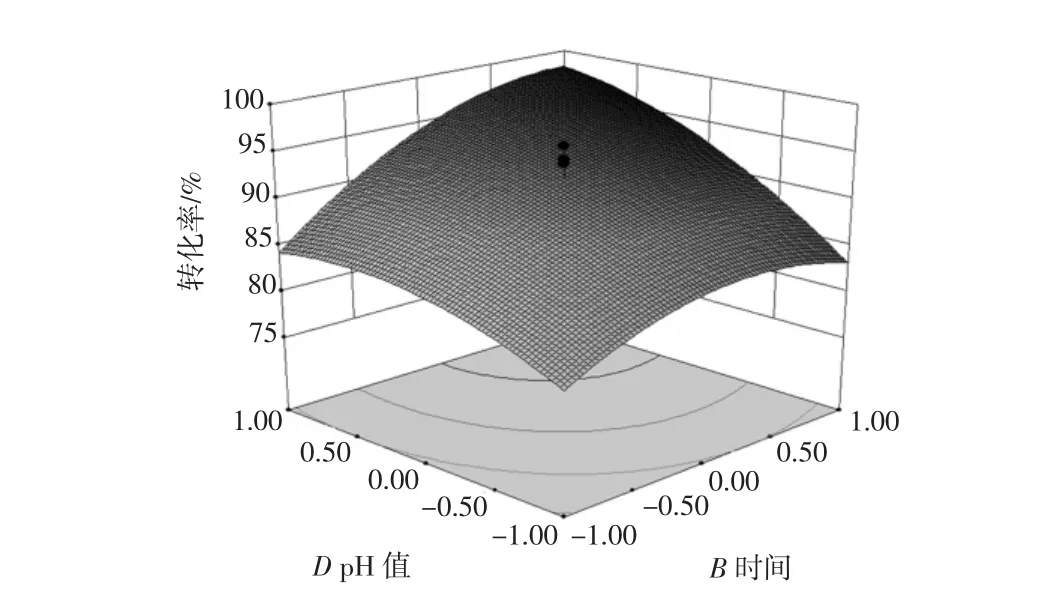
图9 酶解时间和pH值对酶解效果的影响Fig.9 Effect of time and pH on enzymolysis
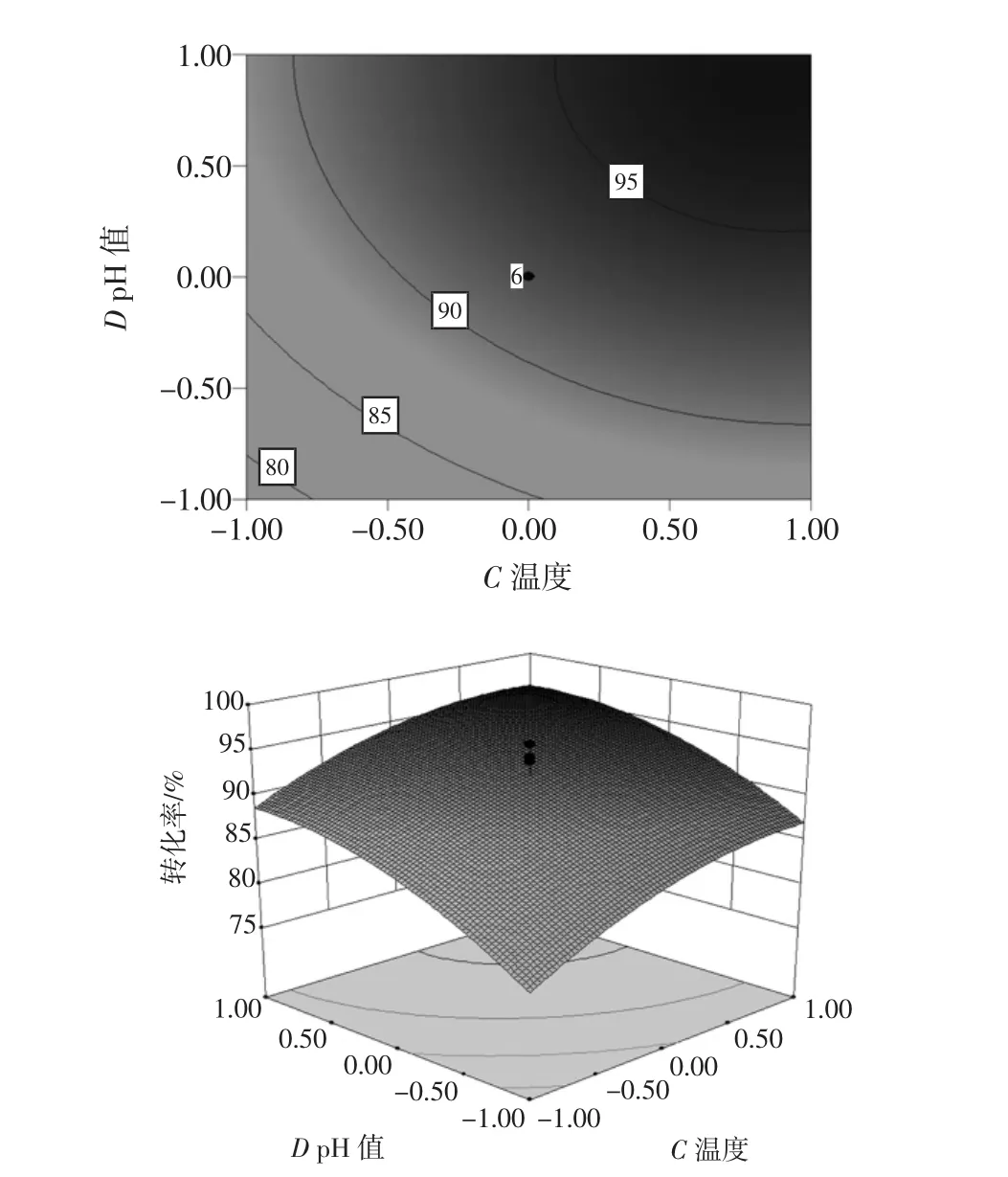
图10 酶解温度和pH值对酶解效果的影响Fig.10 Effect of temperature and pH on enzymolysis
3 结论
通过S960内切型菊粉酶降解菊芋菊粉液制取低聚果糖,采用响应面试验设计优化酶解工艺,其最佳酶解参数为:加酶量2.5 U/g、温度60℃、时间6.0 h、pH值为6.0,此时低聚果糖的转化率为96.27%。
[1] 乌日娜,朱铁霞,于永奇,等.菊芋的研究现状及开发潜力[J].草业科学,2013,30(8):1295-1300
[2] 刘祖昕,谢光辉.菊芋作为能源植物的研究进展[J].中国农业大学学报,2012,17(6):122-132
[3] 华承伟,谢凤珍,王建华,等.内切酶法制取菊苣低聚果糖工艺条件的研究[J].生物技术通讯,2007,18(4):13-17
[4] Lobo A R,Colli C,Alvares E P.Effects of frutans-containing yacon(Smallanthus sonchiflius Poepp and Endl.)flour on caecum mucosal morphometry,calciumand magenesium balance and bone calcium retention in growing rats[J].British Journal of Nutrition,2007,97:776-785
[5] Kaur N,Gupta A K.Applications of inulin and obigo-fructose in health and nutrition[J].Journal of Bioscience,2007,27(7):703-714
[6] 罗登林,武延辉,徐宝成,等.菊粉在面制品中的应用现状及展望[J].食品科学,2014,35(3):253-258
[7] 李雨露,刘丽萍,佟丽媛,等.菊粉对低糖低脂酸奶品质的影响[J].食品与发酵工业,2015,41(12):131-134
[8] 姜彩霞,万莉,姚德坤,等.菊苣低聚果糖在食品加工过程中的应用[J].中国林副特产,2016,35(3):95-97
[9] Morris C,Morris G A.The effect of inulin and fructo-oligosaccharide supplementation on the textural,rheological and sensory properties of bread and their role in weight management:a review[J].Food Chemistry,2012,133(2):237-248
[10]丁红梅.黑曲霉内切菊粉酶生产菊芋低聚果糖工艺及应用研究[D].重庆:西南大学,2008
[11]王静,金征宇,江波,等.Aspergillus ficunm菊粉酶的分离纯化及其酶解菊粉制备低聚果糖[J].食品工业科技,2008,29(11):309-312
[12]陈昱,王丽娜,昌盛,等.菊粉低聚糖的工艺优化研究[J].食品科技,2012,37(4):238-240
[13]李翠莲,方北曙.固定菊粉酶酶解菊芋提取液制备果糖的研究[J].安徽农业科学,2008,36(8):3356-3357
[14]翟丹云,陈兴都,陈庆安,等.响应面设计优化复合酶法提取菊苣菊粉工艺研究[J].食品工业科技,2015,36(6):190-194
Study on Enzymatic Hydrolysis Processing of Fructo-oligosaccharide from Jerusalem Artichoke
CHEN Xing-du,ZHAI Dan-yun,CHEN Qing-an,ZHAO Li-li,DONG Yan-hu,LI Yun,NIU Jie
(Gansu Institute of Business and Technology,Lanzhou 730010,Gansu,China)
Fructo-oligosaccharide was prepared from extraction of Jerusalem artichoke as a inulinase immobilization hydrolysis method.Four enzymolysis parameters including enzyme dosage,enzymolysis temperature,enzymolysis time and enzymolysis pH were optimized as the result of the conditions for enzymolysis of fructooligosaccharide from Jerusalem artichoke by Box-Behnken Response surface design methodology based on the percent conversion as a response value.Results showed that the optimum condition of enzymolysis was as follows:the dosage of enzyme 2.5 U/g,enzymolysis time 6.0 h,enzymolysis temperature 60℃,and enzymolysis pH6.0.Under this condition fructo-oligosaccharide percent conversion was up to 96.27%.Compared with predicted values and the relative error was 1.91%.
jerusalem artichoke;fructo-oligosaccharide;inulinase;percent conversion;response surface design
2016-09-07
10.3969/j.issn.1005-6521.2017.11.024
甘肃省技术研究与开发专项计划(1207TCYA039)
陈兴都(1987—),男(汉),工程师,硕士研究生,主要从事食品工艺、天然产物等相关研究。
