超声波提取枣树皮中总黄酮的条件研究
2017-07-18王英超金红王燕霞张平平
王英超,金红,王燕霞,张平平
(1.天津农学院基础科学学院,天津300384;2.天津农学院农学与资源环境学院,天津300384;3.天津农学院食品科学与生物工程学院,天津300384)
超声波提取枣树皮中总黄酮的条件研究
王英超1,金红2,*,王燕霞1,张平平3
(1.天津农学院基础科学学院,天津300384;2.天津农学院农学与资源环境学院,天津300384;3.天津农学院食品科学与生物工程学院,天津300384)
采用超声波法提取金丝小枣枣树皮中的总黄酮。通过单因素试验研究了料液比、乙醇体积分数、提取时间、超声功率和超声温度等因素对总黄酮提取率的影响,并进行了四因素三水平正交试验,确定了枣树皮总黄酮的最佳提取条件。结果表明:最佳提取条件为料液比1∶15(g/mL),乙醇体积分数50%,提取时间50 min,超声功率342 W,提取温度70℃,提取两次。此条件下总黄酮的平均提取率为5.53%。
超声波;枣树皮;黄酮;正交试验
黄酮类物质属于多酚类,是在各种植物体中存在较多的一种天然成分[1],具有抗癌[2]、抑菌[3]、镇痛消炎[4]的作用。枣树皮为枣树树干或树枝的外层,颜色为褐色或者灰褐色,具有止泻、祛痰、镇咳、止血等作用[5-7]。20世纪90年代后,利用枣提取黄酮的研究多以枣树的叶和果实为研究对象[8-11],对于利用枣树皮提取总黄酮类物质的研究鲜见报道,笔者采用超声波法提取枣树皮中总黄酮类物质,研究了料液比、乙醇浓度、时间、超声功率和温度等5个单因素对枣树皮中总黄酮提取率的影响,正交试验确定了最佳提取条件,为枣树皮资源的开发利用提供参考。
1 材料与方法
1.1 试验材料
金丝小枣枣树皮:采自河北省沧州市枣园。蒸馏水洗净后,60℃烘干,粉碎过70目筛备用。
1.2 主要试剂
无水乙醇、亚硝酸钠、氢氧化钠、盐酸和抗坏血酸:购自天津市风船化学试剂科技有限公司;硝酸铝:购自天津市精细化工研究所;三羟甲基氨基甲烷:购自北京鼎国昌盛生物技术有限责任公司;邻苯三酚:购自Sigma-Aldrich;芦丁:购自上海伊卡生物技术有限公司;1,1-二苯基-2-三硝基苯肼:购自上海市瑞永生物科技有限公司。
1.3 主要仪器
DHG-9240A电热恒温鼓风干燥箱:上海一恒科技有限公司;YS-08小型高速粉碎机:北京燕山正德机械设备有限公司;P180H超声波清洗器:Elma-Hans Schmidbauer GmbH;L550低速离心机:长江湘仪离心机仪器有限公司;TE 4101-L电子天平:赛多利斯科学仪器有限公司;Alpha-1500紫外可见分光光度计:上海谱元仪器有限公司;RE-2000A旋转蒸发仪:上海雅荣生化设备仪器有限公司;STARTER 3100 pH计:奥豪斯仪器(上海)有限公司。
1.4 方法
1.4.1 标准曲线的制作
称取芦丁标准品10 mg,用75%乙醇溶解并定容至100 mL。取5支试管编号,分别吸取芦丁标准品溶液 1、2、3、4、5 mL 于试管中,再分别对应加入 4、3、2、1、0 mL 75%乙醇溶液于5支试管中。各管分别加入1 mL 5%NaNO2溶液,振摇混匀,放置6 min;接着加入1 mL 10%Al(NO3)3溶液,振摇反应 6 min;再加入10 mL 4%NaOH溶液,摇匀静置15 min。以75%乙醇为对照,在510 nm处测定1~5号试管的吸光度值。以芦丁浓度(mg/mL)为横坐标,吸光度值为纵坐标,得到芦丁标准曲线方程为y=7.897 1x-0.015 4,R2=0.994 8。
1.4.2 不同料液比对枣树皮总黄酮提取率的影响
准确称取枣树皮粉末1 g,放入50 mL三角瓶中,按料液比 1 ∶5、1 ∶10、1 ∶15、1 ∶20、1 ∶25(g/mL)分别加入70%的乙醇。50℃,超声功率80%(超声最大功率304 W)的条件下超声30 min,共提取两次。将两次超声提取液合并之后,4 000 r/min离心10 min。取上清液各2.5 mL于5支25 mL比色管中,后续操作按照1.4.1中的方法进行。计算不同料液比下黄酮的提取率。计算公式为:
提取率/%=C×稀释体积×V1×100/(V2×m)
式中:C为枣树皮提取液总黄酮浓度,mg/mL;V1为提取液体积,mL;V2为取样体积,mL;m为所用枣树皮粉末质量,mg。以枣树皮中总黄酮的提取率为评价指标,探讨不同的料液比对枣树皮总黄酮提取率的影响。
1.4.3 不同乙醇体积分数对枣树皮总黄酮提取率的影响
称取枣树皮粉末1 g,共5份,放入5个50 mL三角烧瓶中,按1∶15(g/mL)的料液比加入30%、40%、50%、60%、70%的乙醇溶液,充分混匀后,50℃,304 W的条件下超声30 min,提取两次。提取液合并后,4 000 r/min离心10 min。后续操作按照1.4.1中的方法进行。探讨乙醇体积分数对超声提取枣树皮总黄酮提取率的影响。
1.4.4 不同提取时间对枣树皮总黄酮提取率的影响
称取枣树皮粉末1 g,共6份,放入6个50 mL三角烧瓶中,按料液比1∶15(g/mL)加入50%的乙醇,50 ℃,304W 下,分别超声提取 20、30、40、50、60、70 min,提取两次。后续操作按照1.4.1中的方法进行,研究不同的提取时间对枣树皮总黄酮提取率的影响。
1.4.5 不同超声功率对枣树皮总黄酮提取率的影响
称取枣树皮粉末1 g,共6份,放入6个50 mL三角烧瓶中,按料液比1∶15(g/mL)加入50%乙醇,分别在超声功率 152、190、228、266、304、342 W,50 ℃的条件下,超声60 min,提取两次。后续操作按照1.4.1中的方法进行,探讨不同的超声功率对枣树皮总黄酮提取率的影响。
1.4.6 不同超声温度对枣树皮总黄酮提取率的影响
分别称取枣树皮粉末1 g,共6份,放入6个50 mL三角烧瓶中,按1∶15(g/mL)的料液比加入50%乙醇,分别在 30、40、50、60、70、80℃,超声功率 266 W 的条件下,超声60 min,提取两次。提取液合并后,4 000 r/min离心10 min。后续操作按照1.4.1中的方法进行,探讨不同的超声温度对枣树皮总黄酮提取率的影响。
1.4.7 正交试验
选取料液比、提取时间、超声功率和温度4个因素进行四因素三水平正交试验。以枣树皮总黄酮提取率为指标,确定超声提取枣树皮总黄酮的最佳提取条件。因素水平表见表1。
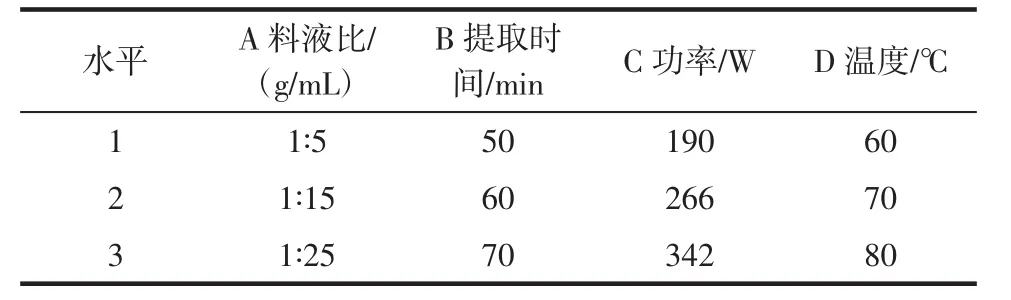
表1 因素水平表Table 1 Factors and levels
2 结果与分析
2.1 不同料液比对枣树皮总黄酮提取率的影响
不同料液比对枣树皮总黄酮提取率的影响结果见图1。
从图1中可以看出,在料液比1∶5(g/mL)至1∶15(g/mL)内,总黄酮提取率随着料液比的升高而升高,在1∶15(g/mL)时达到最大值1.9%,随后开始下降。这是由于料液比处于一定范围时,随着溶剂的量增大,提取率升高。当溶剂的量超过某一范围后,杂质溶出增大,与原材料中的黄酮竞争性溶出导致提取得率下降[12],故从成本方面考虑料液比应为1∶15(g/mL)。
2.2 不同乙醇体积分数对枣树皮总黄酮提取率的影响
不同乙醇体积分数对枣树皮总黄酮提取率的影响见图2。

图1 不同料液比对枣树皮总黄酮提取率的影响Fig.1 Effect of different solid-liquid ratio on the extraction rate of total flavonoids from jujube peel

图2 不同乙醇浓度对枣树皮总黄酮提取率的影响Fig.2 Effect of ethanol concentration on the extraction rate of total flavonoids from jujube peel
随着乙醇浓度的增大,枣树皮总黄酮的提取得率也随其增大,在乙醇浓度达到50%时,提取率达到2.43%,之后开始随着乙醇体积分数的增大而降低。黄酮类化合物在植物体中存在种类众多,乙醇体积分数在30%~50%范围内时提取得率较高,可能是由于溶液极性与枣树皮多数黄酮类物质极性相近,目标产物比较容易溶入提取剂中;之后,乙醇体积分数增大,极性降低,与黄酮类物质极性的相似程度降低,从而不利于黄酮类物质的溶出,提取率开始下降[13]。
2.3 不同提取时间对枣树皮总黄酮提取率的影响
不同提取时间对枣树皮总黄酮提取率的影响结果见图3。
如图3所示,总黄酮的提取率随着提取时间的提高而呈现平缓上升的趋势,在60 min时,总黄酮提取率为2.7%。超过60 min提取率下降。这可能是因为提取时间过短,黄酮还没有被完全提取出来,造成提取得率比较低;时间过长,枣树皮黄酮类物质部分被分解或者氧化,从而导致目标产物提取得率的降低[14]。因此利用超声对枣树皮总黄酮类物质的提取时间为60 min。
2.4 不同超声功率对枣树皮总黄酮提取率的影响
不同超声功率对枣树皮总黄酮提取率的影响结果见图4。
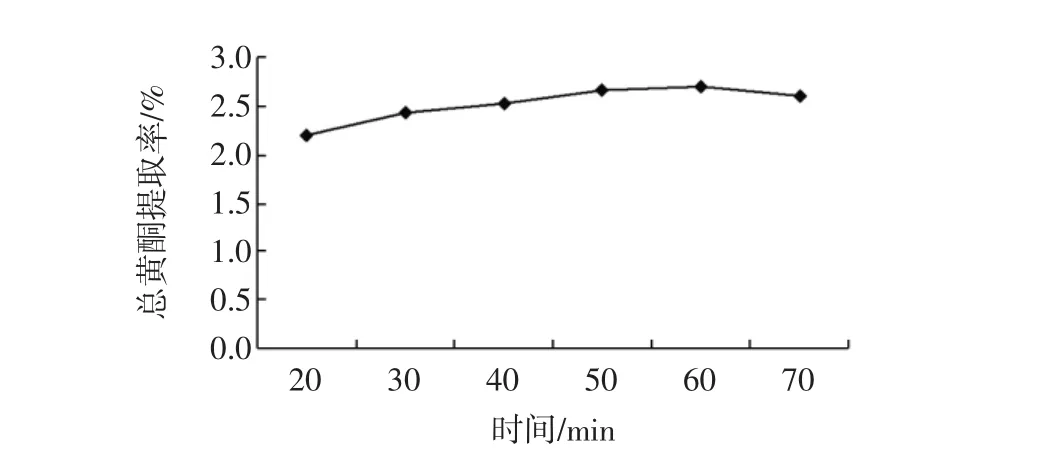
图3 不同提取时间对枣树皮总黄酮提取率的影响Fig.3 Effect of extract time on the extraction rate of total flavonoids from jujube peel

图4 不同超声功率对枣树皮总黄酮提取率的影响Fig.4 Effect of ultrasonic power on extraction of total flavonoids from jujube peel
在超声功率为152 W~266 W的区间内枣树皮总黄酮提取率近直线上升,在266 W时,总黄酮提取率达到2.75%。之后随着超声功率的持续增大,总黄酮提取率下降。超声功率较低时,超声产生的机械效应达不到使枣树皮细胞壁破坏的程度,黄酮的浸出阻力增大,导致提取得率比较低。但随着超声功率的过量加大,超声过程所产生的空化效应使枣树皮中的成分溶出加快,导致了枣树皮中杂质的溶出增加;热效应使分子运动更加剧烈,导致黄酮成分与提取出的杂质分子相互反应,从而导致枣树皮黄酮的提取得率下降[15]。因此,确定提取总黄酮的超声功率为266 W。
2.5 不同超声温度对枣树皮总黄酮提取率的影响
不同超声温度对枣树皮总黄酮提取率的影响结果见图5。
总黄酮提取率随着温度的升高而缓慢上升,至70℃时达到5.19%。之后随着温度的升高,提取率下降。温度的增加可以加快分子运动,加快枣树皮中目标成分的扩散速度和溶出速度,使更多的枣树皮黄酮成分溶出[16];温度过高,易导致乙醇挥发,造成溶剂减少,也有可能温度过高导致浸出的黄酮类物质成分被破坏,从而导致了提取率的下降。因此,确定提取总黄酮的超声温度为70℃。
2.6 正交试验结果
采用L9(34)正交试验确定最佳超声提取条件。试验结果如表2所示。

图5 不同超声温度对枣树皮总黄酮提取率的影响Fig.5 Effect of different ultrasonic temperature on the extraction of flavonoids from Jujube peel
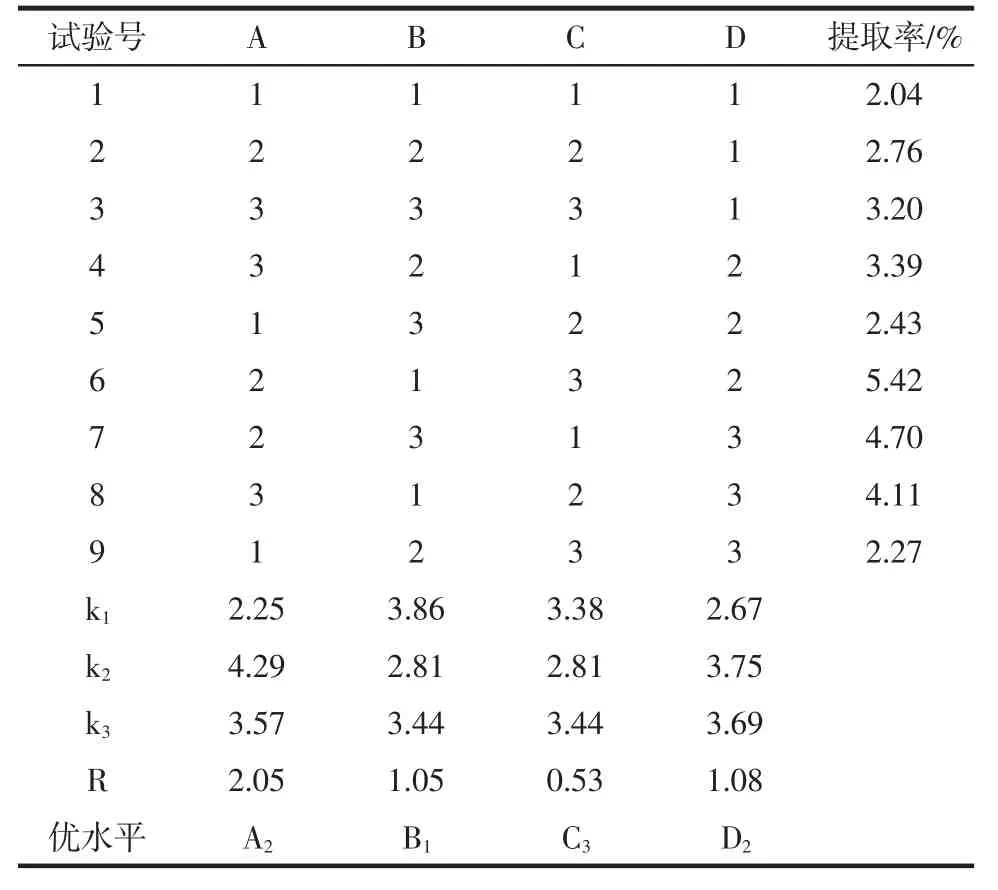
表2 正交试验结果Table 2 Results of orthogonal test
由极差分析可知,对枣树皮总黄酮提取率的影响因素大小为料液比、时间、温度、功率。正交试验得到最佳提取条件为 A2B1C3D2,即料液比 1 ∶15(g/mL),时间50 min,功率342 W,温度70℃。根据得到的最佳提取工艺,进行三组验证试验,测得枣树皮总黄酮提取率为5.53%。
3 讨论
常规提取天然产物的方法有冷浸提取、索氏提取和回流提取。冷浸提取法由于不用加热,可以避免对原材料中的某些目标产物的破坏,但是所用时间较长;索氏提取由于需要将原料长期浸润,所以对于提取剂的消耗量比较大;回流提取由于对原料加热时间较长,所以不适用于对温度敏感的物质的提取,同时用时较长。超声提取由于其作用原理的不同——直接作用于原材料细胞,并且具有空化、机械等效应,具有提取产率高,节省提取时间,节约成本等优点在试验过程中发现,单因素试验时,当超声温度升至70℃时,具有最高的提取得率;正交试验时,最佳超声温度水平同样为70℃,与程力惠、徐砺瑜等[17-18]报道的提取核桃楸树皮与杨梅树皮中黄酮的超声温度不一致。这是由于各品种中的树皮成分不一致,树皮中黄酮种类也不尽相同,枣树皮中对热稳定的黄酮类物质占比较大,所以在温度较高时仍然有较高的提取率。
4 结论
确定枣树皮总黄酮的超声提取最佳工艺组合为:料液比 1 ∶15(g/mL),乙醇浓度 50%,时间 50 min,超声功率342 W,超声温度70℃,提取两次。通过三组验证试验,得到枣树皮总黄酮的提取率为5.53%。
[1] 赵雪巍,刘培玉,刘丹,等.黄酮类化合物的构效关系研究进展[J].中草药,2015,46(21):3264-3271
[2] Shunan Tang,Wei Huang,Shuai Ji,et al.Prenylated flavonoids from Glycyrrhiza uralensis as promising anti-canceragents:a preliminary structure-activity study[J].Journal of Chinese Pharmaceutical Sciences,2016,25(1):23-29
[3] 孙丽萍,杜夏,陈有根,等.油菜蜂花粉中抑菌活性成分的分离纯化和结构鉴定[J].食品科学,2011,32(19):75-78
[4] 张博男,储金秀,韩淑英.荞麦花叶总黄酮的舒张血管作用及其机制[J].中国药理学通报,2010,26(7):952-956
[5] 高姣.枣种质资源遗传多样性研究及核心种质构建[D].北京:北京林业大学,2015:1-30
[6] 唐忠建,罗建国,吕玲,等.枣股的生长习性及促进枣股生长发育的技术研究[J].陕西农业科学,2011(4):22-23
[7] 杨艳梅,毛晓宇,马海燕.枣树的生态习性及栽培技术[J].现代农村科技,2014(9):33
[8] 司传领,吴磊,许杰,等.沙枣树中总黄酮的分布规律研究[J].纤维素科学与技术,2010,18(4):43-48
[9] 王君,王敏.冬枣黄酮的提取及其抗氧化作用探讨[J].山东工业技术,2015(22):32
[10]刘晔玮,王勤,宋海,等.沙枣叶中总黄酮的含量测定方法研究[J].现代中药研究与实践,2006,20(1):42-44
[11]李加兴,陈选,邓佳琴,等.黄秋葵黄酮的提取工艺和体外抗氧化活性研究[J].食品科学,2014,35(10):121-125
[12]刘海鸥,虎春艳,赵声兰,等.滇黄芩总黄酮酶解超声提取工艺及抗氧化活性研究[J].中国酿造,2016,35(1):110-114
[13]罗飞华,杨莉,张萍,等.杜仲叶中总黄酮的超声波提取工艺优化[J].绿色科技,2015(11):247-249
[14]刘永青,任琳,张子峰,等.响应曲面法优化超声波提取白蒿总黄酮研究[J].天津农业科学,2015,21(11):63-67
[15]胡晓丹,孙爱东,张德权.超声波提取紫苏叶黄酮的工艺研究[J].安徽农业科学,2009,37(5):2046-2048
[16]温馨,田甜,沈悦,等.超声波辅助提取变叶海棠中总黄酮工艺优化及抗氧化活性研究[J].天然产物研究与开发,2016,28(3):452-456,461
[17]程力惠,潘育方,卢丽霞.核桃楸树皮总黄酮提取方法及工艺研究[J].亚热带植物科学,2009,38(4):41-43
[18]徐砺瑜,秦刚.杨梅树皮黄酮的提取及体外抗氧化研究[J].生物学杂志,2011,28(1):50-52
Study on the Conditions of Total Flavonoids from Jujube Peel by Ultrasonic Extraction
WANG Ying-chao1,JIN Hong2,*,WANG Yan-xia1,ZHANG Ping-ping3
(1.College of Basic Science,Tianjin Agriculture University,Tianjin 300384,China;2.College of Agronomy and Resource Environment,Tianjin Agriculture University,Tianjin 300384,China;3.College of Food Science and Biotechnology,Tianjin Agricultural University,Tianjin 300384,China)
Total flavonoids from jujube peel was extracted by ultrasonic method.Experiments of single factor including solid-liquid ratio,ethanol concentration,extraction time,ultrasonic power and temperature were done to find the influence of various factors on the extraction rate.Based on single factor experiments,four factor and three level orthogonal test was designed.The results showed that optimum extraction conditions of total flavonoids from jujube peel were solid-liquid ratio 1∶15 (g/mL),50%ethanol concentration,extraction time 50 min,power of 342 W,temperature 70℃,two step extraction.The average extraction rate of total flavonoids was 5.53%.
ultrasound;jujube peel;total flavonoids;orthogonal test
2016-09-06
10.3969/j.issn.1005-6521.2017.11.012
天津市科技支撑项目(11ZCKFNC01600)
王英超(1981—),女(汉),实验师,硕士,研究方向:生物化学实验教学与研究工作。
*通信作者:金红(1967—),女(汉),研究员,硕士,研究方向:主要从事生物化学教学与生物技术研究。
