藤三七多糖超声波辅助提取工艺及抗氧化性研究
2017-07-18杨申明王振吉陈文范树国罗鑫
杨申明,王振吉,陈文,范树国,罗鑫
(楚雄师范学院化学与生命科学学院,云南楚雄675000)
藤三七多糖超声波辅助提取工艺及抗氧化性研究
杨申明,王振吉,陈文,范树国,罗鑫
(楚雄师范学院化学与生命科学学院,云南楚雄675000)
以藤三七为材料,优化超声波辅助提取藤三七多糖的提取工艺,并测定其多糖的抗氧化性。在单因素试验的基础上,通过正交试验优化超声波辅助提取多糖的最佳工艺条件;并通过藤三七多糖对·OH、DPPH·和O2-·的清除来评价抗氧化性。结果表明:藤三七多糖的最佳提取工艺条件为:液料比50∶1(mL/g)、超声温度50℃、超声功率350 W,超声时间60min,在此条件下多糖提取率为6.24%,平均加样回收率为94.56%。多糖质量浓度为0.024 2 g/mL时,对·OH、DPPH·和O2-·的清除率可分别为67.59%、61.01%和81.46%,说明藤三七多糖具有较强的体外抗氧化活性。
藤三七;多糖;超声波辅助提取;正交试验;抗氧化性
藤三七,又称洋落葵、落葵薯、川七、疑洛葵、藤子三七,为落葵科(Basellaceae)植物落葵属(Basella)Boussingaultia gracilis Miers var.Pseudobaselloides Bailey的珠芽[1-2]。它属药食两用,在我国主要分布在云南、四川、广东、福建、浙江等地[3]。藤三七作蔬菜食用,其营养价值较高,除含有蛋白质、各种矿物元素外,还富含维生素、胡萝卜素等营养物质[4-6],经常食用藤三七可增强人体的免疫力,是一种独特的绿色食品[7]。《新华本草纲要》中记载,藤三七具有补益肝肾、壮腰膝、消肿散痰、健胃保肝等功效,在民间常用藤三七来治疗腰膝痹痛、病后体弱、跌打损伤等病症,疗效显著。现代药理研究明,藤三七具有杀菌消炎[8-9]、降血糖[10-11]、抗HIV[12]、抗脂质过氧化[13]等作用。
目前,国内外对藤三七的研究主要集中在化学成分[8,12,14-15]、营养成分[4-6]、药理作用[9-11,13]、食用与养生保健[16-17]、栽培技术[18-19]等方面,未见有关藤三七多糖类物质的提取工艺及抗氧化性研究的相关报道。多糖广泛存在于植物、动物和微生物等体内中,具有多种生物活性。研究表明[20-21],植物多糖具有免疫调节功能及抗肿瘤、抗病毒、抗衰老、抗凝血、降血糖、降血脂、抗溃疡等多种生物活性及药理作用,而且来源较广,细胞毒性较低,是许多新药和功能性食品开发的重要来源。因此,从植物中提取多糖并对其生物活性进行研究,对进一步开发利用植物多糖具有重要意义和价值。
本研究以藤三七为原料,采用超声波辅助提取其多糖,研究提取工艺条件中液料比、超声温度、超声功率和超声时间对藤三七多糖提取率的影响,通过正交试验优化提取工艺条件;同时,对所提取的藤三七多糖从清除·OH、DPPH·和O2-·的能力3个方面来研究其抗氧化性,旨在为藤三七保健品的开发提供理论依据和科学参考。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
藤三七:采自楚雄师范学院校园内,经鉴定为落葵科植物落葵薯(Basella)Boussingaultia gracilis Miers var.Pseudobaselloides Bailey的珠芽。
葡萄糖标准品:天津市优谱化学试剂有限公司;1,1-苯基-2-苦肼基自由基(DPPH):上海蓝季科技发展有限公司;抗坏血酸:昆山谱森实验室用品科技有限公司;其它所用试剂均为分析纯:天津市化学试剂三厂。
1.1.2 仪器与设备
Alpha-1502紫外可见分光光度计:上海谱元仪器有限公司;SK8210HP型超声波清洗器:上海科导超声仪器有限公司;SHZ-III A型循环水真空泵:巩义市予华仪器有限责任公司;CP224C型电子天平:奥豪斯仪器上海有限公司;HWS-26型电热恒温水浴锅:金坛市大地自动化仪器厂;DG-111型电热干燥箱:威瑞科教仪器有限公司。
1.2 方法
1.2.1 供试材料处理
将采集到新鲜的藤三七用蒸馏水洗净晾干后切片,置于55℃干燥箱中烘干,粉碎过60目,得藤三七干粉。取适量藤三七干粉用滤纸包好后置于索氏提取中,加适量石油醚浸泡24 h,然后将其置于水浴中索氏回流提取,除去样品中脂类及脂溶性色素,然后取出样品滤纸包风干至石油醚全部挥发,再将滤纸包置于55℃干燥箱中烘干,得去除色素和油脂的藤三七干粉,备用。
1.2.2 供试品溶液制备
精确称取2.00 g去除色素和油脂的藤三七干粉,置于250 mL锥形瓶中,加入100 mL蒸馏水,在超声温度50℃,超声功率350 W的超声波中提取60 min,提取完毕后,往滤液中加0.20 g活性炭脱色,减压抽滤,取上层滤液,用Sevag法(氯仿与正丁醇的体积比为4∶1)脱除蛋白后,把溶液定容至50 mL容量瓶中,摇匀,得藤三七多糖提取液,即供试品溶液。
1.2.3 藤三七多糖含量测定
1.2.3.1 标准曲线的绘制
[22]的方法,稍作修改。精确吸取质量浓度 1.000 mg/mL 葡萄糖标准液 0.0、0.5、1.0、1.5、2.0、2.5、3.0 mL于7个50 mL的容量瓶中,用蒸馏水定容至刻度,摇匀。再精确吸取这7种溶液2.0 mL分别置于25 mL的比色管中,依次精确加入1.0 mL新配制的5%苯酚溶液,摇匀后缓慢加入5.0 mL浓硫酸,摇匀后静置5 min,置沸水浴中加热15 min后,取出冷至室温;用2.0 mL蒸馏水按同样操作作空白,在波长490 nm处测定吸光度。由测定的吸光度和葡萄糖标准溶液的浓度,得到标准曲线A=16.282C-0.004 3(A为吸光度;C为葡萄糖标准溶液浓度,mg/mL;R2=0.999 7)。
1.2.3.2 多糖提取率计算
精确吸取2.0 mL藤三七多糖提取液于50 mL容量瓶中,用蒸馏水定容至刻度线,混匀。再精确吸取2.0 mL置于25 mL的比色管中,标准曲线绘制方法在波长490 nm处测定吸光度。多糖提取率计算公式为:
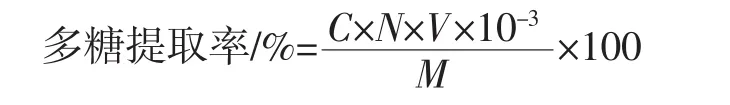
式中:C为所测藤三七多糖溶液的吸光度值带入回归方程计算出的多糖类化合物质量浓度,mg/mL;N为稀释倍数;V为藤三七提取液定容的体积,mL;M为藤三七干粉的质量,g。
1.2.4 单因素试验
在前期预试验对提取溶剂、提取方法考察的基础上,选较佳提取溶剂蒸馏水作为提取溶剂,较佳提取方法超声波辅助法作为提取方法。分别考察以下单因素影响:1) 选择液料比分别为 30 ∶1、40 ∶1、50 ∶1、60 ∶1、70∶1(mL/g)的条件下进行比较,超声温度 40℃,超声功率350 W,超声时间40 min;2)确定了液料比50∶1(mL/g)提取效果较好后,分别在超声温度 20、30、40、50、60℃的条件下进行提取,超声功率350 W,超声时间40 min;3)确定了超声温度40℃提取效果较好后,分别在超声功率 300、350、400、450、500 W 的条件下进行提取,液料比 50 ∶1(mL/g),超声时间 40 min;4)确定了超声功率400 W提取效果较好后,分别在超声时间 30、40、50、60、70 min 的条件下进行提取,液料比50∶1(mL/g),超声温度40℃从而确定超声时间影响效果。
1.2.5 正交试验优化
在单因素试验的基础上,选取对藤三七多糖提取率影响较大的液料比(A)、超声温度(B)、超声功率(C)、超声时间(D)为试验考察因素,以藤三七多糖提取率为评价指标,设计L9(34)正交试验优化提取工艺参数,因素及水平见表1。
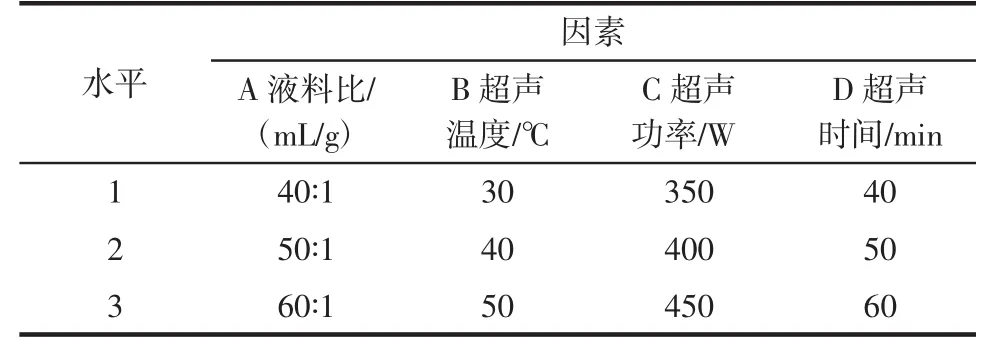
表1 正交试验因素及水平Table 1 Factors and levels of orthogonal design
1.2.6 加样回收率测定
取1.0 mL已测得藤三七多糖提取率的样品溶液,分别加入质量浓度为0.100 0 mg/mL葡萄糖对照液0.2、0.4、0.6、0.8、1.0 mL,按标准曲线绘制方法测定吸光度,计算回收率。
1.2.7 藤三七多糖抗氧化活性的测定
将超声辅助提取得到的藤三七多糖溶液分别配制成 0.004 8、0.009 7、0.014 5、0.019 4、0.024 2 mg/mL 5种质量浓度,研究其抗氧化性。
1.2.7.1 藤三七多糖对·OH的清除作用
参照文献[23]的测定方法,稍作修改。取不同质量浓度的藤三七多糖溶液1.0 mL于25 mL比色管中,依次分别加9 mmol/L FeSO4、9 mmol/L水杨酸-乙醇、8.8 mmol/L H2O2各2.0 mL,最后用蒸馏水定容至10mL,在37℃的水浴中恒温反应30 min,用蒸馏水作参比,在波长510 nm处测定吸光度值记为Ax;分别用水代替藤三七多糖溶液和H2O2溶液,其它按上述加入试剂量后,按上述方法测定吸光度值分别记为A0和Ax0。同时,以相同质量浓度的VC溶液作阳性对照,清除率计算公式为:
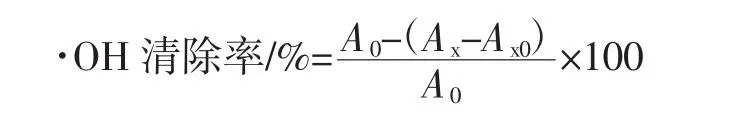
式中:A0为不加藤三七多糖溶液空白对照的吸光度;Ax为加H2O2藤三七多糖溶液的吸光度;Ax0为不加H2O2藤三七多糖溶液的吸光度。
1.2.7.2 藤三七多糖对DPPH·的清除作用
参照文献[24]的测定方法,稍作修改。向2.5 mL 2×10-4mol/L DPPH乙醇溶液中分别加入不同质量浓度的藤三七多糖溶液1.0 mL,混匀后避光保存反应30 min后,在波长517 nm处测吸光度记为Ai,同时测定2.5 mL 2×10-4mol/L DPPH乙醇溶液与1.0 mL无水乙醇溶液混合液的吸光度记为Ac,及2.5 mL无水乙醇与不同质量浓度的藤三七多糖溶液1.0 mL混合液的吸光度记为Ab。同时,以相同质量浓度的VC溶液作阳性对照,清除率计算公式为:
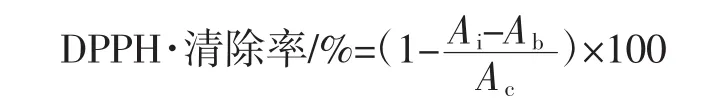
式中:Ac为不加藤三七多糖溶液空白对照的吸光度;Ai为DPPH溶液加藤三七多糖溶液的吸光度;Ab为无水乙醇加藤三七多糖溶液的吸光度。
1.2.7.3 藤三七多糖对O2-·的清除作用
参照文献[25]的测定方法,稍作修改。在5支25 mL比色管中加入不同质量浓度的藤三七多糖溶液1.0 mL,再依次加入4.5 mL 50 mmol/L Tris-HCl溶液(pH=8.2)、3.2 mL超纯水,混匀后在25℃水浴中恒温20 min后,取出后迅速加入25℃水浴中预热好的0.3 mL 3 mmol/L邻苯三酚溶液(以0.3 mL 10 mmol/L盐酸代替邻苯三酚作参比),混匀后迅速在波长325 nm处每隔30 s测一次吸光度,直到5 min时停止。计算藤三七多糖溶液的吸光度随时间的变化率Fx;取一支25 mL比色管不加藤三七多糖溶液,按上述加入试剂量后,按上述方法测定吸光度,计算空白液的吸光度随时间的变化率F0。同时,以相同质量浓度的VC溶液作阳性对照,清除率计算公式为:
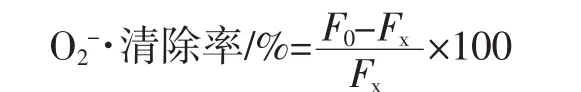
式中:F0为空白液的吸光度随时间的变化率;Fx为藤三七多糖溶液的吸光度随时间的变化率。
1.3 数据分析
所有试验均重复3次,结果取平均值,试验数据采用Excel 2007软件作图和分析处理。
2 结果与分析
2.1 提取工艺单因素试验结果
液料比、超声温度、超声功率、超声时间对多糖提取效果的影响见图1。
2.1.1 液料比对藤三七多糖提取效果的影响
在超声温度40℃、超声功率350 W、超声时间40 min的条件下,考察液料比对藤三七多糖提取效果的影响,结果见图1A。从图1A可以看出,液料比为30 ∶1(mL/g)~50 ∶1(mL/g)时,藤三七多糖提取率随提取溶剂用量的增大而增大,当液料比增大到50∶1(mL/g)时,提取率达到最大为5.68%;之后随提取溶剂用量的继续增大,藤三七多糖提取率下降。这可能是溶剂用量影响有效成分浸出溶液的浓度差,从而影响原料内部与外部之间提取成分的传质过程。在液料比较小时,短时间内多糖的溶出就达到平衡,不利于多糖的进一步溶出,但液料比太大受溶解度的约束作用变小,且溶剂用量过多导致后续蒸发困难,而底物浓度过低使得提取得率呈现下降趋势[26]。因此,确定适宜的液料比为 50 ∶1(mL/g),选择液料比为 40 ∶1、50 ∶1、60∶1(mL/g)进行正交试验。
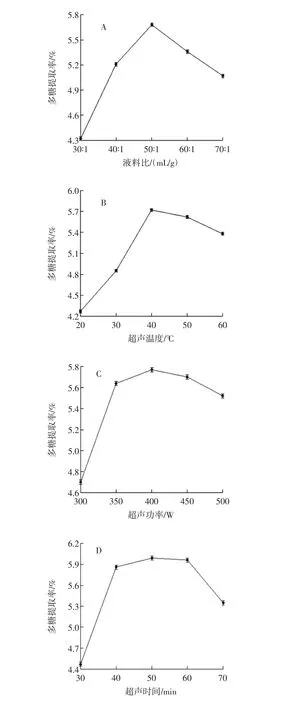
图1 液料比(A)、超声温度(B)、超声功率(C)和超声时间(D)对多糖提取效果的影响Fig.1 Effect of liquid/material ratio(A),ultrasonic temperature(B),ultrasonic power(C)and ultrasonic time(D)on the extraction yield of polysaccharide
2.1.2 超声温度对藤三七多糖提取效果的影响
在液料比 50∶1(mL/g)、超声功率 350 W、超声时间40 min的条件下,考察超声温度对藤三七多糖提取效果的影响,结果见图1B。从图1B可以看出,超声温度为20℃~40℃时,藤三七多糖提取率随超声温度的升高而增大,当超声温度升高到40℃时,提取率达到最大为5.72%;之后随超声温度的继续升高,藤三七多糖提取率下降。这是因为多糖在溶剂中溶解度一般随着温度的升高而增大,溶剂中多糖的质量分数则随着超声提取温度的升高而不断增大(40℃之前),即多糖提取率增大;但超声提取温度太高,一方面会破坏多糖的结构,另一方面细胞中其他杂质的溶出也应增加,使多糖质量分数下降(40℃之后),即多糖提取率下降。因此,确定适宜的超声温度40℃,选择超声温度30、40、50℃进行正交试验。
2.1.3 超声功率对藤三七多糖提取效果的影响
在液料比 50∶1(mL/g)、超声温度 40℃、超声时间40 min的条件下,考察超声功率对藤三七多糖提取效果的影响,结果见图1C。从图1C可以看出,超声功率为300 W~400 W时,藤三七多糖提取率随超声功率的增大而增大,当超声功率增大到400 W时,提取率达到最大为5.77%;之后随超声功率的继续增大,藤三七多糖提取率下降。这可能是由于超声波功率越大,产生的空化效应和机械作用越剧烈,加速粒子间的碰撞及扩散程度,导致多糖渗透出来的速率加快,但当超声功率达到一定值时,细胞内藤三七多糖含量逐渐减少,造成内外渗透压达到平衡,使多糖的渗透率降低[27]。因此,确定适宜的超声功率400 W,选择超声功率350、400、450 W进行正交试验。
2.1.4 超声时间对藤三七多糖提取效果的影响
在液料比 50∶1(mL/g)、超声功率 400 W、超声温度40℃的条件下,考察超声时间对藤三七多糖提取效果的影响,结果见图1D。从图1D可以看出,超声时间为30 min~50 min时,藤三七多糖的提取率随超声时间的延长而增大,当超声时间延长到50 min时,提取率达到最大为5.99%;之后随超声提取时间的继续延长,藤三七多糖的提取率逐渐减小。这可能是由于超声提取时间太长,多糖分子在强烈振动和空化效应作用下发生破坏和降解,同时也使一些水溶性杂质溶出,使得多糖得率下降。因此,确定适宜的超声时间50 min,选择超声时间40、50、60 min进行正交试验。
2.2 提取工艺参数优化正交试验结果
正交试验结果见表2。
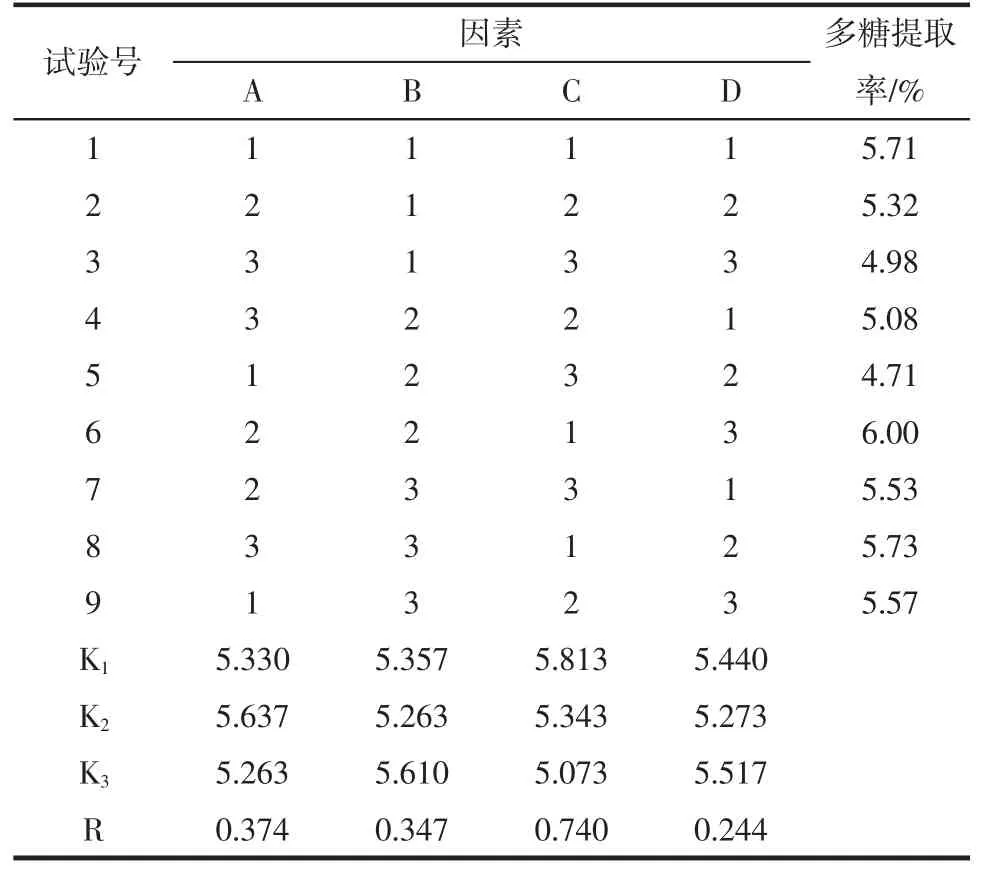
表2 正交试验结果Table 2 Results of the orthogonal experiment
由表2分析可知,影响藤三七多糖提取率的主次顺序依次为:C>A>B>D,即超声功率>液料比>超声温度>超声时间。藤三七多糖的最佳提取工艺参数为:A2B3C1D3,即液料比为 50∶1(mL/g),超声温度为 50℃,超声功率为350 W,超声时间为60 min。由于正交试验中没有出现A2B3C1D3最优组合,故在该条件下进行验证性试验,重复5次,测得藤三七多糖平均提取率为6.24%,大于正交试验结果中的最高提取率6.00%,相对标准偏差(RSD)值为0.55%,表明该方法重复性良好,适合于藤三七多糖的提取。
2.3 回收率测定结果
回收率试验结果见表3,平均加样回收率为94.56%,RSD值为0.91%,表明本试验方法对藤三七多糖提取率测量的准确度较高。
2.4 藤三七多糖抗氧化性分析
藤三七多糖对·OH、DPPH·和O2-·的清除作用见图2。
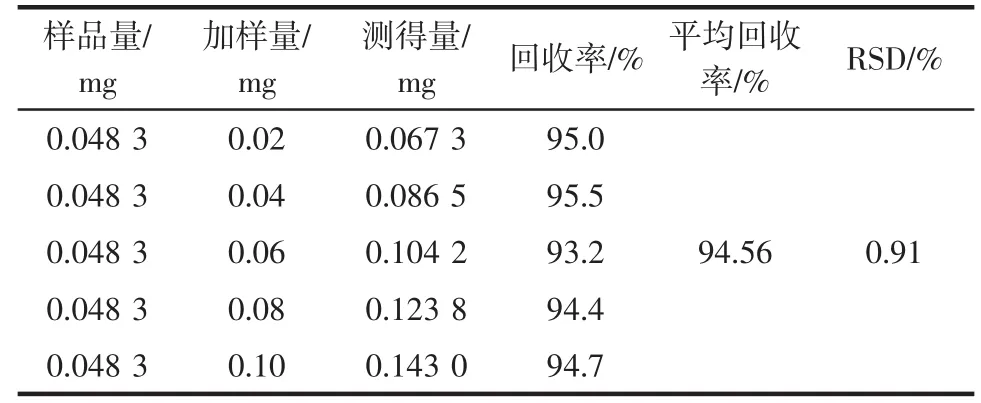
表3 回收率试验结果Table 3 Results of recovery test
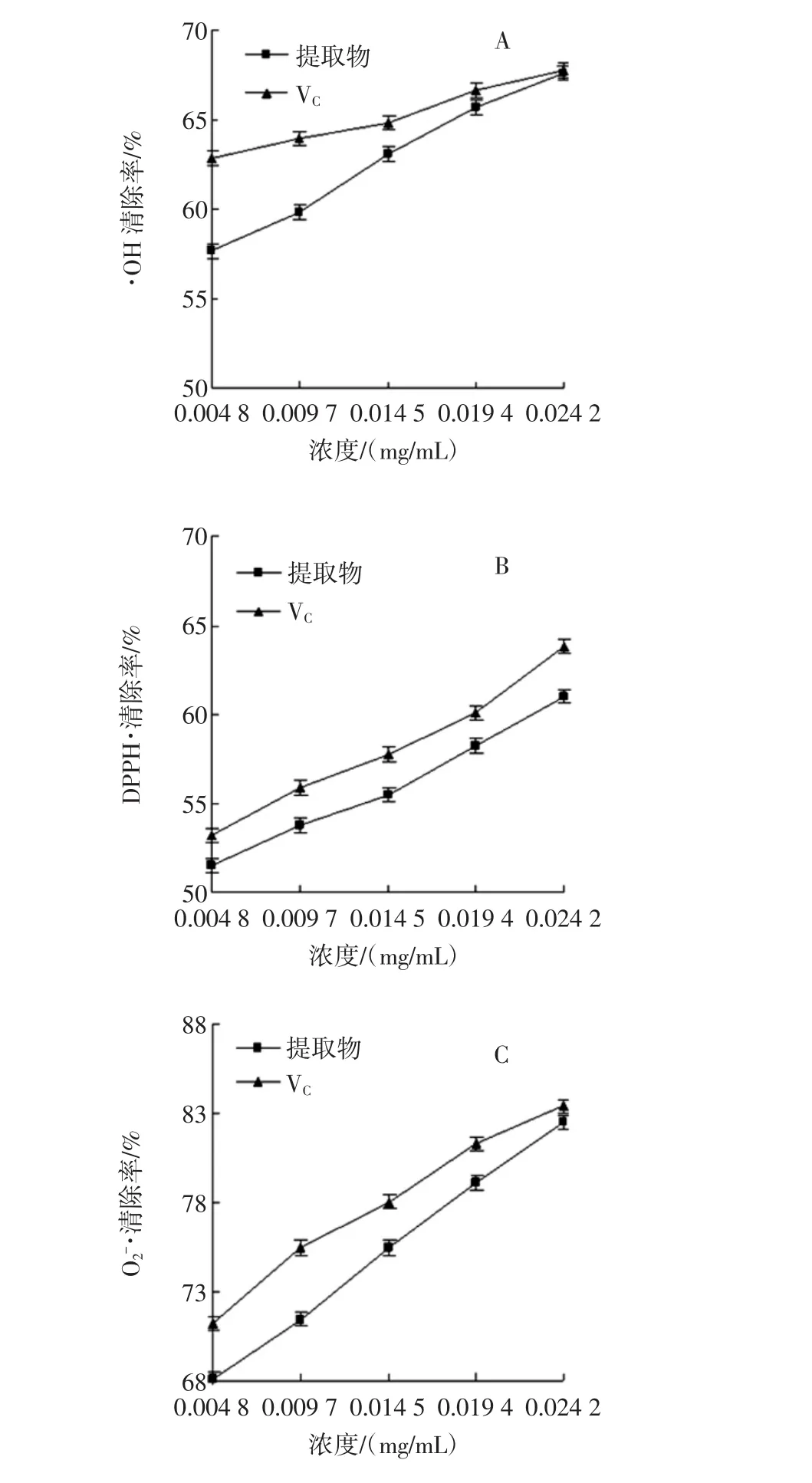
图 2 藤三七多糖对·OH(A)、DPPH·(B)和 O2-·(C)的清除作用Fig.2 Scavenging effect of polysaccharides from Boussingaultia gracilis on hydroxyl(A),DPPH(B)and superoxide anion(C)radicals
2.4.1 清除·OH的能力评价
H2O2与FeSO4反应(Fenton反应)会产生·OH,·OH具有很强的氧化能力,通过攻击水杨酸分子中的苯环使其发生氧化反应,生成的有色物质在波长510 nm处的吸光度值与·OH的生成量成正比[28]。若在反应体系中加入抗氧化剂,·OH受到抑制,使有色物质生成量减少,可用清除·OH的能力来评价抗氧化物的抗氧化性。藤三七多糖对·OH的清除作用见图2A。由图2A可以看出,在藤三七多糖质量浓度0.004 8 mg/mL~0.024 2 mg/mL范围内,随着藤三七多糖质量浓度的增加,清除·OH的能力增强,即清除率与多糖质量浓度有量效关系。当藤三七多糖质量浓度为0.0242 mg/mL时,藤三七多糖对·OH的清除率可达到67.59%,对照液VC对·OH的清除率为67.81%,二者对·OH的清除率比较接近,说明藤三七多糖具有较强的清除·OH的能力。
2.4.2 清除DPPH·的能力评价
DPPH·是一种合成的含氮有机自由基,其结构中存在单电子,在乙醇溶液中溶液显深紫色,在波长517 nm处有特征吸收;若加入抗氧化剂后,DPPH与抗氧化剂中的氢结合,使DPPH的特征紫色逐渐变成黄色或淡黄色,通过测定吸收减弱的程度来评价清除其自由基能力的强弱[29]。藤三七多糖对DPPH·的清除作用见图2B。由图2B可以看出,在藤三七多糖质量浓度0.004 8 mg/mL~0.024 2 mg/mL范围内,随着藤三七多糖质量浓度的增加,清除DPPH·的能力增强,即清除率与多糖质量浓度有量效关系。当藤三七多糖质量浓度为0.024 2 mg/mL时,对DPPH·的清除率可达到61.01%,与对照液VC对DPPH·的清除率63.79%相比稍弱,但藤三七多糖依然表现出较强的清除DPPH·的能力。
2.4.3 清除O2-·的能力评价
O2-·是一种体内很容易产生的自由基,多糖能清除O2-·,使邻苯三酚自氧化产物在波长325 nm处的吸收峰受到抑制,通过检测中间产物的生成量,可测定多糖对O2-·的清除能力[30]。多糖能够与O2-·结合形成稳态自由基,终止自由基链反应,而发挥抗氧化作用。藤三七多糖对O2-·的清除作用见图2C。从图2C可以看出,藤三七多糖对O2-·有清除作用,在藤三七多糖质量浓度0.004 8 mg/mL~0.024 2 mg/mL范围内,随着藤三七多糖质量浓度的增加,清除O2-·的能力增强,即清除率与多糖质量浓度也有量效关系。当藤三七多糖质量浓度为0.024 2 mg/mL时,对O2-·的清除率可达到82.46%,与对照液VC对O2-·的清除率83.39%很接近,表明藤三七多糖具有很强的清除O2-·的能力。
3 结论与讨论
超声波辅助提取是一种高效、快速、环保的提取方法,本试验采用超声波辅助提取藤三七多糖,充分利用超声波产生的机械振动和空化作用,引起媒质质点振动,从而促使有效成分进入溶剂中来提高藤三七多糖的提取率,因此能大大缩短提取时间。通过本试验的研究,得到超声波辅助提取藤三七多糖的最佳工艺参数为液料比50∶1(mL/g),超声温度50℃,超声功率为350 W,超声时间60 min。在此工艺条件下进行验证性试验,得到藤三七多糖平均提取率为6.24%,平均加样回收率为94.56%,RSD值为0.91%。该提取工艺操作简单、重复性好、回收率高,是一种较为理想的提取藤三七多糖的方法,可为藤三七多糖的提取提供科学依据。
越来越多的研究证明,多糖不但能治疗使免疫系统受到严重损伤的癌症,而且能治疗多种免疫缺损疾病,如慢性病毒肝炎和某些耐药细菌与病毒引起的慢性疾病,还能治疗诸如风湿病之类的自身免疫疾病,有的还能诱导干扰素的产生。多糖作为药物,其细胞毒性极小,在治疗肿瘤、代谢及感染性疾病等方面的应用不断扩大。因此,多糖市场需求很大,是急需进一步开发研究的活性成分,也是现代天然药物的主要来源之一。
多糖作为一种天然抗氧化剂能够清除自由基,可减少自由基对人体的损伤及减缓慢性疾病的发生[31]。本研究从清除·OH、DPPH·和O2-·的能力3个方面测定了藤三七多糖的抗氧化性。试验结果表明,藤三七多糖对·OH、DPPH·和O2-·具有较强的清除作用,在多糖质量浓度0.004 8 mg/mL~0.024 2 mg/mL范围内,随着多糖质量浓度的增加其清除率增大,即多糖质量浓度与清除率呈量效关系。与对照液VC相比,总体上来讲,藤三七多糖对·OH、DPPH·和O2-·的清除能力稍弱VC,但作为具有抗氧化性质的天然成分,藤三七多糖有望开发成天然抗氧化剂应用于医药、食品等行业,为藤三七的进一步开发利用提供理论依据。
本研究结果表明,藤三七中含有丰富的多糖类化合物,藤三七多糖具有较强的体外抗氧化活性,相关研究结果对藤三七多糖的提取及抗氧化活性成分的开发利用提供理论依据。但由于本研究仅对超声辅助提取的藤三七多糖进行抗氧化性测定,而采用超声辅助提取是否会影响藤三七多糖生物活性尚未知晓,因此在后续的试验中可对不同提取方法与活性之间的关系进行深入研究。
参考文献:
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:760-761
[2] 吴萍,严建业,黄丹,等.藤三七的现代研究进展[J].科技导报,2012,30(16):76-78
[3] 杨思雨.藤三七的研究综述[J].山西林业科技,2014,44(3):40-43
[4] 黄亮华,郭碧瑜,谭雪,等.3种常用野菜的硝酸盐含量和主要营养成分的测定[J].广西园艺,2006,17(4):38-39
[5] 杨暹,郭巨先.华南主要野生蔬菜的基本营养成分及营养价值评价[J].食品科学,2002,23(11):121-125
[6] 林春华,谭雪,郭碧瑜,等.几种人工栽培野菜的营养成分及食用价值评价[J].广东农业科学,2006(7):23-24
[7]王文涛.藤三七引种栽培及种植前景[J].现代农村科技,2010(21):16
[8] 刘佳,陈晓辉,钱忠直,等.RP-HPLC法测定藤三七不同部位中腺苷的含量[J].沈阳药科大学学报,2009,26(9):724-726
[9]TSHIKALANGE T E,MEYER J J M,HUSSEIN A A.Antimicrobial activity,toxicity and the isolation of a bioactive compound from plants used to treat sexually transmitted diseases[J].Journal of Ethnopharmacology,2005,96(3):515-519
[10]Kan W S.Pharmaceutical botany[M].Taipei:National Research Institute of Chinese Medicine,1986:447
[11]Yen G C,Chen H Y,Peng H H.Evaluation of the cytotoxicity,mutagenicity and antimutagenicity of emerging edible plants[J].Food and Chemical Toxicology,2001,39(11):1045-1053
[12]顾琼,马云保,张雪梅,等.藤三七中一个新黄烷醇和抗HIV活性成分[J].高等学校化学学报,2007,28(8):1508-1511
[13]仇洁,周永标,谭玉兰,等.落葵薯提取物清除氧自由基及抗脂质过氧化作用[J].中药材,2004,27(8):608-609
[14]柳杨,李清,王菲,等.柱前衍生HPLC法分析藤三七多糖中单糖的组成[J].中药新药与临床药理,2011,22(2):199-202
[15]刘佳,李国萍,慕善学,等.反相高效液相色谱法同时测定藤三七不同部位中尿嘧啶和假鹰爪黄酮的含量 [J].中南药学,2011,9(4):261-264
[16]郭淑英,马金贵.药食兼用新型蔬菜——藤三七北方温室栽培技术[J].北方园艺,2006(6):80
[17]吴蔚.藤三七——一种新兴的高营养保健蔬菜[J].健康,2000(1):l3-14
[18]林蒲田.保健蔬菜——藤三七[J].湖南农业,2005(9):9
[19]蒋向辉,佘朝文,李定亮.藤三七的组织培养与快速繁殖[J].植物生理学通讯,2007(6):1151
[20]杨娜,王鸿飞,郝艳佳,等.裂褶菌多糖提取工艺及抗氧化性研究[J].中国食品学报,2014,14(8):92-98
[21]葛霞,陈婷婷,蔡教英,等.青钱柳多糖抗氧化活性的研究[J].中国食品学报,2011,11(5):59-63
[22]刘振亮,张昌军,刘克,等.白花丹参多糖含量测定及其抗氧化性研究[J].山东农业大学学报(自然科学版),2013,44(3):357-360
[23]Chen R Z,Liu Z Q,Zhao J M,et al.Antioxidant and immunobilogical activity of water-soluble polysaccharide fractions purified from A-canthopanax senticosu[J].Food Chemistry,2011,127:434-440
[24]MOHSE S M,AMMAR A S M.Total phenolic contents and antioxidant activity of corn tassel extracts[J].Food Chemistry,2009,112:595-598
[25]吐尔干乃义·吐尔逊,热衣木·马木提,阿不都拉·阿巴斯.中国树花中地衣多糖的抗氧化活性研究[J].食品与发酵工业,2009,35(11):119-121
[26]贾琳雯,郭姣,李清宇,等.响应曲面法优化海红果水溶性多糖提取工艺及抗氧化活性的研究[J].食品工业科技,2015,35(10):252-257
[27]周思思,王榆元,刘丹,等.超声波辅助提取人参花多糖工艺优化及其抗氧化活性[J].食品科学,2015,35(6):76-81
[28]XIONG Shuangli,LI Anlin,HUANG Ni,et al.Antioxidant and immunoregulatory activity of different polysaccharide fractions from tuber of Ophiopogon japonicus[J].Carbohydrate Polymers,2011,86:1273-1280
[29]周萍,安东,王朝川,等.食用菌复合多糖的抗氧化活性研究[J].中国食用菌,2011,30(6):42-44,48
[30]陈莉华,廖微,肖斌,等.玄参多糖体外清除自由基和抗氧化作用的研究[J].食品工业科技,2013,34(7):86-89
[31]Xu W T,ZHANG F F,LUO Y B,et al.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research,2009,344:217-222
Study on the Extraction Technology by Ultrasonic-assisted and Antioxidant Activity of Polysaccharides from Boussingaultia gracilis
YANG Shen-ming,WANG Zhen-ji,CHEN Wen,FAN Shu-guo,LUO Xin
(Department of Chemistry and Life Science,Chuxiong Normal University,Chuxiong 675000,Yunnan,China)
Ultrasonic-assisted extraction of polysaccharides from Boussingaultia gracilis was optimized,and the antioxidant properties of polysaccharides were determined.On the basis of single factor experiment,the optimum conditions of ultrasonic-assisted extraction of polysaccharides were optimized by orthogonal test.Meanwhile,the antioxidant activity of polysaccharides from Boussingaultia gracilis was evaluated by hydroxyl,DPPH and superoxide anion free radical scavenging capacity.Results showed that the optimal conditions of polysaccharides extraction as follows:liquid to solid ratio 50∶1(mL/g),ultrasonic temperature 50 ℃,ultrasonic power 350 W,and ultrasonic time 60 min.Under the optimal conditions,the yield of polysaccharides was 6.24%,the average recovery rate of the added sample was 94.56%.When the polysaccharides concentration was 0.024 2 mg/mL,the clearance rate of polysaccharides on·OH,·DPPH and O2-·were 67.59%,61.01%and 81.46%,respectively,implying such material had a strong antioxidant activity in vitro.
Boussingaultiagracilis;polysaccharide;ultrasonic-assistedextraction;orthogonaltest;antioxidation properties
2016-08-27
10.3969/j.issn.1005-6521.2017.11.008
国家自然科学基金青年项目(31300370);云南省高校科技创新团队支持计划项目(IRTSTYN);云南省省级重点学科建设基金项目“生物学”(05YJJSXK03);楚雄师范学院教改项目(1510)
杨申明(1976—),男(汉),高级实验师,学士,研究方向:天然有机产物化学。
