黑豆红花色苷的分子修饰和稳定性研究
2017-07-18张晓圆汪旭陈玥赵宇孙平陈野
张晓圆,汪旭,陈玥,赵宇,孙平,陈野
(天津科技大学食品工程与生物技术学院,天津300457)
黑豆红花色苷的分子修饰和稳定性研究
张晓圆,汪旭,陈玥,赵宇,孙平,陈野*
(天津科技大学食品工程与生物技术学院,天津300457)
为了提高花色苷的稳定性,通过辅色、醚化、酰化和酯化修饰黑豆红花色苷,并研究修饰后花色苷对光、热的稳定性和对DPPH自由基的清除能力。结果表明,在90℃经过5 h后,经过辅色、酰化和醚化修饰后花色苷保存率比未修饰组分别提高了17.88%、16.75%、5.46%。在太阳光下照射8 d后经过辅色、酰化、酯化、醚化修饰后的花色苷保存率分别比未修饰组高25.27%、20.86%、20.19%、13.83%,且对DPPH自由基的清除率和VC相当,都在95%以上。
黑豆红花色苷;分子修饰;稳定性;抗氧化
黑豆皮,又称黑豆衣或乌豆衣,是黑豆的种皮,其中富含黑豆红色素、多糖、果胶和微量元素等[1]。黑豆皮有防治盗汗,羊血疏风,治阴虚烦热的功能[2],还可以通过抑制酪氨酸激酶达到美白的效果,其抗氧化、抗衰老效果显著。黑豆红色素是以黑豆皮为原料,经过提取纯化得到的天然色素,主要成分为花色苷,因此又称为黑豆红花色苷,其主要成分是矢车菊-3-葡萄糖苷(Cy-3-G)[3]。黑豆红花色苷对光、热、金属离子、pH、糖、酶等条件比较敏感,稳定性较差,因此限制了其在食品、医药领域的应用[4-8]。因此如何提高黑豆红花色苷的稳定性成为研究热点,目前一般可通过添加保护剂、辅助色素、金属络合和微胶囊化等方法来提高其稳定性[9-13],但通过分子修饰的方法并不多见。
本试验以黑豆红花色苷分子为研究对象,通过辅色、酯化、酰化、醚化进行分子修饰,在花色苷分子上接枝新的基团,从而保护发色团,以期提高黑豆红花色苷的稳定性以及其抗氧化活性,从而为黑豆红花色苷在医药、食品和化妆品行业的开发利用提供技术支撑。
1 材料与方法
1.1 材料与仪器
黑豆皮:天津市兴达和平食品有限公司;草酸、乙酸、环氧丙烷、丁二酸酐、无水乙醇、1,1-二苯基-2-苦肼基(DPPH)等试剂均为国产分析纯。
HL-1S恒流泵、BS-100A自动部分收集器:上海泸西分析仪器厂有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;FD-10冷冻干燥机:北京德天佑科技发展有限公司;VECTOR 22傅立叶红外变换光谱仪:布鲁克仪器公司;JSM-IT300LV钨灯丝扫描电子显微镜:日本电子株式会社;756PC紫外分光光度计:天津普瑞斯仪器有限公司。
2 试验方法
2.1 黑豆红花色苷制备
黑豆皮100 g,用75%的乙醇提取,料液比1∶40(g/mL),盐酸调节 pH 为 1,提取时间为 1 h,抽滤,收集滤液,于50℃减压浓缩。所得的浓缩液用等体积石油醚作为萃取剂进行萃取3次,再经AB-8大孔树脂纯化,最后用80%酸性乙醇作为洗脱剂洗脱,洗脱液在50℃减压浓缩,经冷冻干燥得到黑豆红花色苷。
2.2 分子修饰
2.2.1 辅色
取0.5 g经过冻干的黑豆红花色苷粉末,溶解于50 mL pH 3的缓冲液,再加入适量的草酸,使草酸的浓度为1 mol/L,混匀后再暗处放置4 h,测定其在200 nm~800 nm范围内的最大吸收峰以及最大吸光值。
2.2.2 醚化
取0.5 g经过冻干的黑豆红花色苷粉末,溶解于20 mL pH为3的缓冲液,再加入环氧丙烷0.5 mL,混匀后于40℃下水浴加热4 h,将反应后的溶液过滤、浓缩,在经真空冷冻干燥得到醚化产物,对其稀释后测定在200 nm~800 nm处紫外可见吸收光谱。
2.2.3 酰化
取0.5 g经过冻干的黑豆红花色苷粉末,溶解于50 mL pH为3的缓冲液,再加入乙酸(1 mol/L)25 mL,于90℃的水浴加热4 h,再将反应后的溶液经真空浓缩、冷冻干燥得到酰化产物,对其稀释后测定在200 nm~800 nm处紫外可见吸收光谱。
2.2.4 酯化
取1.0 g经过冻干的黑豆红花色苷粉末,溶解于30 mL无水乙醇,再加入5 g丁二酸酐,搅拌均匀后在60℃下水浴加热4 h,将反应后的溶液冷却后通过真空浓缩、冷冻干燥得到酯化产物,对其稀释后测定在200 nm~800 nm处紫外可见吸收光谱。
2.3 分子修饰后黑豆红花色苷的稳定性研究
2.3.1 高温对修饰前后花色苷稳定性的影响
取一定量的修饰前后花色苷粉末,分别用pH为3的缓冲液稀释,每组3个平行样,分别置于具塞试管中,于90℃的恒温水浴加热,每隔1 h在513 nm处测定其吸光值,通过下式计算花色苷保存率。

式中:A为试验中测定的样品吸光度;A0为样品初始吸光度。
2.3.2 光照对修饰前后花色苷稳定性的影响
取一定量的修饰前后花色苷粉末,分别用pH为3的缓冲液稀释,每组3个平行样,分别置于具塞试管中,在太阳光下持续照射,每隔1 d在513 nm处测定溶液的吸光值,通过式(1)计算花色苷保存率。
2.4 结构观察
利用离子溅射仪和扫描电子显微镜对原始花色苷和分子修饰后花色苷的显微结构进行观测与分析。相关分析步骤如下:在导电胶上面均匀地平铺一薄层粉末,然后放入离子溅射仪中喷金90 s,平均电流为15 mA,真空度为5 Pa,喷金结束后取出,最后快速转移至扫描电子显微镜样品装载区域中进行扫描检测。
2.5 红外光谱测定
将经过分子修饰后的黑豆红花色苷样品研磨成粉末,再与KBr混合,研磨均匀后压片,进行红外光谱测定。仪器参数如下:光谱范围为4 000 cm-1~400 cm-1,分辨率4 cm-1,扫描信号累加次数16次,扫描时扣除空气的干扰,得到化合物的红外光谱图,并对修饰前后花色苷红外光谱图进行对比分析。
2.6 抗氧化活性试验
2.6.1 黑豆红花色苷对DPPH自由基的清除活性
分别称取不同浓度的经过不同处理的黑豆红花色苷溶液2 mL和2 mL的2×10-4mol/L的DPPH溶液于同一具塞试管,摇匀后避光放置30 min,以乙醇为空白对照,在517 nm测定吸光度Ai。同时测定2 mL乙醇和相应浓度的花色苷样品溶液混合后溶液的吸光度Aj,最后再测定2 mL的DPPH溶液和2 mL的乙醇溶液混合后溶液的吸光度Ac。以抗坏血酸为阳性对照。
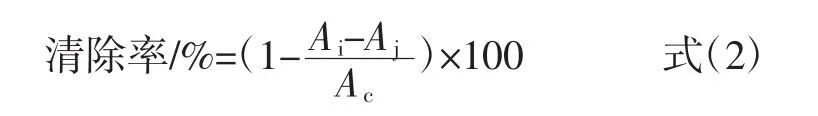
式中:Ai为加测定溶液后DPPH溶液的吸光度;Aj为测定溶液在测定波长的吸光度;Ac为未加测定溶液时DPPH溶液的吸光度。
3 结果与分析
3.1 分子修饰前后紫外可见光光谱特性
分子修饰前后花色苷紫外可见吸收光谱图见图1。
从图1A中可以看出,经过草酸辅色后花色苷溶液的最大吸收波长由513 nm变成515 nm,且在最大吸收波长处的吸光度有明显的增大,有明显的增色和红移效应。

图1 分子修饰前后花色苷紫外可见吸收光谱图Fig.1 The ultraviolet-visible absorption spectrum of anthocyanins before and after molecular modified
从图1B中可以看出,醚化后花色苷最大吸收波长由513 nm变成了511 nm,这说明醚化后花色苷的最大吸收峰发生了蓝移,这可能是由于在花色苷生色团的碳原子端引入了向蓝基团,从而使最大吸收峰处的波长向短波长方向移动。
从图1C中可以看出,酰化后花色苷最大吸收波长没有发生变化。酰化前后最大的区别就是在290 nm~300 nm出现新的吸收峰,这说明黑豆红花色苷与乙酸确实发生了酰基化反应[14-15]。
从图1D中可以看出,酯化后花色苷的最大吸收波长由513 nm变成515 nm,说明酯化修饰后最大吸收波长发生了红移现象,这可能是由于花色苷与丁二酸酐结合,分子间相互作用变弱,使得花色苷分子之间π-π电子对减少,从而导致最大吸收波长的移动。
3.2 分子修饰前后花色苷稳定性
3.2.1 温度对修饰前后花色苷稳定性的影响
90℃对分子修饰前后花色苷稳定性的影响如图2。

图2 90℃对分子修饰前后花色苷稳定性的影响Fig.2 Effect of 90℃on the anthocyanins stability before and after molecular modified
由图2可知,经过分子修饰后黑豆红花色苷的耐热性有明显的增强,其中经过辅色处理后的效果最好。在90℃下加热5 h后,经过辅色、酰化、醚化修饰后的花色苷的保存率要比未修饰组分别高17.88%、16.75%、5.46%。酯化修饰后花色苷的保存率虽然比未修饰组的花色苷稍低,但酯化后花色苷的保存率达到稳定状态,稳定性较好。
3.2.2 光照对修饰前后花色苷稳定性的影响
光照对分子修饰前后花色苷稳定性的影响见图3。
由图3可知,经过分子修饰后的花色苷在太阳光下稳定性有了显著的提高,其中经过辅色处理后效果最为明显。在太阳光下连续照射8 d后,经过辅色、酰化、酯化、醚化修饰后的花色苷保存率分别比未修饰组高25.27%、20.86%、20.19%、13.83%。

图3 光照对分子修饰前后花色苷的稳定性Fig.3 Effect of light on the anthocyanins stability before and after molecular modified
高温下花色苷性质不稳定,可能发生水解和去糖基开环反应,从而形成查尔酮或其同分异构体α-二酮使得花色苷溶液褪色,光照条件下花色苷也不稳定[16]。辅色剂使花色苷稳定性增强是由于辅色剂中的电子与花色苷分子中吡喃阳离子之间以疏水键和氢键发生结合,形成垂直层叠的复合物,这个过程中产生的疏水力能够减慢亲水核的加和作用而失色[17-18]。酰化修饰后花色苷稳定的增加是由于酰基阻止了花色苷从红色的黄盐阳离子水解成无色的查尔酮或蓝色的醌酮,这是由于花色苷吡喃环的酰基堆积减弱了花色苷对水亲核攻击的敏感性,从而防止花色苷形成甲碱或查尔酮而失色[19]。酯化修饰使花色苷稳定性的提高可能是由于花色苷分子中羟基与酸酐之间形成了大量的酯键[20]。醚化修饰后花色苷稳定性的有所提高,究其原因有待深入研究,这可能是在花色苷分子上接枝一些新的基团从而保护发色团,从而使得稳定性增强。
3.3 结构观察
分子修饰前后花色苷电镜扫描图见图4。

图4 分子修饰前后花色苷电镜扫描图Fig.4 SEM images of the anthocyanins before and after molecular modified
图4中图A表示的是未修饰样品,表面较光滑,呈圆球状,而且结构比较致密,没有明显的断层和破碎。图B、C、D、E分别表示经过醚化、酰化、酯化、辅色处理后的样品,经过分子修饰后原有的球状结构遭到破坏,表面粗糙,不规则,呈疏松多孔状,有明显的断裂和分层,同时还可以观察到有大量的碎片。这表明加入修饰剂后花色苷的原有结构遭到破坏,表面积增大,修饰剂能够与花色苷充分接触,发生反应,从而改变了花色苷的理化性质。
3.4 分子修饰前后红外光光谱特性
分子修饰前后花色苷的红外光谱图见图5。

图5 花色苷分子修饰前后的红外光谱Fig.5 IR spectrum of the anthocyanins before and after molecular modified
由图5可知,未修饰的花色苷的主要吸收峰有3 424.46、1 617.28、1 336.38、1 284.88、1 113.31 cm-1。酰化后花色苷的主要吸收峰有3427.32、1720.58、1624.17、1 396.66、1 231.12、1 118.75 cm-1。两者在 3 420 cm-1左右有-OH吸收峰,1 620 cm-1左右可能是C=O键的吸收振动峰,在1 396 cm-1左右可能是甲氧基C-H面内弯曲振动吸收峰,甲氧基的吸收振动峰在1 120 cm-1~1 100 cm-1。对比酰化前后花色苷的红外光谱图可知,在1 720.58 cm-1处有一新的吸收峰,为黑豆红花色苷酰化后C=O键的吸收峰,说明酰化反应是通过羧基和花色苷糖基上羟基发生了缩合反应,红外光谱吸收峰发生红移可能是由于羰基和苯环产生共轭,从而使得酯羰基伸缩振动频率发生红移[21]。
对比醚化前后花色苷的红外光谱图可知,两者轮廓相似,但从曲线的变化规律可以看出,醚化后红外光谱曲线在1 720.74 cm-1是酯羰基C=O的伸缩振动,1 043.64 cm-1为芳醚=C-O-C的伸缩振动。由于在试验过程中丁二酸酐已经经过过滤除去,所以结果表明环氧丙烷已经接枝到花色苷分子上,而且红外光谱图显示花色苷其他官能团的特征吸收峰并没有发生明显的改变。
对比花色苷酯化修饰前后的红外光谱图可知,在1 698.03 cm-1处出现新的酯羰基C=O的伸缩振动峰。一般情况下,酯羰基是位于1 720 cm-1~1 715 cm-1的附近,此处C=O的振动峰向低频发生移动,这可能是由于芳环和羰基发生共轭,因此说明酯化后花色苷结构中含有大量的酯羰基结构。此外,在1 200.78 cm-1和1 113.31 cm-1是C-O-C的伸缩振动峰,其中包括对称伸缩振动和不对称伸缩振动,也称为酯谱带[22],且在这两处谱峰强度有很明显的增强。酯基存在的特征吸收峰是C=O和C-O-C的伸缩振动,因此可以推断黑豆红花色苷经过酯化修饰后含有大量的酯基。由于辅色的研究范畴在液体介质中发生分子间或者分子内辅色,故在此无法与未修饰以及酰化、醚化、酯化的花色苷红外光谱图进行比较。
3.5 黑豆红花色苷对DPPH自由基的清除活性
分子修饰前后花色苷的DPPH自由基的清除能力见图6。

由图6可以看出,在所选浓度范围内,随着浓度的增加,对DPPH自由基清除率呈上升趋势。在花色苷浓度为 10 μg/mL~250 μg/mL 时,随着浓度的增加,对DPPH自由基清除率急剧上升,此时修饰前后的花色苷分子对DPPH自由基清除率比VC低。在花色苷浓度为 250 μg/mL~1 000 μg/mL 之间,对 DPPH 自由基清除率增加的比较缓慢,且在此浓度区间内,修饰前后的花色苷分子对DPPH自由基清除率跟VC对其清除率都在95%以上。黑豆红花色苷经辅色、醚化、酰化和酯化分子修饰后跟初始花色苷的清除率相当,这说明黑豆红花色苷经过分子修饰后仍具有超强的DPPH自由基清除能力。
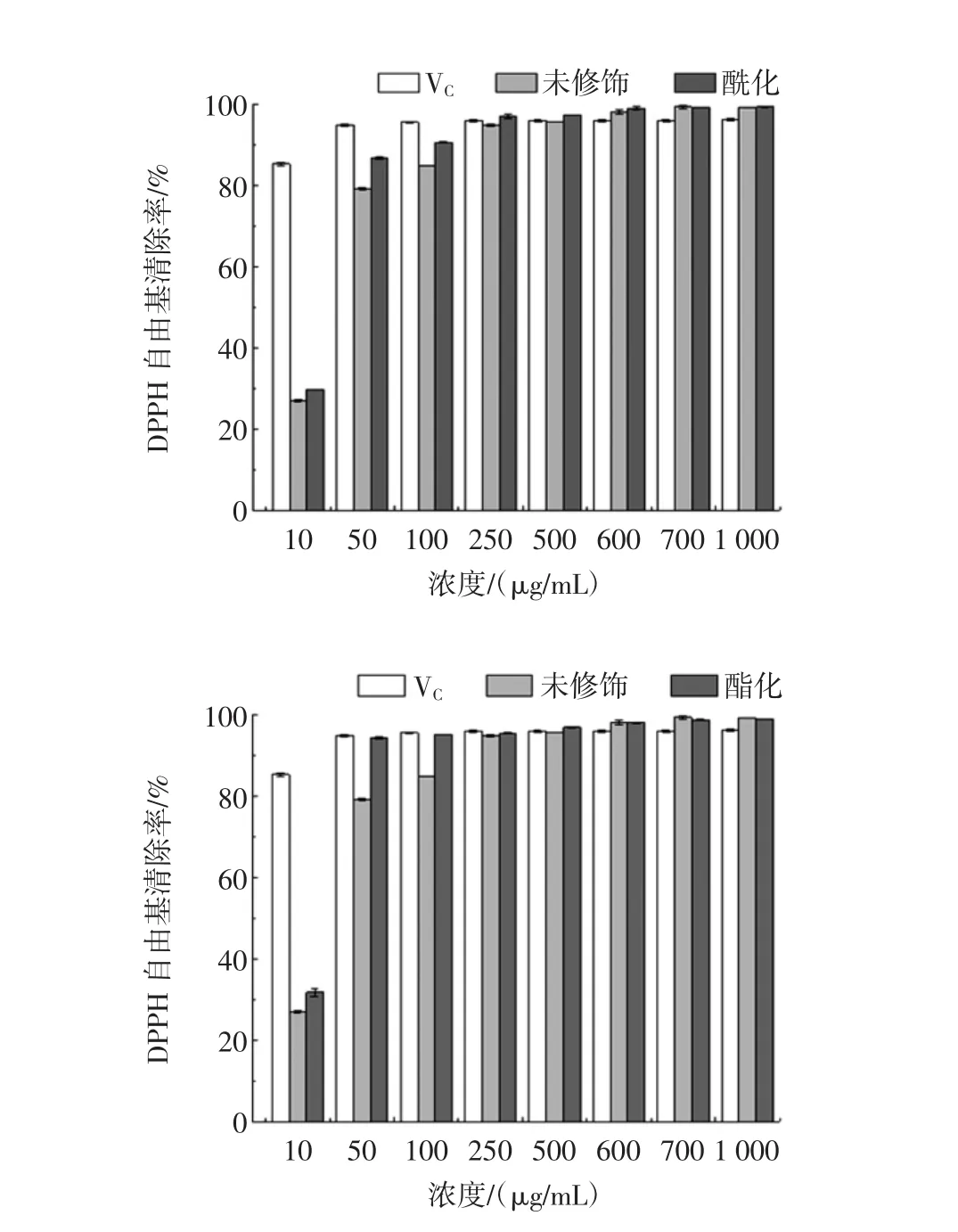
图6DPPH自由基的清除能力Fig.6 DPPH radical scavenging rates
4 结论
黑豆红花色苷经过辅色、酰化、醚化、酯化修饰后,其紫外光谱、红外光谱特性均发生相应的变化,说明黑豆红花色苷分子结构发生了变化,同时花色苷的耐热性和耐光性都有明显的提高。此外,分子修饰前后黑豆红花色苷对DPPH自由基的清除能力都在95%以上,其作为新型抗氧化剂和天然色素有更广泛的利用价值,为花色苷在食品、化妆品、医药领域中的广泛应用提供了理论依据。
[1] 王少波.黑豆皮中花色苷的提取及纯化研究[D].西安:西安理工大学,2008
[2]常汝镇.中国黑豆资源及其营养和药用价值[J].中国食物与营养,1998(5):38-39
[3] 王威,王春利,闫炳宗.天然食用黑豆红色素的研究[J].天津师范大学学报(自然版),1995,15(1):49-54
[4] 李海萍,苗在京.影响黑豆皮色素稳定性因素研究[J].粮油食品科技,2010,18(5):51-53
[5] Kader F,Rovel B,Girardin M,et al.Mechanism of Browning in Fresh Highbush Blueberry Fruit(Vaccinium corymbosum,L).Role of Blueberry Polyphenol Oxidase,Chlorogenic Acid and Anthocyanins[J].Journal of the Science of Food&Agriculture,1999,74(1):31-34
[6] Fleschhut J,Kratzer F,Rechkemmer G,et al.Stability and biotransformation of various dietary anthocyanins in vitro[J].European Journal of Nutrition,2006,45(1):7-18
[7] Jiménez N,Bohuon P,Lima J,et al.Kinetics of anthocyanin degradation and browning in reconstituted blackberry juice treated at high temperatures(100-180℃)[J].Journal of Agricultural&Food Chemistry,2010,58(4):2314-2322
[8] Cavalcanti R N,Santos D T,Meireles M A A.Non-thermal stabilization mechanisms of anthocyanins in model and food systems—An overview[J].Food Research International,2011,44(2):499-509
[9] 孙健,彭子模,彭宏祥,等.提高蜀葵天然色素稳定性方法的研究[J].食品工业科技,2009,30(1):275-279
[10]Bakowska A,Kucharska A Z,Oszmiański J.The effects of heating,UV irradiation,and storage on stability of the anthocyanin-polyphenol copigment complex[J].Food Chemistry,2003,81(3):349-355
[11]赵佳丽,欧阳杰,王建中,等.萝卜红色素金属络合化学修饰后的稳定性研究[J].食品工业科技,2006,27(7):153-154
[12]Tonon R V,Brabet C,Hubinger M D.Anthocyanin stability and antioxidant activity of spray-dried açai(Euterpe oleracea,Mart.)juice produced with different carrier agents[J].Food Research International,2010,43(3):907-914
[13]Ersus S,Yurdagel U.Microencapsulation of anthocyanin pigments of black carrot(Daucuscarota,L.)by spray drier[J].Journal of Food Engineering,2007,80(3):805-812
[14]张秀丽,李劲涛,杨军.植物花色苷定性定量研究方法[J].西华师范大学学报(自然科学版),2006,27(3):300-303
[15]朱宏明,蒋天龙,高橙,等.黑豆皮花色苷的分子修饰及抗氧化性研究[J].浙江树人大学学报(自然科学版),2015(1):24-28
[16]宋会歌,刘美艳,董楠,等.食品中花色苷降解机制研究进展[J].食品科学,2011,15(13):355-359
[17]Plata N,Konczak-Islam I,Jayram S,et al.Effect of methyl jasmonate and p-coumaric acid on anthocyanin composition in a sweet potato cell suspension culture[J].Biochemical Engineering Journal,2003,14(3):171-177
[18]Shikov V,Kammerer D R,Mihalev K,et al.Heat stability of strawberry anthocyanins in model solutions containing natural copigments extracted from rose(Rosa damascena Mill.)petals[J].Journal of Agricultural&Food Chemistry,2008,56(18):8521-8526
[19]Bakowska-Barczak A.Acylated anthocyanins as stable,natural food colorants-a review[J].Journal of Food Biochemistry,2005,11(3):201-247
[20]卢晓蕊,孟宇,欧阳杰,等.增加花色苷类色素稳定性的醚化分子修饰方法:200610140838.6[P].2011-11-02
[21]李颖畅,李冰心,吕春茂,等.酰基化蓝莓花色苷的稳定性和对氧自由基清除能力[J].食品工业科技,2012,33(6):212-214
[22]卢晓蕊,路金丽,武彦文,等.红外光谱法研究花色苷色素的酯化修饰[J].光谱学与光谱分析,2010,30(1):38-41
Molecular Modified of Black Soybean Red Anthocyanins and Its Stability Properties
ZHANG Xiao-yuan,WANG Xu,CHEN Yue,ZHAO Yu,SUN Ping,CHEN Ye*
(College of Food Engineering and Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
In order to improve the stability of anthocyanins,the molecular modification of the purified anthocyanins from black bean peel by copigmentation,etherification,acylation and esterification,and then the light,thermal stability and the scavenging effects on DPPH free radical of modified anthocyanins was studied.The results showed that,after being heated at 90℃ for 5 h,the preservation rate of anthocyanins by copigmentation,acylation and etherification increased 17.88%,16.75%,5.46%,respectively.Under the sunlight irradiation for 8 d,the preservation rate of anthocyanins by copigmention,acylation,esterification and etherification increased 25.27%,20.86%,20.19%,13.83%,respectively.Besides,the scavenging rate on DPPH free radical of modified anthocyanins was more than 95%,that is the same as VC.
black bean red anthocyanins;molecular modification;stability;antioxidant
2016-09-01
10.3969/j.issn.1005-6521.2017.11.007
张晓圆(1992—),女(汉),硕士研究生,研究方向:食品科学。
*通信作者:陈野,男(汉),教授,博导,研究方向:食品科学。
