实验小鼠烧伤后对皮肤解毒酶表达水平的影响
2017-07-18潘凌鸿周士胜伦永志
潘凌鸿,孙 杰,周士胜,伦永志,*
(1. 莆田学院 药学与医学技术学院,福建 莆田 351100;2. 大连大学 医学院 辽宁省高校生物物理学重点实验室,辽宁 大连116622)
实验小鼠烧伤后对皮肤解毒酶表达水平的影响
潘凌鸿1,孙 杰1,周士胜2,伦永志1,*
(1. 莆田学院 药学与医学技术学院,福建 莆田 351100;2. 大连大学 医学院 辽宁省高校生物物理学重点实验室,辽宁 大连116622)
本文旨在通过检测烧伤诱导的大鼠体内烟酰胺降解的改变,探索皮肤本身可能在胰岛素抵抗中起到的重要作用。此实验通过检测与解毒相关的酶的mRNA的表达(包括烟酰胺N-甲基转移酶、醛氧化酶、儿茶酚-O-甲基转移酶、单胺氧化酶A、超氧化物歧化酶2、谷胱甘肽过氧化物酶1、过氧化氢酶和过氧化还原酶1)。进而研究假烧伤大鼠与烧伤大鼠体内的烟酰胺和N1-甲基烟酰胺的清除能力是否有所差异。结果表明,在烧伤大鼠的皮肤中酶均未表达,但假烧伤大鼠均有表达。假烧伤大鼠的烟酰胺的代谢能力大于烧伤大鼠的代谢能力且全层烧伤的大鼠皮肤中检测不到异型生药物代谢酶的表达。烧伤能降低机体对过多烟酰胺的清除能力。
烧伤;皮肤;烟酰胺
皮肤对异型生物质及内源性毒物的生物转化、解毒和清除起着重要的作用。大面积烧伤后很快出现糖代谢紊乱和胰岛素抵抗,数天内达到高峰。通常认为烧伤后胰岛素抵抗与应激反应有关。然而,即使烧伤愈合多年以后,胰岛素抵抗还持续存在。我们推测,烧伤后胰岛素抵抗可能与烧伤部位皮肤的生物转化和排泄功能永久性丧失有关,因此通过检测烧伤诱导的大鼠体内烟酰胺降解的改变来探索该可能性。
代谢综合征(metabolic syndrome),指一组多种代谢紊乱伴随发生的集群,包括肥胖、胰岛素抵抗、高血压和血脂异常等,是2型糖尿病和心血管疾病的主要危险因素[1,2]。烟酰胺,B族维生素的一种,主要存在于动物肉类中,在世界上大多数国家已被作为食品添加剂强制性添加到面粉及谷物中。在过去二、三十年间,代谢综合征出现了全球性快速流行趋势,其发病与环境因素和生活方式有密切关系。越来越多的证据显示,环境因素可能主要是那些增加体内异型生物质水平的因素,包括环境污染、药物、高肉类饮食和食物添加剂等,而生活方式(例如久坐行为)的作用则在于削弱了机体的毒物代谢和排泄能力。在肉食摄入增加以及食用维生素和含添加剂食物增加的情况下,皮肤的解毒和排泄功能显得尤为重要。
皮肤是人体最大的器官,在室温下,只有少数小汗腺处于分泌活动状态,无出汗的感觉(又称不显性出汗)。而与之相对应的是显性出汗,一般是温度超过 30℃时,这时,排汗量就明显增加,小汗腺也会相应增加。汗液排泄一般在环境温度较高时会发生,这样的话,在环境温度较低时,汗腺活动降低,这样以来,需要通过皮肤的汗腺排泄的毒物就会受到一定阻碍。这样的话,汗腺的活动减弱将直接导致体内毒物的蓄积。值得注意到是,许多内源性生物活性物质也是皮肤药物代谢酶的底物。其皮肤含有的药物代谢酶和汗腺,在对内外源性的毒物的解毒和清除方面起到了重要的作用。可能会引起皮肤功能永久地丧失的严重烧伤,与长期胰岛素抵抗相关联。毒性物质可以引发胰岛素抵抗。这些证据都说明一种可能,即皮肤本身可能在胰岛素抵抗中起到了重要的作用。所以皮肤在烟酰胺的代谢中就起到了重要的作用。所以皮肤在烟酰胺的代谢中就起到了重要的作用。这种排泄方式因不需进行任何生物转化,所以对于有药物代谢酶功能缺陷的人来说,可能尤为重要[3]。我们通过检测烧伤诱导的大鼠体内烟酰胺降解的改变来探索该可能性。结果表明,在烧伤大鼠的皮肤中均未检测到与解毒相关的酶的mRNA的表达(包括烟酰胺N-甲基转移酶,醛氧化酶,儿茶酚-O-甲基转移酶,单胺氧化酶A,超氧化物歧化酶2,谷胱甘肽过氧化物酶1,过氧化氢酶和过氧化还原酶 1),但假烧伤大鼠均有表达。与假烧伤大鼠相比,烧伤大鼠体内的烟酰胺和N1-甲基烟酰胺的清除能力明显降低。
1 材料与方法
1.1 材料与方法
1.1.1 实验动物
成年雄性Sprague-Dawley大鼠(SPF级)70只,体重180~200 g,购自大连医科大学SPF级动物实验中心,动物合格证号:SCXK(辽)2008-0002。
1.1.2 主要试剂和实验仪器
PrimeScript RT Master Mix购于宝生物工程(大连)有限公司;TRIZOL® Reagent(Invitrogen, Carlsbad,CA);烟酰胺、葡萄糖、氯化钠均购于Sigma公司(St.Louis, MO, USA);烟酰胺标准品、TCEP、SBD-F、18-冠-6醚、4-bromophenacyl bromide、氢氧化钠N1-甲基烟酰胺购于Takeda化学工业公司(Osaka,Japan);Hypersil ODS C18 柱(Thermo,Bellefonte,PA, USA);SupelcosilTM LC-SCX column(Supelco, Bellefonte,PA, USA);荧光检测器(Waters-470)(Milford, MA,USA);L8-80MST-21超速离心机(贝克曼);纯水系统(MDF492/492AT);Bio-Rad 550酶标仪(Bio-Rad Co, California, USA);UVP GDS-8000型 凝胶成像系统(UVP公司,美国)。
1.2 方法
1.2.1 大鼠烧伤模型的建立
成年雄性Sprague-Dawley大鼠(180~220 g)采用标准鼠粮喂养,自由饮水。按照文献报道的方法[4],对占大鼠总体表面积40%的背部皮肤予以全层烧伤。在带盖的密闭容器内底部放入沾有乙醚的棉花,将大鼠放进容器内,盖好盖稍晃动容器,待大鼠昏迷不动后,将其抓出,背部浸入到95 °C的热水中15 s。假烧伤大鼠操作同上,除了背部只是浸在25 °C温水水中。
1.2.2 烟酰胺负荷试验
(1)确定实验对象分组,即:按照统计学方法,将成年雄性Sprague-Dawley大鼠(180~220 g)随机分成假烧伤组和烧伤组。假烧伤组再随机分成两组:假烧伤对照组(组1,n=8)和假烧伤加烟酰胺组(组2,n=8)。烧伤组再随机分成烧伤组(组 3,n=13)和烧伤加烟酰胺组(组 4,n=13)。同时在大鼠相关部位进行标号;
(2)在大鼠烧伤或假烧伤48 h后,禁食12 h,不禁水,然后组2和组4的大鼠给予烟酰胺腹腔注射;
(3)收集样本血浆,直接液氮保存备用;
(4)对样本进行检测。
1.2.3 逆转录-聚合酶链式反应(RT-PCR)
(1)总RNA提取
①取肌肉(股直肌,肱二头肌,背阔肌和腓肠肌)和背部皮肤(烧伤和未烧伤的部位)样本各 50~100 mg,放入含有1 mL Trizol Microtube管内,用已经高压灭菌的剪刀将组织尽可能地剪碎,约30 min左右,室温静置 10 min;②于上述组织裂解液中加入氯仿200 μL,盖紧Microtube管盖,用手剧烈振荡15 s。待溶液充分乳化(无分相现象)后,再室温静置5 min;③12000转,4°C离心15 min;④取上清,移置另一Microtube管中,加入等体积的异丙醇,上下颠倒充分混匀后,室温下静置10 min;⑤12000转,4°C离心10 min,弃去上清,吸取出残留的异丙醇;⑥加入75%的乙醇l mL(勿触及Microtube管底部沉淀),轻轻上下颠倒洗涤 Microtube管壁,12000转,4°C离心5 min,弃去乙醇;⑦室温干燥3 min,加入20~100 μL灭菌DEPC水溶解沉淀即得到提取出的RNA。
(2)反转录反应:
①将提取出的RNA作为模板,与反转录的引物和dNTP Mixture混合,于PCR仪上进行变性退火反应,65 °C,5 min,4 °C;②按表1在上述Microtube管中配制转录反应液;③在PCR仪上按下列条件进行反应:


表1 转录反应液配制
(3)PCR反应:
①按表2配制PCR反应液;相关引物序列见表3。②反应条件


表2 PCR反应液配制

表3 引物序列
(4)5 μL PCR产物上样1.5%琼脂糖凝胶电泳;
(5)紫外凝胶成像系统拍照,分析。
1.2.4 血浆中烟酰胺和N-甲基烟酰胺含量的测定
(1)烟酰胺测定
样品预处理:取血浆200 µL于EP管中,加入100 µL 20% TCA震荡混匀,12000转,10 min离心,取出200 µL上清液于另一EP管中。分别加入25 µL 0.5 M HCl,100 mg NaCl,震荡混匀,直到水相被NaCl充分饱和。用1 mL的水饱和乙酸乙酯抽提3次,弃去上层乙酸乙酯,然后用N2吹干残余乙酸乙酯。加入 25 µL 0.5M NaH2PO4和 25 µL 0.4M KOH,震荡混匀。随后加入1 mL无水乙酸乙酯,震荡混匀。3000转,3 min离心,取出800 µL于另一EP管中,N2吹干。加入250 µL碘甲烷,混匀,避光保存24 h后用N2吹干。再加入200 µL双蒸水,震荡混匀后用水饱和的乙酸乙酯抽提3次,N2吹干残留乙酸乙酯,此时血浆中的烟酰胺全部被转换成N1-甲基烟酰胺。
加入内标 200 µL(50 ng/mL),再加入 200 µL 100 mM苯乙酮,震荡混匀,冰浴10 min。然后加入400µL 6M NaOH,震荡混匀,冰浴 60 min。再加入 200 µL甲酸,震荡混匀,冰浴60 min。最后置于沸水浴中3 min,生成荧光衍生物,冷却后混匀准备上机检测。
流动相配置和样品检测:流动相:10 mM 庚烷磺酸钠,50 mM 三乙胺水溶液(pH 3.20):乙腈(78:22 v/v);流速:1.0 mL/min;进样量:20 µL。样品经366 nm波长激发后于418 nm波长下用荧光检测器检测。
(2)N-甲基烟酰胺测定
样品预处理:取血浆样品200 µL,加入200 µL内标(N1-乙基烟酰胺,50 ng/mL),再加入20%TCA 100 µL,12000 g离心10 min去除血浆蛋白;加入100 mM苯乙酮200 µL,震荡混匀10 s后冰浴10 min;再加入6 M浓NaOH400 µL,震荡混匀10 s后冰浴60 min;最后加入甲酸200 µL,震荡混匀10 s后冰浴15 min;沸水浴3 min后冷却、经0.45 μm微孔滤膜过滤后,震荡混匀进样分析。
流动相配置和样品检测:流动相由0.01 M庚烷磺酸钠,0.5%三乙胺和 22%乙腈组成,用正磷酸调节PH为3.2;流速调节1.0 mL/min;20 µL样品进样;样品经366 nm波长激发后于418 nm波长下用荧光检测器检测。
2 结果
2.1 烧伤后基因表达变化
我们首先研究了烧伤对异型生/药物代谢酶(包括NNMT,AOX1,COMT和 MAO),ROS清除酶类(包括SOD,GPX1,CAT和PRDX1)和NADPH氧化酶复合体成分之一的p47-phox等基因表达的影响。如图1所示,RT-PCR结果表明,这些所有的酶的mRNA在假烧伤大鼠的皮肤中均有表达,而在烧伤大鼠的皮肤中均未检测到其表达。结果表明皮肤全层烧伤可能导致皮肤丧失解毒和抗氧化功能。
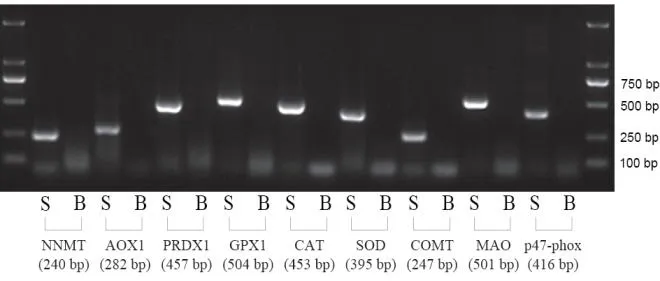
图1 RT-PCR对大鼠皮肤中酶的mRNA表达的分析
2.2 烧伤对烟酰胺代谢的影响
众所周知,烟酰胺可以引起氧化应激,胰岛素抵抗和糖耐量降低[5-7]。因此,对过多烟酰胺的清除能力可能是致胰岛素抵抗的一个关键因素。已知皮肤中有降解烟酰胺酶的表达,即NNMT和AOX1,所以,我们研究烧伤对烟酰胺清除的影响。如图2所示,组3的空腹血浆中的N1-甲基烟酰胺(烟酰胺的甲基化代谢物)水平明显高于组1。烟酰胺负荷导致假烧伤组(组2)和烧伤组(组4)血浆中的烟酰胺和N1-甲基烟酰胺水平明显增加。组4增加比组2更显著。这些结果说明烧伤大鼠对烟酰胺和 N1-甲基烟酰胺的清除能力可能减弱了。大鼠皮肤对总烟酰胺的解毒能力的重要性和贡献与烟酰胺降解酶类在其它器官/组织中的表达也有关联。

图2 烧伤引发的烟酰胺降解的改变
3 讨论
代谢综合征与环境温度的变化有一定的关系,而作为受环境温度影响较大的皮肤,自然,代谢综合征则和皮肤的解毒,排毒功能自然会有一定的关系。皮肤在机体解毒方面有着重要的作用,皮肤的功能降低将直接影响机体的解毒功能。由于环境因素或者是个人的生活方式所引起的皮肤功能降低将直接导致皮肤的解毒功能下降。当今快速流行的代谢综合征,人体摄入的异型生物质的增加也对其造成了严重威胁。这样看来,适当的增加皮肤功能,如增加排汗,可以加强皮肤的解毒功能,对代谢综合征的预防和治疗有很大的作用。
汗液排泄一般在环境温度较高时会发生,这样的话,在环境温度较低时,汗腺活动降低,这样以来,需要通过皮肤的汗腺排泄的毒物就会受到一定阻碍。这样的话,汗腺的活动减弱将直接导致体内毒物的蓄积。一般活动并不能降低MetS的风险,只有到达一定量的体力活动,才能降低MetS风险[5]。
烟酰胺,B族维生素,主要存在于动物源性的食物中,尤其是肉类。烟酰胺是尼亚新的存在形式,主要用于营养补充剂和食物强化[8]。这就意味着西方饮食(尤其是以肉食为主)和尼亚新强化的食物可能会增加烟酰胺超载的风险。我们的生态学证据表明,尼亚新的高消耗(主要源于尼亚新强化)与肥胖和 2型糖尿病等胰岛素抵抗相关的疾病的流行呈明显的相关性[9,10]。本研究发现烧伤大鼠降解烟酰胺的能力明显降低,而过多的烟酰胺增加H2O2生成和加重烧伤后的胰岛素抵抗。这些观察结果说明富含烟酰胺饮食的高消耗可能对烧伤病人有害。
值得注意的是,除了烟酰胺降解酶类,其他异型生物质/药物代谢酶,如细胞色素P450,黄素单氧化酶,MAO,COMT,谷胱甘肽-S-转移酶,N-乙酰基转移酶和磺基转移酶也在皮肤中表达[11-13]。不计其数的异型生物质和内源性的生物活性/毒性物质都是这些酶类的底物。皮肤还表达 SOD,CAT,GPX1和PRDX1,这些酶类均能清除 ROS,以此来抵抗氧化损伤[4,14]。而且,人的外分泌性汗腺,据估计,汗腺的总量与一个肾脏相当(约100g),能够排出众多的异型生物质(如金属和药物[15]),内源性的生物活性物质(如神经递质,细胞因子,固醇类[4,15,16]),即使这些物质很少以原形经尿液排出(如烟酰胺[4])。皮肤全层烧伤会导致烧伤区域皮肤功能的永久性丧失。本研究的结果,即烧伤后空腹血浆中N1-甲基烟酰胺的增高和烟酰胺负荷后糖耐量的降低,为该说法直接提供了有力的证据。
如前所述,胰岛素抵抗是由氧化应激引起的。氧化应激能否发生取决于ROS产生和机体总的抗氧化能力二者之间的平衡,后者代表了各种器官抗氧化能力的总和。每个器官/组织对机体总的抗氧化系统的贡献是不一样的。例如,肝脏主要负责对异型生物质和内源性物质的生物转化/解毒,而肾脏主要负责对毒性物质的排出。因此,这些器官任一功能的降低都可能增加氧化应激和胰岛素抵抗的危险。事实上,众多的研究表明,严重肝脏[17]和肾脏疾病[18]的患者都与氧化应激和胰岛素抵抗相关联。同肝脏和肾脏一样,皮肤也是机体总的抗氧化防御系统的主要贡献者之一,因为它是在解毒和排出内外源性毒物中起重要作用的最大器官。能够想象出,任何能降低皮肤功能的因素都能增加氧化应激和胰岛素抵抗的风险。从这一观点不难看出,烧伤导致的永久性皮肤丢失是一个降低皮肤功能的极端的例子。最新证据表明,皮肤功能降低和常见的代谢紊乱有明显的关联。例如,皮肤温度,不同于总是保持在一个恒定水平的机体内部器官温度(核心温度),它随环境温度的变化而波动。此外,寒冷环境导致皮肤血管收缩从而皮肤血流量减少[18]。因此,皮肤解毒和抗氧化功能可能受外界环境温度的影响,因为皮肤细胞中酶参与的反应和汗腺介导的毒性物质的排出均依赖于温度和血流量。一个有趣的现象,研究发现,冬天血中儿茶酚胺的水平高于夏季,另有研究发现,冬季尿排泄儿茶酚胺的终产物少于夏季[19]。这两个研究结果提示,冬季时儿茶酚胺的降解/失活过程减弱。考虑到皮肤中儿茶酚胺降解酶类(主要是MAO和COMT[20])的活性碎室温的变化而改变,儿茶酚胺降解的季节性变化很大程度上归因于皮肤解毒功能的季节性变化。而且,非烧伤性的严重创伤,由于交感神经过度兴奋引起外周动脉血管收缩导致皮肤血流量减少,也会降低皮肤解毒和抗氧化功能。因此我们推测,非烧伤性创伤和胰岛素抵抗二者之间有着密切的联系[1]。这种说法能够解释为什么烧伤性创伤引起的胰岛素抵抗(与皮肤永久性丢失有关)是永久的[21],而非烧伤性创伤引起的胰岛素抵抗(与皮肤功能暂时性降低有关)是可逆的[1]。
[1] Junien C, Gallou-Kabani C, Vigé A, et al. Nutritional epigenomics of metabolic syndrome [J]. Medecine Sciences M/s, 2005, 21(4): 44-52.
[2] Roberts C K, Sindhu K K. Oxidative stress and metabolic syndrome [J]. Life Sciences, 2009, 84(21-22): 705-712.
[3] 刘星星, 李达, 李春艳, 等. 皮肤功能降低增加代谢综合征风险[J]. 生理学报, 2012(3): 327-332.
[4] G C, Ah M, F E, et al. Elevated neuroimmune biomarkers in sweat patches and plasma of premenopausal women with major depressive disorder in remission: The POWER study[J]. Biological Psychiatry, 2008, 64(10): 907-911.
[5] Churilla J R, Fitzhugh E C. Total physical activity volume,physical activity intensity, and metabolic syndrome: 1999-2004 national health and nutrition examination survey [J].Metabolic Syndrome & Related Disorders, 2012, 10(1):70-76.
[6] Oesch F, Fabian E, Oeschbartlomowicz B, et al.Drug-metabolizing enzymes in the skin of man, rat, and pig[J]. Drug Metabolism Reviews, 2007, 39(4): 659-698.
[7] Zhou S S, Li D, Sun W P, et al. Nicotinamide overload may play a role in the development of type 2 diabetes [J]. World Journal of Gastroenterology, 2009, 15(45): 5674-5684.
[8] 周士胜, 李达, 周一鸣, 等. 慢性烟酰胺超载与 2型糖尿病流行的关系[J]. 生理学报, 2010(1): 86-92.
[9] Hara K, Harris R A. The anesthetic mechanism of urethane:the effects on neurotransmitter-gated ion channels [J].Anesthesia & Analgesia, 2002, 94(2): 313-318.
[10] Zhou S S, Li D, Zhou Y M, et al. B-vitamin consumption and the prevalence of diabetes and obesity among the US adults: population based ecological study [J]. Bmc Public Health, 2010, 10(1): 1-16.
[11] Lane M E. Skin penetration enhancers [J]. International Journal of Pharmaceutics, 2013, 447(1-2): 12-21.
[12] Liu X X, Sun C B, Yang T T, et al. Decreased Skin-Mediated Detoxification Contributes to Oxidative Stress and Insulin Resistance [J]. Experimental Diabetes Research, 2012,2012(12): 128694.
[13] Svensson C K. Biotransformation of drugs in human skin [J].Drug Metabolism & Disposition the Biological Fate of Chemicals, 2009, 37(2): 247-253.
[14] Zhou S S, Li D, Zhou Y M, et al. The skin function: a factor of anti-metabolic syndrome [J]. Diabetology & Metabolic Syndrome, 2012, 4(1): 1-11.
[15] Peralta C A, Kurella M, Lo J C, et al. The metabolic syndrome and chronic kidney disease [J]. Current Opinion in Nephrology & Hypertension, 2006, 15(4): 361-365.
[16] Watanabe S, Yaginuma R, Ikejima K, et al. Liver diseases and metabolic syndrome [J]. Journal of Gastroenterology,2008, 43(7): 509-518.
[17] 朱海琴, 朱文元, 范卫新. 烟酰胺在皮肤局部外用中的进展[J]. 临床皮肤科杂志, 2007, 36(3): 189-190.
[18] Johnson H L, Maibach H I. Drug excretion in human eccrine sweat [J]. Journal of Investigative Dermatology, 1971, 56(3):182-188.
[19] Omokhodion F O, Howard J M. Trace elements in the sweat of acclimatized persons [J]. Clinica Chimica acta;International Journal of Clinical Chemistry, 1994, 231(1):23-28.
[20] Gauglitz G, Herndon D, Kulp G, et al. 83. Abnormal insulin sensitivity persists up to three years in pediatric patients post burn [J]. Journal of Clinical Endocrinology & Metabolism,2009, 94(5): 1656-1664.
[21] Jeschke M G, Gauglitz G G, Kulp G A, et al. Long-term persistance of the pathophysiologic response to severe burn injury [J]. Plos One, 2011, 6(7): 71-79.
Effects on Genes Expressiong Leve of Detoxification-related Enzymes Involved in the Burned Rat Skin
PAN Ling-hong1, SUN Jie1, ZHOU Shi-sheng2, LUN Yong-zhi1,*
(1. Department of Medical Laboratory, Putian University, Putian 351100, China; 2. Liaoning Provincial University Key Laboratory of Biophysics, College of Medicine, Dalian University, Dalian 116622, China)
To explore the skin it may play an important role in insulin resistance by examining the possibility that the burn-induced changes in nicotinamide degradation in rats. This assay was performed by detecting the detoxification-related enzymes mRNA tested in the rat skin (including nicotinamide N-methyltransferase, aldehyde oxidase, catechol-O-methyltransferase, monoamine oxidase A, superoxide dismutase 2, glutathione peroxidase 1,catalase, and peroxiredoxin 1). And to research the difference between the false burned rats and the burned rats about the clearance of nicotinamide and N1-methylnicotinamide. The results showed that none of the detoxification-related enzymes was detected in burned rat skin. Furthermore, the burned rats cannot detect the enzyme expression of drug metabolizing. The clearance of nicotinamide and N1-methylnicotinamide in burned rats was significantly decreased.
burn injury; skin; nicotinamide
R751
A
1008-2395(2017)03-0069-06
2017-01-05
国家自然科学基金项目(31140036)。
潘凌鸿(1986-),女,助理实验师,研究方向:分子生物学。
伦永志(1973-),男,博士,教授,研究方向:感染性疾病的分子生物学。
