纹状体神经元在运动疲劳中枢调控中的区域特征分析
2017-07-18侯莉娟程明晨刘晓莉张吉敏乔德才
侯莉娟 程明晨 刘晓莉 张吉敏 乔德才
北京师范大学体育与运动学院(北京 100875)
纹状体神经元在运动疲劳中枢调控中的区域特征分析
侯莉娟 程明晨 刘晓莉 张吉敏 乔德才
北京师范大学体育与运动学院(北京 100875)
目的:观察运动疲劳后大鼠纹状体背内侧部和背外侧部神经元电活动的变化,探寻纹状体神经元在运动疲劳中枢调控中的区域特征。方法:筛选出36只雄性Wistar大鼠随机分为对照组(CG组)、一次性力竭运动组(SF组)和重复力竭运动疲劳组(RF组),每组各12只。疲劳模型建立采用递增负荷运动方案,CG组大鼠不运动,SF组大鼠进行一次力竭运动,RF组大鼠每天进行一次力竭运动,连续6天;各组大鼠建模结束后即刻采用玻璃微电极胞外技术分别记录纹状体背内侧部(n=6)和背外侧部(n=6)神经元自发电活动。采集到的电信号主要选择放电频率、放电特征及不同类型神经元放电频率等指标进行分析。结果:(1)一次性力竭运动疲劳后纹状体神经元放电频率显著高于对照组(P<0.05),而背外侧部重复力竭运动疲劳后较一次性力竭运动后明显降低(P<0.01);(2)重复力竭运动后纹状体神经元不规则放电比例较对照组降低(P<0.05),爆发放电显著增加(P<0.05);(3)运动疲劳后纹状体背内侧部中等多棘神经元(MSNs)放电频率显著增高(P<0.05),且重复力竭运动疲劳后显著高于背外侧部(P<0.01),快放电中间神经元(FS)在重复力竭运动疲劳后放电频率均明显降低,一次性力竭组大鼠背外侧大型胆碱能神经元(LANs)放电频率较对照组明显降低(P<0.05),而重复力竭组较一次性力竭组显著升高(P<0.05)。结论:(1)纹状体神经元在参与运动疲劳中枢调控中呈现区域特征,且在疲劳发生和积累的不同时段作用有所不同,这与纹状体背内侧部和背外侧部神经元分别接受不同类型投射神经元有关;(2)纹状体快放电中间神经元在运动疲劳后神经元电活动的剂量效应关系中起重要的调节作用。
运动疲劳;大鼠;纹状体神经元;电活动;区域特征
纹状体在运动控制的发起和执行中起重要的调控作用,本实验室前期研究发现,一次性力竭运动可引起大鼠纹状体神经元自发放电频率发生改变,高频放电神经元数量明显增加[1,2],纹状体神经元细胞外液中多巴胺(dopamine,DA)和5-羟色胺的动态变化具有阶段性特征,运动疲劳过程中这两种神经递质代谢水平均显著增强,且以5-羟色胺作用占优[3,4],推测纹状体在运动疲劳中枢调控中具有重要作用。
皮层到达纹状体的神经投射具有明显的定位关系[5],根据皮层与纹状体之间的传入和传出投射关系,将纹状体细分为三个区域:纹状体背外侧部(dorsolateral striatum,DLS),纹状体背内侧部(dorsomedial striatum,DMS)和纹状体腹侧部。纹状体背内侧部主要接受大脑前额叶皮层的联合区域投射,参与目标性行为调控;纹状体背外侧部主要接受大脑感觉运动皮层神经投射,参与习惯性行为调控[6-10]。在运动疲劳积累过程中,背内侧和背外侧及其不同类型神经元的功能活动有无差异现在尚未见有文献报道。为此本研究采用玻璃微电极胞外记录技术,通过一次性力竭运动与重复力竭运动疲劳前后大鼠纹状体背内侧部和背外侧部不同类型神经元自发放电活动改变的比较和分析,揭示这两个区域在运动疲劳中枢调控中的作用。
1 材料和方法
1.1 实验动物与分组
实验选用42只健康成年雄性Wistar大鼠,体重280~300 g,由北京市维通利华实验动物技术有限公司提供(SCXK京2012-0001)。大鼠在实验室分笼饲养,自由进食饮水,室温保持在20±3℃,7天后进行3天的跑台适应性训练,筛选出36只运动能力相近的大鼠,随机分为对照组(CG组)、一次性力竭运动组(SF组)和重复力竭运动疲劳组(RF组),每组各12只,各组建模成功后取材时组内分纹状体背内侧部(DMS,n=6)和纹状体背外侧部(DLS,n=6)。
1.2 运动疲劳模型的建立
采用本实验室改良的Bedford递增负荷运动方案建立大鼠运动疲劳模型。跑台坡度为0°,负荷分为3级:Ⅰ级,8.2 m/min、运动15 min;Ⅱ级,15 m/min、运动15 min;Ⅲ级,20 m/min、运动至力竭。判断力竭的标准:大鼠不能维持预定跑速,长时间滞留于跑台后方挡板处,且用声、光、毛刷刺激均不能驱使其继续跑动。跑台适应性训练后开始正式实验,运动时间为上午,SF组大鼠进行一次力竭运动,RF组大鼠每天进行一次力竭运动,连续6天。CG组大鼠不运动。
1.3 胞外信号采集
CG组大鼠在适应性饲养后、SF组大鼠跑台运动至力竭、RF组大鼠在第6天运动力竭即刻,采用10%水合氯醛按照0.35 m l/kg体重的剂量对大鼠进行腹腔注射麻醉,然后将其头部固定于脑立体定位仪上。沿大鼠头顶正中线做矢状切口,用双氧水烧除颅骨表面的结缔组织,暴露前、后囟及冠、矢状缝等骨性标志,调整门齿高度,使前、后囟处于同一水平线上。参照大鼠脑立体定位图谱[11],于颅骨前囟前1.7 mm至前囟后0.5 mm即AP(1.7~-0.5),颅骨正中线左侧1~5 mm即L(1~5)的范围内完成开颅手术,在手术显微镜下撕掉硬脑膜,使用微电极操纵器将玻璃微电极(尖端直径3~5 μm,阻抗3~8 MΩ,内灌3 mol/L的NaCl溶液)插入纹状体记录其神经元自发放电活动。背内侧范围为AP:1.7~-0.5,L:1.5~3.5;背外侧范围为AP:1.7~-0.5,L:3.5~5,记录深度均为3.4~5.5 mm。记录到的电信号采用Power Lab生物信号系统分析处理。
1.4 组织切片定位
记录完成后,给玻璃微电极内电泳滂胺天蓝(20 μA,15 min)进行标记,然后进行常规灌流、固定、切片,鉴定电极记录位置(见图1),如发现记录电极有偏差则所得数据不予统计。

图1 大鼠纹状体背内侧和背外侧玻璃微电极记录位置示意图
1.5 电生理数据分析与处理
1.5.1 电生理数据分析
采集到的电信号主要选择放电频率、放电特征及不同类型神经元放电频率等指标进行分析。
放电特征分析:采用平均峰峰间隔、众数、不对称指数、放电模式评价采集到神经元动作电位的放电特征,其中平均峰峰间隔即相邻两个峰电位放电时间间隔的平均值,反映神经元放电的密集程度;众数即峰峰间隔对应放电次数最大值时的峰峰间隔时间值;不对称指数即众数与平均峰峰间隔的比值,反映神经元放电峰峰间隔直方图的形状特征,该值为1时表示峰峰间隔直方图成正态分布;放电模式,包括规则、不规则、爆发式放电,主要反映神经元动作电位发放规律。
神经元放电类型判定:按照神经元放电频率、放电波形、放电模式等特征可将纹状体神经元分成三类[12],第一类为快放电中间神经元(fast-spiking neurons,FS),其放电频率较快,动作电位时程相对较短,波宽较窄,约为0.3 ms,后超极化电位约为1 ms,多为规则放电,峰峰间隔直方图特征为对称性分布(见图2A);第二类为大型胆碱能神经元(large aspiny-like neurons,LANs),其放电频率适中,放电形式多为不规则放电,其峰峰间隔直方图特征为随机分布(见图2B);第三类为中等多棘神经元(medium spiny-like neurons,MSNs),其放电频率较低、动作电位波形较宽(一般大于0.4 ms),后超极化电位较长,可达2~5 ms,放电模式多为爆发式放电,其峰峰间隔直方图呈正偏态分布并逐渐衰减(见图2C)。

图2 大鼠纹状体不同类型神经元放电特征
1.5.2 数据处理
电信号采用LabChart 8.0软件处理,SPSS 20.0软件统计分析,Sigma Plot 12.5软件作图,数据用均值±标准差表示。组间电生理数据比较采用单因素方差分析,组内放电模式分布比例用百分率表示,组间百分率比较采用卡方检验,P<0.05表示具有显著性差异,P<0.01表示具有非常显著性差异。
2 结果
本实验共记录了36只大鼠,信噪比超过3︰1且稳定记录超过3 min的神经元放电作为有效电信号,三个组的背内侧部采集到的有效神经元放电个数分别为56、50、57,三个组的背外侧部分别为53、51、57,总共有324个神经元放电被纳入统计分析。
2.1 纹状体背内侧和背外侧部神经元放电频率的变化
结果显示,一次性力竭运动后大鼠纹状体背外侧部的神经元平均放电频率(6.35±2.05 Hz)明显高于背内侧部(4.90±1.66 Hz),均较对照组明显升高(P<0.05);重复力竭运动疲劳后大鼠纹状体背外侧部的神经元平均放电频率(2.89±0.86 Hz)较背内侧部(3.86 ± 0.73 Hz)明显降低(P<0.05),也较一次性力竭运动后明显降低(P<0.01)。见图3。
根据大鼠纹状体神经元放电频率可分为低频(0~1 Hz)、中频(1~10 Hz)、高频(10 Hz以上)三类。低频神经元放电频率改变主要体现在纹状体背内侧部,一次性力竭运动后其放电频率较对照组明显升高(P<0.05),重复力竭运动疲劳后放电频率升高更加显著(P<0.01),且明显高于背外侧部(P<0.01);中频放电频率改变主要体现在纹状体背外侧部,一次性力竭运动后其放电频率较对照组明显降低(P<0.01),而重复力竭运动疲劳后其放电频率较一次性力竭运动组明显升高(P<0.05);高频神经元放电频率改变在纹状体背内侧部和背外侧部均有明显体现且变化趋势不同,一次性力竭运动后背内侧部神经元放电频率较对照组明显升高(P<0.01),重复力竭运动疲劳后背内侧和背外侧部神经元放电频率均较对照组和一次性力竭运动组明显降低(P<0.05)。见表1。

图3 大鼠纹状体背内侧和背外侧部神经元平均放电频率的变化

表1 大鼠纹状体不同频段神经元放电频率和百分比的变化
2.2 纹状体背内侧和背外侧部神经元放电特征的变化
大鼠纹状体背内侧和背外侧部神经元平均峰峰间隔(ISI)重复力竭运动疲劳后较对照组明显降低(P<0.05,P<0.01),且背外侧部重复力竭运动组ISI明显低于一次性力竭运动组(P<0.05),说明重复力竭运动疲劳后纹状体神经元放电的密集程度增大(见图4A)。背内侧部神经元众数(Mode)在一次性力竭运动后较对照组明显降低(P<0.05),重复力竭运动疲劳后背内侧和背外侧部均较对照组明显降低(P<0.05)(见图4B)。一次性力竭运动后背内侧部神经元不对称指数(AI)较对照组明显降低(P<0.01),重复力竭运动疲劳后背内侧和背外侧均明显降低(P<0.01,P<0.05);一次性力竭运动后背内侧部AI明显低于背外侧部(P<0.01),说明大鼠纹状体神经元放电变得不规则(见图4C)。背内侧和背外侧部神经元均出现规则、不规则、爆发三种放电模式,且均以不规则放电和爆发式放电为主,规则放电所占比例较小且背内侧和背外侧部位间均无显著差异(P>0.05),一次性力竭运动和重复力竭运动疲劳后,背内侧和背外侧部神经元不规则放电均较对照组明显降低(P<0.05),而爆发放电均明显增加(P<0.05)(见图4D)。
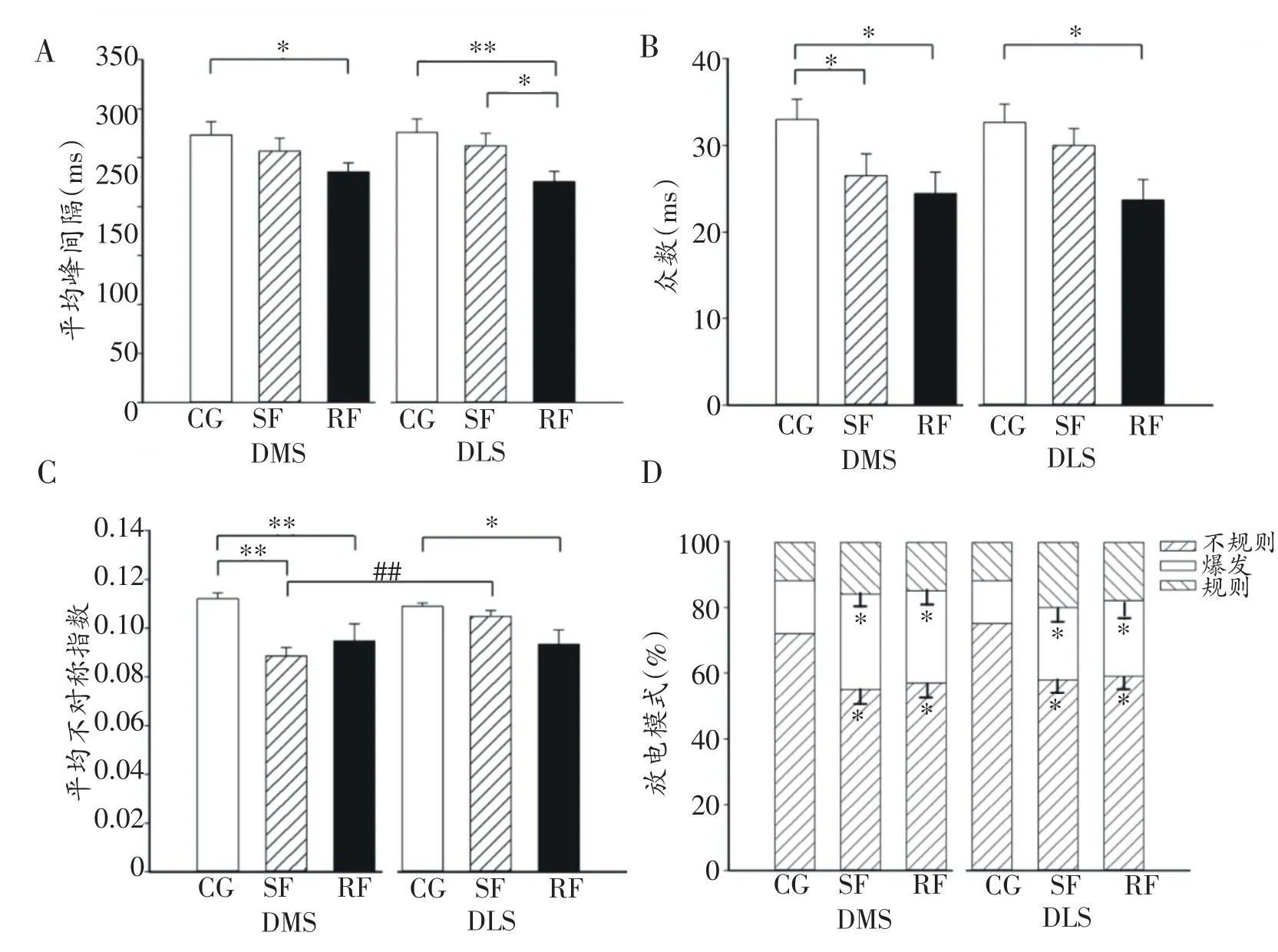
图4 大鼠纹状体神经元放电特征
2.3 纹状体背内侧和背外侧部三种类型神经元放电频率的比较
一次性力竭运动和重复力竭运动疲劳后纹状体背内侧部MSNs的放电频率均较对照组明显升高(P<0.05,P<0.01),且重复力竭运动疲劳组较一次性力竭运动组显著升高(P<0.01),背外侧部MSNs重复力竭运动疲劳后放电频率较对照组显著升高(P<0.01);重复力竭运动疲劳后背内侧部MSNs放电频率较背外侧明显升高(P<0.01)。LANs放电频率的改变主要体现在纹状体背外侧,一次性力竭运动后LANs放电频率较对照组明显降低(P<0.05),重复力竭运动疲劳后放电频率较一次性力竭运动组明显升高(P<0.05),而背内侧部LANs放电频率组内无显著差异(P>0.05)。背内侧和背外侧部FS放电频率在重复力竭运动疲劳后较对照组和一次性力竭运动组均明显降低。(见表2)。

表2 大鼠纹状体不同类型神经元放电频率和百分比的变化
3 讨论
根据皮层与纹状体之间的纤维投射,可将纹状体分为腹侧部、背内侧部和背外侧部三个区域[13]。纹状体腹侧部接受的神经投射最为复杂,与情绪和运动动机调控有关;而纹状体背侧部仅与运动调控有关[14],其中背内侧部与复杂的目标性行为控制有关,背外侧部与习惯性行为控制有关[6-10]。皮层与纹状体通过边缘皮层-纹状体腹侧部,联合皮层-纹状体背内侧部和感觉运动皮层-纹状体背外侧部三条神经通路相互联系,分别参与不同的功能调控[15]。本实验室前期研究发现,纹状体在运动疲劳中枢调控中发挥重要作用[1-4],本研究通过大鼠一次性力竭运动和重复力竭运动疲劳后纹状体背内侧部和背外侧部神经元兴奋性的变化对比,探讨这两个区域在运动疲劳发生过程中,其功能之间存在着何种差异。
3.1 在运动疲劳发生过程中纹状体背内侧部和背外侧部放电活动比较
神经元电活动是神经系统传输和编码内外环境信息的基本方式,其放电频率、放电特征和放电模式是作为评价神经元功能状态的直接和主要指标。纹状体绝大部分神经元是MSNs,由于来自黑质致密部DA能神经投射的抑制影响,MSNs多数处于静息状态,放电频率较低,放电模式以不规则放电为主,这与本研究记录到的对照组实验结果相一致。本实验发现,大鼠一次性力竭运动后纹状体背内侧和背外侧部神经元整体放电频率均较对照组明显升高,且背外侧部神经元整体放电频率明显高于背内侧部。推测这是由于大强度力竭运动作为一种强烈的生理性刺激,导致皮层发放至纹状体的谷氨酸能神经冲动增多引起突触后神经元广泛去极化从而使得兴奋性升高所致,证明纹状体这两个区域均参与了一次性力竭运动的中枢调控。背外侧部神经元兴奋性变化较背内侧部更加显著,这与实验室前期发现运动疲劳后纹状体高频放电神经元数量增多,且高频自发放电神经元主要集中于纹状体外侧深部区域的研究结果相吻合[1]。
大鼠重复力竭运动疲劳后,纹状体背内侧和背外侧部神经元整体放电频率均降低,且神经元放电规则性明显下降,其中背外侧部神经元放电频率较一次性力竭运动组明显降低,且明显低于背内侧部,造成这一结果的原因可能有三个方面:第一,可能是大脑皮层在长期力竭运动影响下出现保护性抑制。巴甫洛夫学派认为无论是体力疲劳还是脑力疲劳都是大脑皮层保护性抑制发展的结果。本实验室前期研究也发现大鼠在力竭运动过程中,皮层运动区神经元呈现广泛抑制现象[16,17]。皮层抑制导致中枢驱动不足,由皮层向纹状体发出的神经冲动减少,谷氨酸兴奋性去极化作用减弱,导致纹状体神经元兴奋性下降;第二,可能是多巴胺、5-羟色胺等神经递质调控产生的影响。本实验室前期研究发现力竭运动过程中大鼠纹状体细胞外液中多巴胺和5-羟色胺浓度变化具有阶段性特征,运动疲劳时纹状体内DA和5-羟色胺代谢水平显著增强[3],且D2型多巴胺受体表达量明显增高[4],多巴胺与D2型多巴胺受体结合导致神经元内腺苷酸环化酶活性降低,神经元兴奋性下降,即多巴胺浓度增加和D2型多巴胺受体表达增多导致间接通路过度激活,间接通路激活使得运动皮层输出受到抑制,这与大鼠重复力竭运动疲劳后运动能力下降的行为表现相一致,同时5-羟色胺作为中枢内重要的抑制性单胺类神经递质,其浓度增加必然对纹状体神经元产生强烈的抑制作用;第三,可能是纹状体内中间神经元尤其是FS的调控作用。综上所述,纹状体神经元在运动疲劳中枢调控中呈现区域特征,且在疲劳发生和积累的不同时段作用有所不同,这与纹状体背内侧和背外侧部神经元分别接受不同类型投射神经元有关。
3.2 三种类型神经元在运动疲劳发生过程中的作用
本研究发现,大鼠在一次性力竭运动后纹状体背内侧部MSNs放电频率较对照组明显升高,重复力竭运动疲劳后背内侧和背外侧部MSNs放电频率均较对照组明显升高,且背内侧部MSNs放电频率明显高于背外侧。MSNs是纹状体信息整合的主要成分,纹状体作为皮层下基底神经节的核团之一,其功能主要是与皮层神经投射相联系。实验中大鼠进行负荷递增的跑台运动时,随着运动负荷不断加大逐渐达到疲劳状态,跟不上跑台的运动速度,为了避免落于跑台后端受到毛刷和声音刺激,必须再次跟上跑台继续运动,大鼠的这种避害行为具有明确的目的性,主要受联合通路来调控;大鼠经过跑台适应性训练已将跑台运动作为一种习得的运动技能,当进行力竭运动时这种习惯化的行为主要受感觉运动皮层的调控。综上分析,当大鼠进行力竭运动时,联合通路和感觉运动通路均发挥着重要的运动调控功能,这就使得相应皮层发出的传出冲动增加,导致纹状体这两个区域的MSNs兴奋性增强,而重复力竭运动疲劳后,纹状体背内侧部MSNs兴奋性高于背外侧部,根据以上分析可以推测纹状体背内侧部所在的联合通路可能相较于背外侧部所在的感觉运动通路有更加重要的调控作用。
纹状体LANs主要通过乙酰胆碱来发挥调控功能,N型乙酰胆碱受体主要表达在突触前的多巴胺能神经末梢上,该受体激活以后通过引起神经元去极化和钙信号调节系统来促进多巴胺的释放,多巴胺再通过两种不同的受体类型实现对纹状体MSNs不同性质的神经调控,同时乙酰胆碱还能通过nAChR直接去极化FS,再通过FS神经纤维末端的突触前M型乙酰胆碱受体减弱对MSNs的γ-氨基丁酸能抑制[18],因此,纹状体LANs的功能相当复杂,要探讨其对运动疲劳所具有的调控作用,还需要进一步详细的实验来证实。纹状体MSNs活动除受到皮层和丘脑的谷氨酸能兴奋性输入影响之外,还需要来自FS的γ-氨基丁酸抑制性输入来平衡,FS是纹状体MSNs前馈性抑制的主要来源,FS的抑制性输入可以降低MSNs的“背景噪音”从而增加传出神经元的活动同步性,使得即使神经元兴奋性没有改变的情况下,通过神经元群体活动同步性增强,同样能够导致靶向神经元的兴奋或抑制[19]。结合本研究三类神经元放电频率的变化分析,纹状体背内侧部和背外侧内MSNs和LANs神经元放电频率在重复力竭运动疲劳后均没有降低,而FS放电频率较对照组和一次性力竭运动组均出现显著下降,FS虽然作为纹状体中间神经元之一,占神经元总数的比例较低,但是由于其通过广泛突触连接与MSNs形成密切的神经联系,且属于高频放电神经元,放电频率远远高于其他两类神经元,在神经元电活动方面形成“剂量效应”,重复力竭运动疲劳后纹状体背内侧部和背外侧神经元整体放电频率的降低有可能是FS放电频率降低导致的。因此推测纹状体FS可能是运动疲劳发生的调节因素之一,这或许也是重复力竭运动疲劳发生机制不同于一次性运动力竭发生机制的原因之一。
4 总结
纹状体神经元参与运动疲劳中枢调控中呈现区域特征,且在疲劳发生和积累的不同时段作用有所不同,这与纹状体背内侧部和背外侧部神经元分别接受不同类型投射神经元有关;纹状体快放电中间神经元在运动疲劳后神经元电活动的剂量效应关系中起重要的调节作用。
[1] 乔德才,侯莉娟,何德富.运动疲劳对大鼠新纹状体神经元电活动的影响[J]. 中国运动医学杂志,2005,24(6):676-680.
[2] 刘晓莉,吴迪,乔德才,等.电刺激前脑内侧束对运动疲劳大鼠纹状体神经元诱发电活动的影响[J].西安体育学院学报,2012,29(1):72-77.
[3] 杨东升,刘晓莉,乔德才.力竭运动及恢复期大鼠纹状体5-HT、DA及其代谢物浓度的动态变化研究[J].中国应用生理学杂志,2011,27(4):432-436.
[4] 侯莉娟,刘晓莉,乔德才.运动疲劳对大鼠纹状体单胺类递质含量及多巴胺受体表达的影响[J].中国康复医学杂志,2010,25(7):639-642.
[5] Voorn P,Vanderschuren LJ,Groenewegen HJ,et al.Put⁃ting a spin on the dorsal-ventral divide of the striatum[J].Trends Neurosci,2004,27(8):468-474.
[6] Shiflett MW,Balleine BW.Molecular substrates of action control in cortico-striatal circuits[J].Prog Neurobiol,2011,95(1):1-13.
[7] Alloway KD,Lou L,Nwabueze-ogbo F,et al.Topography of cortical projections to the dorsolateral neostriatum in rats:multiple overlapping sensorimotor pathways[J].JComp⁃Neurol,2006,499(1):33-48.
[8] Yin HH,Knowlton BJ,Balleine BW.Inactivation of dorso⁃lateral striatum enhances sensitivity to changes in the action-outcome contingency in instrumental conditioning[J].Behav Brain Res,2006,166(2):189-196.
[9] Corbit LH,Balleine BW.The role of prelimbic cortex in instrumental conditioning[J].Behav Brain Res,2003,146(1-2):145-157.
[10]Balleine BW,Lijeholm M,Ostlund SB.The integrative function of the basal ganglia in instrumental conditioning[J].Behav Brain Res,2009,199(1):43-52.
[11]Paxinos G,Watson C.The Rat Brain in Stererotaxic Coor⁃dinates.3th ed.San Diego :Academic Press,1997:35,38-40.
[12]ThornCA,GraybielAM.Differential entrainment and learn⁃ing-related dynamics of spike and local field potential activity in the sensorimotor and associative striatum[J].J Neurosci,2014,34(8):2845-2859.
[13]Zahm DS.Ventral Striatopallidum[M].Springer Berlin Heidelberg,2009.
[14]Atallah HE,Lopez-Paniagua D,Rudy JW,et al.Separate neural substrates for skill learning and performance in the ventral and dorsal striatum[J].Nat Neurosci,2007,10,126-131.
[15]Liljeholm M,O’Doherty JP.Contributions of the striatum to learning,motivation,and performance:an associative ac⁃count[J].Trends Cogn Sci,2012,16(9),467-475.
[16]王大磊,刘晓莉,乔德才.大鼠力竭运动中丘脑底核和皮层神经元电活动的变化 [J].中国应用生理学杂志,2011,27(4):427-431.
[17]胡琰茹,乔德才,刘晓莉.力竭运动过程中大鼠苍白球内侧部对皮层的调控作用 [J].中国运动医学杂志,2013,32(5):420-425.
[18]Koos T,Tepper JM.Dual cholinergic control of fast-spik⁃ing interneurons in the neostriatum[J].J Neurosic,2002,22(2):529-535.
[19]Gittis AH,Hang GB,LaDow ES,et al.Rapid target-spe⁃cific remodeling of fast-spiking inhibitory circuits after loss of dopamine[J].Neuron,2011,71(5),858-868.
Analysisof RegionalCharacteristicsof StriatalNeurons Activities in Ratsw ith Exercise-induced Fatigue
Hou Lijuan,Cheng Mingchen,Liu Xiaoli,Zhang Jimin,Qiao Decai
CollegeofPhysicalEducation and Sports,Beijing NormalUniversity,Beijing 100875,China
Qiao Decai,Email:decaiq@bnu.edu.cn
Objective To observe the local field potential activity of dorsomedial and dorsolater striatal(STR)neurons in rats with exercise-induced fatigue,so as to explore the regional characteristics of those neurons.Methods Thirty-six male Wistar rats were random ly divided into a control group(CG),a single fatigue group(SFG)and a repeated fatigue group(RFG),each of 12.The exercise-induced fatigue model was established according to a load-increasing treadmill running protocol.The CG did not do any treadmill running,SFG finished one-time exhaustive exercise while the RFG repeated exhaustive ex⁃ercise 6 times.The extracellular glass microelectrode technique was used to record the spontaneous fir⁃ing of dorsomedial(n=6)and dorsolateral(n=6)STR neurons in vivo to observe the discharging frequency,characteristics and types.Results(1)Spontaneous firing frequencies of striatal neurons in SFG were sig⁃nificantly higher than those of CG(P<0.01),while those of RFG were significantly lower than SFG.(2)After repeated fatigues,there were significant decreases in the irregular firing pattern and significant in⁃crease in the explosive firing of striatal neurons compared with CG(P<0.05).(3)After the single fa⁃tigue and repeated fatigue,the discharging frequency of dorsomedial medium spiny-like neurons in⁃creased significantly(P<0.05),and that after repeated fatigue significantly higher than that of the dorso⁃lateral(P<0.01).The discharge frequency of the dorsomedial and dorsolateral fast-spiking neurons de⁃creased significantly after repeated fatigues.The discharge frequency of dorsolateral large aspiny-like neurons of RFG was significantly higher than SFG,while that of the latter was significantly lower than CG(P<0.05).Conclusions(1)Striatal neurons mediate exercise-induced fatigue and present regional characteristics,which might be due to dorsomedial and dorsolateral striatal neurons receiving different types of projection neurons.(2)Striatal fast-spiking neurons may play an important role in mediating the exercise-induced fatigue.
exercise-induced fatigue,rat,dorsomedial and dorsolateral striatum,electrical activity of neurons
2016.12.21
国家自然科学基金(31171138/31401018),北京市自然科学基金(5142012)
第1作者:侯莉娟,Email:houlj@bnu.edu.cn;
乔德才,Email:decaiq@bnu.edu.cn
