滴滴涕胁迫对棘跳虫的毒理研究
2017-07-13刘国翠
刘国翠


摘要 [目的]探讨有机氯类农药对土壤动物的毒害作用。[方法]对棘跳虫进行不同濃度的滴滴涕(DDT)暴露胁迫,同时采用彗星实验技术研究棘跳虫细胞DNA的损伤程度。[结果]棘跳虫死亡率与DDT浓度呈明显正相关;DDT对棘跳虫24、48、72、96 h的半数致死浓度分别为31.83、24.28、17.15和13.93 μg/L,安全质量浓度为1.39 μg/L。不同浓度的DDT暴露均能引起棘跳虫细胞DNA的损伤,其最大损伤程度可达3级,且彗星尾长、尾距及彗星尾部DNA含量变化与DDT浓度有显著的剂量-效应关系。[结论]试验首次选取跳虫类作为指示动物,通过在细胞水平探究有机农药DDT对棘跳虫细胞DNA的损伤,为评估土壤污染物对土壤动物的毒害机制提供了新思路。
关键词 棘跳虫;滴滴涕;半数致死浓度;DNA损伤
中图分类号 S482.3+2;X171.5 文献标识码 A 文章编号 0517-6611(2017)13-0151-03
Toxic Effects of Dichlorodiphenyltrichloroethane on the Springtails Onychiuyus fimeitayius linnaeus
LIU Guo-cui
(College of Life Sciences, Liaocheng University, Liaocheng, Shandong 252000)
Abstract [Objective] The aim was to study toxic effects of dichlorodiphenyltrichloroethane on the springtails Onychiuyus fimeitayius linnaeus. [Method] The effects of pp-dichlorodiphenyltrichloroethane (DDT) on DNA damage in the springtails of Onychiuyus fimeitayius linnaeus were studied by comet assay. Meantime, the mortality of the springtails was observed after different concentrations of DDT exposure. [Result] The DDT had significant toxic effect on the mortality of the springtails. The median lethal dose was 31.83, 24.28, 17.15, 13.93 μg/L on 24, 48, 72 and 96 h, respectively. The safe concentration was 1.39 μg/L. The DNA damage of springtails cells could be induced under the different mass concentrations of DDT, and the maximum damage degree could reach to 3 levels. The effects of DDT stress on comet tail length, tail length and DNA content in the tail of springtails cells were significantly related to the dose-effect relationship. [Conclusion] It provides a new idea to evaluate the toxicity mechanism of soil pollutants to soil animals, by using the springtails as the indicator animal.
Key words Onychiuyus fimeitayius linnaeus;Dichlorodiphenyltrichloroethane;Median lethal dose;DNA damage
棘跳虫(Onychiuyus fimeitayius linnaeus)属于无翅亚纲弹尾目跳虫科的一类农业昆虫。由于较强的环境耐受力与繁殖力,棘跳虫对蔬菜、食用菌等经济作物的危害日益严重,已成为制约经济作物健康发展的害虫之一。
人工合成的有机氯农药滴滴涕(DDT)因具有极好的杀虫效果,被广泛应用于农业害虫及疟疾和斑疹伤寒等虫媒传染病的控制。据统计,我国累计使用DDT总量达46.4万t,占世界DDT使用总量的 25.8%[1]。土壤是DDT最主要的环境介质,人类活动产生的大量DDT经过各种途径进入土壤,通过食物链最终在动物体脂肪组织内高度富集,其蓄积系数可达百万倍。调查显示,DDT使用量最高的是华东和华北地区,其次是华南地区和新疆棉田地区[2-3]。
有关杀虫剂对跳虫类的防治工作已取得一定成效。陈先玉[4]通过观察高效氯氰菊酯、溴氰菊酯等农药对棘跳虫死亡率的影响,探究了相关杀虫剂在蔬菜种植及防治跳虫类侵害等方面的应用。但目前相关研究仅停留在害虫防治的数量及暴发频次上,相关有机杀虫剂对跳虫类昆虫细胞水平的毒理研究仍然匮乏。鉴于此,笔者通过彗星电泳技术探究了不同浓度的有机氯农药DDT对棘跳虫细胞DNA损伤的影响,以期从细胞水平揭示环境农药对跳虫类昆虫毒害的分子机制,为跳虫类的防治及农药的剂量应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要仪器。
电泳仪(型号为DYY-7C),购自北京六一仪器厂;荧光倒置显微镜(型号为IX71),购自日本Olympus公司;台式冷冻离心机(型号为5702),购自德国Eppendorf公司;高压蒸汽灭菌锅(型号为YX280B),购自上海三申医疗器械有限公司;电子天平(型号为AY220),购自日本Shimadzu公司;纯水仪(型号为MilliQ),购自美国Millipore公司。
1.1.2 主要试剂与药剂。
低熔点琼脂糖凝胶购自Biotech公司;Tris、DMSO、曲拉通X-100等均购自美国Amresco公司;台盼兰、SYBR Green1荧光染料等均购自美国Sigma公司;其他试剂均为国产分析纯。
pp-DDT 购自美国Sigma公司;富铬酵母购自河北燕科生物科技有限公司。
1.1.3 试验动物。
棘跳虫于2015年9月采自聊城大学试验田。采用吸器挑选500只弹跳力较强的个体,体长为(1.2±0.1) mm。于恒温箱25 ℃驯养 7 d,期间喂食酵母菌。
1.2 方法
1.2.1 試验动物分组与给药。
根据国内DDT污染状况与预试验设置5个浓度的DDT酵母溶液,分别为0、5、10、20、40 μg/L。以DMSO作为溶剂配制40 μg/L母液,然后分别稀释至各浓度。试验处理组均设置3个平行,每个平行30只棘跳虫,容器为600 mL聚乙烯盒。试验期间每天于固定时间喂食含不同浓度DDT的酵母溶液。
1.2.2 彗星试验方法。
于暴毒96 h时分别采集不同DDT浓度暴露下的棘跳虫,进行DNA损伤探究试验。彗星电泳方法参照 Singh 等[5]的方法并略加改进,采用三明治凝胶法。制胶前用0.5%台酚蓝染色法检测细胞活力,于4 ℃下铺胶;待凝胶完全凝固后,将制备好的凝胶片放入新鲜配制的预冷的裂解液裂解1 h,4 ℃蒸馏水漂洗掉表层裂解液后,将载玻片移入盛有新鲜配制的预冷的电泳液(1 mmol/L Na2EDTA,300 mmol/L NaOH,pH 13)的电泳槽的阳极端解旋30 min;待双链DNA解旋后于电压25 V、电流300 mA环境下电泳30 min;电泳完毕后,用Tris-HCl浸泡胶片5 min,后经50%、70%、90%、100%等浓度乙醇脱水,然后于4 ℃冰箱中保存凝胶玻片。7 d内取出胶条,经SYBR Green1染色后于荧光显微镜下观察、拍摄单细胞电泳图像用于荧光分析。
1.2.3 统计学分析。
分别于24、48、72、96 h在显微镜下观察记录棘跳虫的生存及死亡情况,以玻璃棒碰触虫体10 s内无肢体反应为死亡标准。利用CASP 1.2.2软件分析彗星图像[6],检测指标包括彗星尾长(TL)、Olive 尾距(OTM)、彗星尾部DNA百分含量(Tail DNA%)。TL反映了损伤产生的DNA片段移动的距离;Tail DNA%=尾部 DNA 荧光强度/(头部 DNA 荧光强度+尾部 DNA 荧光强度)×100%;OTM=尾部重心至头部重心距离×尾部 DNA 百分比。
采用SPSS 19.0软件进行各时间点的半数致死浓度(LC50)计算及单因素方差分析,同时采用Duncans多重比较法分析各组间的差异显著性,结果以平均值±标准差表示。
2 结果与分析
2.1 DDT对棘跳虫死亡率的影响
由图1可知,随暴毒时间的延长,各浓度的棘跳虫死亡率均呈上升趋势,与空白对照组差异显著;最大死亡率出现在96 h的最高浓度组。同时,相同浓度的DDT暴露组随着时间的延长,棘跳虫死亡率也呈持续上升的趋势。
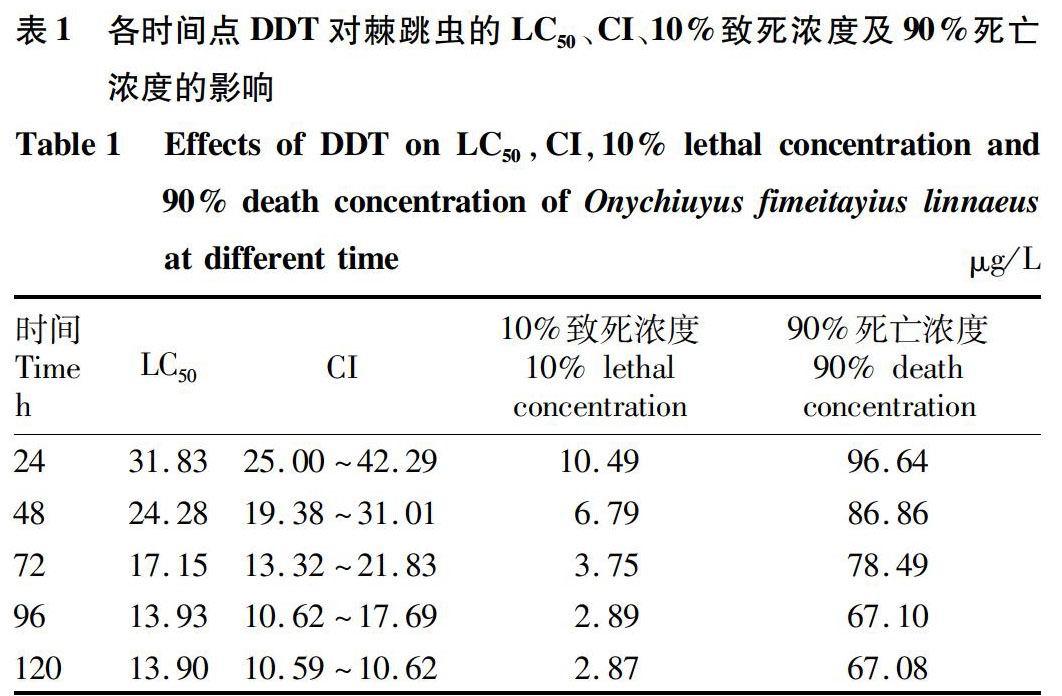
急性毒性试验结果表明,DDT暴露对棘跳虫24、48、72、96 h的LC50分别为31.83、24.28、17.15和13.93 μg/L,其安全质量浓度为1.39 μg/L。总体而言,各时间点LC50、95%置信区间(CI)及各时间致死浓度表现出良好的时间-剂量效应。随DDT暴露时间的延长,其LC50呈现下降趋势,于96 h达到最低值(表1)。
2.2 DDT对棘跳虫DNA的损伤
由图2可知,在荧光显微镜下,DNA片段被SYBR Green1核酸染料染成翠绿色。在DMSO对照组中,细胞呈圆形荧光头部,并未发现拖尾现象,表明在溶剂对照组细胞中未发生DNA链的断裂(图2-a)。随着DDT暴露浓度的升高,棘跳虫细胞DNA链断裂情况愈加严重,表现为DNA断片离头部向阳极方向迁移,在激发光下呈现可见的慧星样拖尾(图2-b~e)。且浓度越高,彗星尾部拖尾越严重,表明随着DDT浓度的升高,棘跳虫细胞DNA损伤程度愈加严重。
由图3可知,不同质量浓度DDT暴露均能引起棘跳虫细胞DNA的损伤,表现为彗尾DNA含量(Tail DNA%)的增加、彗尾长度(TL)加长、Olive尾矩(OTM)增加。3个指标间存在较高的相关性,说明采用以上3个指标,可以很好地反映跳虫细胞DNA的损伤状况。根据彗星尾部DNA百分含量,可将DNA损伤的程度分为5级[7]。以此指标,溶剂对照组Tail DNA%<5%,无损伤;5和10 μg/L浓度组Tail DNA%在5%~20%,属于中度损伤中的1级损伤;20 μg/L浓度组Tail DNA%在20%~40%,属于中度损伤里的2级损伤;最高浓度组(40 μg/L)Tail DNA%含量在40%~95%,属于重度损伤里的3级损伤。
3 结论与讨论
彗星电泳又称单细胞凝胶电泳(SCGE),因其灵敏、简便、快捷等特点,被广泛用于检测DNA遗传损伤细胞凋亡、生态毒理等领域。目前,利用彗星电泳技术监测海洋环境的污染状况已被列入国际通用手段[8],而在土壤污染物环境监测方面的应用鲜见相关报道。以DDT为代表的杀虫剂类药物在土壤中的积累会破坏土壤生态系统的稳定性[9]。同时,一定浓度的DDT积累可引起昆虫乃至高等动物机能亢进和惊厥,最终导致死亡[10]。跳虫作为土壤中的一类优势种群,不但基数大,对土壤污染物刺激也十分敏感,具有成为土壤环境质量指示生物的潜力[11]。结合该研究可以发现,在DDT暴露24 h内,棘跳虫已对低浓度的DDT暴露(5 μg/L)产生反应,同时彗星结果同样显示DDT低浓度组对棘跳虫细胞DNA造成严重损伤。以上结果证实,跳虫对土壤有机氯类农药污染物反应灵敏,可尝试用于土壤环境污染物的检测评估。
受限于土壤污染评价方法,长期以来对土壤质量评价的研究集中在检测污染物的浓度分布状况等方面,而很少将污染物与指示生物二者之间结合起来评价。目前国内外关于土壤污染物毒理的研究主要集中在探究相关污染物对蚯蚓的毒理及DNA的损伤状况,以此来评价土壤污染物对生物体的生理机制[12]。因此,从生物机制层面探究一种对土壤有机污染物毒害作用的快速有效的检测方法,已成为当务之急。
该研究通过对棘跳虫细胞SCGE试验,发现DDT胁迫对棘跳虫细胞的彗星尾长、尾距及彗星尾部DNA含量影响有显著的剂量-效应关系,且3个指标具有很好的一致性。说明不同浓度的DDT胁迫均对棘跳虫细胞造成了不同程度的损伤,且彗星的3个指标可以很好地用于DDT毒理评价的联合指标。说明利用跳虫作为指示生物,通过探究土壤环境中有机污染物对跳虫类的DNA损伤,可以快速有效地评价土壤污染生态风险。
参考文献
[1] 韓文亚,黄俊,余刚,等. 我国持久性有机污染物类废弃杀虫剂库存的清单调查方法学研究[J].农业环境科学学报,2007,26(5):1615-1618.
[2] QIU X H,ZHU T,YAO B,et al.Contribution of dicofol to the current DDT pollution in China[J].Environmental science & technology,2005,39(12):4385-4390.
[3] LI J,ZHANG G,QI S H,et al.Concentrations,enantiomeric compositions,and sources of HCH,DDT and chlordane in soils from the Pearl River Delta,South China[J].Science of the total environment,2006,372(1):215-224.
[4] 陈先玉.几种杀虫剂防治白菜田棘跳虫的试验[J].现代农药,2006,5(2):55-56.
[5] SINGH N P,MCCOY M T,TICE R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cells[J].Experimental cell research,1988,175(1):184-191.
[6] CASAB N,PIOLA L,FUCHS J,et al.Ecotoxicological assessment of the effects of glyphosate and chlorpyrifos in an Argentine soya field[J].Journal of soils and sediments,2007,7(4):232-239.
[7] 张先勇,刁晓平,杨宝,等.苯并[a]芘对马氏珠母贝血淋巴细胞DNA损伤的研究[J].生态环境学报,2011,20(6/7):1107-1110.
[8] 宛立,周遵春,刘桂英,等.单细胞凝胶电泳技术在海洋环境监测中的应用 单细胞凝胶电泳技术检测海洋双壳类遗传损伤的研究[C]//Proceedings of conference on environmental pollution and public health(CEPPH 2012).武汉:美国科研出版社,2012:6.
[9] LI Y F,CAI D J,SINGH A.Historical DDT use trend in China and usage data gridding with 1/4° by 1/6° longitude/latitude resolution[J].Adv Environ Res,1999,2(41):497-506.
[10] GUO Y,YU H Y,ZENG E Y.Occurrence,source diagnosis,and biological effect assessment of DDT and its metabolites in various environmental compartments of the Pearl River Delta,South China:A review[J].Environmental pollution,2009,157(6):1753-1763.
[11] 刘玉荣,贺纪正,郑袁明.跳虫在土壤污染生态风险评价中的应用[J].生态毒理学报,2008,3(4):323-330.
[12] BEYER A,MACKAY D,MATTHIES M,et al.Assessing long-range transport potential of persistent organic pollutants[J].Environmental science & technology,2000,34(4):699-703.
