钠燃烧实验系列问题的探究
2017-07-13郑少绵陈裕森陈国良林珩
郑少绵+陈裕森+陈国良+林珩
摘要:为提高钠在空气中燃烧的最佳观看效果进行实验改进,对其燃烧过程生成物呈现的颜色变化进行系统的实验探究,得出钠在空气中燃烧过程存在Na2O2與NaO2的转化且Na2O2颜色为白色的结论。
关键词:钠燃烧现象;NaO2;Na2O2;实验探究
文章编号:1005–6629(2017)6–00079–04 中图分类号:G633.8 文献标识码:B
1 研究目的
钠在空气中的燃烧是高中化学中对碱金属性质认识的一个重要实验,本文从钠燃烧过程的最佳观赏效果角度出发,通过多次实验得出最佳实验方案。虽然已有人对过氧化钠的颜色进行过研究,但是还没有以钠燃烧实验整体为对象进行系统探究并总结的。为此,本文结合已有文献和对实验的探究,对钠燃烧过程的颜色变化做一个比较系统的讨论和总结。
2 研究现状
以“钠的燃烧”为关键词,从知网搜查由1980年至今的相关文献,得出对钠的燃烧实验改进和燃烧过程的问题进行探讨的文献共有42篇,根据研究角度的不同,对所有文献提供的探究信息分类如表1所示。
由表1可以看出从观察角度和为得到更多淡黄色产物进行实验改进的研究者居多;对燃烧过程出现的黑色物质进行研究改进的也不少,主要是以煤油和空气中的CO2的影响为出发点;对产物颜色变化进行探讨并系统研究的则凤毛麟角,且都为高校研究者,文章发表时间也为最近这几年,说明近几年学界中对钠的燃烧产物颜色变化的问题研究不再局限于实验外界环境,开始从内部原因进行探究,这也使得我们离钠的燃烧产物颜色变化的这一实验谜题的真相越来越近。本文从观察最佳效果的实验改进出发,相对系统和完整地对钠燃烧实验问题进行系列的实验探究。
3 药品和仪器
金属钠块、MnO2粉末、H2O2溶液、浓硫酸、工业Na2O2粉末、高硼硅耐高温培养皿(90mm)、厚2mm铝片、小刀、玻璃片、镊子、滤纸、酒精灯、火柴、三脚架、坩埚钳、硬质玻璃通管、分液漏斗、大试管、玻璃导管、橡胶塞、集气瓶、烧杯、坩埚、泥三角
4 最佳效果实验
通过查阅文献和多次实验后,笔者得出实验效果最佳的方案为以培养皿为燃烧皿,在铝块上进行钠的燃烧。
4.1 实验操作及现象
实验装置如图1所示,点燃酒精灯,将2mm厚的铝片在酒精灯上先加热10s,接着放于培养皿上,并预热,切取黄豆大小金属钠块(擦干钠块表面煤油并切除表面氧化层后)放在培养皿上铝片(铝片起隔热防止培养皿炸裂的作用)正中间。从培养皿边沿就可以观察到钠很快熔化成半球状,约4s后半球面变黑,20s后开始冒火星,并迅速剧烈燃烧起来,这一过程中产物迅速由黑色转化为棕色最后为黄色的珊瑚状固体,最后黄色固体变成带有少许黄色的白色固体。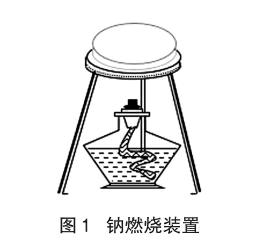
4.2 实验分析及疑问
该实验改进之处是用高硼硅耐高温培养皿和2mm厚的铝片来进行钠的燃烧,原因为:①由于培养皿是透明玻璃材质,学生观看实验过程视觉效果好,如图1所示;②不直接将钠放在培养皿上燃烧而是加了2mm厚的铝片,目的是解决钠燃烧过程局部温度过高使培养皿炸裂的问题;③避免培养皿与钠直接接触反应,降低杂质影响,使得燃烧产物效果更好。
笔者在实验过程产生的疑问:①钠的燃烧产物为何是呈现黑色、棕色到黄色的颜色变化;②黄色固体最后为何变成白色。
根据实验产生的疑问进行相关文献查阅:较多文献将钠燃烧过程产生的黑色物质归结为钠表面残留的煤油燃烧或高温下钠与空气中的CO2反应置换出C,而将最后的淡黄色固体转变成白色固体则大多解释为Na2O2与空气中的CO2反应生成了Na2CO3。朱心奇、范广、李俊生等对Na2O2的颜色进行了探究,认为过氧化钠在不同温度下呈现不同颜色,白色状态是过氧化钠的最稳态[1~3]。
5 钠的燃烧过程颜色变化的实验探究
为了探讨钠在空气中燃烧产物呈现黑色、棕色到黄色的颜色变化的原因,笔者进行了钠在纯氧下燃烧的实验。
5.1 实验操作及现象
实验装置如图2所示。切取绿豆大小钠块(擦干钠块表面煤油并切除表面氧化层后),置于通管的铝片(铝片起隔热防止通管炸裂的作用)上,启动氧气的制取装置经浓硫酸干燥后,进入通管,排尽装置的空气,用酒精灯加热垫有铝片处的通管(整个过程氧气制取一直进行着,通满整个实验装置)。实验现象:钠很快熔化成半球状,约65s后半球面变黄,接着从黄色平面的中心开始变黑,冒火星,并迅速剧烈燃烧起来,少量黑色熔融状物质溢出铝片平面,流到玻璃管壁,同时很快由黑变棕色,再变黄,也很快变成略带黄色的白色固体;而铝片上的产物也迅速由黑色转化为棕色接着变为黄色的珊瑚状固体,最后黄色固体变成带有少许黄色的白色固体,铝片上产物颜色变化的时间比流到玻璃管壁上的产物长。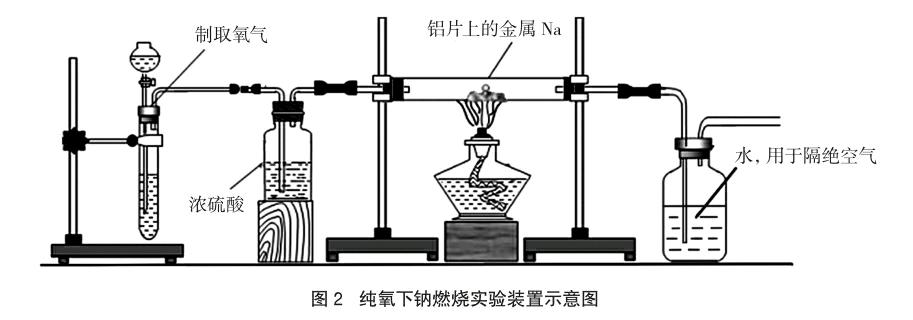
5.2 实验结果分析
观察钠的燃烧过程,黑色物质是先从中心温度最高处产生,再扩散到边缘,且由于钠块较大,使熔融状产物流到玻璃壁上这一实验“事故”,反而有了一个对照实验。说明温度是影响钠的燃烧产物颜色变化的主要原因。即在同一条件下,玻璃壁的温度较铝块的温度低,因此产物由黑色、棕色、黄色再到白色这一颜色变化过程快。
通过本实验笔者认为可以得到以下结论:
(1)“黑色物质是残留的煤油燃烧不充分引起的”结论不成立。原因有三点:①由于已经擦干钠表面的煤油并切除钠表面氧化层,所以燃烧的钠表面的煤油影响基本可忽略;②通过计算得出金属钠的原子间间隙为0.85A9,煤油分子约为0.18A9
,考虑到金属原子间有间隙,煤油分子可进入间隙中这一原因,笔者通过查阅资料得煤油燃点为180~310℃,钠燃烧时温度为500~1000℃,所以当钠燃烧时,煤油早已燃尽或挥发;③当煤油燃烧不充分时会产生黑烟即炭黑,但是本实验为纯氧环境下,全程只产生白烟并无黑烟,所以“黑色物质是残留煤油燃烧不充分引起的”假设不成立。
6.2 实验结果分析
观察过氧化钠高温受热过程,颜色逐渐加深,接着从中间部分变浅棕色和趋向黑色液态状物质,这和钠燃烧的颜色变化几乎是个相反的过程,发生了如下反应:
7 对钠燃烧实验系列问题探究对中学化学教学的意义
化学是一门以实验为基础的学科,教师在形成实验结论时必须科学严谨,不应人云亦云。对钠燃烧产物,许多教师对于淡黄色固体后期变为白色固体的问题解释含糊不清,同时为追求质量高的钠燃烧产物——淡黄色固体而付出很多无用功。这就要求广大中学化学教师应努力提高自己的理论知识和实验研究能力,对中学教材的研究应该与科研实验相结合,不应局限于中学课本。对钠燃烧实验系列问题的探究正是一个能丰富教师专业知识和提高教师研究能力的很好案例,中学教师应该具有勇于挑战教材中存在争议的内容的精神。同时对钠燃烧实验系列问题探究过程及结果也能让中学化学教师根据学生特点和实际情况进行有针对性的教学设计,这一过程不仅为解决学生的疑难问题提供比较科学准确的素材,也能培养学生对实验、对科学应秉持大胆猜测小心论证的思维方式,是一个能有效提高学生化学核心素养的不错案例。同时,由于将要重新改编课标,所以建议在编写教材时应将这一类学术性错误予以纠正,有利于广大中学教师更好地进行教学。
参考文献:
[1]朱心奇.过氧化钠是呈白色还是淡黄色[J].化学教育,2009,(2):69.
[2][6]李俊生,张笑宇,胡志刚.对过氧化钠颜色的研究[J].化学教学,2012,(12):26~28.
[3]范廣,张引莉,孙家娟,徐维霞,马占营.钠在空气中燃烧生成过氧化钠的热力学讨论[J].大学化学,2011,(12):79~80.
[4] ю·B. 卡尔雅金.无机化学试剂手册[M].北京:化学工业出版社,1959:421.
[5] 涅克拉索夫.普通化学教程[M].北京:高等教育出版社,1956:712.
