羊口疮病毒蛋白ORFV035的表达、纯化和多克隆抗体的制备
2017-07-12陈慧芹王小平罗树红王丽洁陈倩倩郝文波
陈慧芹 王小平 罗树红 王丽洁 陈倩倩 郝文波
(南方医科大学检验与生物技术学院抗体工程研究所,广州 510515)
羊口疮病毒蛋白ORFV035的表达、纯化和多克隆抗体的制备
陈慧芹 王小平 罗树红 王丽洁 陈倩倩 郝文波
(南方医科大学检验与生物技术学院抗体工程研究所,广州 510515)
克隆表达羊口疮病毒蛋白ORFV035,并制备其多克隆抗体,为后续对病毒复制、装配、形态发生和成熟过程的研究奠定基础。PCR扩增羊口疮病毒ORFV035基因,将其与质粒pET-30a(+)经BamH Ⅰ和Hind Ⅲ双酶切后连接,构建重组质粒pET30a-035。重组质粒经双酶切和测序鉴定,转化感受态大肠杆菌BL21,IPTG诱导表达,SDS-PAGE鉴定蛋白表达情况。表达产物进行超声破碎和Ni柱纯化,纯化后目的蛋白免疫小鼠,制备多克隆抗体并对其进行鉴定。成功构建了重组质粒pET30a-035,在大肠杆菌BL21中以包涵体形式高效表达。包涵体洗涤、溶解后进行Ni柱纯化,得到纯度较高的ORFV035-his融合蛋白。以纯化蛋白免疫小鼠获得多克隆抗体。Western blot检测显示该多抗可以识别天然ORFV035蛋白。成功诱导表达、纯化ORFV035蛋白并制备ORFV035多克隆抗体。
羊口疮病毒;ORFV035;纯化;多克隆抗体
羊口疮病毒(orf virus,ORFV)属痘病毒科,副痘病毒属。该病毒可引起羊传染性脓疱病,是羊的主要疫病之一[2]。由于病毒的抵抗力强,羊群一旦被感染则不易清除,可持续危害羊群多年,给畜牧业造成一定的经济损失。ORFV基因组含132个基因,由末端基因区和中间核心基因区组成[4]。ORFV中间核心基因区(ORFs009-111)较保守,主要包括与病毒复制和病毒粒子装配成熟的相关基因,与痘病毒相关基因的同源性较高[5]。ORFV035即为中间核心区的一个基因,较保守,基因全长为1 293 bp,编码大小约48.68 kD的蛋白。生物信息学分析发现,ORFV035基因与痘苗病毒(VV)I7L的基因结构类似。在痘苗病毒中,I7L编码核心半胱氨酸蛋白水解酶,主要识别核心蛋白前体P25K和P4b的A-G-A位点,是核心蛋白的成熟,病毒组成和感染子代所必须的。羊口疮病毒的ORFV035是否同样编码半胱氨酸蛋白水解酶,发挥与痘苗病毒I7L基因类似的功能,尚有待进一步研究[6]。
本研究通过PCR扩增获取了ORFV035的基因片段,将其克隆入pET-30a(+)中。经诱导表达获得与His融合表达的ORFV035蛋白,纯化后免疫小鼠制备多克隆抗体,旨为进一步研究035蛋白在ORFV感染过程中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、质粒及菌株 ORFV NA1/11病毒株及其基因组DNA和质粒pET-30a(+)由本室保存;TOP10感受态细胞和大肠杆菌BL21(DE3)pLys购自TIANGEN公司。
1.1.2 试剂 PrimeStar Max DNA聚合酶、限制性核酸内切酶BamH Ⅰ、Hind Ⅲ、DNA Marker、T4 DNA连接酶购自宝生物工程(大连)有限公司;DNA片段凝胶纯化回收试剂盒和质粒提取试剂盒购自Omega公司;LB培养基,酶切缓冲液10× K buffer,TAE缓冲液购自宝生物工程(大连)有限公司;SDS-PAGE电泳缓冲液,SDS样品缓冲液,考马斯亮蓝R-250染色液,考马斯亮蓝脱色液,异丙基硫代半乳糖苷(IPTG)购自Sigma公司。
1.2 方法
1.2.1 PCR引物设计 利用Primer 5.0软件设计扩增ORFV035基因的特异性引物,在上、下游引物中分别引入BamH Ⅰ和Hind Ⅲ酶切位点。引物序列如下:Forward primer:(BamH Ⅰ)5'GCGGATCCATG GACAAGTACACGGATTTAGTGG 3';Reverse primer:(Hind Ⅲ)5' ATAAGCTTTTCATGGCGCCGCCGGCTT CTCGGG 3'。引物送华大基因公司合成。
1.2.2 PCR扩增 以ORFV NA1/11基因组为模板,建立 50 μL PCR 反应体系:PrimeStar Mix 25 μL、病毒 DNA 1 μL、上下游引物各1 μL、ddH2O 21 μL、DMSO 1 μL。反应条件:98℃预变性5 min;98℃变性10 s,56℃退火10 s,72℃延伸15 s,共30个循环;72℃延伸10 min。PCR 产物进行琼脂糖凝胶电泳鉴定,并切胶回收扩增产物。
1.2.3 重组质粒的构建与鉴定 将回收的PCR产物与质粒pET-30a(+)分别进行BamH Ⅰ和Hind Ⅲ双酶切,胶回收后用T4 DNA连接酶4℃反应过夜,连接产物转化TOP10感受态细胞。卡那霉素筛选阳性重组克隆,提取质粒进行双酶切鉴定,并送华大基因有限公司进行DNA测序。
1.2.4 重组质粒的诱导表达和SDS-PAGE分析 测序正确的重组质粒pET30a-035及空质粒pET-30a(+)分别转化大肠杆菌BL21。分别挑单个菌落接种于1 mL含卡那霉素的LB液体培养基中,37℃ 220 r/min振荡培养2 h;按1∶1 000的比例将菌液加到对应的含卡那霉素的LB液体培养基中,37℃ 220 r/min振荡培养3 h至OD≈0.6;收集未诱导的菌液作为阴性对照,余下菌液按1∶500加诱导剂IPTG使终浓度为0.2 mmol/L,37℃ 220 r/min振荡培养4 h。10% SDS-PAGE电泳分析蛋白表达情况。相同条件对小量表达成功的阳性重组菌进行大量表达,收集诱导后样品。冰浴中超声破碎菌体。裂解后的菌液分别收集超声上清和沉淀,10% SDS-PAGE分析重组蛋白的可溶性。
1.2.5 包涵体溶解 大量诱导表达的菌体,用1× PBS重悬,并加入溶菌酶,-80℃反复冻融3次。1∶ 1 000加入100 mmol/L PMSF,冰上超声破碎菌体,4℃高速离心收集包涵体沉淀。用包涵体洗涤液重悬沉淀,搅拌2 h,12 000 r/min,4℃条件下离心30 min,弃上清继续重悬沉淀,共洗涤包涵体3次。用40 mL×2的1% NLS(十二烷基肌氨酸钠)彻底重悬沉淀[7],4℃震荡3 d,12 000 r/min,4℃,60 min离心收集上清和沉淀,进行SDS-PAGE分析鉴定。
1.2.6 Ni柱亲和层析纯化 采用镍柱亲和层析法纯化包涵体蛋白[8]。将1% NLS溶解的融合蛋白用0.22 μmol/L滤膜过滤,过平衡好的镍柱,再用含1% NLS的Binding Buffer平衡,采用0.1 mol/L、0.25 mol/L、0.5 mol/L咪唑的Elution Buffer进行洗脱,并分别收集流穿液和洗脱液[9]。10% SDS-PAGE电泳分析蛋白纯化情况[10]。
1.2.7 ORFV035抗血清的制备及鉴定 纯化的pET30a-035融合蛋白与弗氏佐剂以1∶1(V/V)的比例进行乳化后对小鼠的颈部、背部皮下多点注射。首次免疫采用弗氏完全佐剂,抗原剂量为80 μg/只;之后每隔1周,加强免疫一次,抗原剂量不变,佐剂为弗氏不完全佐剂,加强免疫3次。第3次免疫后3 d断尾采集少量血,分离血清测定效价。待效价符合要求后,再加强免疫一次,3 d后眼球采血,静置后4℃离心后取上清液,-80℃保存备用。Western blot分析制备的ORFV035抗血清的特异性。用感染复数(MOI)为3的野生株病毒感染OFTu细胞,未感染病毒的细胞作为阴性对照,感染后24 h裂解细胞,加入含β-巯基乙醇的2× loading buffer煮样,离心后取上清进行SDS-PAGE电泳,用全湿法电转移到0.22 μmol/L PVDF膜。以制备的ORFV035多抗为一抗(1∶2 000),HRP标记的羊抗鼠IgG作为二抗,ECL发光液显色,暗室曝光显影。
2 结果
2.1 PCR扩增ORFV035基因
PCR扩增ORFV035基因,扩增产物经琼脂凝胶电泳鉴定,获得了与预期大小(1 293 bp)相符的特异性片段,见图1。

图1 ORFV035基因片段PCR扩增结果
2.2 重组质粒pET30a-035的构建与鉴定
PCR产物回收后与质粒pET30a(+)双酶切、连接和转化,成功构建了重组质粒pET30a-035。重组质粒pET30a-035用BamH I和Hind III进行双酶切鉴定,除载体片段外,还出现了约1 293 bp的条带,其大小与预期相符(图2)。选取阳性克隆送华大基因有限公司进行DNA测序,结果与NA1/11株ORFV035基因完全一致。

图2 重组质粒ORFV-035的双酶切鉴定
2.3 重组蛋白的表达与鉴定
重组质粒pET30a-035在大肠杆菌BL21中小量诱导表达,SDS-PAGE电泳分析发现,与对应空载体pET-30a的菌液相比,重组质粒pET30a-035的诱导菌在大小40-55 kD间出现一条较粗的蛋白条带。而未诱导的重组质粒转化菌和空载体质粒转化菌均没有出现相同的条带(图3)。扩大培养后,收集细菌,经超声破碎及离心分离沉淀和上清,分别进行SDS-PAGE电泳,结果(图4)显示重组蛋白主要存在于沉淀中,表明蛋白表达产物主要以包涵体形式存在。

图3 SDS-PAGE分析pET30a-035的诱导表达
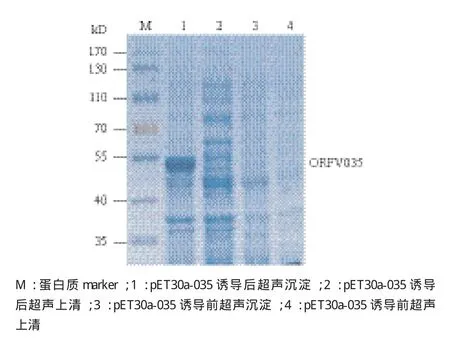
图4 SDS-PAGE分析pET30a-035融合蛋白的可溶性
2.4 包涵体的溶解与纯化
将洗涤过的包涵体用1% NLS溶解,离心后收集上清和沉淀进行SDS-PAGE电泳分析,结果(图5)显示重组蛋白主要存在于上清中,表明重组表达的包涵体蛋白溶解效果较佳。
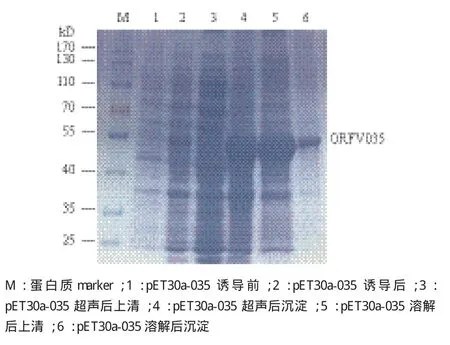
图5 pET30a-035 1% NLS溶解效果的检测
溶解后的包涵体蛋白过镍柱亲和纯化,SDSPAGE电泳结果(图6)显示,洗脱获得的目的蛋白相比诱导表达的重组蛋白和流穿液中的目的蛋白杂带明显减少,达到预期纯化效果。
2.5 多克隆抗体的制备与鉴定
以纯化的重组ORFV035免疫小鼠,制备了鼠抗ORFV035多克隆抗血清。效价测定显示该多抗血清效价达1∶20 000以上。Western blot分析(图7)显示ORFV多抗能识别病毒感染OFTu细胞组约48 kD的特异性条带,而正常OFTu细胞组未见到此大小条带,表明该多抗能够识别天然ORFV035蛋白,可用于后期该蛋白的功能研究。
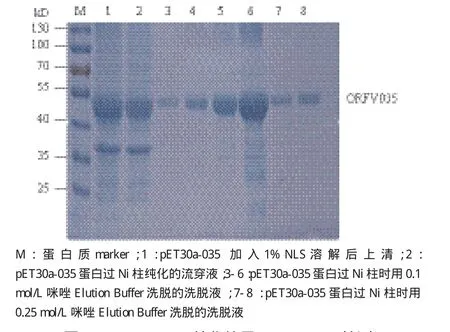
图6 pET30a-035纯化效果SDS-PAGE检测

图7 Western blot检测天然ORFV035蛋白
3 讨论
羊口疮病毒的ORFV035与痘苗病毒的I7L同源性高。在早期和晚期的病毒装配中,I7L编码的病毒蛋白酶与病毒包膜和核心蛋白在特异性位点AG/X断裂相关[11],也参与到了体内三大核心蛋白的水解(P4a、P4b和P25K)[12]。可以说,I7L编码的半胱氨酸蛋白酶和其他基因产物负责病毒核心蛋白水解酶(vCPP)的活动[13]。ORFV035预测功能与I7L相似,推断在ORFV病毒装配中也是需要其作为核心蛋白水解酶来水解核心蛋白以达到形成有感染性子代的目的。研究该蛋白质水解反应的酶学和辅助因子的需求,有可能促进抗病毒药物的发展[14]。而对ORFV035的结构和功能的进一步研究都需要有效表达该蛋白并制备其特异性抗体。
本实验中,为获得满足免疫原用量需求的ORFV035蛋白大量表达,选用大肠杆菌作为表达体系。因为缺乏真核蛋白修饰体系,二硫键的错配加大了蛋白发生错误折叠的可能性,表达产物主要为包涵体形式。实验中尝试了多种诱导条件,包括18℃的低温表达等,结果依然为包涵体表达。而配对正确的二硫键是形成正确蛋白构象的前提,所以要想获得具有生物活性的蛋白必须经过包涵体的变性和复性,打断错配的二硫键并重新配对。我们对包涵体蛋白的溶解条件也做了多次摸索,采用常规的尿素溶解方法,浓度达到8 mol/L尿素溶解效果仍不佳。后采用1% NLS(十二烷基肌氨酸钠),终于获得较好包涵体蛋白溶解效果。包涵体溶解后纯化的蛋白作为免疫原免疫小鼠,也获得了效价好、能特异性识别天然ORFV035的多克隆抗血清。
4 结论
本研究成功构建了原核表达质粒pET30a-035,并在大肠杆菌BL21中以包涵体形式高效表达。包涵体经变性、复性、纯化后获得的ORFV035融合蛋白具有较好的免疫原性,免疫小鼠获得了效价好、能特异性识别天然ORFV035的多克隆抗体。
[1] Zhang K, Liu Y, Kong H, et al. Comparison and phylogenetic analysis based on the B2L gene of orf virus from goats and sheep in China during 2009-2011[J]. Arch Virol, 2014, 159(6):1475-1479.
[2] Yang H, Meng Q, Qiao J, et al. Detection of genetic variations in Orf virus isolates epidemic in Xinjiang China[J]. J Basic Microbiol, 2014, 54(11):1273-1278.
[3] 于永忠, 吴志军, 朱战波, 等. 羊口疮病毒分子特征与免疫逃逸策略[J]. 病毒学报, 2012(3):278-284.
[4] 白刚, 贾怀杰, 何小兵, 等. 羊口疮病毒ORF129基因重组质粒的构建及其在BHK-21细胞中的表达[J]. 甘肃农业大学学报, 2013, 48(5):8-13.
[5] 罗云, 申之义. 羊传染性脓疱病毒分离及生物学特性研究[J].中国畜牧兽医, 2007(1):94-96.
[6] Byrd CM, Hruby DE. A conditional-lethal vaccinia virus mutant demonstrates that the I7L gene product is required for virion morphogenesis[J]. Virol J, 2005, 4(2):1-8.
[7] 徐静, 李树香, 刘立成, 等. 血管内皮细胞生长因子的表达及其单克隆抗体的制备[J]. 中国生物制品学杂志, 2008(11):1002-1005.
[8] 李杰, 李前瑞, 田婷婷, 等. 羊口疮病毒B2L和VIR基因原核表达及抗原性鉴定[J]. 动物医学进展, 2013(3):1-6.
[9] 姬晓南, 张瑜, 冯丽亚, 等. 抗人甲胎蛋白单链抗体融合蛋白的构建、表达及初步鉴定[J]. 药物生物技术, 2013(6):471-474.
[10] 张晓, 杨洋, 孙梅好. 一种基于酵母3', 5'-二磷酸核苷酸酶的蛋白亲和层析纯化体系[J]. 今日科技, 2014(3):47-49.
[11] Ansarah-Sobrinho C, Moss B. Role of the I7 protein in proteolytic processing of vaccinia virus membrane and core components[J]. J Virol, 2004, 78(12):6335-6343.
[12] Byrd CM, Bolken TC, Hruby DE. Molecular dissection of the vaccinia virus I7L core protein proteinase[J]. J Virol, 2003, 77(20):11279-11283.
[13] Byrd CM, Bolken TC, Hruby DE. The vaccinia virus I7L gene product is the core protein proteinase[J]. J Virol, 2002, 76(17):8973-8976.
[14] Byrd CM, Hruby DE. Development of an in vitro cleavage assay system to examine vaccinia virus I7L cysteine proteinase activity[J]. Virol J, 2005, 63(2):1-6.
(责任编辑 狄艳红)
Expression and Purification of orf Virus Protein ORFV035 and Preparation of Polyclonal Antibody
CHEN Hui-qin WANG Xiao-ping LUO Shu-hong WANG Li-jie CHEN Qian-qian HAO Wen-bo
(Institute of Antibody Engineering,School of Laboratory Medicine and Biotechnology,Southern Medical University,Guangzhou 510515)
This work aims to express and purify recombinant orf virus encoded protein 035(ORFV035)in Escherichia coli and prepare a polyclonal antibody(pAb)against ORFV035 for immunoassays,as well as lay foundation for the further researches on the replication,assembly,morphogenesis,and mature process . The gene of ORFV035 was amplified by PCR from orf viral genome,and sub-cloned into the expression vector pET-30a(+),and recombinant plasmid pET-30a-035 was constructed by enzymatic digestion and ligation of BamH I and Hind III. Then the plasmid pET-30a-035 after double enzyme digestion and sequencing was transformed into Escherichia coli BL21,the transformants were induced by IPTG,and SDS-PAGE was used to identify the expression of the protein. The His-tagged fusion protein ORFV035 was ultrasonic-treated and then purified through Ni-chelating affinity chromatography. The purified ORFV035 was used to immune into BALB/c mouse for producing anti-ORFV035 pAb. The results showed that the recombinant plasmids pET30a-035 was successfully constructed,and the protein ORFV035 in E. coli BL21 was in inclusion body. The ORFV035-his fusion protein was obtained after washing,dissolving,and purifying the inclusion body,and the pAb anti-ORFV035 was prepared. The Western blot analysis showed that this pAb recognized natural ORFV035.
orf virus;ORFV035;purification;polyclonal antibody
10.13560/j.cnki.biotech.bull.1985.2016-1182
2017-01-01
国家自然科学基金项目(31672536,31170147)
陈慧芹,女,硕士,研究方向:羊口疮病毒ORFV119蛋白诱导细胞凋亡的分子机制;E-mail:595235420@qq.com
郝文波,女,博士,教授,博士生导师,研究方向:病原体与宿主相互作用;E-mail:haowa@126.com
