乙醇诱导对鼠李糖乳杆菌HCCB 20591代谢乙醛的影响
2017-07-12钟俭鸿殷瑜陈代杰
钟俭鸿殷瑜陈代杰
(1. 华东理工大学生物工程学院,上海 200237;2. 上海交通大学药学院,上海 200240;3. 上海来益生物药物研究开发中心有限责任公司,上海 201203)
乙醇诱导对鼠李糖乳杆菌HCCB 20591代谢乙醛的影响
钟俭鸿1,3殷瑜2,3陈代杰1
(1. 华东理工大学生物工程学院,上海 200237;2. 上海交通大学药学院,上海 200240;3. 上海来益生物药物研究开发中心有限责任公司,上海 201203)
乙醛是酒类饮品中的风味物质,但乙醛过高不仅会影响酒类饮品的风味,还会对人体产生潜在的危害。从可食用的益生菌中筛选可以代谢乙醛的菌株,并探究活性菌株的乙醛代谢能力跟乙醇诱导的关系。通过静息细胞法筛选获得的鼠李糖乳杆菌HCCB 20591具有较强代谢乙醛的能力,且其代谢能力受乙醇诱导。当乙醇诱导浓度为3%,诱导时间为12 h时,乙醛转化率达到41.13%。GC-MS分析其代谢产物除了乙酸外,还生成了乙醇。采用Real time RT-PCR方法分析相关基因的转录水平,发现乙醛代谢是乙醇脱氢酶、乙醛脱氢酶和醛氧化还原酶综合催化作用的结果。
鼠李糖乳杆菌;乙醇诱导;乙醛代谢;综合催化作用
乙醛是酒类饮品中普遍存在的风味物质[1],还在红酒的着色中起作用[2],其主要由酵母菌代谢乙醇产生[3]。但乙醛过高不仅会影响酒类饮品的风味,还会对人体产生潜在的危害[4]。GB31640-2016规定食用酒精中醛的含量应小于30 mg/L,但是研究发现我国成品白酒中乙醛的平均含量经常远超出规定值,高者可达173.24 mg/L[5]。研究如何降低白酒中的乙醛含量具有重要的意义。
乳酸菌作为益生菌对人体是有益的,在维持肠道内菌群的平衡,抑制内毒素分泌,增强免疫,改善肝功能等方面具有重要作用[6-8]。部分肠道乳杆菌,如鼠李糖乳杆菌Lactobacillus rhamnosus ATCC5 3103和发酵乳杆菌Lactobacillus fermentum MG590具有代谢乙醛的活性[9,10],一些乳制品中的乳杆菌也具有代谢乙醛的活性[11]。但是,关于乙醇诱导对乳杆菌代谢乙醛影响的研究却鲜有报道。
本研究试图从可食用的益生菌中筛选具有代谢乙醛能力的乳酸菌,并通过对其相关基因的转录水平分析,推测活性益生菌的乙醛代谢能力与乙醇诱导相关性的可能机制。
1 材料与方法
1.1 材料
1.1.1 试验菌株 实验所用到的菌株:干酪乳杆菌Lactobacillus casei HCCB 20533,罗伊氏乳杆菌Lactobacillus reuteri HCCB 20534、HCCB 20594,嗜酸乳杆菌Lactobacillus acidophilus HCCB 20535、HCCB 20559、HCCB 20592、HCCB 20597,保加利亚乳杆菌Lactobacillus bulgaricus HCCB 20540、HCCB 20560,植物乳杆菌Lactobacillus plantarum HCCB 20553、HCCB 20554,鼠李糖乳杆菌Lactobacillus rhamnosus HCCB 20555、HCCB 20591、HCCB 20598、HN001,均由上海来益生物药物研究开发中心保藏。
1.1.2 试剂与培养基 胰蛋白胨和酵母提取物购自Oxoid公司;40%乙醛购自天津市光复精细化工研究所;其他均为国产分析纯试剂。
菌体培养基为MRS培养基:胰蛋白胨 10 g,牛肉膏 10 g,酵母提取物 5 g,葡萄糖 20 g,乙酸钠 5 g,柠檬酸铵 2 g,吐温80 1 g,磷酸氢二钠 2 g,一水硫酸锰 0.03 g,琼脂15 g,定容至1L,pH4.3,121℃,15 min灭菌,备用。根据需要加入适当浓度的乙醇。
1.1.3 试剂盒 细菌总RNA提取试剂盒购自天根生化科技有限公司;Revert Aid First Strand cDNA Synthesis Kit试剂盒购自Thermo Scientific Fermentas;SYBR Green Real-Time qPCR试剂盒购自Roche。
1.1.4 主要仪器与设备 Centrifuge 5417R 台式离心机和Mastercycler ep PCR仪购自Eppendorf公司;ABI 7500 Real time-PCR System购自ABI公司;气相色谱-质谱联用仪(GC-MS)7890A-5975C购自美国安捷伦公司。
1.2 方法
1.2.1 菌体细胞的培养与菌悬液的制备 将菌株从甘油管中接种至MRS培养基内,37℃过夜生长,获得预培养液;然后将预培养液按1%的接种量接至不含乙醇及含不同乙醇浓度(1%、3%、5%)的MRS培养基内,37℃静置培养3-18 h。取出菌液,离心,去上清;PBS(10 mmol/L,pH7.5)洗涤菌体两次,再重悬菌体,调整菌悬液浓度约为3×109CFU/mL[9];获得的菌悬液用于代谢乙醛。
1.2.2 平板菌落计数法测定菌浓 将待测样品用新鲜MRS培养基稀释,吸取10-4、10-5和10-6的稀释菌悬液各100 μL于平皿中,倒入融化后冷却至45℃左右的MRS培养基,混匀,37℃培养48 h。取出平板,计算同一稀释度3个平板上的菌落数,按下列公式计算菌浓:
每毫升中菌落形成单位(CFU)=同一稀释度3次重复的平均菌落数×稀释倍数×10
1.2.3 乙醛的静息细胞转化 取900 μL经过不同条件培养获得的菌株的PBS菌悬液与300 μL 1%的乙醛溶液混合,于37℃,220 r/min的反应条件下培养2 h[9];以不加菌悬液的反应作为阴性对照。反应结束后,12 000 r/min离心反应液5 min,上清用于检测乙醛的残留量。文中所有生物代谢实验均重复3次,取其平均值。
1.2.4 具有乙醛代谢活性的益生菌株筛选 选取15株益生菌,分别在有氧、无氧条件下,在无添加以及添加5%乙醇的MRS培养基中培养15 h后,收集菌体细胞用于乙醛转化,用化学法检测乙醛的含量。
1.2.5 分析方法 乙醛化学定量检测方法参见文献[12]。乙醛及其代谢产物的GC-MS检测方法参见文献[13]。
1.2.6 细菌总RNA提取及反转录 采用细菌总RNA提取试剂盒分别提取不同培养条件下获得的菌体的总RNA,参考RNAprep Pure Cell/Bacteria Kit 产品说明书去除总RNA中的基因组DNA,依据如下公式:RNA浓度=(A260-A280)×稀释倍数×0.04 μg/μL,测定总RNA的浓度。使用Revert Aid First Strand cDNA Synthesis Kit反转录试剂盒中的随机引物将1 μg的总RNA进行反转录反应,得到cDNA并置于-80℃冰箱备用。
1.2.7 Real time RT-PCR 选择乙醇脱氢酶基因(alcohol dehydrogenase,adh)、乙醛脱氢酶基因(aldehyde dehydrogenase,aldh)和醛氧化还原酶基因(aldehyde oxidoreductase,aor)进行mRNA转录水平分析,以鼠李糖乳杆菌L. Rhamnosus ATCC 53103内源稳定表达的16S RNA基因[14]作为内参基因。根据L. Rhamnosus ATCC 53103基因组(GenBank号:NC_013198.1)设计用于荧光定量PCR扩增目标片段的引物序列,由上海英骏生物技术有限公司合成。引物特征见表 1。反应体系10 μL及反应程序均按照Roche公司SYBR Green Real-Time qPCR试剂盒说明书操作,每个反应设3个重复。采用相对定量的Comparative Delta-delta Ct方法,分析目的基因相对表达量。

表1 Real time RT-PCR引物序列
2 结果
2.1 具有乙醛代谢活性的益生菌株的筛选
不同培养条件下各菌株代谢乙醛情况结果(图1)显示,鼠李糖乳杆菌L. Rhamnosus HCCB 20591代谢乙醛活性最为突出,且乙醇的存在显著增强其乙醛代谢活性,乙醛转化率为26.01%,为无乙醇诱导时的3.61倍。因此,后继实验选定在有乙醇诱导培养的L. Rhamnosus HCCB 20591作进一步的研究。2.2 不同乙醇诱导浓度的影响
不同乙醇浓度诱导HCCB 20591 15 h后,菌体细胞代谢乙醛的情况如图2所示。从图中可以看出乙醇诱导浓度为3%时,代谢乙醛活性最大,乙醛转化率为34.69%。因此,确定3%为最适乙醇诱导浓度。
2.3 不同乙醇诱导时间的影响
将HCCB 20591接种到乙醇浓度为3%的培养基中,每3 h用平板菌落计数法测定菌浓并用化学检测法检测菌体代谢乙醛的活性。结果如图3所示,诱导时间12 h时,HCCB 20591代谢乙醇的活性最大,乙醛转化率为41.13%。相比无乙醇培养15 h时,转化率提高了5.69倍。因此,确定乙醇浓度3%,诱导时间12 h为合适的诱导条件。
2.4 乙醛代谢产物的GC-MS分析
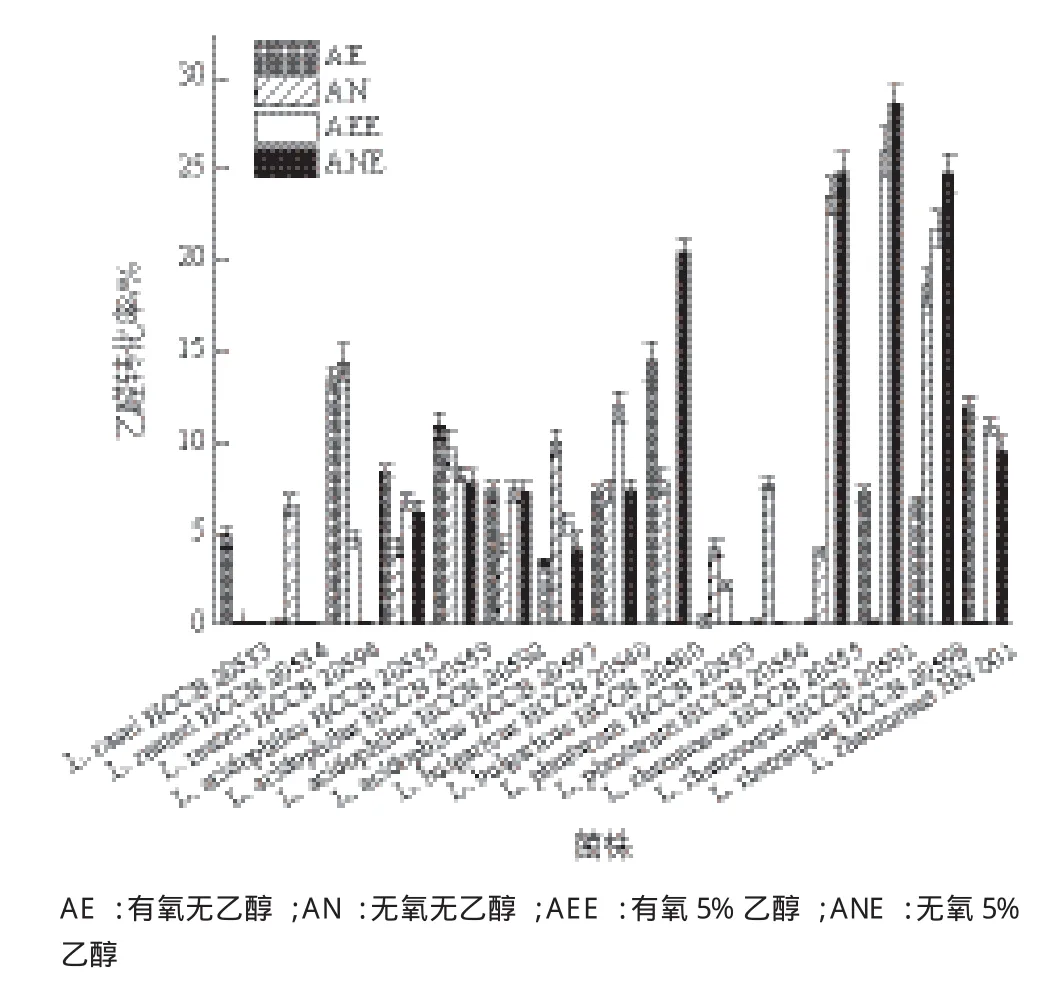
图1 不同培养条件下益生菌静息细胞代谢乙醛的情况

图2 乙醇诱导浓度对HCCB 20591静息细胞代谢乙醛能力的影响
采用GC-MS分析HCCB 20591经不同乙醇浓度诱导12 h后代谢乙醛的产物(表2),发现HCCB 20591代谢乙醛生成乙酸的同时也生成了乙醇,且菌体转化乙醛的量和生成乙酸、乙醇的量与乙醇的诱导有关。3%乙醇诱导时,菌体转化乙醛的量和生成乙醇的量最多。
2.5 乙醛代谢相关基因的转录水平分析
从2.4的结果可看出,乙醛的代谢途径不单一,可能涉及多个酶。本研究通过对ATCC 53103的基因组分析,发现aor基因编码的醛氧化还原酶(AOR)、adh基因编码的乙醇脱氢酶(ADH)和aldh编码的乙醛脱氢酶(ALDH)可能参与了乙醛代谢。其中,AOR催化乙醛还原为乙醇,ADH催化乙醇氧化为乙醛,ALDH催化乙醛氧化为乙酸。进一步对aor、 adh和aldh基因进行了转录水平分析(表3),可以看出,3个基因都有乙醇诱导表达现象存在,但不同乙醇浓度诱导下其表达量不同,这可能是导致HCCB 20591代谢乙醛的量、生成乙酸和乙醇的量出现差异的主要原因。
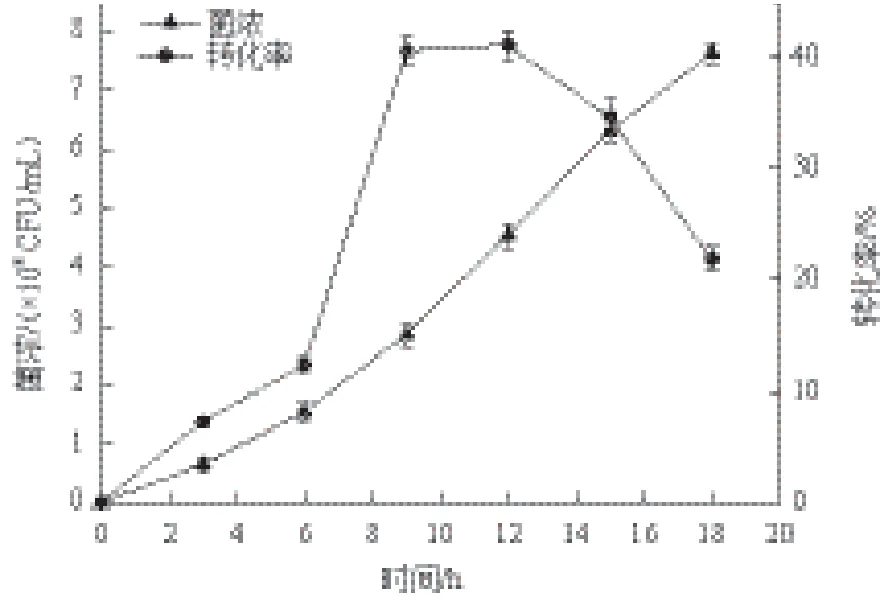
图3 HCCB 20591菌浓以及代谢乙醛能力随诱导时间的变化情况
3 讨论
乙醛作为挥发性的风味物质在酒中起重要作用。酒中乙醛浓度偏高成为我国酿酒行业普遍面临的难题。本研究对15株益生菌的静息细胞代谢乙醛的能力进行比较,发现HCCB 20591具有较强的代谢乙醛的能力,并且这种能力与乙醇诱导有关。经过对乙醇诱导条件的选择,HCCB 20591乙醛转化率达到41.13%。这意味着HCCB 20591代谢酒中的乙醛是可行的。其部分代谢乙醛的能力既可以降低乙醛浓度,又不至于完全改变乙醛带来的风味,具有潜在的应用价值。
ALDH作为参与乙醛降解主要的酶,广泛存在于微生物中[15]。利用具有乙醛生物降解功能的微生物降解乙醛成为酒精性疾病预防的研究重点[16]。Kim等[10]研究发现Lactobacillus fermentum MG-590具有ADH 和ALDH 活性,能降解乙醇,缓解由乙醇引起的肝细胞损伤。另外,也有研究发现ADH、AOR在催化乙醛转化时起作用[17,18]。本研究通过对可能涉及HCCB 20591代谢乙醛过程的3个基因(adh、aldh和 aor)进行Real time RT-PCR分析,发现HCCB 20591代谢乙醛是ADH、ALDH和AOR综合作用的结果,随乙醇诱导浓度而变化,代谢的产物既有乙酸,也有乙醇。
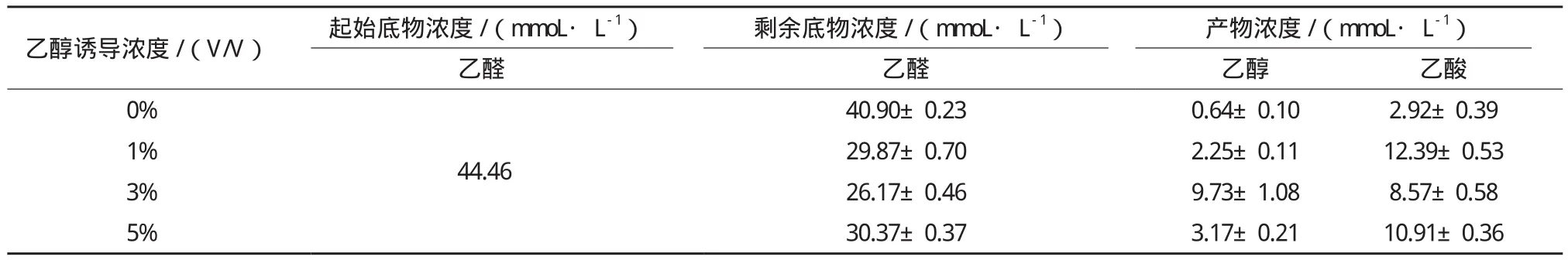
表2 GC-MS分析HCCB 20591经不同乙醇浓度诱导后代谢乙醛的情况
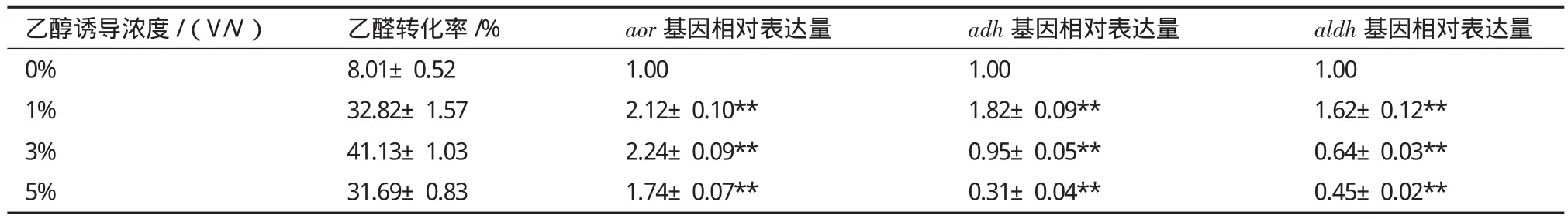
表3 不同乙醇浓度诱导12 h后HCCB 20591乙醛代谢相关基因的相对表达量
乙醇对乳杆菌代谢的影响涉及的因素比较多,如关键酶的活力、菌体存活率、细胞膜性质等[19,20]。本研究主要从分子水平探讨乙醇诱导对HCCB 20591代谢乙醛相关基因的影响,是否还有别的因素在乙醇诱导后菌体代谢乙醛的过程中起作用有待进一步探究。
4 结论
HCCB 20591具有较强的代谢乙醛的能力,并且这种能力与乙醇诱导有关。当乙醇诱导浓度为3%,诱导时间为12 h时,乙醛转化率达到41.13%。HCCB 20591代谢乙醛是ADH、ALDH和AOR综合作用的结果。
[1]Miyake T, Shibamoto T. Quantitative analysis of acetaldehyde in foods and beverages[J]. Journal of Agricultural and Food Chemistry, 1993, 41(11):1968-1970.
[2]Sheridan MK, Elias RJ. Exogenous acetaldehyde as a tool for modulating wine color and astringency during fermentation[J]. Food Chem, 2015, 177:17-22.
[3]Liu SQ, Pilone GJ. An overview of formation and roles of acetaldehyde in wine making with emphasis on microbiological implications[J]. International Journal of Food Science & Technology, 2000, 35(1):49-61.
[4]Paiano V, Bianchi G, Davoli E, et al. Risk assessment for the Italian population of acetaldehyde in alcoholic and non-alcoholic beverages[J]. Food Chem, 2014, 154:26-31.
[5]朱梦旭, 范文来, 徐岩. 我国白酒蒸馏过程及原酒, 成品酒中乙醛的研究[J]. 食品与发酵工业, 2016(04):6-11.
[6]Alvarez-Olmos MI, Oberhelman RA. Probiotic agents and infectious diseases:a modern perspective on a traditional therapy[J]. Clinical Infectious Diseases, 2001, 32(11):1567-1576.
[7]Vitini E, Alvarez S, Medina M, et al. Gut mucosal immunostimulation by lactic acid bacteria[J]. Biocell, 2000, 24(3):223-232.
[8]Tian F, Chi F, et al. Lactobacillus rhamnosus CCFM1107 treatment ameliorates alcohol-induced liver injury in a mouse model of chronic alcohol feeding[J]. J Microbiol, 2015, 53(12):856-863.
[9]Nosova T, Jousimies-Somer H, Jokelainen K, et al. Acetaldehyde production and metabolism by human indigenous and probiotic Lactobacillus and Bifidobacterium strains[J]. Alcohol Alcohol, 2000, 35(6):561-568.
[10]Kim JH, Kim HJ, Son JH, et al. Effect of Lactobacillus fermentum MG590 on alcohol metabolism and liver function in rats[J]. Journal of Microbiology and Biotechnology, 2003, 13(6):919-925.
[11]Liu SQ, Asmundson RV, Holland R, et al. Acetaldehyde metabolism by Leuconostoc mesenteroides subsp. cremoris under stress conditions[J]. International Dairy Journal, 1997, 7(2):175-183.
[12]冯泳兰. 检验乙醛的一种简便方法[J]. 衡阳师范学院学报, 1990(3):41-43.
[13]贾青青, 邵威平, 辛秀兰, 等. 黑加仑果与果酒香气成分的GC-MS分析[J]. 中国酿造, 2014, 33(3):141-146.
[14]Hayashi H, Sakamoto M, Benno Y. Phylogenetic analysis of the human gut microbiota using 16S rDNA clone libraries and strictly anaerobic culture-based methods[J]. Microbiol Immunol, 2002, 46(8):535-548.
[15]Kelson TL, Mcvoy JRS, Rizzo WB. Human liver fatty aldehyde dehydrogenase:microsomal localization, purification, and biochemical characterization[J]. Biochim Biophys Acta, 1997, 1335(2):99-110.
[16] 杨亚平. 乙醇脱氢酶基因和乙醛脱氢酶基因的克隆及表达[D]. 芜湖:安徽工程大学, 2013.
[17]徐惠娟, Dürre P, 梁翠谊, 等. Clostridium ljungdahlii乙醛铁氧还蛋白氧化还原酶基因插入失活载体的构建[J]. 化工进展, 2012(S1):523-523.
[18]Whitham JM, Tirado-Acevedo O, Chinn MS, et al. Metabolic response of Clostridium ljungdahlii to oxygen exposure[J]. Appl Environ Microbiol, 2015, 81(24):8379.
[19]朱敏, 李宝坤, 李开雄, 等. 乙醇胁迫对乳酸杆菌关键酶活力的影响[J]. 食品与发酵工业, 2015(1):40-45.
[20]Ramos JL, Duque E, Rodríguezherva J, et al. Mechanisms for solvent tolerance in bacteria[J]. Journal of Biological Chemistry, 1997, 272(7):3887-3890.
(责任编辑 朱琳峰)
Effect of Ethanol-induction on the Metabolism of Acetaldehyde in Lactobacillus rhamnosus HCCB 20591
ZHONG Jian-hong1,3YIN Yu2,3CHEN Dai-jie1
(1. School of Biotechnology,East China University of Science and Technology,Shanghai 200237;2. School of Pharmacy,Shanghai Jiao Tong University,Shanghai 200240;3. Shanghai Laiyi Center for Biopharmaceutical R&D,Shanghai 201203)
Acetaldehyde is a flavor substance in alcoholic beverages. Excessive acetaldehyde not only affects the flavor of alcoholic beverages,but also causes health damages to human body. This study is to screen edible probiotic strains with the ability to metabolize acetaldehyde,and explore the relationship between acetaldehyde metabolism and ethanol-induction. Strain HCCB 20591 of Lactobacillus rhamnosus with strong acetaldehyde metabolism ability was obtained via a resting cell system,and its metabolic ability was induced by ethanol. When the ethanol concentration was 3% and the induction time was 12 h,the acetaldehyde conversion ratio by HCCB 20591 was 41.13%. GC-MS analysis of the acetaldehyde metabolites showed that in addition to acetic acid,ethanol was also generated by HCCB 20591. RT-PCR method was used to analyze the transcription level of the related genes. It was found that acetaldehyde metabolism was the combined catalytic result of alcohol dehydrogenase,aldehyde dehydrogenase and aldehyde oxidoreductase.
Lactobacillus rhamnosus;ethanol-induction;acetaldehyde metabolism;combined catalytic result
10.13560/j.cnki.biotech.bull.1985.2017-0051
2017-01-24
钟俭鸿,男,在读硕士研究生,研究方向:发酵工程微生物;E-mail:906269707@qq.com
陈代杰,男,博士,研究方向:微生物药物的开发;E-mail:hccb001@163.com
