重症肺炎患者血清过氧化物及抗氧化物水平与病情严重程度的关系
2017-07-12黄志卫陆玲
黄志卫+陆玲
【摘要】 目的 探究重症肺炎患者血清过氧化物及抗氧化物水平的情况及其与患者病情严重程度的关系。
方法 临床选取80例肺炎患者,其中40例符合重症肺炎诊断标准为A组,40例非重症肺炎患者为B组。检测两组患者血清过氧化脂质(LPO)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px),用t检验比较两组患者的差异。评价重症肺炎患者组急性生理与慢性健康评分(APACHE-Ⅱscore)、临床肺部感染评分(CPIS),同时对患者APACHE-Ⅱ评分、CPIS评分与LPO、SOD、GSH-Px进行Spearman相关性分析,探究过氧化物及抗氧化物含量与病情严重程度的相关性。
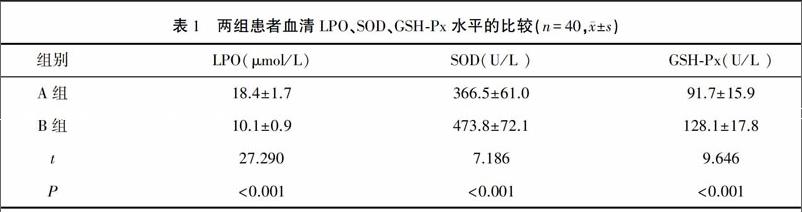
结果 A组患者血清LPO显著高于B组,血清SOD、GSH-Px活性显著低于B组,差异有统计学意义(P<0.05)。患者LPO水平与APACHE-Ⅱ评分呈正相关(rs=0.866,P<0.001),SOD水平与APACHE-Ⅱ评分呈负相关(rs=-0.620,P<0.001),GSH-Px与APACHE-Ⅱ评分呈负相关(rs=-0.734,P<0.001);患者LPO水平与CPIS评分呈正相关(rs=0.641,P<0.001),SOD水平与CPIS评分呈负相关(rs=-0.613,P<0.001),GSH-Px與CPIS评分呈负相关(rs=-0.727,P<0.001)。
结论 重症肺炎患者血清过氧化水平显著高于非重症肺炎患者,且血清过氧化水平越高病情越严重。
【关键词】 重症肺炎;全身反应;氧化-抗氧化平衡;APACHE-Ⅱ评分;CPIS评分
中图分类号:R563.1 文献标识码:A DOI:10.3969/j.issn.1003-1383.2017.03.014
【Abstract】 Objective To explore relationship between the level of serum peroxides and antioxidants and the severity of patients with severe pneumonia.
Methods 80 cases of pneumonia were selected,of which 40 cases of patients with severe pneumonia diagnosis criteria for group A,and 40 cases of non severe pneumonia for group B.Serum lipid peroxides (LPO),superoxide dismutase (SOD) and glutathione peroxidase (GSH-Px) were measured in the two groups,and T test was used to compare the differences between the two groups.Acute physiology and chronic health score (APACHE-Ⅱ score) and clinical pulmonary infection score (CPIS) were evaluated.Meanwhile,Spearman correlation analysis was carried out on APACHE-Ⅱscore,CPIS and LPO,SOD and GSH-Px.In addition,relationship between serum peroxides and antioxidants and the severity was explored.
Results The serum LPO of the group A was significantly higher,but the activities of serum SOD and GSH-Px were significantly lower than those of the group B,difference was statistically significant(P<0.05).The serum LPO level was positively correlated with APACHE-Ⅱ score(rs=0.866,P<0.001),the SOD level was negatively correlated with APACHE-Ⅱ score (rs=-0.620,P<0.001),and GSH-Px was negatively correlated with APACHE-Ⅱ score (rs=-0.734,P<0.001).In addition,the serum LPO level was positively correlated with CPIS(rs=0.641,P<0.001),the SOD was negatively correlated with CPIS (-0.613,P<0.001),and GSH-Px was negatively correlated with CPIS(rs=-0.727, P<0.001).
Conclusion Serum peroxides levels of patients with severe pneumonia are significantly higher than that in patients without severe pneumonia,and the patients with higher serum level of peroxides are more serious.
【Key words】 severe pneumonia;systemic reaction;imbalance of oxidation and anti-oxidation;APACHE-Ⅱ score;CPIS
绝大多数重症肺炎患者除存在严重的呼吸系统症状外,尚有明显累及其他系统功能的表现,可见重症肺炎是一种系统性疾病。有关重症肺炎全身反应机制的报道有很多,如休克、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)[1~3]等,但有关重症肺炎与氧化应激报道并不多见。重症肺炎进展过程中引起的缺氧及炎症反应都可能影响机体氧化-抗氧化平衡[4],导致患者机体氧化应激的发生,从而推动病情进一步发展。本研究拟探讨重症肺炎患者血清中过氧化物(Reactive oxygen species,ROS)及抗氧化物水平及其与重症肺炎患者病情严重程度的关系。
1 对象与方法
1.1 研究对象
为我院2016年2月至5月ICU收治的重症肺炎患者40例,以及呼吸内科肺炎住院患者40例。重症肺炎患者为A组,男性23例,女性17例;年龄47~74岁,中位年龄62岁,四分位间距为53岁及67岁;社区获得性肺炎22例,医院獲得性肺炎18例。非重症肺炎患者为B组,男性20例,女性20例;年龄44~70岁,中位年龄59岁,四分位间距为51岁及65岁;社区获得性肺炎24例,医院获得性肺炎16例。两组患者在性别、年龄、肺炎类型等方面比较,差异无统计学意义(P>0.05)。
1.2 对象选取条件
依据美国胸科学会(ATS)2001年对重症肺炎的诊断标准[5],重症肺炎患者诊断符合1条主要标准或2条次要标准。主要诊断标准:①需要机械通气;②入院48 h内肺部病变扩大≥50%;③少尿(每日<400 ml)或非慢性肾衰患者血肌酐>177 μmol/L(2 mg/dl)。次要标准:①呼吸频率>30次/min;②PaO2/FiO2<250;③病变累及双肺或多肺叶;④收缩压<12 kPa(90 mmHg);⑤舒张压<8 kPa(60 mmHg)。两组均排除合并严重的免疫缺陷和免疫抑制,凝血功能障碍以及难以控制的呼吸衰竭,合并其他基础疾病的患者。
1.3 检测方法
取患者入院后2小时内2 ml静脉血,血清过氧化脂质(lipoperoxides,LPO)检测采用硫代巴比妥酸比色法检测,使用碧云天公司的脂质氧化检测试剂盒(Lipid Peroxidation MDA Assay Kit),货号:S0131,单位以丙二醛含量表示(μmol/L)。超氧化物歧化酶(Superoxide Dismutase,SOD)测定采用氮蓝四唑法检测,使用碧云天公司的总SOD活性检测试剂盒(Total Superoxide Dismutase Assay Kit with NBT),货号:S0107,单位以酶活性表示(U/L)。谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)检测采用改良Hafaman氏法,使用上海盈公酶联检测试剂有限公司人谷胱甘肽过氧化酶ELISA定量试剂盒(Human Glutathione peroxidase,GSH-Px ELISA Kit),货号:yg-elisa-2241,单位以酶活性表示(U/L)。
1.4 评分标准
(1)危重症评分(Acute Physiology and Chronic Health Evaluation, APACHE-Ⅱ score)评价患者病情严重程度:APACHE-Ⅱ评分量表包含生理评分、年龄、慢性病评分3个部分。生理评分包括直肠温度、平均动脉压、心率、呼吸、肺泡-动脉氧分压差(A-ADO2)或氧分压(PaO2)(FiO2≥0.5时用A-ADO2,FiO2<0.5时用PaO2)、动脉血pH值、血清钠、血清钾、血清肌酐、血细胞比容、白细胞计数以及血电解质12个指标,根据各指标不同的异常程度划分等级并评分。年龄划分为5个等级:≤45,0分;46~54,2分;55~64,3分;65~74,5分;≥75,6分。合并慢性病且非手术或急诊手术患者5分,择期手术者2分。总分71分,评分越高,患者病情越危重,病死率越高。(2)患者感染程度采用临床肺部感染评分(Clinical Pulmonary Infection score,CPIS)衡量,其评分标准为:①体温(12 h平均值,℃):36.5~38.4为0分,38.5~38.9为1分,≥39.0或≤36.0为2分;②白细胞计数(×104):4~11为0分,<4或>11为1分;③分泌物(24小时吸出物性状及量):无痰或少量为0分,中量非脓性为1分,大量为2分,大量伴脓性为3分;④氧合指数(PaO2/FiO2,mmHg):>240为0分;≤240为2分;⑤X线胸片浸润影:无为0分,斑片状为1分,融合片状为2分;⑥两次培养到同一种细菌或者革兰染色与培养一致为2分。评分越高,患者感染症状越严重。
1.5 统计学方法
采用SPSS 19.0统计分析软件,Kolmogorov-Smirnov检验数据的正态性,偏度以s表示,峰度以K表示,正态分布计量资料采用平均数±标准差(±s)表示,使用t检验比较两组检查结果,非正态分布资料用中位数±四分位间距表示,秩和检验比较两组差异,采用Spearman相关分析判断患者血清中氧化物、抗氧化物水平与APACHE-Ⅱ评分、CPIS评分是否有相关性,检验水准:α=0.05,双侧检验。
2 结 果
2.1 两组患者血清LPO、SOD、GSH-Px水平的比较 D检验结果显示两组患者LPO、SOD、GSH-Px水平均符合正态分布(其中PLPO=0.17,PSOD=0.23,PGSH-Px=0.19,P均大于0.05,可以认为LPO、SOD、GSH-Px水平均符合正态分布),两组患者血清LPO、SOD、GSH-Px水平比较,A组患者血清LPO水平明显高于B组,SOD、GSH-Px水平显著低于B组,差异有统计学意义(P<0.001)。见表1。

2.2 重症肺炎患者血清LPO、SOD、GSH-Px水平与患者APACHE-Ⅱ评分的相关性分析 APACHE-Ⅱ及CPIS评分均呈偏态分布,故使用Spearman相关性分析,重症患者LPO水平与APACHE-Ⅱ评分呈正相关(rs=0.866,P<0.001),SOD水平与APACHE-Ⅱ评分呈负相关(rs=-0.620,P<0.001),GSH-Px水平与APACHE-Ⅱ评分呈负相关(rs=-0.734,P<0.001)。
2.3 重症肺炎患者血清LPO、SOD、GSH-Px水平与患者CPIS评分的相关性分析 使用Spearman相关性分析,重症患者LPO水平与CPIS评分呈正相关(rs=0.641,P<0.001),SOD水平与CPIS评分呈负相关(rs=-0.613,P<0.001),GSH-Px水平与CPIS评分呈负相关(rs=-0.727,P<0.001)。
3 讨 论
重症肺炎的本质是多种致病因素引起的急性肺实质炎症的危重状态,且常伴有严重的呼吸窘迫、血流动力学异常、感染性休克、甚至引起多脏器衰竭综合征(multiple organ failure syndrome, MOFS)。肺叶大面积受累,中性粒细胞在肺内大量聚集、各炎症因子和纤维蛋白介导血管内皮及肺上皮细胞通透性增加,肺泡内渗出增加,肺毛细血管炎性肿胀并充血,导致肺水肿及肺毛细血管微血栓的形成,此过程中机体发生严重的缺氧及炎症反应。
一方面,缺氧能够通过多种途径升高体内ROS的水平,影响机体氧化-过氧化平衡。①缺氧引起线粒体功能障碍,从而使ROS水平升高,Kuo及Circu[6~7]的研究显示,缺氧将导致细胞线粒体中LON蛋白的表达上调,该蛋白不仅能够直接使ROS水平升高,还可以通过增强细胞对ROS的敏感性而促进细胞的凋亡;同时缺氧引起的钙离子平衡系统紊乱,使得线粒体通透性转换孔(mitochondrial permeablity transition pore, mPTP)异常开放,加速线粒体中ROS的产生[8]。②缺氧导致缺氧诱导因子(hypoxia inducible factor-1, HIF1)的表达增加,其介导机体内红细胞的增殖,并联合缺氧环境导致新生红细胞破坏,引起抗氧化物及相关酶类的减少,如SOD,从而导致ROS的过度积累[9~10]。③缺氧还可以通过上调雄激素受体、血管内皮生长因子、白介素-8等的表达促进ROS水平增加[11]。
另一方面伴随着持续的炎症反应,大量炎性细胞浸润、炎症因子被释放,多种信号途径被激活,促进ROS的产生。①炎性相关因子核因子Kappa B(Nuclear factor KappaB,NF-κB)能上调Toll样受体(Toll-like receptors,TLR)的表达,从而上调ROS的水平[12~14]。②肿瘤坏死因子(Tumor necrosis factor,TNF)也可以通过NF-κB和JNK(Jun N-terminal kinase)途徑上调ROS的水平[15]。③NLRP3炎性小体同样可以使NF-κB转位,促使线粒体产生ROS[16]。
本研究中,重症肺炎组血清ROS水平显著高于非重症肺炎组,抗氧化物显著低于非重症肺炎组,且重症肺炎组ROS水平越高、抗氧化物水平越低,患者病情越严重,感染症状越明显,说明氧化-抗氧化平衡的紊乱在重症肺炎中起到了关键的作用。ROS不仅能够直接损伤细胞,也可通过多种信号途径诱导细胞凋亡的发生[17~19],同时能与炎症细胞相互作用,在SIRS的发生发展过程中起到促进作用。
综上所述,体内ROS水平不仅可以反映患者病情进展程度,临床上也可以通过调节患者体内的氧化水平达到扭转SIRS的瀑布效应,纠正氧化-抗氧化失调的目的,从而有利于患者病情的稳定,可以减少患者病死率。
参 考 文 献
[1] Liu W,Peng L,Hua S.Clinical significance of dynamic monitoring of blood lactic acid,oxygenation index and C-reactive protein levels in patients with severe pneumonia[J].Experimental and Therapeutic Medicine,2015,10(5):1824-1828.
[2] Paats MS,Bergen IM,Hanselaar WE,et al.Local and systemic cytokine profiles in nonsevere and severe community-acquired pneumonia[J].European Respiratory Journal,2012,41(6):1378-1385.
[3] Frazier SB,Sepanski R,Mangum C,et al.Association of Systemic Inflammatory Response Syndrome with Clinical Outcomes of Pediatric Patients with Pneumonia[J].Southern Medical Journal,2015,108(11):665-669.
[41] KozhemIaka AI,Iea V,Sirenko AO,et al.Oxidation-reduction and blood coagulation process indices in severe forms of pneumonia in children[J].Pediatr Akus Ginekol,1980(2):14-15.
[5] 李怀云.血清前白蛋白、C反应蛋白、载脂蛋白A1对重症肺炎患者生存状况的评估价值[J].安徽医药,2014,18(8):1517-1519.
[6] Kuo CY,Chiu YC,Lee YL,et al.Mitochondrial Lon protease controls ROS-dependent apoptosis in cardiomyocyte under hypoxia[J].Mitochondrion,2015,23:7-16.
[7] Circu ML,Aw TY.Reactive oxygen species,cellular redox systems,and apoptosis[J].Free Radical Biology & Medicine,2010,48(6):749-762.
[8] Seidlmayer LK,Juettner VV,Kettlewell S,et al.Distinct mPTP activation mechanisms in ischaemia-reperfusion:contributions of Ca2+,ROS,pH,and inorganic polyphosphate[J].Cardiovascular Research,2015,106(2):237-248.
[9] Song J,Yoon D,Christensen RD,et al.HIF-mediated increased ROS from reduced mitophagy and decreased catalase causes neocytolysis[J].Journal of Molecular Medicine,2015,93(8):857-866.
[10] Yalu R,Oyesiji A E,Eisenberg I,et al.HIF1A-dependent increase in endothelin 2 levels in granulosa cells:role of hypoxia,LH/cAMP,and reactive oxygen species[J].Reproduction,2014,149(1):11-20.
[11] Ren H,Li X,Cheng G,et al.The effects of ROS in prostatic stromal cells under hypoxic environment[J].Aging Male:the Official Journal of the International Society for the Study of the Aging Male,2015,18(2):84-88.
[12] Wei M,Li Z,Xiao L,et al.Effects of ROS-relative NF-κB signaling on high glucose-induced TLR4 and MCP-1 expression in podocyte injury[J].Molecular Immunology,2015,68 (2 Pt A):261-271.
[13] Jiangkun Yu,Yanyu Lu,Yapeng Li,et al.Role of S100A1 in hypoxia-induced inflammatory response in cardiomyocytes via TLR4/ROS/NF-κB pathway[J].Journal of Pharmacy & pharmacology,2015,67(9):1240-1250.
[14] Morgan MJ,Liu Z.Crosstalk of reactive oxygen species and NF-kappaB signaling[J].Cell Research,2011,21(1):103-115.
[15] Blaser H,Dostert C,Mak TW,et al.TNF and ROS Crosstalk in Inflammation[J].Trends in Cell Biology,2016,26(4):249-261.
[16] Kim SR,Kim DI,Kim SH,et al.NLRP3 inflammasome activation by mitochondrial ROS in bronchial epithelial cells is required for allergic inflammation[J].Cell Death & Disease,2014,5:e1498.
[17] Duan P,Hu C,Quan C,et al.4-Nonylphenol induces apoptosis,autophagy and necrosis in Sertoli cells:Involvement of ROS-mediated AMPK/AKT-mTOR and JNK pathways[J].Toxicology,2016,341-343:28-40.
[18] Lim EJ,Heo J,Kim YH.Tunicamycin promotes apoptosis in leukemia cells through ROS generation and downregulation of survivin expression[J].Apoptosis,2015,20(8):1087-1098.
[19] Qin G,Wu L,Liu H,et al.Artesunate induces apoptosis via a ROS-independent and Bax-mediated intrinsic pathway in HepG2 cells[J].Experimental Cell Research,2015,336(2):308-317.
(收稿日期:2016-10-21 修回日期:2017-03-31)
(編辑:潘明志)
