不同水分胁迫对剑麻生理特性的影响
2017-07-10冯海燕习金根
冯海燕 习金根
摘要[目的]研究不同水分胁迫对剑麻生理特性的影响。[方法]通过盆栽试验,研究了轻度(T1)、重度(T2)水分胁迫处理对剑麻幼苗生长和抗旱性的影响。[结果]各个时期剑麻株高、植株鲜重、叶片含水量、根系活力从大到小均依次为CK、T1、T2,相对电导率(REC)、过氧化物酶(POD)活性、游离脯氨酸(Pro)含量、丙二醛(MDA)含量从低到高依次为CK、T1、T2,N、P、K含量均随着水分胁迫的加剧呈下降趋势。随着处理时间的延长,不同处理剑麻叶片含水量均呈上升趋势;CK和T1处理REC和POD活性均呈先增后减的趋势,T2处理则呈增加趋势;T1、T2处理MDA含量呈增加趋势;各处理N含量均呈先增后减的趋势,P含量逐渐降低;CK和T1处理K含量逐渐增加,而T2处理则逐渐降低。[结论]研究结果可为剑麻的抗旱栽培提供理论参考。
关键词剑麻;水分胁迫;生理特性;抗旱性
中图分类号S563.8文献标识码A文章编号0517-6611(2017)19-0013-03
Effects of Different Water Stress on Physiological Characteristics of Agave sisalana
FENG Haiyan1,XI Jingen2*
(1.South Subtropical Crops Research Institute,Chinese Academy of Tropical Agricultural Sciences,Zhanjiang,Guangdong 524091;2.Environment and Plant Protection Institute,Chinese Academy of Tropical Agricultural Sciences,Danzhou Scientific Observing and Experimental Station of AgroEnvironment of Ministry of Agriculture,Haikou,Hainan 571101)
Abstract[Objective] To study the effects of different water stress on the physiological characteristics of Agave sisalana.[Method] Pot experiment was used to study the effects of mild water stress (T1) and severe water stress (T2) on the growth and drought resistance of A.sisalana seedlings.[Result] The plant height,fresh weight,leaf water content and root vigor changed regularly by the order as CK>T1>T2 during the whole growing period.The relative electric conductivity(REC),POD activity ,free proline (Pro) content and malondialdehyde (MDA) content changed by the order as CK Key wordsAgave sisalana;Water stress; Physiological characteristics;Drought resistance 劍麻为龙舌兰科(Agavaceae)龙舌兰属(Agave linnaeus)多年生草本植物,是热带、亚热带地区重要的硬质纤维作物。目前,全世界种植剑麻的国家主要有巴西、中国、墨西哥、哥伦比亚、坦桑尼亚等。剑麻在我国主要分布在广东、广西、海南、云南和福建等省(区),2010年末种植面积为2.05万hm2,收获面积为1.83万hm2,纤维总产量为4.63万t。剑麻具有纤维拉力强、耐磨、耐酸、耐碱、耐腐蚀等特性,广泛用于制作绳缆、钢索绳心、地毯等,是国防、航海、工矿等领域的重要原料。随着绿色天然产品的大量开发,剑麻纤维的用途将会更广泛,用量将不断增加[1-3]。水分是作物生长发育的必要条件之一,是作物生产力的关键生态因素。水分缺乏会直接影响植物光合系统的结构和功能,降低光能利用率。水分胁迫是指植物水分散失超过水分吸收,使植物组织含水量下降,正常代谢失调的现象,可导致植物同化效率降低[4-5]。目前,水分胁迫在小麦、胡萝卜、香蕉等作物上已有大量研究[4-6],但有关剑麻水分胁迫研究的报道较少。笔者以龙舌兰H.11648幼苗为材料,进行盆栽种植,通过人工控制土壤水分含量,设置对照、轻度胁迫、重度胁迫3个处理,研究剑麻在水分胁迫下的生长情况和生理特性,以期为剑麻的抗旱栽培提供理论参考。
1材料与方法
1.1试验材料
供试剑麻为大小一致的H.11648品种幼苗,规格为20 cm×18 cm×20 cm的塑料盆。供试土壤为玄武岩发育的砖红壤,有机质含量21.4 mg/g,pH 5.05,速效钾120.3 mg/kg,全氮1.60 mg/g,全磷2.50 mg/g,交换性钙20.3 mg/kg,交换性镁5.9 mg/kg,田间持水量22%。土壤过筛后装盆,每盆土壤重4.4 kg,按N 0.3 g/kg、P2O5 0.2 g/kg、K2O 0.3 g/kg一次性施肥。
1.2试验设计
选取长势正常一致的剑麻苗进行盆栽试验,采用称重法快速测定土壤水分含量,及时补充水量,维持土壤水分在处理水平。试验设置对照(CK,田间持水量60%~70%)、轻度水分胁迫(T1,田间持水量40%~50%)、重度水分胁迫(T2,田间持水量20%~30%)共3个处理,4次重复。每天18∶00用称重法补充损失的水分,使含水量维持在各预定胁迫水平。试验持续120 d,水分胁迫期间,晴天将盆栽苗置于露天环境下接受自然光照,阴雨天置于简易温棚中。
1.3测定项目与方法
试验期间,每隔30 d每个处理取样1次,每次取4盆,分别测量剑麻株高、地上部和根系生物量;采用愈创木酚法测定过氧化物酶(POD)活性,采用酸性茚三酮法测定游离脯氨酸(Pro)含量,以相对电导率(REC)来测定叶片质膜相对透性,采用硫代巴比妥酸法测定丙二醛(MDA)含量,采用α-萘胺法测定根系活力[7-9]。
1.4数据处理使用Excel 2007软件和SPSS 19.0统计软件进行数据统计与分析。
2结果与分析
2.1水分胁迫对剑麻生长的影响
2.1.1水分胁迫对剑麻株高的影响。
由表1可知,不同水分胁迫处理的剑麻株高差异显著。随着水分胁迫的加剧,各个时期剑麻株高均显著下降。随着处理时间的延长,不同处理的剑麻株高均逐渐增加,但增幅有所不同。第30~60 天,T1和T2处理剑麻株高的增幅较大,而对照(CK)处理增幅较小。这说明水分胁迫明显抑制剑麻植株的生长,但随着时间的推移,剑麻逐渐适应水分胁迫条件后,植株生长速度逐渐恢复正常。
2.1.2水分胁迫对剑麻生物量的影响。
由表2可知,不同时期剑麻植株鲜重均随着水分胁迫的加剧而显著减少。随着水分胁迫时间的延长,不同处理剑麻植株鲜重总体上均有所增加,但其增幅随着水分胁迫的加剧而减少,这反映出剑麻的生物量积累随着水分胁迫的加剧而减少。由此可见,水分胁迫强度越大,剑麻生长就越缓慢。
2.1.3水分胁迫对剑麻叶片含水量的影响。
由表3可知,各个时期剑麻叶片含水量总体上随着水分胁迫的加剧而减少,但轻度水分胁迫处理(T1)与CK差异不显著。随着处理时间的延长,不同处理剑麻叶片含水量均有所提高,但增幅不同。其中,CK增幅较小, T1处理次之, T2处理增幅最大。这说明水分胁迫会明显降低剑麻叶片含水量,但水分胁迫强度较小时降幅不明显。随着胁迫时间的延长,剑麻逐渐适应水分胁迫条件,产生抗旱性,植株生长恢复正常,叶片含水量逐渐提高。
2.2水分胁迫对剑麻细胞膜透性和根系活力的影响
2.2.1水分胁迫对剑麻细胞膜透性的影响。
植物受到水分胁迫时,质膜会受到不同程度破坏,电导率增大,因而常用测定电导率变化的方法来判别植物组织受伤害的程度[10-12]。由表4可知,各个时期剑麻相对电导率(REC)均随着水分胁迫的加剧而增加。随着处理时间的延长,CK和T1处理REC均呈先升高后下降的趋势,T2处理REC逐渐增加。这说明水分胁迫条件下剑麻组织受到一定程度破坏,且受破壞程度随着胁迫的加剧而增强。当水分胁迫强度较低时,随着胁迫时间的延长,剑麻逐渐适应胁迫条件,并产生抗旱性,组织受破坏程度逐渐减轻;但当水分胁迫较为严重,超出了剑麻可以忍耐的程度后,组织将逐渐受破坏,无法修复。
2.2.2水分胁迫对剑麻根系活力的影响。
在干旱胁迫下,根系氧化活力和还原活力明显增加。研究表明,根系活力从本质上反映苗木根系生长与土壤水分及环境之间的动态关系[10-13]。由表5可知,不同水分胁迫对剑麻根系活力的影响显著,总体上各个时期剑麻根系活力均随着水分胁迫的加剧而逐渐降低。随着处理时间的延长,不同处理剑麻根系活力的变化不明显。
2.3水分胁迫对剑麻保护酶活性的影响
2.3.1水分胁迫对剑麻POD活性的影响。
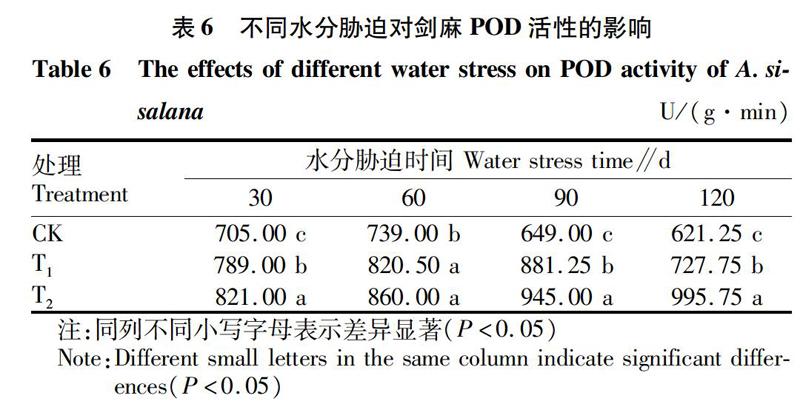
从表6可以看出,不同处理剑麻体内POD活性存在显著差异。各个时期不同处理POD活性均有较大差异,总体上随着水分胁迫的加剧而增加。这说明剑麻的保护酶活性在水分胁迫条件下明显增强,以抵御干旱逆境造成的伤害。随着胁迫时间的延长,CK和T1处理POD活性均呈先增加后减小的趋势,但二者出现峰值的时间不同,前者出现在第60天,后者则出现在第90天,而T2处理的POD活性则随着处理时间的延长而逐渐增加。由此可见,水分胁迫条件下,随着胁迫时间的延长,剑麻可通过增强保护酶活性来逐渐适应干旱逆境。水分胁迫强度越低,适应速度越快,胁迫强度越高,剑麻对逆境的适应速度越慢,甚至无法适应,造成植株死亡。
2.3.2水分胁迫对剑麻游离脯氨酸含量的影响。
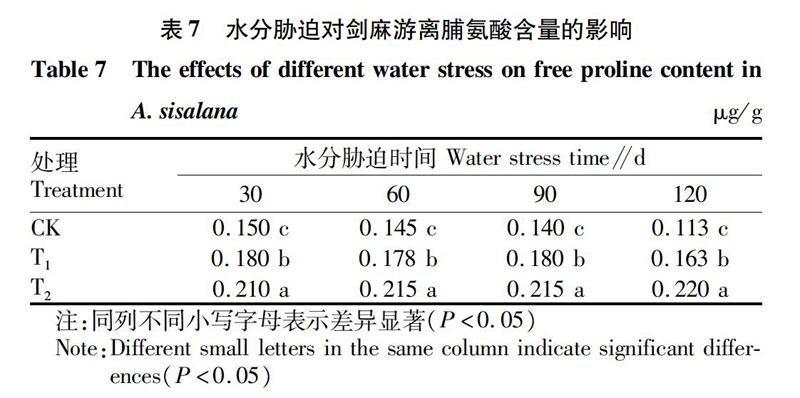
游离脯氨酸含量是植物抗旱性的一个指标,植物遭受逆境胁迫时大量累积游离脯氨酸这一现象已被人们证实[14]。由表7可知,不同水分胁迫处理剑麻游离脯氨酸含量存在显著差异,各个时期均随着水分胁迫的加剧而升高。随着处理时间的延长,CK处理剑麻游离脯氨酸含量逐渐降低,但T1、T2处理则相对稳定。这说明水分胁迫条件下,剑麻可通过增加体内游离脯氨酸含量,降低渗透势,维持细胞膨压,来适应外界干旱逆境条件。
2.3.3水分胁迫对剑麻MDA含量的影响。
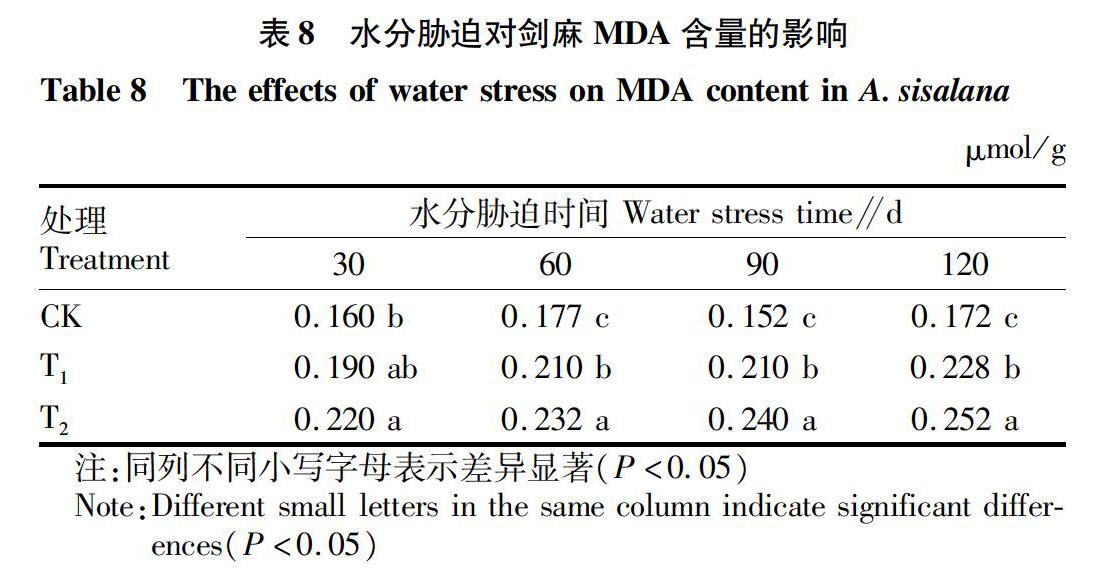
MDA是脂质过氧化的主要产物之一,其积累的多少及其变化幅度反映植物质膜系统的稳定性及受到的伤害程度,植物体内MDA积累越多,表明组织的自我保护能力越弱[15-16]。从表8可以看出,各个时期剑麻MDA含量均随着水分胁迫的加剧而增加。随着处理时间的延长,CK处理剑麻MDA含量起伏变化,而T1处理MDA含量缓慢增加,T2处理逐渐升高,增幅较为明显。这说明水分胁迫条件下,剑麻叶片膜脂过氧化作用明显加强,膜系统受到破坏,膜透性增加。
2.4水分胁迫对剑麻N、P、K吸收的影响
N、P、K是植物体内的大量元素,N、P、K的含量直接影响剑麻的品质,研究剑麻体内N、P和K含量可以反映水分胁迫对剑麻吸收N、P和K的影响。由表9可知,各个时期不同处理剑麻N含量的变化规律不同。第60天,不同处理剑麻N含量差异不显著;第90和120天,T2处理N含量显著低于CK和T1处理。随着处理时间的延长,不同处理剑麻N含量均呈先增后减的趋势。
不同处理剑麻P含量的变化规律总体上与N含量相似。水分胁迫初期,不同处理剑麻P含量差异不显著,而水分胁迫中后期,T2处理的P含量显著低于CK和T1处理。但随着处理时间的延长,不同水分胁迫处理P含量均明显降低。
不同处理剑麻K含量的变化规律与N、P含量有相似之处。第60天,不同处理剑麻K含量差异不显著;第90天,T1和T2处理K含量均显著低于CK;第120天,剑麻T2处理K含量显著低于CK和T1处理,而T1处理K含量最高,显著高于CK。随着处理时间的延长, CK和T1处理K含量逐渐增加,而T2处理K含量则逐渐降低。
3结论与讨论
该试验结果表明,随着水分胁迫的加剧,各个时期剑麻株高、植株鲜重、叶片含水量和根系活力,以及N、P、K含量均呈下降趋势,而相对电导率(REC)、过氧化物酶(POD)活性、游离脯氨酸(Pro)含量、丙二醛(MDA)含量均呈增加趋势。这说明在水分胁迫下,剑麻细胞膜遭到破坏,膜透性增加,根系活力下降。虽然剑麻可通过保护酶活性的增加,来减轻细
胞膜的受害程度,但效果有限。水分胁迫在一定程度上影响剑麻对水分和矿质营养的吸收,导致植株生长受到抑制,生物量积累降低。
该试验结果表明,随着胁迫时间的延长,不同处理剑麻叶片含水量均呈上升趋势。这与笔者前期的研究以及任丽花等[15]、习金根等[17]有所不同,前者发现剑麻叶片含水量在水分胁迫前期增加而后期持续下降,后者试验结果表明圆叶决明叶片含水量随着胁迫时间的延长而持续下降。造成这种差异的原因,还有待进一步研究。该试验还发现,CK和T1处理REC和POD活性均呈先增后减的趋势,而T2处理则呈增加趋势;CK处理Pro含量逐渐降低;T1、T2处理MDA含量呈增加趋势;各处理N含量均呈先增后减的趋势,P含量均逐渐降低,CK和T1处理K含量逐渐增加,而T2处理则逐渐降低。这都说明轻度水分胁迫初期,剑麻逐渐表现出旱害现象,但随着胁迫时间的延长,剑麻通过提高自身保护酶活性,逐渐适应水分胁迫条件,各种生理指标恢复正常。在重度水分胁迫下,剑麻自我调控相对缓慢,甚至失去自我调控能力。剑麻N、P、K含量受到多种因素的影响,总体上变化规律不明显。
参考文献
[1]
薛刚,王越川.近十年世界剑麻生产与贸易概况[J].热带农业科学,2010,30(4):62-66.
[2] 周文钊,张燕梅,陆军迎.“十二五”剑麻科技发展趋势与建议[J].热带农业工程,2011,35(3):49-52.
[3] 黄艳.国内外剑麻产业研究现状与发展趋势[J].热带农业科学,2013,33(4):87-90.
[4] 张军,吴秀宁,鲁敏,等.拔节期水分胁迫对冬小麦生理特性的影响[J].华北农学报,2014,29(1):129-134.
[5] 陳菁菁,王晓巍,杨德龙.地面覆盖和水分胁迫对胡萝卜叶片光合特性的影响[J].甘肃农业大学学报,2014(3):47-52.
[6] 黄鹤丽,林电,章金强,等.水分胁迫对巴西香蕉幼苗水分状况、质膜透性和根系活力的影响[J].基因组学与应用生物学,2009,28(4):740-744.
[7] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2001.
[8] 上海植物生理学会.植物生理学实验手册[M].上海:上海科学技术出版社,1985.
[9] 华东师范大学生物系植物生理教研组.植物生理学实验指导[M].北京:人民教育出版社,1980.
[10] 习金根,周文钊,石伟琦,等.部分根系施肥对剑麻植株和根系生长的影响[J].安徽农业科学,2009,37(29):14171-14172.
[11] 丁金玲,段承俐,文国松,等.氮素用量对K326 生理生化特性的影响[J].云南农业大学学报,2005,20(2):204-208.
[12] 刘彦琴,张丰雪,杨敏生.电导率在白杨杂种无性系耐旱性鉴定中的应用[J].河北林果研究,1997,12(4):301-305.
[13] 谭勇,梁宗锁,董娟娥,等.水分胁迫对不同产地板蓝根幼苗抗氧化物酶活性和根系活力的影响[J].华北农学报,2006,21(5):20-23.
[14] 王守生.茶树游离脯氨酸含量及水分胁迫对其影响[J].茶叶科学,1995,21(1):22-25.
[15] 任丽花,王义祥,罗旭辉,等.水分胁迫对圆叶决明生理生化特性的影响[J].福建农业学报,2013,28(11):1093-1098.
[16] 桑子阳,马履一,陈发菊.干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J].西北植物学报,2011,31(1):109-115.
[17] 习金根,郑金龙,易克贤.干旱胁迫对剑麻幼苗生理生化的影响[J].中国麻业科学,2012,34(5):216-219.
