大鼠部分肝切除后肝细胞生长因子激活因子抑制因子1,2的表达
2017-07-07李晓涛王丽娟
席 锐,李晓涛,王 璐,王丽娟
大鼠部分肝切除后肝细胞生长因子激活因子抑制因子1,2的表达
席 锐,李晓涛,王 璐,王丽娟
目的探讨肝细胞生长因子激活因子抑制因子(hepatocyte growth factor activator inhibitor, HAI)1、HAI-2在部分肝切除后的表达特点,分析HAI-1和HAI-2在肝再生中的作用。方法随机将健康雄性SD大鼠分成对照组和肝切除组,各30只。在肝切除手术前和手术后3 h、12 h、24 h以及48 h时,对比2组HAI-1和HAI-2 mRNA和蛋白的表达变化。结果手术前2组HAI-1、HAI-2的 mRNA及蛋白均呈显著低表达,组间无明显差异(P>0.05);与手术前相比,术后对照组HAI-1、HAI-2的mRNA及蛋白均无明显变化(P>0.05);而肝切除组HAI-1 mRNA和蛋白表达水平先显著升高再逐渐下降,同时间点与对照组比较,差异均有统计学意义(P<0.05);HAI-2 mRNA和蛋白则无明显变化(P>0.05)。结论HAI-1在部分肝切除肝细胞再生过程中呈持续高表达,其可能参与了肝细胞再生过程,而HAI-2对肝再生过程无明显影响。
肝切除;肝再生;肝细胞生长因子激活因子抑制因子
肝细胞具有极强的再生能力,在肝脏发生损伤或切除后,肝细胞能够立即启动再生过程以满足肝细胞功能代偿性需要。因此,积极研究肝再生机制具有重要意义。现有研究表明肝细胞再生过程极为复杂,不仅与血管形成过程相关,而且与多种细胞因子水平具有密切关系[1]。肝细胞生长因子激活因子抑制因子(hepatocyte growth factor activator inhibitor, HAI)作为肝细胞生长因子激活因子(hepatocyte growth factor activation factor, HGFA)的抑制性因素[2-4],被证实能够影响基于恶性肿瘤、组织缺损情况下的肝细胞、组织生长分化过程[5-6]。本文通过观察HAI-1和HAI-2在肝再生过程中的表达情况,旨在初步分析HAI对肝再生的影响效果。
1 材料与方法
1.1 实验动物 健康雄性清洁级别SD大鼠60只,体质量为180~210 g,周龄为10~12周,购自上海西普尔必凯实验动物有限公司,沪检证第SCXK2008 0002号。处理方法符合实验动物处理原则[7]。
1.2 主要仪器和试剂 超低温冰箱(德国Heraeus公司);TGL高速离心机(中国上海离心机械研究所);PCR定量扩增仪、Real-time PCR试剂(美国Applied Biosystems公司);Trizol试剂、 RNA逆转录试剂等(美国Invitrogen公司)。
1.3 建立肝再生动物模型 将SD大鼠于常温(25±2) ℃、恒湿(50%~60%)环境中喂养3 d,自由饮食和喂水,光暗接受比例为12 h∶12 h。适应性喂养后将大鼠随机分成对照组和肝切除组,各30只。参照文献[8],将肝切除组大鼠切除部分肝组织(约70%)建立部分肝切除再生模型,具体方法如下:大鼠腹腔注射2%戊巴比妥钠(40 mg/kg)麻醉,于腹部正中作一长2.0 cm切口,依次锐性分离进入腹腔,利用摄子将整个肝脏轻轻提起,完全切除肝脏中叶和左叶,剩余肝组织止血、冲洗、还纳腹腔,确认无活动性出血后依次缝合切口,手术结束。对照组大鼠接受假手术,术中不切除任何组织。
1.3 检测指标
1.3.1 组织获取 对照组和肝切除组在手术前、手术后3 h、12 h、24 h以及48 h各时间段分别取6只SD大鼠,通过剖杀方式获取全脾组织作为检测标本。
1.3.2 RT-PCR 将对照组和肝切除组脾组织分别进行无菌研磨后,提取1.0 g组织作为检测标本,添加细胞裂解溶液,经贴壁培养,DEPC处理,核蛋白复合物解离等处理后用Trizol溶液一步法提取脾组织RNA,添加氯仿并用手甩脱震荡15 s后,在室温下进行孵育,提取经过孵育的RNA 1.0 μg,利用AMV反转录酶提取cDNA(具体条件为42 ℃下15 min→95 ℃下5 min→4 ℃下终止反应5 min),将cDNA产物放置到-20 ℃冰箱中留存。利用Beacon designer软件设计HAI-1和HAI-2的引物序列,由上海歌凡生物设计公司合成。完成引物合成、PCR反应液配置后将HAI-1和HAI-2反应液分别放置到96孔微孔板中,添加对应cDNA模板(5.0 μl),完成封膜后,将微孔板放置到定量PCR分析仪完成RT-PCR扩增反应,勾画溶解曲线,读取吸光值,双标准曲线法计算目的基因mRNA相对表达量。
1.3.3 Western blot 分别取对照组和肝切除组脾组织1.0 g进行蛋白裂解和超声匀浆,抽提细胞总蛋白,调整样品蛋白浓度为2 μg/μl,配置分离胶和浓缩胶。提出1.0 μl样品总蛋白量,添加2.0倍体积loading溶液,放置到沸水中煮5 min后冷却放置到4 ℃冰箱中备用。将蛋白样本缓慢加入到反应玻璃孔板中并做好标记,将样品放置到配置好的电泳中进行电泳反应(上层80 V作用约20 min,下层120 V作用约40 min,待溴酚蓝至分离胶底部为宜),完成电泳后,取下玻璃板进行常规切胶、PVDF转膜、封闭后,添加一抗(即HAI-1抗体和HAI-2抗体,比例均为1∶10 000)并在4 ℃下孵育过夜,TBST洗涤后添加二抗孵育,制备ECL化学发光剂A和B等体积工作液,将印迹膜和工作液共同放置并孵育5 min后,吸除多余工作液和气泡,将待测品转移到暗室中拍摄X线片并进行显影定影,通过图像分析软件进行分析,将待测品与β-actin积分光密度比作为相对蛋白表达量。
1.4 统计学处理 用CHISS 2004进行统计分析。计量资料呈正态分布,用±s表示。多组间比较用F检验(组间方差齐),多重比较用q检验。2组间比较用成组t检验(组间方差齐)。P<0.05表示差异有统计学意义。
2 结 果
2.1 HAI-1 mRNA和HAI-2 mRNA表达变化 手术前2组SD大鼠的脾组织中均有HAI-1 mRNA和HAI-2 mRNA表达,但是2组均为低表达,且差异无统计学意义。
肝切除组HAI-1 mRNA术后3 h即显著升高,12 h达峰值,然后开始逐渐下降,48 h下降到术后3 h水平,但术后各时间点均高于术前水平(P均<0.05)。对照组HAI-1 mRNA水平术后各时间点无明显上升,与术前保持在相同水平(P均>0.05)。在术后各时间点,肝切除组HAI-1 mRNA均高于对照组(P均<0.05)。见表1。2组术后HAI-2 mRNA均无明显升高(P均>0.05)。在术后各时间点,2组间HAI-2 mRNA差异亦无统计学意义。见表2。
表1 2组手术后不同时间点HAI-1 mRNA水平比较(±s)Table 1 Comparison of HAI-1 mRNA levels at different time points after operation in 2 groups(±s)

表1 2组手术后不同时间点HAI-1 mRNA水平比较(±s)Table 1 Comparison of HAI-1 mRNA levels at different time points after operation in 2 groups(±s)
注:a. 与手术前比较,P<0.05; b. 与手术后3 h比较,P<0.05;c. 与手术后12 h比较,P<0.05;d. 与手术后24 h比较,P<0.05
手术时间 肝切除组(n=6) 对照组(n=6) t值 P值手术前 8.554±0.315 8.548±0.325 0.032 0.975术后3 h 11.426±0.295a 8.534±0.266 17.834 0.000术后12 h 31.157±2.583ab 8.565±0.513 19.091 0.000术后24 h 18.425±2.809abc 8.545±0.153 8.603 0.000术后48 h 12.471±0.432acd 8.555±0.298 18.277 0.000 F值 147.964 0.007 P值 0.000 0.999
表2 2组手术后不同时间点HAI-2 mRNA水平比较(±s)Table 2 Comparison of HAI-2 mRNA levels at different time points after operation in 2 groups(±s)

表2 2组手术后不同时间点HAI-2 mRNA水平比较(±s)Table 2 Comparison of HAI-2 mRNA levels at different time points after operation in 2 groups(±s)
手术时间 肝切除组(n=6) 对照组(n=6) t值 P值手术前 1.098±0.276 1.095±0.253 0.020 0.984术后3 h 1.115±0.243 1.118±0.494 -0.013 0.990术后12 h 1.135±0.263 1.109±0.163 0.206 0.841术后24 h 1.128±0.215 1.113±0.232 0.116 0.910术后48 h 1.123±0.234 1.102±0.153 0.184 0.858 F值 0.020 0.006 P值 0.999 1.000
2.2 HAI-1蛋白和HAI-2蛋白表达变化 手术前2组SD大鼠的脾组织中均有HAI-1蛋白和HAI-2蛋白表达,但是2组均为低表达,且差异无统计学意义。
肝切除组术后HAI-1蛋白水平3 h即显著升高,12 h达峰值,然后开始逐渐下降,但术后各时间点HAI-1蛋白水平均高于术前水平(P均<0.05)。对照组术后各时间点无明显上升,与术前保持在相同水平(P均>0.05)。在术后各时间点,肝切除组HAI-1蛋白水平均高于对照组(P均<0.05)。见表3。 2组术后HAI-2蛋白水平均无明显升高(P均>0.05)。在术后各时间点,2组间HAI-2蛋白水平差异亦无统计学意义。见表4。
表3 2组手术后不同时间点HAI-1蛋白水平比较(±s)Table 3 Comparison of HAI-1 protein levels at different time points after operation in 2 groups(±s)
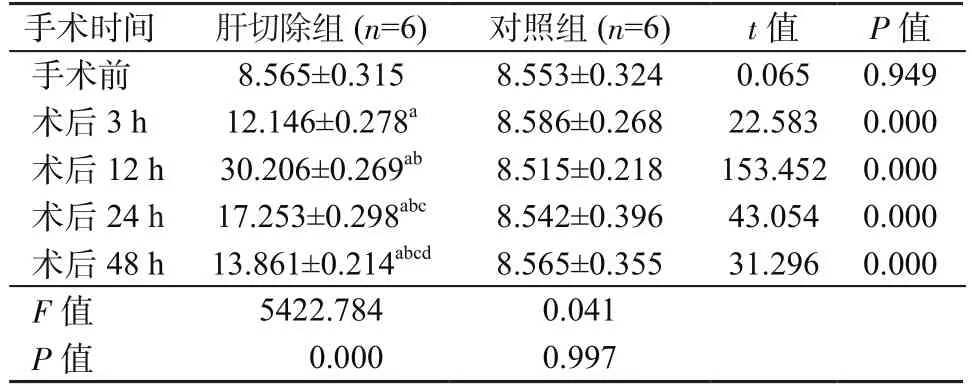
表3 2组手术后不同时间点HAI-1蛋白水平比较(±s)Table 3 Comparison of HAI-1 protein levels at different time points after operation in 2 groups(±s)
注:a. 与手术前比较,P<0.05;b. 与手术后3 h比较,P<0.05;c. 与手术后12 h比较,P<0.05;d. 与手术后24 h比较,P<0.05
手术时间 肝切除组(n=6) 对照组(n=6) t值 P值手术前 8.565±0.315 8.553±0.324 0.065 0.949术后3 h 12.146±0.278a 8.586±0.268 22.583 0.000术后12 h 30.206±0.269ab 8.515±0.218 153.452 0.000术后24 h 17.253±0.298abc 8.542±0.396 43.054 0.000术后48 h 13.861±0.214abcd 8.565±0.355 31.296 0.000 F值 5422.784 0.041 P值 0.000 0.997
表4 2组手术后不同时间点HAI-2蛋白水平比较(±s)Table 4 Comparison of HAI-2 protein levels at different time points after operation in 2 groups(±s)

表4 2组手术后不同时间点HAI-2蛋白水平比较(±s)Table 4 Comparison of HAI-2 protein levels at different time points after operation in 2 groups(±s)
手术时间 肝切除组(n=6) 对照组(n=6) t值 P值手术前 1.096±0.254 1.083±0.265 0.087 0.933术后3 h 1.113±0.245 1.132±0.492 -0.085 0.934术后12 h 1.145±0.238 1.165±0.182 -0.164 0.873术后24 h 1.123±0.256 1.115±0.333 0.047 0.964术后48 h 1.085±0.268 1.084±0.278 0.006 0.995 F值 0.052 0.067 P值 0.995 0.991
3 讨 论
在生理性条件下,肝细胞主要呈静息状态,但是在病理性肝损伤发生后,肝脏超强的代谢和再生能力就会被即刻激活。肝细胞的再生能力作为肝部分切除术、肝脏移植术治疗的生理学基础,一直是临床研究的热点。由于肝脏再生过程受到肝脏细胞、肝外器官、蛋白基因表达、转录因子激活等诸多因素影响[9-10],目前关于肝再生机制仍有诸多难解之谜,一直是再生医学中最受关注的热点方向。由于伦理道德的限制,目前关于肝细胞再生性研究仍处于动物实验水平。
HGFA作为调节肝细胞生长因子生物学活性的关键性因子,能够通过活化前体肝细胞生长因子而促进肝组织再生,而一旦HGFA活性受到抑制,则肝再生过程将受到严重影响。HAI作为首次发现于胃癌中的HGFA表面抑制因子,随着研究的不断深入,国内外研究相继发现其对于HGFA具有蓄积效应,能够通过膜结合形式将HGFA进行定位和聚集,并且通过活化细胞周围的生长因子活性而加快细胞生长增殖。目前有研究发现在肿瘤生长过程中HAI-1和HAI-2发挥了重要作用,但是截至目前关于肝再生过程中HAI的作用价值研究仍极为少见[11-12]。
鉴于目前已经证实在肝再生过程中主要为脾源性HAI表达[13],且肝组织中HAI几乎不表达,因此,本实验在建立部分肝切除肝再生动物模型基础上,以健康小鼠作为对照,旨在研究在肝再生过程中脾源性HAI-1和HAI-2的表达情况。经过实验观察发现,在手术前,SD大鼠体内脾源性HAI-1和HAI-2表达水平均较为低下,说明在正常情况下,动物体内脾源性HAI-1和HAI-2几乎不表达。在手术后,对照组大鼠HAI-1和HAI-2表达水平没有出现显著改变,说明假手术虽然也属于应激性反应,但是由于未对肝组织造成损失,因此对HAI-1和HAI-2表达并无明显影响,间接证实了HAI-1和HAI-2表达可能仅在肝再生过程中发生明显变化。进一步对2组SD大鼠HAI-1和HAI-2表达情况进行分析发现,在手术后,肝切除组HAI-2未出现明显变化,而HAI-1先显著上升到峰值后逐渐下降,说明在肝再生过程中HAI-2未发挥明显影响,而HAI-1表达则与肝再生过程密切相关,同时直接证实了在肝切除后短期内肝再生即可启动,且HAI-1能够参与调节肝再生过程,HAI-2虽然与HAI-1具有同源性,但是并未参与肝再生过程,说明二者生物学作用仍存在一定差别。国内学者在实验中通过对肝再生过程中HAI-1和HAI-2 mRNA表达水平进行分析也发现二者生物学作用存在相异之处[14-16]。HAI-1和HAI-2作为同源性代表因子,是目前研究最为广泛的HAI家族成员,HAI-1作为Kunitz型抑制因子,能够通过调节HGFA和Matriptase活性而调控HGF/ c-Met信号传导通路,其表达水平能够直接影响靶蛋白酶活性,从而对细胞生长增殖、组织损伤修复过程产生影响,其表达水平与肝再生过程中细胞生长周期、体内HGFA合成分泌出现匮乏、肝细胞生长因子活性明显不足、肝再生活性间歇期等有关。HAI-2作为II型跨膜型抑制剂,对组织形态形成具有重要作用,但是对于靶蛋白酶活性无明显干预作用,因此对肝细胞再生无明显影响。由于实验条件有限,对于HAI具体作用通路和机制研究仍不完全,且对于肝脏疾病对肝再生的影响未予纳入,因此,关于HAI在肝再生中生物学效应仍有待临床完善。综上所述,部分肝切除肝再生过程中HAI-1显著高表达,提示HAI-1参与调节肝细胞再生能力,而HAI-2并不干预肝细胞再生过程,考虑不同类型HAI因子间生物学作用存在差异,建议临床深入研究。
[1] 赵晓彪,明玉玲,陈平. 肝切除术后肝脏再生的研究进展[J].解放军医学杂志,2014,39(1):70-74.
[2] Hu C, Jiang N, Wang G, et al. Expression of hepatocyte growth factor activator inhibitor-1 (HAI-1) gene in prostate cancer: clinical and biological significance[J]. J BUON, 2014, 19(1):215-220.
[3] Maurer E, Gütschow M, Stirnberg M. Hepatocyte growth factor activator inhibitor type 2 (HAI-2) modulates hepcidin expression by inhibiting the cell surface protease matriptase-2[J]. Biochem J, 2013, 450(3):583-593.
[4] Kawaguchi TCMCC, Kitamura N, Miyazawa K. Hepatocyte growth factor activator inhibitor[J]. Applied Surface Science, 2015, 331(1):1-7.
[5] Huang HP, Chang MH, Chen YT, et al. Persistent elevation of hepatocyte growth factor activator inhibitors in cholangiopathies affects liver fibrosis and differentiation[J]. Hepatology, 2012, 55(1):161-172.
[6] Kawaguchi M, Ai K, Sawaguchi A, et al. Hepatocyte growth factor activator inhibitor type 1 maintains the assembly of keratin into desmosomes in keratinocytes by regulating protease-activated receptor 2-dependent p38 signaling[J]. Am J Pathol, 2015, 185(6):1610-1623.
[7] 杨镇. 外科转化医学动物实验研究的质量管理[J]. 中华实验外科杂志,2013,30(11):2249-2252.
[8] 杨龙,张雅敏,崔子林,等. 肝细胞生长因子激活抑制因子在肝硬化大鼠部分肝切除后肝再生过程中的表达[J]. 中华肝胆外科杂志,2015,21(5):324-327.
[9] Hohmann N, Weiwei W, Dahmen U, et al. How does a single cell know when the liver has reached its correct size?[J]. PloS One, 2013, 9(4):e93207.
[10] 杨蕗璐,罗燕. 肝大部切除后肝脏再生的研究进展[J]. 世界华人消化杂志,2016,24(1):67-74.
[11] Hong Z, Nowakowski M, Spronk C, et al. The solution structure of the MANEC-type domain from hepatocyte growth factor activator inhibitor-1 reveals an unexpected PAN/apple domain-type fold[J]. Biochem J, 2015, 466(2):299-309.
[12] Yasuda K, Komiya A, Watanabe A, et al. Expression of hepatocyte growth factor activator inhibitor type-1 (HAI-1) in prostate cancer[J]. Anticancer Res, 2013, 33(2):575-581.
[13] Ye J, Kawaguchi M, Haruyama Y, et al. Loss of hepatocyte growth factor activator inhibitor type 1 participates in metastatic spreading of human pancreatic cancer cells in a mouse orthotopic transplantation model[J]. Cancer Sci, 2014, 105(1):44-51.
[14] 杨龙,张雅敏,崔子林,等. 部分肝切除肝再生过程中肝细胞生长因子激活因子抑制因子1,2的表达[J]. 中国组织工程研究,2015,19(24):3844-3848.
[15] 胡敏. 肝脏干细胞与肝脏再生[J]. 传染病信息,2011,24(3):129-131.
[16] 徐志强. 肝脏再生、肝癌和细胞周期调节蛋白[J]. 传染病信息,1998,11(4):180.
(2017-02-01收稿 2017-04-11修回)
(本文编辑 闫晶晶)
Study on the expressions of hepatocyte growth factor activator inhibitor -1, -2 after partial hepatectomy in rats
XI Rui, LI Xiao-tao, WANG Lu, WANG Li-juan*
Department of Hepatobiliary Surgery, Hanzhong Central Hospital, 723000, China *Corresponding author, E-mail: 344291852@qq.com
ObjectiveTo investigate the expressions of hepatocyte growth factor activator inhibitor (HAI-1 and HAI-2) expression after partial hepatectomy, to analyze the functions of HAI-1 and HAI-2 in liver regeneration. Methods Sixty healthy male SD rats were randomly divided into control group and hepatectomy group. Before operation and at 3 h, 12 h, 24 h and 48 h after operation, the expressions of HAI-1, HAI-2 mRNA and protein in the 2 groups were compared. Results Before operation, HAI-1, HAI-2 mRNA and protein expression levels were significantly low in the 2 groups, there were no significant differences between 2 groups (P>0.05); When compared with the data before operation, there were no obvious changes on the HAI-1, HAI-2 mRNA and protein expressions of the control group (P>0.05). However, the levels of HAI-1 mRNA and protein expression increased at first and then decreased gradually in the hepatectomy group after operation. When compared with the control group at the same time point, the difference was statistically significant (P<0.05), but there were no significant changes in HAI-2 mRNA and protein (P>0.05). Conclusions HAI-1 is highly expressed in the regeneration process after partial hepatectomy, it may be involved in the process of hepatocyte regeneration. But HAI-2 has no significant effect on liver regeneration.
liver resection; liver regeneration; HAI
R333.4
A
1007-8134(2017)03-0161-04
10.3969/j.issn.1007-8134.2017.03.009
723000,汉中市中心医院肝胆外科(席锐、李晓涛、王璐、王丽娟)
王丽娟,E-mail: 344291852@qq.com
