地上-地下生物协同调控与养分高效利用*
2017-07-06沈仁芳施卫明赵学强
沈仁芳 孙 波 施卫明 赵学强
中国科学院南京土壤研究所南京210008
地上-地下生物协同调控与养分高效利用*
沈仁芳 孙 波 施卫明 赵学强
中国科学院南京土壤研究所南京210008
提高养分利用率是协调粮食安全和环境安全的核心问题。地下生物种类繁多,数量巨大,功能多样,包括植物根系、微生物和动物等。地下生物直接参与了养分的活化、转化、吸收和运输等过程,是地上植物生产力和养分利用率的重要驱动者。文章概括性地介绍了(1)土壤-根系-微生物对话的信号基础与养分转化,(2)土壤微生物组成多样性与养分转化,(3)根系与植物高效吸收养分,以及(4)微生物与根系高效摄取土壤养分;在此基础上,提出将来应该加强研究土壤生物功能和区域分异规律、微生物介导的土壤养分转化过程与养分高效利用之间的关系、养分高效型作物的根系特征、生物制剂的研发等内容。随着技术的发展和相关机理的探明,地下生物“黑箱”将逐步被破解,有望研发出靶标明确、切实可行的地上-地下生物协同调控技术,实现养分的高效利用。
养分效率,根系,微生物,土壤养分转化,协同调控
DOI 10.16418/j.issn.1000-3045.2017.06.003
作为世界上最大的发展中国家,我国一公顷耕地平均需要负担 10 人的食物来源,而发达国家一公顷耕地平均只需负担不到 2 人[1]。改革开放 30 余年来,我国粮食总产增加了约 73%,但同期化肥用量却增加了约 467%,粮食增长很大程度上依赖于大量化肥的投入。我国以不到世界 1/10 的耕地,施用了世界 1/3 的化肥,单位面积化肥用量是世界平均水平的 3 倍。我国氮肥平均用量(按粮食作物播种面积计算)已达 191 kg hm-2,分别是法国、德国和美国的 151%、159% 和 329%,但耕地粮食单产水平却比这些国家低 1 到 3 成。我国单位养分投入产出粮食(折算为水稻当量)仅 14 kg kg-1,而美国为 40 kg kg-1,德国为 60 kg kg-1[2]。近 10 年来,我国三大主要粮食作物水稻、小麦、玉米的氮肥表观利用率分别为 39.0%、34.8%、29.1%[3],表明作物当季仅吸收了施入化肥的约 1/3,而剩下的 2/3 残留在了环境中。化肥不仅要担负保障国家粮食供应的重任,而且要最大限度地降低对生态环境的破坏,因此,提高化肥利用率已成为当务之急。
尽管在提高化肥利用率方面已开展了很多研究,但是 30 多年来我国化肥利用率仍徘徊在 30% 左右[3,4],如何提高化肥利用率一直是农业领域和化肥行业的一个研究难点和热点。越来越多的证据表明,地下生物是地上生物多样性和生产力的重要驱动力,地上生物与地下生物之间联系紧密[5,6]。地下生物包括根系、微生物和动物(表 1),它们数量巨大,例如:全球根系生物量大约是地上生物量的 3/4,地球原核生物(细菌、古菌)氮量相当于植物氮量的 10 倍[7,8]。地下生物全程参与了土壤养分的转化、迁移、固定和植物吸收等过程,对地上植物养分利用效率具有重要影响。反过来,地上植物对地下生物和土壤养分循环也有很大影响。因此,地上、地下生物紧密偶联,并显著影响植物氮磷利用效率。
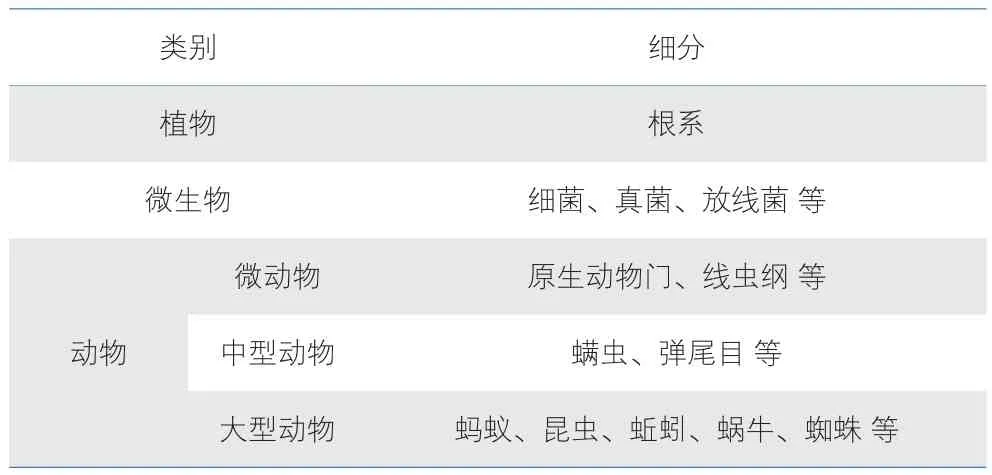
表1 地下生物举例
鉴于地下生物在提高植物养分效率中的重要性,2014 年中科院启动了 “土壤-微生物系统功能及其调控”战略性先导科技专项(B 类),其中一个重要研究内容是地上-地下生物协同调控与氮磷高效利用机理。专项拟通过研究地上-地下生物协同作用机理,来提高植物氮磷利用率。地上-地下生物的耦合点是根系、土壤和微生物三者间的交互区域,即根际,充分发挥根系-土壤-微生物的协同增效机制是提高养分利用率的关键。土壤、根系、微生物三者之间存在着丰富的物质和信息“交流”,土壤-微生物、根系-微生物和根系-土壤 3 个界面过程与养分转化、吸收密切相关,最终决定着地上植物的养分利用效率。
1 土壤-根系-微生物对话的信号基础与养分转化
地上-地下生态系统内各要素间存在紧密而复杂的互动关系,主要通过物质和信息的交换,实现各要素间的相互作用。系统各组成要素之间的对话机制主要依赖于植物和微生物所分泌的信号物质。随着分析技术的进步,微生物和植物相关的信号分子及其功能的挖掘已经成为目前研究的热点[9-12]。
土壤微生物是土壤肥力形成和持续发展的核心动力。一方面,微生物分解有机质,释放养分;另一方面,微生物与植物争夺养分[13]。土壤微生物几乎参与了土壤中氮素循环的所有过程,包括氮矿化、硝化、反硝化、生物固氮等。铵态氮和硝态氮是对植物有效的两种主要无机氮源,不同植物种类甚至同一种植物的不同品种对铵态氮和硝态氮具有不同偏好[14]。通过调控土壤硝化微生物的活性,可以影响铵态氮和硝态氮比例,进而影响植物氮效率。
土壤硝化作用主要受氨氧化细菌(Ammonia-Oxidizing Bacteria,AOB)和氨氧化古菌(Ammonia-Oxidizing Archaea,AOA)控制,氨氧化古菌主要在酸性土壤中发挥作用,氨氧化细菌更多的在中性和石灰性土壤中发挥作用[15,16]。土壤硝化作用受到多种信号分子的调控。反硝化副球菌(Paracoccus denitrificans)中存在群体感应系统的已知信号分子(C6-HSL),厌氧条件下该信号分子能够促进土壤反硝化作用进行[17]。土壤代表性的化能自养氨氧化细菌-亚硝化螺菌(Nitrosospira multiformis)中也存在群体感应系统的信号分子的合成、识别与调控体系[18]。最近发现参与土壤硝化过程的维氏硝酸杆菌(Nitrobacter winogradskyi)中存在群体感应系统,并且产生一个结构未被报道的新信号分子(C10:1-HSL),该信号分子能够促进亚硝酸盐的吸收及转化[19]。
植物也能够向根际分泌一些信号物质,影响土壤氮素转化过程。在浮萍根系分泌物中,脂肪酸酰胺类化合物能够促进反硝化荧光假单胞菌(Pseudomonas fluorescens)的脱氮效率[20]。在这些脂肪酸酰胺类化合物中,主要是芥酸酰胺在发挥作用:芥酸酰胺通过影响细菌的两个反硝化关键酶(硝酸还原酶和亚硝酸还原酶),促进微生物反硝化过程脱氮[21]。与浮萍相似,水稻根系分泌物也具有很强的生物硝化抑制效应,这些根系分泌物中已鉴定了一种新型的生物硝化抑制剂1,9-癸二醇,其主要通过抑制氨单加氧酶(Ammonia monooxygenase)来抑制硝化作用,1,9-癸二醇分泌量与根际硝化抑制能力、铵态氮吸收效率、铵态氮偏好存在显著正相关[22]。稻田研究表明,使用硝化抑制剂能够显著提高水稻氮肥利用率,在保持相同产量的情况下,硝化抑制剂可使氮肥施用量从 240 kg N hm-2降低到180 kg N hm-2,同时降低了温室气体氧化亚氮的排放[23]。独角金内酯是一种新型激素,可作为一种信号分子与丛枝菌根真菌进行交流[10],丛枝菌根真菌对植物磷吸收具有重要影响,暗示着独角金内酯在增强植物磷效率方面可能发挥重要作用。因此,通过调控地下生物过程,可以提高植物养分利用率,减少化肥施用量,同时能够降低化肥的环境效应。
2 土壤微生物组成多样性与养分转化
土壤微生物组成受气候、植被、土壤、耕作等多种因素的综合影响[24]。土壤微生物是陆地生态系统重要组成部分,数量巨大,种类繁多,在地球物理和化学循环中发挥着重要作用。通过研究土壤氮磷转化微生物组成的演变规律,提出提高功能微生物多样性的措施,可以促进农田生态系统养分循环,增加土壤养分生物有效性,降低养分的损失,提高化肥利用率。
在区域尺度上,基于我国东部温度梯度带的土壤置换长期试验,发现气候条件变化显著影响了土壤微生物群落结构和功能的演替。气候变暖(土壤南移)和气候变冷(土壤北移)均能显著改变潮土中微生物群落的结构,土壤南移对微生物群落演替速率的促进作用高于土壤北移,说明温度增加促进了微生物的演替和竞争[25]。潮土中不同微生物对气候变化敏感性分异,其中放线菌门与厚壁菌门最敏感,变形菌门抗性最强。同时,气候变暖(土壤南移)显著增加了碳循环功能基因(如碳固定、碳降解、甲烷循环等)和氮循环(硝化)功能基因的丰度,且与土壤二氧化碳呼吸通量和硝化能力显著正相关[26]。气候变冷(土壤北移)也显著改变了土壤微生物生物量和群落结构,其中氨氧化功能基因的平均丰度与土壤硝化潜势呈显著正相关[27]。在黑土、潮土和红壤中,与休闲(裸地)处理相比,种植玉米增加了核心氮转化基因的丰度和基因网络的交互作用,网络中的关键基因由休闲处理的固氮基因转变为种植玉米处理的固氮、反硝化和硝化基因[28,29]。这些结果丰富了跨气候带土壤微生物功能多样性对气候变化响应的知识,也为提出适应气候-土壤类型的养分转化微生物功能调控措施提供了理论依据。
在微域尺度上,土壤养分转化微生物组成受到土壤团聚体和食物网(包括食微动物、捕食性动物和微生物)影响[24]。基于中亚热带瘠薄红粘土红壤的长期施肥试验(2002—2015 年),针对我国南方丘陵区典型的瘠薄红粘土红壤,发现在不同的土壤团聚体中,施用猪粪均促进了氨氧化微生物 AOB 和 AOA 丰度的增加,但 AOA/AOB比值呈下降趋势;尽管AOA丰度较氨氧化细菌更高,但 AOB 是硝化作用的主要参与者,食细菌线虫专一性捕食 AOB 刺激了土壤硝化强度,促进了氮素循环[30]。同时,红壤团聚体中线虫和氨氧化微生物形成食物网,相比于小团聚体和微团聚体,大团聚体中的食物网结构最为复杂、相互作用的强度最大,其中起关键作用的氮转化微生物为氨氧化细菌 cluster 3a 和 cluster 10[31]。这些结果在红壤团聚体尺度上阐明了土壤线虫与微生物的协同分布特征对硝化强度的影响,揭示了线虫-氨氧化微生物网络结构对土壤硝化作用的驱动机制,为建立红壤有机培肥和调控氮素供应功能的生物学措施提供了科学依据。
与土壤氮素转化特征不同,磷的主要问题是易被土壤固定和吸附。菌根真菌被广泛证明能够提高土壤磷的生物有效性和植物对磷的吸收[32],但是不同耕作措施如何影响菌根真菌的群落结构多样性却很少被关注。中科院封丘农田生态系统国家野外科学观测站研究了小麦-玉米轮作对丛枝菌根真菌群落多样性的影响。结果表明,在潮土实施免耕耕作可维持较高丛枝菌根真菌多样性、侵染率和玉米磷利用效率,暗示着免耕在提高作物磷利用效率方面的应用潜力[33]。影响土壤磷有效性的另外一类重要微生物是解磷菌,解磷菌约占实验室可培养细菌的 40% 左右,其中一部分为根际促生菌。不少研究结果表明解磷菌能够提高土壤磷的生物有效性和植物吸磷量[13]。土壤解磷菌表现出明显的根际效应,主要受植被和管理措施的影响[24]。虽然解磷菌的研究已有很长时间,但是目前仍缺乏将解磷菌应用于农田的切实可行途径。
3 根系与植物高效吸收养分
虽然叶片也可以吸收少量矿质养分,但是根系是植物获得矿质营养的主要器官。在植物必需的 17 种营养元素中,碳、氢、氧可通过光合作用在地上部获得,其他的 14 种必需营养元素均主要依靠根系从土壤中获取,这 14 种元素被称为矿质营养元素。根系是地下生物的重要组成部分,根系重量远高于土壤中微生物和动物的重量。“根深叶茂”一词表明了地下根系对植物地上部的重要作用,优良的根系对于植物高效吸收养分至关重要,优良根系不仅指根系要大,而且要有良好的根构型和根系生理状态如高效的养分转运体。
在水稻中过量表达编码一种蛋白激酶的基因 PSTOL1显著增强了水稻对低磷的耐性,其机制主要是促进了水稻早期根系的生长[34]。铵态氮和乙烯都能通过调控细胞壁果胶和一个磷转运体 OsPT2 来提高水稻对磷的再利用[35,36],水稻根系中多个铵态氮和硝态氮运输基因与水稻氮效率有关[37]。水稻 OsAMT1;1 是一个相对低亲和的 NH4+吸收系统,其吸收机制不依赖于质子,为 NH4+单向运输,且铵的吸收能力受体内 NH4+积累的反馈抑制调控[38]。植物氮效率不仅依赖于氮,碳不足也会影响氮效率,以碳促氮有可能被用来提高植物氮效率。转录组学的研究结果表明,水稻可通过调节碳氮代谢水平以应对根外铵态氮养分水平的变异,暗示着提高水稻氮利用效率需要考虑碳氮平衡[39]。目前,很多根系跨膜转运养分的基因已被鉴定[40],这些基因对于提高养分效率和保障粮食安全将具有重要作用。
4 微生物与根系高效摄取土壤养分
根系一方面可以直接从土壤获取养分,也可以借助于土壤微生物如菌根真菌和根瘤固氮菌的帮助来获得养分。植物根系在土壤中会与一些微生物形成共生关系,影响植物摄取土壤养分的能力,这些微生物主要有根瘤固氮菌、菌根真菌和根际促生菌[13]。共生微生物帮助植物获得更多养分,植物根系分泌物为微生物提供碳源,形成互惠互利的关系。
生物固氮是地球上最大规模的天然氮肥工厂,但是大多数农田作物(如水稻、小麦和玉米)生物固氮量极低,仍需施用大量氮肥才能高产[13,41]。根瘤固氮机理一直是一个研究热点和难点。大豆是一种典型的根瘤固氮作物,但是氮磷调控大豆根瘤形成的机制一直不清楚。最近研究发现,基因 GmEXPB2 不仅能够提高大豆磷效率[42],还具有调控大豆结瘤性状的新功能[43]。因此,GmEXPB2 是能同时调控大豆氮磷效率的关键基因,通过增强该基因在大豆中的表达,有望协同提高大豆氮磷效率。
菌根是一种最为古老的植物和微生物共生现象,可以追溯到 4 亿年前,菌根真菌最主要的植物营养功能是提高植物对土壤磷的摄取能力,虽然现在也有不少报道表明菌根促进了植物吸氮[13]。铝毒和低磷胁迫经常共存于酸性土壤,协同提高酸性土壤植物耐铝和耐低磷能力是发挥酸性土壤作物生产力的一项主要策略[44,45]。研究发现菌根具有协同提高作物根系抗铝毒和耐低磷的能力,菌根对根系铝毒的缓解能力与菌根诱导的磷转运子 GmPT9 的表达相关[46],这为通过调控菌根、协同提高酸性土壤植物耐铝和耐低磷能力提供了理论依据。
丛枝菌根真菌一般在低磷土壤上发挥作用。最近的研究表明,丛枝菌根真菌在高磷土壤上也能够发挥作用[47]。不接种菌根真菌,莴笋达到最大生长量的土壤有效磷含量为 67.9 mg Olsen-P kg-1,而接种菌根真菌后仅为 59.3 mg Olsen-P kg-1,降低了14.5%,表明接种菌根真菌能够降低芦笋获得最大生长量对磷素的需求[47]。菌根真菌不仅能够降低高磷土壤施磷量,还能改善土壤结构。接种丛枝菌根真菌,种植番茄和玉米的土壤团聚体的标准化平均当量直径分别提高了 46.2% 和 17.7%,土壤团聚体中大于 1 mm 的粒径比例显著增加,显著改善了砂姜黑土的土壤结构[48]。目前我国菜地磷累积非常严重,有些菜地土壤有效磷含量达到了上百 mg Olsen-P kg-1,存在巨大的环境风险和资源浪费[49,50]。另外,菜地土壤盐渍化问题突出,土壤板结。因此,如能够将菌根应用在菜地高磷土壤,不仅可以降低施磷量,还能改善土壤结构,缓解土壤板结问题,是一项具有应用潜力的技术途径。
5 研究展望
我国过去 30 多年来的农业发展以高产为主要目的,将来农业发展必须以“高产、高效、优质”并重为目的,任何仅仅以高产为目的的生产措施必将是不可持续的。地下生物是个“黑箱”,由于观念和技术手段的限制,过去几十年并没有完全认识到地下生物在作物养分高效利用方面的重要地位。目前科学界已经将重心转向地下生物的调控,通过遗传育种方式筛选具有优良根系的作物品种、添加外源生物物质促进根系活力、施用生物肥料改变土壤养分转化过程、增强微生物-根系共生体系的构建等措施,来提高养分利用率,降低传统物理和化学调控的使用成本和环境风险,达到“增产、增效、优质和环保”的目标。20 世纪 90 年代以前,植物促生菌相关的专利和文献仅有 31 个研究报道;20 世纪 90 年代达到582 个;2000 年至今猛增至 22 055个,增幅超过 700 倍。表明调控土壤微生物为主的管理措施是未来高产高效农业的发展趋势。调控土壤微生物的研究已经证明具有广泛的增产潜力。与传统氮磷钾施肥相比,通过调控土壤微生物的增产报道占 98%,增产幅度超过 5%的报道占 87.4%,超过 10% 的报道占 56.6%。文献综合分析表明,各类微生物肥料的平均增产量在 12.0%—22.3%之间。虽然地下生物调控在机理研究和应用效果上已展现出了良好的发展前景,但是目前还存在诸多问题,包括效果不稳定、机理不清楚、成本较高等。因此,建议对以下 4 个方面加强研究。
(1)控制养分循环的土壤生物功能和区域分异规律。土壤生物群落在微米尺度下生理代谢作用推动了宏观尺度下土壤养分和能量的循环。我国气候、土壤、作物存在巨大的时空差异,导致土壤微生物结构及其相互之间的关系复杂多样,目前对土壤微生物在系统和区域尺度上控制养分和能量循环的功能认识不清。过去 200 年的土壤科学发展史中,土壤微生物研究一直受限于技术手段的发展和科学理论的突破。2005 年以来,高通量测序技术跨跃发展,可以将认识微生物资源和功能的程度从目前的 1% 增加到 30% 左右,这为揭示控制养分循环的土壤生物功能和区域分异规律提供了契机。
(2)微生物介导的土壤养分转化过程与养分高效利用之间的关系。土壤氮磷养分循环的全过程均有微生物参与,不同的微生物参与了不同步骤,最终形成了不同的养分形态,不同的养分形态具有不同生物有效性和损失性。另外,微生物和植物分泌的一些信号分子也会影响微生物介导的土壤氮磷转化。虽然对微生物介导的土壤养分转化过程认识已比较完善,但是目前对于微生物介导的土壤养分转化过程与养分高效利用之间的确切关系并不明了,如何利用这种关系来调控作物氮磷效率仍缺乏切实可行的措施。某种提高土壤养分有效性的措施也有可能带来过多的养分损失,将土壤有效养分含量控制在适宜水平是调控微生物介导的土壤养分转化的关键。由于不同植物种类或品种铵硝偏好和土壤硝化作用能力的差异,硝化抑制剂适宜应用的作物种类、品种和土壤类型仍需深入探讨。
(3)养分高效型作物的根系特征解析。根系是将地下养分向地上传送的“桥梁”,同时也是植物获得更多养分的“抓手”。具有拙劣根系的作物,其养分效率必定低下;但是反过来,养分高效型作物的根系应该具有哪些具体关键特征呢?这个问题并不容易回答。例如,一般认为大的根系对于植物获得养分有益,但是这不仅会消耗更多的碳水化合物,而且有时候一个粗根吸收养分的效果并不如一个细根。影响根系发育的生理过程和基因多种多样,但是这些过程和基因并不一定与养分效率都有关系,需要进一步深入研究哪个关键生理过程和哪些基因联合控制着根系发育和养分高效吸收。另外,根系与微生物密切相关,根系会分泌一些物质影响土壤养分转化,同时根系会与微生物形成共生结构如菌根和根瘤,菌根和根瘤直接影响养分吸收。将来需要研究作物向土壤分泌信号物质和形成根微共生体的机理。为什么有些作物或品种具有这种能力而其他作物不具有这些能力?传统的思路是向土壤接种一些微生物来影响植物分泌信号物质和形成根微共生体的能力,将来可以尝试直接选育和种植一些具有这种能力的作物。如本文前面所述,有些水稻品种根系能够分泌抑制土壤硝化作用的物质,这些品种同时具有较高的铵态氮吸收效率。根系除了要具有良好的构型和根微特征,而且要具有较强的养分吸收能力和根—茎养分转运能力。目前已有不少与养分吸收、运输相关的基因被鉴定,如铵态氮、硝态氮和磷酸根等运输体,将来需要进一步深入解析它们与养分高效利用之间的关系。
(4)生物制剂的研制和应用。由于我国《肥料法》的缺乏[51],目前微生物肥料没有一个严格可操作的定义和执行标准,市场上微生物肥料(确切讲,是添加微生物制剂的肥料)种类繁多,质量参差不齐,价格昂贵,加上效果不稳定,人们会产生对微生物作用的怀疑,甚至认为不能称为生物肥料。今后的研究一方面需要加强对生物肥料的定义和市场化规范。同时,随着上述相关机理的进一步阐明,逐步生产出一些高效、高纯、制作技术简单、易推广的生物试剂,单独施用于土壤或者与常规肥料混合施用,增强人们对于土壤微生物重要性的认识。
6 结语
地下生物是影响地上植物高效吸收养分的决定性因素,目前调控生物已经显示出了良好的增产增效潜力。21 世纪是生物的世纪,生物技术日新月异。随着一些技术瓶颈问题的解决,人们将逐步破解地下“黑箱”中生物学问题,研发靶标明确、区域适宜性强的地下微生物调控措施,实现地上-地下生物的协同调控和养分高效利用,为协调粮食安全和环境安全作出突出贡献。
1 赵其国, 沈仁芳, 滕应. 中国土壤安全“一带一路”发展战略的思考. 生态环境学报, 2016, 25(3): 365-371.
2 杨林章, 孙波. 中国农田生态系统养分循环和平衡及其管理.北京: 科学出版社, 2008.
3 于飞, 施卫明. 近10年中国大陆主要粮食作物氮肥利用率分析. 土壤学报, 2015, 52(6): 1311-1324.
4 张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径. 土壤学报, 2008, 45(5): 915-924.
5 Wardle D A, Bardgett R D, Klironomos J N, et al. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629-1633.
6 Heijden M G A, Bardgett R D, Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(3): 296-310.
7 Whitman W B, Coleman D C, Wiebe W J. Profkaryotes: theunseen majority. PNAS, 1998, 95: 6578-6583.
8 Heijden M G A, Klironomos J N, Ursic M, et al. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 1998, 396: 69-72.
9 Mathesius U, Mulders S, Gao M, et al. Extensive and specific responses of a eukaryote to bacterial quorum-sensing signals. PNAS, 2003, 100(3): 1444-1449.
10 Umehara M, Hanada A, Yoshida S, et al. Inhibition of shoot branching by new terpenoid plant hormones. Nature, 2008, 455(7210): 195-200.
11 Belimov A A, Dodd I C, Hontzeas N, et al. Rhizosphere bacteria containing 1-aminocyclopropane-1-carboxylate deaminase increase yield of plants grown in drying soil via both local and systemic hormone signaling. New Phytologist, 2009, 181(2): 413-423.
12 Ruyter S C, Babili S, Krol S, et al. The biology of strigolactones. Trends in Plant Science, 2013, 18(2): 72-83.
13 沈仁芳, 赵学强. 土壤微生物在植物获得养分中的作用. 生态学报, 2015, 35(20): 6584-6591.
14 Zhao X Q, Guo S W, Shinmachi F, et al. Aluminum tolerance in rice is antagonistic with nitrate preference and synergistic with ammonium preference. Annals of Botany, 2013, 111(1): 69-77.
15 Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils. The ISME Journal, 2012, 6(5): 1032-1045.
16 Che J, Zhao X Q, Zhou X, et al. High pH-enhanced soil nitrification was associated with ammonia-oxidizing bacteria rather than archaea in acidic soils. Applied Soil Ecology, 2015, 85: 21-29.
17 Cheng Y, Zhang Y, Shen Q, et al. Effects of exogenous shortchain N-acyl homoserine lactone on denitrifying process of Paracoccus denitrificans. Journal of Environmental Sciences, 2017, 54: 33-39.
18 Gao J, Ma A, Zhuang X, et al. 2014. An N-acyl homoserine lactone synthase in the ammonia-oxidizing bacterium Nitrosospira multiformis. Applied and Environmental Microbiology, 80(3): 951-958.
19 Shen Q, Gao J, Liu J, et al. A new acyl-homoserine lactone molecule generated by Nitrobacter winogradskyi. Scientific Reports, 2016, 6: 22903.
20 Lu Y, Zhou Y, Nakai S, et al. Stimulation of nitrogen removal in the rhizosphere of aquatic duckweed by root exudate components. Planta, 2014, 239(3): 591-603.
21 Sun L, Lu Y, Kronzucker H J, et al. Quantification and enzyme targets of fatty acid amides from duckweed root exudates involved in the stimulation of denitrification. Journal of Plant Physiology, 2016, 198: 81-88.
22 Sun L, Lu Y, Yu F, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen use efficiency. New Phytologist, 2016, 212(3): 646-656.
23 Sun H, Zhang H, Powlsond D, et al. Rice production, nitrous oxide emission and ammonia volatilization as impacted by the nitrification inhibitor 2-chloro-6-(trichloromethyl)-pyridine. Field Crops Research, 2015, 173: 1-7.
24 孙波, 廖红, 苏彦华, 等. 土壤–根系–微生物系统中影响氮磷利用的一些关键协同机制的研究进展. 土壤, 2015, 47(2): 210-219.
25 Liang Y, Jiang Y, Wang F, et al. Long-term soil transplant simulating climate change with latitude significantly alters microbial temporal turnover. The ISME Journal, 2015, 9: 2561-2572.
26 Zhao M, Xue K, Wang F, et al. Microbial mediation of biogeochemical cycles revealed by simulation of global changes with soil transplant and cropping. The ISME Journal, 2014, 8(10): 2045-2055.
27 Liu S, Wang F, Xue K, et al. The interactive effects of soil transplant into colder regions and cropping on soil microbiologyand biogeochemistry. Environmental Microbiology, 2015, 17(3): 566-576.
28 汪峰, 孙波. 我国东部土壤氮转化微生物的功能分子生态网络结构及其对作物的响应. 科学通报, 2014, 59(4/5): 387-396.
29 Wang F, Liang Y, Jiang Y, et al. Planting increases the abundance and structure complexity of soil core functional genes relevant to carbon and nitrogen cycling. Scientific Reports, 2015, 5: 14345. 30 Jiang Y, Jin C, Sun B. Soil aggregate stratification of nematodes and ammonia oxidizers affects nitrification in an acid soil. Environmental Microbiology, 2014, 16(10): 3083-3094.
31 Jiang Y, Sun B, Li H, et al. Aggregate-related changes in network patterns of nematodes and ammonia oxidizers in an acidic soil. Soil Biology and Biochemistry, 2015, 88: 101-109.
32 李晓林, 姚青. VA菌根与植物的矿质营养. 自然科学进展, 2000, 10(6): 524-531.
33 Hu J, Yang A, Zhu A, et al. Arbuscular mycorrhizal fungal diversity, root colonization, and soil alkaline phosphatase activity in response to maize-wheat rotation and no-tillage in North China. Journal of Microbiology, 2015, 53(7): 454-461.
34 Gamuyao R, Chin J H, Pariasca-Tanaka J, et al. The protein kinase Pstol1 from traditional rice confers tolerance of phosphorus deficiency. Nature, 2012, 488(7412): 535-539.
35 Zhu C Q, Zhu X F, Hu A Y, et al. Differential Effects of nitrogen forms on cell wall phosphorus remobilization are mediated by nitric oxide, pectin content, and phosphate transporter expression. Plant Physiology, 2016, 171(2): 1407-1417.
36 Zhu X F, Zhu C Q, Zhao X S, et al. Ethylene is involved in root phosphorus remobilization in rice (Oryza sativa) by regulating cell-wall pectin and enhancing phosphate translocation to shoots. Annals of Botany, 2016, 118(4): 645-653.
37 Shi W M, Xu W F, Li S M, et al. Responses of two rice cultivars differing in seedling-stage nitrogen use efficiency to growth under low-nitrogen conditions. Plant and Soil, 2010, 326(1-2): 291-302.
38 Yang S, Hao D, Cong Y, et al. The rice OsAMT1;1 is a protonindependent feedback regulated ammonium transporter. Plant Cell Reports, 2015, 34(2): 321-330.
39 Yang S, Hao D, Song Z, et al. RNA-Seq analysis of differentially expressed genes in rice under varied nitrogen supplies. Gene, 2015, 555(2): 305-317.
40 Schroeder J I, Delhaize E, Frommer W B, et al. Using membrane transporters to improve crops for sustainable food production. Nature, 2013, 497(7447): 60-66.
41 沈世华, 荆玉祥. 中国生物固氮研究现状和展望. 科学通报, 2003, 48(6): 535-540.
42 Zhou J, Xie J, Liao H, et al. Overexpression of β-expansin gene GmEXPB2 improves phosphorus efficiency in soybean. Physiologia Plantarum, 2014, 150(2): 194-204.
43 Li X, Zhao J, Tan Z, et al. GmEXPB2, a cell wall β-expansin, affects soybean nodulation through modifying root architecture and promoting nodule formation and development. Plant Physiology, 2015, 169: 2640-2653.
44 Zhao X Q, Chen R F, Shen R F. Coadaptation of plants to multiple stresses in acidic soils. Soil Science, 2015, 179(10/11): 503-513.
45 赵学强, 沈仁芳. 提高铝毒胁迫下植物氮磷利用的策略分析.植物生理学报, 2015, 51 (10): 1583-1589.
46 Zhang S, Zhou J, Wang G, et al. Role of mycorrhizal symbiosis in aluminum and phosphorus interactions in relation to aluminum tolerance in soybean. Applied Microbiology and Biotechnology, 2015, 99: 10225-10235.
47 Xu P, Liang L Z, Dong X Y, et al. Response of soil phosphorus required for maximum growth of Asparagus officinalis L. to inoculation of arbuscular mycorrhizal fungi. Pedosphere, 2014, 24(6): 776-782.
48 Xu P, Liang L Z, Dong X Y, et al. Effect of arbuscular mycorrhizal fungi on aggregate stability of a clay soil inoculating with two different host plants. Acta Agriculturae Scandinavica,Section B – Soil and Plant Science, 2015, 65(1): 23-29.
49 赵学强, 沈仁芳. 我国菜地土壤氮磷钾养分状况与均衡调控,江苏耕地质量建设论文集. 南京: 河海大学出版社, 2008: 97-101.
50 Liang L Z, Zhao X Q, Yi X Y, et al. Excessive application of nitrogen and phosphorus fertilizers induces soil acidification and phosphorus enrichment during vegetable production in Yangtze River Delta, China. Soil Use and Management, 2013, 29: 161-168.
51 沈仁芳, 梁林洲, 赵学强. 日本、韩国、台湾地区肥料相关的立法及其对我国肥料管理的启示. 土壤, 2012, 44(4): 529-534.
沈仁芳 中科院南京土壤所所长,研究员,长期从事酸性土壤改良与利用研究。中科院“百人计划”入选者,国家“跨世纪百千万人才工程”入选者,国家杰出青年基金获得者,“973”项目首席科学家。中国土壤学会理事长,Pedosphere主编,第七、八、九届低pH下植物-土壤相互作用系列国际会议(PSILPH)国际指导委员会委员。发表学术论文150余篇,主编专著 1 部,荣获中科院科技促进发展奖二等奖和中国土壤学会科技奖一等奖各 1 项。
Email: rfshen@issas.ac.cn
Shen Renfang Professor and the director general of Institute of Soil Science, Chinese Academy of Sciences (CAS). Prof. Shen has long been involved in the research of improving and utilizing acid soils, and is the member of 7th, 8th, and 9th committee of International Symposium on Plant-Soil Interactions at Low pH (PSILPH). He is the winners of National Science Fund for Outstanding Young Scholars, “Hundred Talents Program” of CAS, and state level “Cross-Century Talent Program”. In addition, he is the Chief Scientist for national “973” project, the president of Soil Science Society of China, and the Editor-in-Chief of Pedosphere. He has published more than 150 academic papers and one book. Prof. Shen wins the second prize of Science and Technology Promotion Development of CAS and the first prize of Science and Technology of Soil Science Society of China. E-mail: rfshen@issas.ac.cn
Interactions between Above- and Below-ground Organisms for Nutrient-efficient Utilization
Shen Renfang Sun Bo Shi Weiming Zhao Xueqiang
(Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
The improvement of nutrient use efficiency is the double demanding for both food and environmental safety. In the below-ground, there are large amount of various organisms including plant roots, microbes, and animals. The below-ground organisms are involved in the mobilization, transformation, uptake and transport of nutrients, being the main driver of the above-ground productivity and nutrient use efficiency. This review summarized four aspects of research progresses: (1) biologically signaling basis and nutrient transformation in soil-root-microbe interfaces; (2) microbial community composition and nutrient transformation; (3) plant roots and nutrient-efficient uptake; (4) microbes and nutrient-efficient acquisition by roots. Based on these progresses, four research focuses are suggested to be enhanced in the future: (1) the function and regional differentiation of soil organisms; (2) the relationship between soil microbe-regulated processes and nutrient efficiency; (3) the root characteristics of nutrient-efficient plant varieties; (4) the development of biological reagents for nutrient-efficient use. The technological development and mechanistic clarification will hopefully promote the uncovering of the “black box” of the below-ground organisms, ultimately contributing to the improvement of nutrient use efficiency by regulating the interactions between the above- and below-ground organisms.
nutrient efficiency, roots, microbes, nutrient transformation, cooperative regulation
*资助项目:中科院战略性先导科技专项(B类)(XDB15000000)
修改稿收到日期:2017年5月10日
