粉葛直链淀粉与支链淀粉分离工艺研究
2017-07-05刘一芳
张 钟,刘一芳
(广东石油化工学院,广东 茂名 525000)
粉葛直链淀粉与支链淀粉分离工艺研究
张 钟,刘一芳
(广东石油化工学院,广东 茂名 525000)
以粉葛为原料,对粉葛中直链淀粉和支链淀粉的分离工艺进行了研究。根据直链和支链淀粉的理化特性及结构的不同,采用正丁醇-异戊醇配合物沉淀法对粉葛直链和支链淀粉进行粗分离,再经正丁醇重结晶得到较纯的直链与支链淀粉,讨论了分离前对淀粉进行预处理、纯化次数、分离过程中离心时间对分离效果的影响。通过对淀粉-碘复合物光吸收特性分析和蓝值比较,表征分离得到的直链与支链淀粉的纯度。结果表明:直链淀粉纯化5次、支链淀粉纯化6次、分离前经过预处理、支链淀粉纯化时离心时间和速度为30 min,5 000 r/min的条件下,光谱分析测得的最大吸收波长和蓝值都落在直链淀粉与支链淀粉文献报道结果的相应数值范围内,表明此时分离效果最佳,正丁醇结晶法分离的直链和支链淀粉纯度较高。
粉葛;直链淀粉;支链淀粉;丁醇沉淀;分离
新鲜的粉葛中含淀粉约20%~25%,该淀粉具有糊化温度低,淀粉糊透明度高、稳定性好等特点,从粉葛中提取的葛根淀粉是绿色保健食品。粉葛中含支链淀粉21%。用粉葛制作的食品不易老化,而且具有粉葛特有的清香味[1]。
粉葛淀粉的透明度和冻融性方面较玉米淀粉差,而凝胶强度较玉米淀粉强,粉葛淀粉对酸碱较玉米和甘薯淀粉稳定[2]。直链淀粉与支链淀粉的分离方法分别有配合剂分离法[3-4]、温水抽提法、盐类分离法、控制结晶法[5]以及色谱法和纤维素吸附法等。直链淀粉和支链淀粉的纯度表征方法有碘亲和力法、光谱分析法[6-8]以及色谱分析法[9-11]。本研究采用正丁醇-异戊醇配合物沉淀法对粉葛直链和支链淀粉进行粗分离,再经正丁醇重结晶得到较纯的直链与支链淀粉,讨论了分离前对淀粉进行预处理、纯化次数、分离过程中离心时间对分离效果的影响。研究粉葛淀粉中直链和支链淀粉的含量,为研究粉葛淀粉的性质提供参考。
1 材料与仪器
1.1 试验材料与试剂
新鲜高州粉葛,成熟度为九成,表皮为土黄色,长圆形,完整,购于官渡市场。
氢氧化钠、盐酸、碘、碘化钾、正丁醇、异戊醇、无水乙醇、石油醚、酒石酸氢钾、邻苯二甲酸氢钾、无水碳酸钠、酚酞、溴甲酚绿-甲基红混合指示剂均为分析纯。
1.2 试验仪器
JY2502分析天平,HH-6数显恒温水浴锅,SG-200GI打浆机,DHG-9070A电热鼓风干燥箱,80-2离心机,TD5B台式大容量离心机,PHS-3C数显pH计,TU-1810紫外可见分光光度计,RE-52AA旋转蒸发器。
2 试验方法
2.1 粉葛中粗淀粉的提取
2.1.1 工艺流程
原料→清洗→粉碎→浸泡→磨浆→过滤→静置→脱水→干燥→粗淀粉。
2.1.2 操作要点
(1)原料选择、清洗:挑新鲜成熟的粉葛1 000 g左右,以果皮亮滑、无摔碰痕、无腐烂、无病虫害为好,使用清水清洗干净。
(2)去皮、打浆:将粉葛去皮,然后将粉葛切成小块,加入粉葛质量20%的水进行打浆。
(3)将粉葛浆用4层纱布过滤,滤液加入一定量的水,再过滤,滤液装入大盆子内加入大量的水,静置8~12 h。
(4)除去粉上浮渣和清水,将沉淀后的粉浆加入清水拌匀,再次沉淀10~12 h,待粉面上水色透明,淀粉粘固在大容器底后,轻轻斜桶倒掉粉面上清水。
(5)重复步骤(4)多次。
(6)倒掉上清水,沥干水分,先铲去沉淀的表层部分,取出中层的淀粉。把淀粉切成大小适中的块状,置于40℃鼓风干燥箱中烘干,最后称重,记录。
2.2 正丁醇结晶法分离直链淀粉和支链淀粉
2.2.1 工艺流程
粉葛淀粉→称重→预处理→干燥→称重→过筛→无水乙醇湿润→加入NaOH溶液→沸水浴加热→冷却→离心→HCl调至中性→加入混和溶液→沸水浴加热→冷却→4℃冰箱中静置24 h→离心→产品。
2.2.2 操作要点
2.2.2.1 分离前预处理
(1)滤纸筒的制备:将大小为8 cm×15 cm的滤纸,用直径约2 cm的试管为模型,将滤纸以试管壁为基础,折叠成底端封口的滤纸筒,筒内底部放一小片脱脂棉。在105℃中烘至恒重,至于干燥器中备用。
(2)样品处理:称取15.00 g于沸水浴上蒸干后,置于95~105℃烘干,研碎,全部移入滤纸筒内,蒸发皿及粘附有样品的玻璃棒都用沾有乙醚的脱脂棉擦净,将脱脂棉一同放在滤纸筒上面,再用脱脂棉线捆滤纸筒口。
(3)抽提:将滤纸筒放入索氏提取器内,连接已干燥至恒重的脂肪接收瓶,由冷凝管上端加入石油醚,加入量为接收瓶的三分之二体积,于水浴上80℃左右加热使石油醚不断回流提取,一般提取6~12 h,至抽提完全为止。
2.2.2.2 分离
(1)分别称取10.0 g经300目过筛的经预处理和未预处理的原淀粉样品,用少量无水乙醇湿润,加0.5 mol/LNaOH溶液350 ml,在沸水浴中加热分散至整个淀粉糊完全透明且无结块状,冷至室温后离心(4 000 r/min,20 min),去掉不溶物。
(2)淀粉糊用2 mol/L的HCl调至中性,再加入80 ml正丁醇和异戊醇混和溶液(3∶1),在沸水浴中加热搅拌10 min至整个体系透明,冷却至室温后,置于4℃冰箱中静置24 h。
(3)从冰箱中取出,再进行离心(4 000 r/min,20 min),沉淀为粗直链淀粉,上清液为粗支链淀粉。
2.2.3 直链淀粉与支链淀粉的提纯
2.2.3.1 直链淀粉的纯化操作要点
(1)将沉淀物移入200 ml水正丁醇混合溶液中(水和正丁醇为8∶1),在沸水浴中加热搅拌10 min使其溶解至透明,冷至室温后,置于4℃冰箱中静置24 h,离心(4 000 r/min,20 min)后得沉淀物。
(2)重复上述操作,提纯次数分别为2、3、4、5、6次。
(3)最后用无水乙醇浸泡24 h后,沉淀物再用无水乙醇洗涤3~4次,将沉淀物置于40℃鼓风干燥箱中干燥,即得纯直链淀粉样品,称重,记录体积,每组做3次平行试验。
2.2.3.2 支链淀粉的纯化操作要点
(1)将粗支链淀粉溶液置于分液漏斗中静置数分钟后,溶液分成3层,取下层乳胶体溶液,加入40 ml体积比为1∶1的正丁醇-异戊醇混合液,于沸水浴中加热搅拌直至溶液分散透明(大约10 min),冷至室温,移入2~4℃的冰箱中静置48 h。
(2)从冰箱中取出,分别控制离心速度和离心时间(5 000 r/min,20 min)、(5 000 r/min,25 min)、(5 000 r/min,30 min),去除沉淀物,取澄清乳胶体溶液重复上述操作,提纯次数分别为2、3、4、5、6次。
(3)所得澄清乳胶体溶液用旋转蒸发仪(40℃)减压浓缩至原体积的二分之一,加入2倍体积冷冻无水乙醇进行沉淀,将沉淀溶于热的100 ml 0.5 mol/L NaOH溶液中,再加入2倍体积的无水乙醇,将析出的沉淀溶于100 ml蒸馏水中,用2倍体积的无水乙醇再沉淀,以无水乙醇洗涤沉淀3次,将样品置于40℃的鼓风干燥箱中干燥,即得纯支链淀粉样品,称重。每组做3次平行试验。
2.2.4 直链淀粉与支链淀粉的测定
2.2.4.1 操作要点
(1)分别称取5 mg直链淀粉、25 mg支链淀粉溶于5 ml 1 mol/LNaOH溶液中,振摇后沸水浴3 min制备成直链淀粉和支链淀粉溶液,冷却后各取1 ml溶液至50 ml容量瓶中,用0.1 mol/LHCl调节溶液pH值至3.5,加入0.07~0.1 g酒石酸氢钾和0.5 ml碘试剂(I 22.0 mg/ml+KI 20.0 mg/ml),用蒸馏水定容并在室温静置20 min。
(2)用紫外-可见分光光度计在400~800 nm范围内对样品进行扫描,最高吸收峰处的光谱波长为最大吸收波长λmax,测定样品在λmax处的吸光度Aλmax,以相同浓度的碘溶液作空白。
2.2.4.2 蓝值比较法操作要点
用紫外-可见分光光度计分别测定直链淀粉和支链淀粉的最大吸收波长和吸光度后,通过下式计算出每组淀粉的蓝值。
蓝值=Aλmax×4/C样品,
式中,C样品为淀粉样品溶液的浓度,mol/L。
3 结果与讨论
3.1 粉葛中粗淀粉的提取
从表1可知,粉葛中淀粉的提取率为17.00%。

表1 粉葛淀粉的提取率
3.2 直/支链淀粉的分离
3.2.1 纯化离心时间对支链淀粉的影响
从表2可看出,随着离心时间的增加,分离所得到的支链淀粉的质量极显著下降,最大吸收峰向长波长方向移动,离心时间在25 min和30 min时最大吸收峰差异不显著,蓝值也随之下降。
在离心时间为25 min和30 min的条件下,分离出较纯的支链淀粉。但在离心时间为20 min时,最大吸收波长为519 nm,蓝值为0.240,这两个数值都不在文献报道支链淀粉与碘形成的复合物吸收峰(520~590 nm)和蓝值(0.08~0.22)的结果范围内,说明分离出的支链淀粉纯度较差。
在5 000 r/min,20 min的离心条件下,导致离心液较混浊,直链淀粉与支链淀粉无法完全分离开,最后制得的支链淀粉中含有较多无法完全沉淀的直链淀粉。
支链淀粉的质量随着离心时间的增加而减少的原因是:随着离心时间的加长,使直链淀粉更加充分沉淀出来,即从支链淀粉中分离出来,所以得到的支链淀粉质量越少,其纯度越高。

表2 纯化离心时间对支链淀粉质量的影响
3.2.2 纯化次数对直链淀粉和支链淀粉的影响
从表3可看出,随着纯化次数的增加,分离所得到的直链淀粉的质量逐渐缓慢上升,最大吸收峰向长波长方向移动,蓝值也逐渐上升。随着纯化次数的增加,分离所得到的支链淀粉的质量逐渐缓慢下降,最大吸收峰向短波长方向移动,蓝值也随之下降。5组纯化次数对分离获得的直链淀粉质量都有极显著差异;而对支链淀粉质量的影响中,纯化次数为2次和其他次数相比有极显著差异,3次、4次、5次没有显著差异,综合所测得蓝值和最大吸收波长,说明纯化次数2次对分离效果有很大的影响且此条件下纯化效果不好,而纯化次数5次时纯化效果最佳。
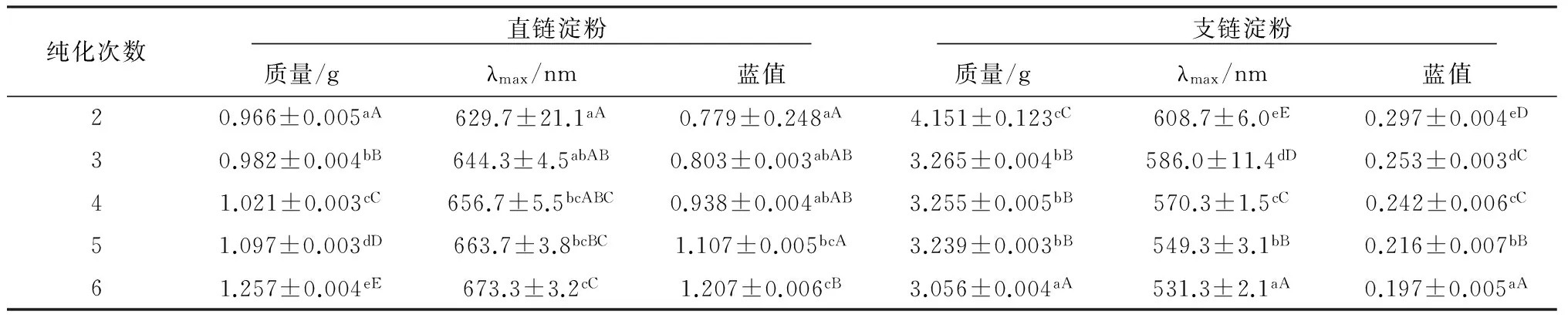
表3 纯化次数对直链淀粉和支链淀粉质量的影响
在纯化次数为2~6次时,分离得到的直链淀粉的最大吸收波长都在文献报道支链淀粉与碘形成的复合物吸收峰(600~680 nm)的结果范围内,但纯化次数为2次和6次的情况下,蓝值与标准直链淀粉的蓝值(0.8~1.2)有较小的误差。对于支链淀粉,纯化2次所测得最大吸收波长不在文献报道支链淀粉与碘形成的复合物吸收峰(520~590 nm)的结果范围内,纯化次数2~4次所测得蓝值(0.08~0.22)也不在文献报道结果的范围内。这是因为纯化次数太少达不到直链淀粉和支链淀粉分离的效果,导致分离出来的直链淀粉和支链淀粉都不够纯。所以,当纯化次数达6次时可得到纯度较高的直、支链淀粉。
3.2.3 去脂、未去脂对直链淀粉和支链淀粉的影响
在粉葛淀粉经过去脂预处理和未去脂的两种情况下,通过光谱分析法测定这两种情况下分离得到的直链淀粉和支链淀粉的纯度,并进行比较,结果见表4。

表4 去脂、未去脂对直链淀粉和支链淀粉的影响
从表4可看出,样品在经过预处理,去脂的条件下,分离所得到的直链淀粉和支链淀粉的质量和最大吸收波长都比未预处理的多,而蓝值比未预处理的低。
去脂和未去脂的条件下对分离获得的直链淀粉和支链淀粉质量都有极显著差异,说明去脂和未去脂对分离效果有很大的影响,综合所测得蓝值和最大吸收波长,在去脂的条件下,分离效果更好。
未经预处理过的样品,在分离后得到的直链淀粉和支链淀粉的最大吸收波长虽然都在文献报道结果的范围内,但测得的蓝值不在文献报道结果的范围内。这是因为脂质是与淀粉中直链分子络合的状态存在的,可以认为它可能是影响直链组分纯度的重要因素。在进行直链淀粉和支链淀粉的分离前,要对样品进行抽提除去脂质,消除这些微量成分对于直链淀粉和支链淀粉纯度的影响。
4 结论
(1)粉葛中淀粉的提取率为17.00%。
(2)纯化次数、分离前的预处理和纯化时的离心时间对直链淀粉和支链淀粉分离效果均有影响,其中影响支链淀粉得率的主要因素是离心时间。
(3)在直链淀粉纯化5次、支链淀粉纯化6次、分离前经过预处理、支链淀粉纯化时离心时间为30 min,5 000 r/min的条件下,用正丁醇结晶法分离粉葛中的直链淀粉和支链淀粉,通过光谱分析法测定自制直链淀粉、支链淀粉的最大吸收波长和蓝值,测定值均落在直链与支链淀粉相应数值范围内,说明用正丁醇结晶法可提纯得到较高纯度的粉葛直、支链淀粉。
[1] 尹 巍,王 帅.葛根淀粉分离纯化及其药用价值现状分析[J].粮食加工,2008(l):84-86.
[2] 徐明生,吴磊燕,吴少福.葛根淀粉物理特性研究[J].江西农业大学学报:自然科学版,2002,24(4):454-45.
[3] 石海信,郝媛媛,方怀义,等. 双波长法测定木薯淀粉中直链和支链淀粉的含量[J]. 食品科学, 2011,21:123-127.
[4] 石海信,周艳沙,宾 敏,等. 芭蕉芋直链和支链淀粉纯品的提取及其光谱分析[J]. 食品科技, 2012(5):149-153.
[5] 刘 洁,刘亚伟.直链淀粉与支链淀粉的分离方法[J]. 粮食与饲料工业,2005(2):15-17.
[6] LIN Jheng-hua, WANG Shu-wen, CHANG Yung-ho. Effect of molecularsize on gelatinization thermal properties before and after annealing of ricestarch with different amylose contents[J]. Food Hydrocolloids, 2008,22: 156-163.
[7] GILBERT G T, SPRAGG S P. Iodimetric determination of amylase iodine sorption: blue value //WHISTLER R L. Methods in carbohydrate chemistry[M]. New York: Academic Press, 1964: 168-169.
[8] 李 臻,赖富饶,吴 晖.葛根的营养成分分析[J]. 现代食品科技, 2011(08):1 010-1 019.
[9] 李海普,李 彬,欧阳明,等. 直链淀粉和支链淀粉的表征[J]. 食品科学,2010,11:273-277.
[10] 刘巧瑜, 赵思明, 熊善柏, 等. 稻米淀粉及其级分的凝胶色谱分析[J].分析检验, 2003, 24(3): 105-108.
[11] 程 科, 许永亮, 熊善柏, 等. 结晶法分离纯化大米直链淀粉[J]. 中国粮油学报, 2008, 23(2): 170-173.
[12] CHEETHAM N W H,TAO L.The effects of amylase content on the Molecular size of amylose,and on the distribution of amylopectin Chain length in maize starches[J].Carbohydrate Polymers,1997,33:251-261.
[13] CHEN Ming-hsuan,CHRISTINE J.Bergman method for determining the amylase content,molecular weights,and weight and molar-based distributions of degree of polymerization of amylase and fine-structure of amylopectin[J].Carbohydrate Polymers,2007,69:562-578.
(责任编辑:赵琳琳)
Separation of amylose and amylopectin from pueraria thomsonii
ZHANG Zhong, LIU Yi-fang
(Guangdong University of Petrochemical Technology,Maoming 525000,China)
Using pueraria thomsonii as raw material, we studied the separation process of amylose and amylopectin from pueraria thomsonii. According to the structural property and physicochemical property of amylose and amylopectin, we used butanol precipitation to separate amylose and amylopectin from pueraria thomsonii starch, and then n-butyl alcohol recrystallization to obtain high purity of amylose and amylopectin. The effect of pretreatment, extracting times, centrifugal time on separation effect were discussed. Through analyzing the characteristic of starch-iodine compound light absorption and blue value comparison method, the purity of amylose and amylopectin were studied. The results showed that the maximum absorption wavelength and blue value were in the corresponding numerical range under the condition of amylose extracting 5 times, amylopectin extracting 6 times, pretreatment and amylopectin purification conditions for 30 min ,5 000 r/min, which could get a higher purity of both amylose and amylopectin.
pueraria thomsonii;amylose;amylopectin;butanol precipitation;separating
2016-10-08;
2017-04-15
广东省科技计划(2015B020230001)。
张 钟(1962-),男,教授,研究方向为农产品贮藏与加工。
10.7633/j.issn.1003-6202.2017.05.009
TS236.9;TS235.5
A
1003-6202(2017)05-0033-04
