烟草α-西柏三烯二醇的分离及抑制HepG2细胞活性研究
2017-07-05毛新新侯小东杜咏梅袁晓龙颜培珍
毛新新,侯小东,杜咏梅,袁晓龙,颜培珍,
董维杰1,2,张继旭1,3,王红刚1,3,张忠锋1*
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京,100081;3.青岛农业大学,青岛266109)
烟草α-西柏三烯二醇的分离及抑制HepG2细胞活性研究
毛新新1,2,侯小东1,杜咏梅1,袁晓龙1,颜培珍1,
董维杰1,2,张继旭1,3,王红刚1,3,张忠锋1*
(1.中国农业科学院烟草研究所,青岛 266101;2.中国农业科学院研究生院,北京,100081;3.青岛农业大学,青岛266109)
为挖掘烟草中α-2,7,11-西柏三烯-4,6-二醇(α-CBD)在抗肿瘤活性方面的应用价值,从烟花中提取并分离获得α-CBD,以HepG2肿瘤细胞为材料,在体外培养条件下,分别应用噻唑蓝(MTT)法、集落形成试验和吉姆萨染色法研究了不同质量浓度(2.5~80 mg/L)的α-CBD对HepG2细胞增殖、生长和形态变化的影响。结果发现,α-CBD具有抑制HepG2细胞株增殖、降低细胞克隆形成并使细胞呈现凋亡形态的作用。说明烟草α-CBD具有抑制肿瘤细胞生长的活性,具有深度开发利用价值。
烟草;α-西柏三烯二醇;分离;抑制HepG2细胞活性
我国历代本草及国内外医药文献均对烟草的药用价值进行过论述,现代烟草化学研究表明,烟草中富含茄尼醇、绿原酸、西松烷二萜等具有重要医药、保健功能的活性成分[1]。
在我国,烟草主要是作为工业原料用于卷烟生产,研究其主要化学成分的活性及用途,使其向食品、保健品、医药等行业发展,有利于烟草种植业的可持续发展,发挥其潜在价值,具有十分重要的意义。
西松烷型二萜(cembranoid type diterpenes)是一种大环二萜类天然活性成分,由4个异戊二烯单元首尾相连组成,具有十四元环与3个对称分布的甲基和1个异丙基的母体骨架[2]。最先在松属植物和烟草中发现[3-5],随后从海洋生物中发现了多种该化合物[6]。烟草中的西松烷型二萜更多地存在于叶片和花的表面分泌物中,主要包含西柏三烯二醇[7]。α-西柏三烯二醇和β-西柏三烯二醇作为同分异构体,前者含量更高,是西松烷型二萜最主要的成分[8],而且具有良好的生物活性。AQIL等[9]研究发现西柏三烯二醇能够抑制白念珠菌等真菌以及金黄色葡萄球菌、枯草芽孢杆菌等细菌的生长,NACOULMA等[10]研究发现烟草中的西松烷二萜混合物能够抑制人脑胶质瘤细胞的增殖,MARTINS等[11]证明西柏三烯二醇具有神经保护作用。然而,肝细胞癌作为死亡率居世界第二的恶性肿瘤,近年来发生率逐步上升[12],烟草中西柏三烯二醇对肝癌HepG2细胞的抑制作用研究却鲜有报道。为探索烟草中西柏三烯二醇的抗肿瘤活性,充分利用烟草资源,作者从烟草中提取了西柏三烯二醇,以α-2,7,11-西柏三烯-4,6-二醇[(1S, 2E, 4S, 6R, 7E, 11E)-2, 7,11-Cembratriene-4,6-diol,α-CBD]为对象,体外作用于肝癌HepG2细胞,探究其抗肿瘤活性。
1 材料与方法
1.1材料与仪器
烟花样品于2014年7月采自山东省青岛市即墨试验基地,品种为中烟100。人肝癌HepG2细胞购自中国科学院细胞库。
Sephadex LH-20羟丙基葡聚糖凝胶(GE Healthcare公司),GF254柱层层析硅胶(青岛海洋化工公司),乙醇、正己烷、二氯甲烷,氯仿、丙酮、甲醇(分析纯,国药集团化学试剂有限公司),二甲基亚砜(DMSO,Sigma公司),胎牛血清(杭州四季青公司),溴化-3-(4,5-二甲基-2-噻唑基)-2,5-二苯基四氮唑盐(MTT,Sigma公司),MEM培养基(Hyclone公司),青链霉素双抗(Gibco公司),磷酸缓冲盐溶液(PBS, Sigma公司)。
RE-52AA旋转蒸发器(上海亚荣生化仪器厂),Bruker AVIII 600型核磁共振波谱仪(德国Bruker公司),Agilent 1260超高速液相色谱仪(Agilent公司),Multiskan FC酶标仪(Thermo公司),T-DH倒置显微镜(Nikon公司),HF90二氧化碳培养箱(Heal Force公司),SW-CJ-2FD医用超净台(Airtech公司),Centrifuge 5424 R低速离心机(Eppendorf公司)。
1.2方法
1.2.1 α-CBD的提取、分离 取新鲜烟草花序,用二氯甲烷室温下浸提3次,每次浸提时间1~2 s,将提取液合并,过滤,滤液以无水硫酸钠除去水分后减压浓缩,获得膏状粗提物。取粗提物10 g,用300 mL 70%乙醇溶解、离心,倾出上清液,沉淀以300 mL 70%乙醇洗涤2次,将上清液合并,减压浓缩至300 mL,加入石油醚萃取3次,每次300 mL,将石油醚层合并,浓缩得浅黄色西松烷二萜粗提物。取西松烷二萜粗提物1 g,进行硅胶柱层析分离,层析样品依次用5:1(V:V)和3:1(V:V)石油醚/乙酸乙酯洗脱,收集石油醚/乙酸乙酯(3:1,V:V)洗脱液第二馏分,浓缩后再经硅胶柱层析,用氯仿/丙酮(5:1,V:V)洗脱分离,获得无色油状单体化合物,在中国科学院化学物理研究所通过核磁共振波谱进行结构确认。
1.2.2 细胞培养与细胞增殖抑制率检测 人肝癌HepG2细胞用MEM培养基(含10%胎牛血清、1%青霉素+1%链霉素双抗),置于37 ℃、5% CO2饱和湿度的培养箱中培养,每2~3 d传代1次。收集对数期细胞,调整细胞密度为5×104个/mL,按100 μL/孔的量接种于96孔培养板中,培养12 h后,试验组加入α-CBD,使其终浓度为2.5、5、10、20、40、60、80 mg/L,对照组加入完全MEM培养基,每一浓度均设3个复孔,CO2培养箱中继续培养24、48和72 h,培养结束前4 h,每孔加入20 μL MTT溶液(5 mg/mL),放回培养箱内继续孵育4 h后,吸去上清液,然后每孔加入150 μL DMSO,震荡5 min,用酶联免疫测定仪检测波长为570 nm下每孔的吸光度(A)值[13],并计算细胞活力抑制率:
介绍一部研究天然气产业的专著:《低碳经济下中国天然气产业发展战略》… ……………… 周 鹏(6.封三)
细胞增殖抑制率=(1-试验组A570/正常对照A570)×100%。
1.2.3 细胞集落形成能力检测 按1.2.2培养和收集细胞,并调整细胞密度为5×104个/mL,接种于25 cm2培养瓶,培养12 h后,根据MTT检测结果,选择作用较为明显的浓度,加入α-CBD,设空白对照,继续培养48 h后,采用0.25% 胰酶消化并将细胞稀释至100~1000细胞/mL,接种于培养皿继续培养2周,吸除培养基,经PBS漂洗2遍后,加入10 mL无水甲醇固定10 min,经PBS漂洗2遍后,加入10 mL 0.01 mg/L吉姆萨染液染色,拍照并统计集落形成数[14]。
1.2.4 细胞形态观察 按上述方法培养和收集细胞,将HepG2细胞按5×104个/孔的浓度接种于24孔培养板中,加入上述培养基于37 ℃、5%CO2培养箱中培养。HepG2细胞到达对数期后,用含有不同质量浓度的α-CBD培养基进行全换液处理,同种条件下继续培养48 h后,经吉姆萨染色,在倒置光学显微镜下观察HepG2细胞的形态改变[15]。
1.3统计学处理

2 结 果
2.1 α-CBD的结构鉴定
经核磁共振波谱鉴定(图1),HR-ESI-MSm/z:329.2460 [M+Na]+,分子式为C20H34O3。1H NMR(400 MHz, measured in CDCl3):δH 1.72 (1H, m, H-1),5.36 (1H, dd,J= 8.6, 15.7 Hz, H-2), 5.37 (1H, m, H-3), 2.00 (1H, m, H-5α), 2.01 (1H, m, H-5β), 4.49 (1H, m, H-6), 5.36 (1H, d,J= 8.8 Hz H-7), 1.51 (1H, m, H-9α), 1.99 (1H, m, H-9β), 2.02 (2H, m, H-10), 5.04 (1H, m, H-11), 2.13 (2H, m, H-13), 1.68 (2H, m, H-14), 1.54 (1H, m, H-15), 0.83 (3H, d,J=5.8 Hz, H-16), 0.86 (3H, d,J= 5.8 Hz, H-17), 1.36 (3H, s, H-18), 1.71 (3H, s, H-19), 1.56 (3H, s, H-20);13C NMR (100 MHz, measured in CDCl3):δC46.43 (C-1, CH), 127.83 (C-2, CH), 137.58 (C-3, CH), 72.46 (C-4, C), 52.19 (C-5, CH2), 66.38 (C-6, CH), 130.61 (C-7, CH), 136.90 (C-8, C), 38.88 (C-9, CH2), 23.34 (C-10, CH2), 124.43 (C-11, CH), 133.43 (C-12, C), 36.82 (C-13, CH2), 27.97 (C-14, CH2), 33.02 (C-15, CH), 19.35 (C-16, CH3), 20.66 (C-17, CH3), 30.15 (C-18, CH3), 16.08 (C-19, CH3), 15.01 (C-20, CH3)。以上数据与文献[16]报道的数据对照基本一致,故鉴定化合物为α-CBD。

图1 α-CBD结构Fig. 1 Structure of α-CBD
2.2 α-CBD对HepG2细胞增殖抑制的影响
MTT试验结果显示(表1),α-CBD在体外对HepG2细胞具有明显的增殖抑制作用。α-CBD处理24 h后,对HepG2细胞的增殖抑制较弱;处理48 h 和72 h后,对HepG2细胞的抑制较强,而质量浓度大于60 mg/L时,抑制率变化不明显。作用48 h、72 h时,α-CBD对HepG2细胞的半数抑制质量浓度(IC50)分别为26.97、22.82 mg/L。
2.3 α-CBD对HepG2细胞集落形成能力的影响
与HepG2细胞对照组形成的克隆相比(图2),处理组HepG2细胞形成的克隆数随α-CBD浓度的增加而减少,20、40、60、80 mg/L浓度下的细胞克隆形成率分别为66.37%、55.16%、28.39%、0.00%。
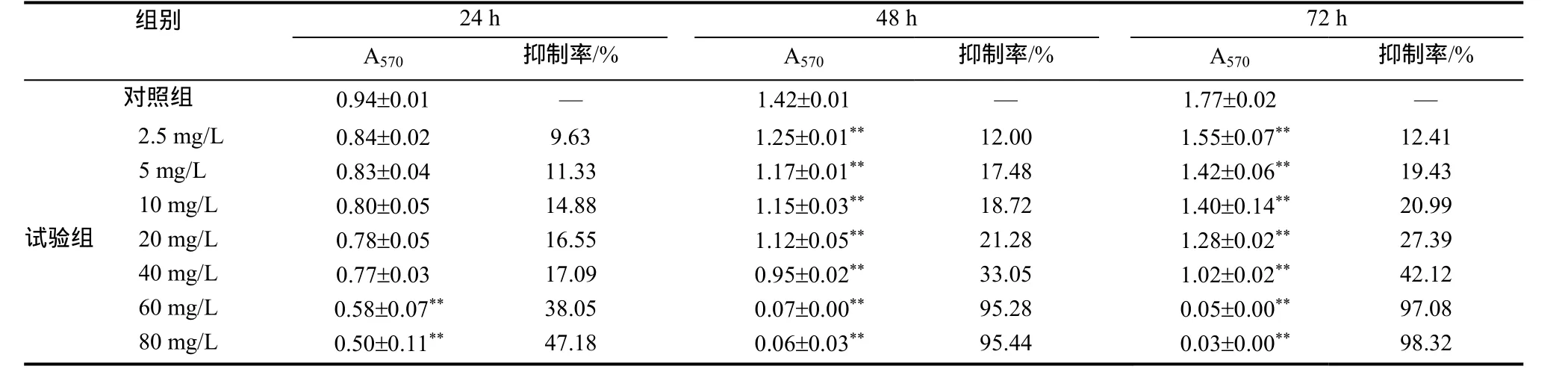
表1 α-CBD作用于HepG2细胞的增殖抑制率比较(n=3)Table 1 Comparison of prolifetation inhibition effects of HepG2 cells after α-CBD treatment
2.4 α-CBD对HepG2细胞形态的影响
光学显微镜下观察结果显示(图3),对照组细胞呈梭形、不规则多边形,细胞贴壁,生长均匀饱满;试验组HepG2细胞经质量浓度为20、40、60 mg/L的α-CBD处理,吉姆萨染色后,细胞皱缩、变圆、体积缩小,从皿壁脱落,悬浮于培养基中,呈现凋亡形态。

图2 α-CBD对HepG2细胞克隆形成能力的影响Fig. 2 Effects of α-CBD on colony formation of HepG2 cells
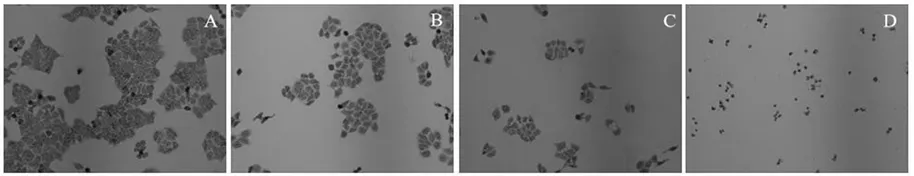
图3 α-CBD处理48 h对HepG2细胞形态变化的影响Fig. 3 Cell morphology changes of HepG2 cells after α-CBD treatment
3 讨 论
大多数抗肿瘤药物都能够抑制敏感肿瘤细胞的增殖,并且其抗肿瘤效果与细胞在药物诱导下发生增殖抑制的活性有关[17]。因此,细胞增殖抑制测定通常作为体外抗肿瘤药物和临床肿瘤敏感试验的第一步。MTT比色法、集落形成试验分别从细胞活力、克隆抑制能力两方面测定药物对肿瘤细胞增殖的抑制活性。在本试验的MTT比色法中,用IC50值作为衡量药物的增殖抑制能力的指标,数值越低,表明细胞对药物处理越敏感,而药物的增殖抑制能力越强。结果显示,不同质量浓度(2.5、5、10、20、40、60、80 mg/L)的α-CBD均对HepG2细胞增殖具有抑制作用,相比于24 h,作用48 h、72 h后,增殖抑制效果更为显著。而α-CBD的IC50值相较紫杉醇等抗肿瘤药物相比仍然较高[18],说明抑制效果不如紫杉醇,但仍有进一步研究价值。
通过MTT比色试验,证明α-CBD能够使细胞活力降低,进一步通过集落形成试验检测细胞克隆形成能力。费洪荣等[19]通过此试验方法测定了40 μmol/L告达庭和100 μg/L TRAIL联合应用能够明显抑制HepG2细胞增殖,史江颖等[20]证明了谷糠内、外壳结合态多酚均对HepG2细胞有明显的抑制效果,孙建超等[21]试验结果表明,5、25、50 μmol/L吴茱萸碱处理HepG2细胞,集落数明显少于对照组。在本试验中,随着α-CBD浓度的增加,HepG2细胞的克隆形成率逐渐降低,说明α-CBD能够抑制HepG2细胞的克隆形成能力,进而抑制细胞增殖。
恶性肿瘤形成的病理学基础是肿瘤细胞异常增殖、凋亡严重减退而造成的。就细胞调控机制而言,既需拮抗、抑制肿瘤细胞增殖,又需诱导促使细胞凋亡[22]。目前,许多抗肿瘤药物的主要作用机制之一就是诱导肿瘤细胞发生凋亡[23]。细胞凋亡主要的表现之一就是形态学改变,细胞形态学观察是判断细胞凋亡的最基本、最可靠方法[24]。胡琦等[25]用臭牡丹总黄酮、刘丽璇等[26]用丹参酮IIA、刘媛等[27]用海湾扇贝多肽混合物作用HepG2细胞,形态学观察结果显示细胞出现了细胞皱缩、变圆、体积缩小等凋亡特征。在本试验中,经α-CBD作用后,HepG2细胞发生的形态学变化与上述文献中的凋亡形态一致,表明α-CBD诱导HepG2细胞发生了凋亡。
α-CBD是烟草腺毛分泌物的主要化学成分,在烟草中含量丰富,具有丰富的原料资源。本研究表明,α-CBD培养基对HepG2细胞生长具有较好的抑制作用,具有作为先导化合物进行抗肿瘤药物创制的潜力,下一步还需应用化学或生物手段通过结构修饰进一步增强其对肿瘤细胞的抑制活性并明确其构效关系,为新型抗肿瘤药物的筛选提供研究基础,也为烟草活性成分的深度开发利用提供技术支撑。
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M].北京:科学出版社,1990.
[2] 孙汉董,黎胜红. 二萜化学[M]. 北京:化学工业出版社,2012.
[3] DAUBEN W G, THIESSEN W E, RESNICK P R. Cembrene, a 14-membered ring ditepene hydrocarbon[J]. J Am Chem Soc, 1962, 84(10): 2015-2016.
[4] KOBAYASHI H, AKIYOSHI S. Thunbergene, a macrocyclic diterpene[J]. B Kor Chem Soc, 1962, 35(6): 1044-1045.
[5] ROBERTS D L, ROWLAND R L. Macrocyclic diterpenes. α- and β- 4, 8, 13- Duvatriene-1, 3- diols from Tobacco[J]. J Org Chem, 1962, 27(11): 3989-3995.
[6] 任晋,苏亚伦. 西松烷型大环二萜类化合物研究进展[J]. 中草药,2014,45(20):2997-3008.
[7] SEVERSON R F, JOHNSON A W, JACKSON D M. Cuticular constituents of tobacco: factors affecting their production and their role in insect and disease resistance and smoke quality[J]. Adv Tob Sci, 1985, 11: 105-174.
[8] GUO Z, WAGNER G J. Biosynthesis of cembratrienols in cell-free extracts from trichomes of Nicotiana tabacum[J]. Plant Sci, 1995, 110(1): 1-10.
[9] AQIL F, ZAHIN M, SAYED K E, et al. Antimicrobial, antioxidant, and antimutagenic activities of selected marine natural products and tobacco cembranoids[J]. Drug Chem Toxicol, 2011, 34(2): 167-179.
[10] NACOULMA A P, MEGALIZZI V, POTTIER L R, et al. Potent antiproliferative cembrenoids accumulate in tobacco upon infection with Rhodococcus fascians and trigger unusual microtubule dynamics in human glioblastoma cells[J]. Plos One, 2013, 8(10): e77529.
[11] MARTINS A H, HU J, XU Z, et al. Neuroprotective activity of (1S,2E,4R,6R,-7E,11E)-2,7,11-cembratriene-4,6-diol (4R) in vitro and in vivo in rodent models of brain ischemia[J]. Neuroscience, 2015, 291: 250-259.
[12] MALUCCIO M, COVEY A. Recent progress in understanding, diagnosing, and treating hepatocellular carcinoma[J]. CA Cancer J Clin, 2012, 62(6): 394-399.
[13] 谭卫东,金红,罗弟祥,等. 抗肿瘤药物筛选中MTT法和SRB法的比较[J]. 天然产物研究与开发,1999,11(3):17-22.
[14] 丘仑兴,廖彩森,石强,等. 乳酸脱氢酶检测化疗药物敏感性与MTT法及集落形成试验的比较[J]. 中国肿瘤临床,1994,21(9):23-25.
[15] 孙倩,樊廷俊,邱月,等. 贝特舒对人角膜上皮细胞凋亡诱导作用的实验研究[J]. 山东大学学报(理学版),2013,48(7):14-19,28.
[16] OLSSON E, BERG J E, WAHLBERG I. Eight new cembranoids from tobacco: structural elucidation and conformational studies[J]. Tetrahedron, 1993, 49(22):4975-4992.
[17] MELET A, SONG K, BUCUR O, et al. Apoptotic pathways in tumorprogression and therapy[J]. Adv Exp Med Biol, 2008, 6(15): 47-79.
[18] 何松,沈薇,沈鼎明. 体外观察紫杉醇对肝癌HepG2细胞生长的影响[J]. 重庆医学,2003,32(3):268-270.
[19] 费洪荣,王桂玲,赵莹,等. 告达庭增强TRAIL诱导的HepG2细胞凋亡[J]. 中国病理生理杂志,2015,31(2):279-283.
[20] 史江颖,单树花,李宗伟,等. 谷糠结合态多酚对四种肿瘤细胞增殖的抑制作用[J]. 营养学报,2015,37(2):178-184.
[21] 孙建超,娄方方,史云,等. 吴茱萸碱对肝癌HepG2细胞侵袭和迁徙的影响[J]. 世界华人消化杂志,2015,23(10):1546-1552.
[22] FANG E F, ZHANG C Z, NG T B, et al. Momordica Charantialectin, a type II ribosome inactivating protein, exhibits antitumor activity toward human nasopharyngeal carcinoma cells in vitro and in vivo[J]. Cancer Prev Res, 2011, 5(1): 109-121.
[23] 程春旭,高颜茹. 抗肿瘤药物作用机制的研究进展[J].吉林医学,2009,30(23):3080-3083.
[24] 宋莹,王建刚,崔朝初,等. 壁虎粗多肽诱导人肝癌细胞HepG2凋亡的机制研究[J]. 中药材,2012,35(6):863-866.
[25] 胡琦,朱克俭,谭小宁,等. 臭牡丹总黄酮对人肝癌HepG2细胞增殖作用的实验研究[J]. 湖南中医杂志,2015,31(4):166-168.
[26] 刘丽璇,吴灵飞,邓巍,等. 丹参酮IIA对低氧条件下人肝癌HepG2细胞增殖、凋亡的影响及与HIF-1α、VEGF和野生型P53蛋白表达的关系[J]. 中国病理生理杂志,2014,30(12):2155-2160.
[27] 刘媛,王健,牟建楼,等. 海湾扇贝多肽混合物对人肝癌HepG2细胞增殖和凋亡的影响[J]. 食品科学,2015,36(23):257-261.
Isolation and Anti-HepG2 Activity Study of α-cembratriene -diol from Tobacco
MAO Xinxin1,2, HOU Xiaodong1, DU Yongmei1, YUAN Xiaolong1, YAN Peizhen1, DONG Weijie1,2, ZHANG Jixu1,3, WANG Honggang1,3, ZHANG Zhongfeng1*
(1. Tobacco Research Institute of CAAS, Qingdao 266101, China; 2. Graduate School of CAAS, Beijing 100081, China; 3. Qingdao Agricultural University, Qingdao 266109, China)
To investigate the anti-tumour activities of α-2,7,11- cembratriene-4,6 -diol (α-CBD) from tobacco, we isolated α-CBD from tobacco flowers. HepG2 cells were incubated with different concentrations of α-CBDin vitro. The inhibition rate on cell proliferation was determined with methylthiazolyldiphenyl -tetrazolium bromide (MTT) assay and colony formation assay. The change of morphology was observed with inverted microscope after Giemsa’s staining. The results indicated that, α-CBD from tobacco exhibited obvious inhibitive effects on the growth and colony forming rate of HepG2 cells. Typical morphology changes of apoptosis were observed. In summary, α-CBD from tobacco showed anti-tumor effects on HepG2 cells, which would have high value of further development and utilization.
tobacco; α-cembratriene-diol; isolation ; anti-HepG2 activity
TS41+3
1007-5119(2017)03-0080-06 DOI:10.13496/j.issn.1007-5119.2017.03.014
中国农业科学烟草研究所青年科学基金“烟草西松烷二萜体外抗肿瘤作用研究”(2015B04);中国农业科学院科技创新工程(ASTIP-TRIC05)
毛新新(1992-),女,在读硕士研究生,研究方向为植物功能成分。E-mail:mxxcaas@163.com。*通信作者,E-mail:zhangzhongfeng@caas.cn
2016-09-22
2017-02-04
