敲除TPX2基因可以降低乳腺癌干细胞活性及增加放疗敏感性
2017-07-03黄超有吴德华朱珊珊广州市番禺区何贤纪念医院乳腺甲状腺外科广东广州5400南方医科大学南方医院放疗科广东广州5055
黄超有,吴德华,韩 铮,朱珊珊广州市番禺区何贤纪念医院乳腺甲状腺外科,广东 广州 5400;南方医科大学南方医院放疗科,广东 广州5055
敲除TPX2基因可以降低乳腺癌干细胞活性及增加放疗敏感性
黄超有1,吴德华2,韩 铮1,朱珊珊11广州市番禺区何贤纪念医院乳腺甲状腺外科,广东 广州 511400;2南方医科大学南方医院放疗科,广东 广州510515
目的研究TPX2基因对乳腺癌干细胞活性及放疗敏感性的影响。方法使用蛋白质印迹法检测TPX2基因在乳腺癌细胞及组织中的表达情况。使用RT-PCR检测TPX2基因在乳腺癌组织及癌旁组织中的表达差异。使用慢病毒干扰载体建立稳定低表达TPX2蛋白的乳腺癌细胞。平板克隆、MTT试验验证TPX2对乳腺癌细胞生长能力的影响。流式细胞仪检测敲除TPX2之后对乳腺癌细胞凋亡比率的影响。检测CD44阳性细胞比例、肿瘤球形成能力以及侧群细胞比例,验证敲除TPX2之后对乳腺癌干细胞活性影响。结果TPX2基因在乳腺癌组织及细胞中表达水平明显升高(P<0.05)。敲除TPX2之后,可以使乳腺癌细胞生长能力减弱并促进细胞凋亡。TPX2敲除后,可以降低乳腺癌干细胞活性及提高放疗敏感性。结论TPX2为促进乳腺癌细胞生长的一个癌基因,其可通过提高乳腺癌干细胞活性来影响乳腺癌细胞的放疗敏感性。
TPX2;肿瘤干细胞;放疗敏感性;乳腺癌
近年来,随着乳腺外科手术技术和妇科肿瘤学的不断发展,乳腺癌的预后仍不容乐观,目前常规手术结合放化疗的综合治疗,其5年生存率只有54.5%[1]。恶性乳腺癌中的一小群乳腺肿瘤干细胞(BTSC)具有自我更新功能并呈现显著的放射抵抗性,是放射抵抗性的根源。CD44+作为乳腺肿瘤干细胞的一个重要标志物,在不同恶性级别的乳腺癌中比例不同,已有研究证实CD44+细胞是放疗抵抗的根源之一[2-3]。此外,还可以使用肿瘤球形成能力以及侧群细胞的比率来衡量BTSC的活性[4-7]。
TPX2是近年来研究比较热的一个基因,研究发现其在多种恶性肿瘤,如食管癌、肺癌、乳腺癌、宫颈癌、子宫内膜癌、人脑胶质瘤、唾液腺癌及卵巢癌中均有高表达,并且其高表达与肿瘤的生物学行为密切相关,阻断其表达可抑制肿瘤细胞的生长[8-10]。TPX2的下调在许多肿瘤细胞系中均导致细胞凋亡性死亡[11],但是TPX2在乳腺癌的表达情况、其与BTSC及乳腺癌细胞的放疗敏感性关系,尚未充分明确。
1 材料和方法
1.1 细胞培养
乳腺癌细胞株及永生化乳腺上皮细胞MCF-10A购买至上海中科院。所有细胞使用DMEM培养基(含10%胎牛血清),放置于含5%CO2的37 ℃的培养箱中培养。
1.2 实时荧光定量PCR及蛋白质印迹法试验
提取细胞RNA使用TRIzol试剂法(Invitrogen)。实时荧光定量PCR的试剂盒(qSYBR-green-containing PCR kit)购自上海吉凯。
提取细胞蛋白质后,使用蛋白质印迹法检测相关蛋白在细胞中的表达水平。TPX2以及GAPDH抗体购自santa cruz。二抗购自中杉金桥。ECL显色发光试剂盒购自康维世纪。
1.3 细胞凋亡试验
检测细胞凋亡试剂盒(FITC-PI双染色)购自凯基公司。细胞染色后,使用流式细胞仪检测相关凋亡情况。
1.4 构建低表达TPX2基因的乳腺癌细胞
根据TPX2基因(NM-1003620)序列,设计合成已证实能稳定沉默TPX2基因的片段(shTPX2)。使用PCR技术,将shTPX2基因片段构建到慢病毒载体(pLK0.1)中。包装慢病毒,使用慢病毒上清感染MCF7细胞。根据绿色荧光蛋白筛选出稳定感染的细胞。
1.5 裸鼠皮下成瘤实验
将裸鼠随机分成4组,每组5只。将1×106个细胞接种于裸鼠皮下,接种后5 d,按以下方式处理:第1组为空白对照组,第2组为单纯放疗组,第3组为sh-TPX2组,第4组为放疗+sh-TPX2组。肿瘤体积每3 d监测1次。肿瘤体积使用V=π/6(高度×长度×宽度)公式计算。
1.6 统计学处理
使用SPSS 13.0软件进行统计学分析。两组之间的差异使用两独立样本t检验。多组之间的差异使用方差分析。P<0.05为差异具有统计学意义。
2 结果
2.1 TPX2在乳腺癌细胞和组织中表达上调
本研究使用蛋白质印迹法试验检测TPX2在一系列乳腺癌细胞以及永生化乳腺上皮细胞MCF-10A表达的差异。结果提示,乳腺癌细胞株中TPX2的表达水平显著高于非癌细胞MCF-10A(图1,P<0.05)。实时荧光定量PCR试验结果提示:与癌旁组织相比,乳腺癌组织中TPX2显著升高。
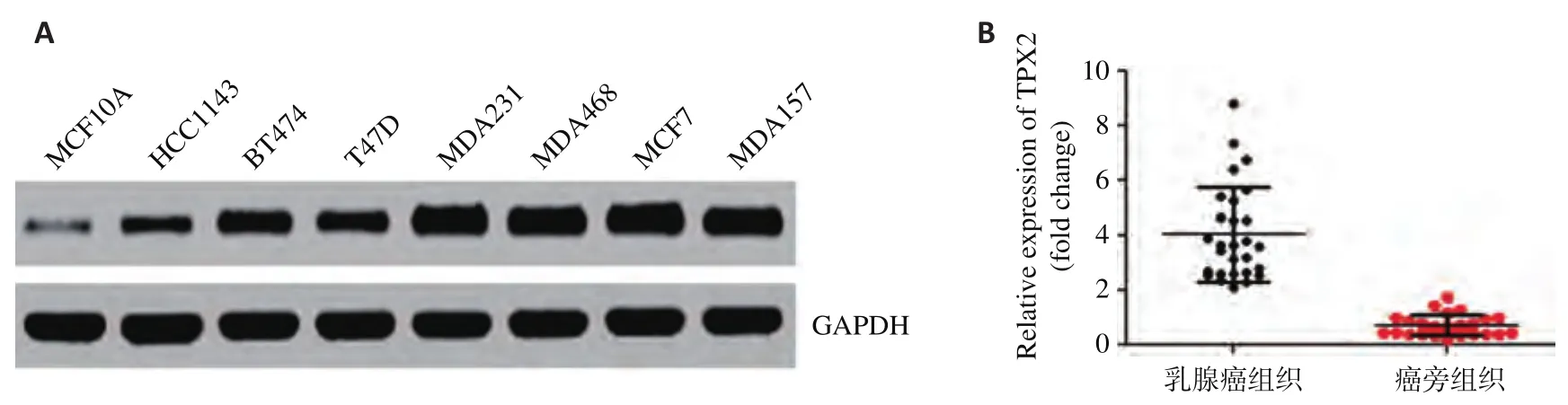
图1 TPX2在乳腺癌细胞和组织中表达
2.2 敲除TPX2可以抑制乳腺癌细胞增殖及促进凋亡
由于TPX2可能作为乳腺癌的一个促癌基因,本研究验证敲除TPX2之后,乳腺癌MCF-7细胞的相关功能变化。首先使用慢病毒感染MCF-7细胞,建立低表达TPX2蛋白的细胞株(图2A)。平板克隆试验发现:敲除TPX2蛋白后,MCF-7细胞形成克隆的数目和大小较空白对照组明显减弱(图2B,P<0.05)。MTT试验发现敲除TPX2蛋白后,细胞生长的速度明显减慢(图2C)。凋亡试验发现敲除TPX2蛋白后,可以促进MCF-7细胞的凋亡(图2D)。
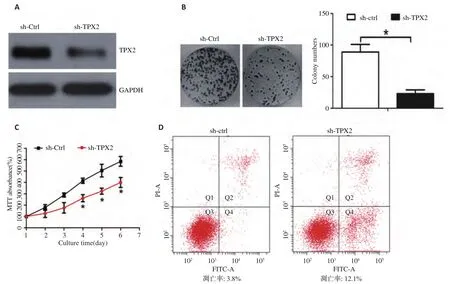
图2 敲除TPX2抑制乳腺癌细胞增殖及促进凋亡
2.3 敲除TPX2可以减低乳腺癌干细胞活性及提高放疗敏感性
进一步研究TPX2基因是否可以影响乳腺癌干细胞活性及放疗敏感性,发现敲除TPX2基因之后,MCF7细胞中CD44+细胞的比例明显下降(图3A)。同时,MCF7细胞中侧群细胞的比例(图3B),以及形成肿瘤球的能力(图3C)也是显著下降的。
研究TPX2基因是否可以影响乳腺癌细胞的放疗敏感性,结果发现敲除了TPX2基因之后,MCF7细胞对放疗的敏感性升高(图3D)。
2.4 体内试验
使用裸鼠皮下成瘤试验,验证敲除了TPX2基因之后,乳腺癌细胞生长能力及对放疗敏感性的变化情况。结果发现:TPX2基因敲除后,MCF7细胞皮下成瘤的能力下降。与对照相及单纯放疗组相比,敲除了TPX2基因之后可使放疗的敏感性增加(图4)。

图3 敲除TPX2减低乳腺癌干细胞活性及提高放疗敏感性

图4 敲除TPX2基因增加放疗敏感性
3 讨论
肿瘤干细胞能促使肿瘤细胞逃脱机体免疫系统的监控,从而导致肿瘤形成和无限生长。肿瘤干细胞能够耐受传统的细胞毒化疗和放射治疗,是肿瘤复发、转移及治疗耐受的根本原因。肿瘤干细胞和放疗抵抗密切相关:肿瘤干细胞对放疗产生抵抗的原因可以归结为以下几点:①放射通过引起DNA双链断裂和DNA-蛋白交联,最终导致细胞死亡。因此DNA的修复能力是影响细胞存活或者死亡的重要因素。肿瘤干细胞比普通肿瘤细胞具有更强的DNA修复能力,所以在相同的放疗剂量下,能够更好地存活[12]。②细胞周期可影响细胞对放疗的敏感性。一般而言,处于有丝分裂期(M期)的细胞对放疗相对敏感。肿瘤干细胞较长时间处于G0静滞期,相对处于休眠状态,细胞周期的推进较为缓慢,这导致了CSC对放疗的敏感性大大降低[13]。
乳腺癌细胞中存在一定比例的BTSC,这类细胞具有肿瘤干细胞活性。BTSC可能是乳腺癌细胞产生放疗抗性的根本原因,阻断BTSC的活性能够使乳腺癌患者对治疗更好的获益。目前,可以使用CD44表明抗原标记物,肿瘤球形成能力以及侧群细胞的比率来衡量BTSC的活性[14]。TPX2基因在很多实体瘤里面被普遍认为是一个促癌基因,比如:TPX2蛋白高表达和晚期透明细胞肾癌具有正相关性,是该类肾癌患者根治术后的预后预测指标之一[15]。TPX2蛋白高表达还可以通过活化AKT信号通路,从而促进胶质瘤细胞的生长和侵袭水平[16]。在胃癌中,TPX2蛋白可作为患者预后的指标,其水平升高预示患者预后不佳[17]。TPX2还可以促进肝癌细胞的增殖,抑制凋亡,并通过上皮-间充质转化导致肝癌细胞的侵袭[18]。但TPX2在乳腺癌中的表达情况及作用尚未充分明确。本研究发现,TPX2基因在乳腺癌组织及细胞中的表达水平都是升高的,其可能作为一个促癌基因。进一步的细胞功能发现,TPX2基因可以促进乳腺癌细胞的生长能力。而敲除TPX2基因之后,可以促进细胞的凋亡。本研究结果充分表明TPX2可以通过促进生长,抑制凋亡,从而导致肿瘤的发生和进展。有意思的是,敲除TPX2基因之后,还可以使乳腺癌干细胞的活性下调,从而使乳腺癌细胞的放疗敏感性增加。裸鼠体内试验结果与体外试验一致,充分肯定了TPX2基因可增加BTSC活性,及导致乳腺癌细胞产生放疗抗性。
基于TPX2在乳腺癌中的重要作用,本研究认为:靶向TPX2基因的治疗,有可能为克服临床上乳腺癌细胞的放疗抗性提供新的治疗思路。
[1]Wu SG, He ZY, Zhou J, et al. Serum levels of CEA and CA15-3 in different molecular subtypes and prognostic value in Chinese breast cancer[J]. Breast, 2014, 23(1): 88-93.
[2]Ricardo S, Vieira AF, Gerhard R, et al. Schmitt F and paredes J.breast Cancer stem cell markers CD44, CD24 and ALDH1:expression distribution within intrinsic molecular subtype[J]. J Clin Pathol, 2011, 64(11): 937-46.
[3]Weng D, Song B, Koido S. Immunotherapy of radioresistant mammary tumors with early metastasis using molecular chaperone vaccines combined with ionizing radiation[J]. J Immun, 2013,191(2): 755-63.
[4]Britton KM, Kirby JA. Cancer stem cells and side population cells in breast cancer and metastasis[J]. Cancers, 2011, 3(2): 2106-30.
[5]Hiraga T, Ito S, Nakamura H. Side population in MDA-MB-231 human breast cancer cells exhibits cancer stem cell-like properties without higher bone-metastatic potential[J]. Oncology reports,2011, 25(1): 289-96.
[6]Cao L, Zhou Y, Zhai B, et al. Sphere-forming cell subpopulations with cancer stem cell properties in human hepatoma cell lines[J].BMC Gastroent, 2011, 23(11): 71-6.
[7]Lombardo Y, de Giorgio A, Coombes CR. Mammosphere formation assay from human breast cancer tissues and cell lines[J]. J Vis Exp,2015, 9(7): 12-8.
[8]Wei P, Zhang N, Xu Y, et al. TPX2 is a novel prognostic marker for the growth and metastasis of colon cancer[J]. J Transl Med, 2013,11(6): 31-3.
[9]Neumayer G, Helfricht A, Shim SY, et al. Targeting protein for xenopus kinesin-like protein 2 (TPX2) regulates gamma-Histone 2AX (gamma-H2AX) levels upon ionizing radiation[J]. J Biol Chem, 2012, 287(50): 42206-22.
[10]Neumayer G, Belzil C, Gruss OJ, et al. TPX2: of spindle assembly,DNA damage response, cancer cellular and molecular life sciences[J]. CMLS, 2014, 71(16): 3027-47.
[11]Yang Y, Li DP, Shen N, et al. TPX2 promotes migration and invasion of human breast cancer cells[J]. Asian Pacif J Trop Med,2015, 8(12): 1064-70.
[12]Bao S, Wu Q, Mclendon RE, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J]. Nature, 2006, 444(20): 756-60.
[13]Shima H. Acquisition of G(0) state by CD34-positive cord blood cells after bone marrow transplantation[J]. Exp Hematol, 2010,38(12): 1231-40.
[14]Xun J, Wang DK, Shen L, et al. JMJD3 suppresses stem cell-like characteristics in breast cancer cells by downregulation of Oct4 independently of its demethylase activity[J]. Oncotarget, 2017,8(13): 21918-29.
[15]Glaser ZA, Love HD, Guo S, et al. TPX2 as a prognostic indicator and potential therapeutic target in clear cell renal cell carcinoma[J]. Urol Oncol, 2017, 13(5): 286-93.
[16]Gu JJ, Zhang JH, Chen HJ, et al. TPX2 promotes glioma cell proliferation and invasion via activation of the AKT signaling pathway[J]. Oncol Lett, 2016, 12(6, B): 5015-22.
[17]Liang B, Zheng WJ, Fang L, et al. Overexpressed targeting protein for Xklp2 (TPX2) serves as a promising prognostic marker and therapeutic target for gastric cancer[J]. Cancer Biol Ther, 2016,17(8): 824-32.
[18]Liang B, Jia CH, Huang Y, et al. TPX2 level correlates with hepatocellular carcinoma cell proliferation, apoptosis and EMT[J]. Dig Dis Sci, 2015, 60(8): 2360-72.
2017-02-06
黄超有,E-mail: cjbabay@126.com;
