6.0 Gy X射线辐照所致BALB/c小鼠造血系统损伤的动态检测
2017-07-03金宇林吴洁莹陆琰陈劲松李发
金宇林++吴洁莹++陆琰++陈劲松+李发涛++谢闺娥++吴韶清
[摘要] 目的 观察6.0 Gy X射线辐照对BALB/c小鼠造血系统的影响。 方法 将80只BALB/c小鼠随机分为对照组和辐照组,每组各40只。用直线加速器X射线对辐照组BALB/c小鼠进行一次性全身6.0 Gy X射线照射。照射后,每天记录小鼠体重和状况。辐照前和辐照后1、3、5、7、14、21、28 d检测小鼠外周血血象和骨髓有核细胞数的变化。 结果 与对照组相比,辐照组小鼠辐照后体重下降(P < 0.05),6 d后缓慢上升;外周血象中白细胞、红细胞、血小板和血红蛋白含量均下降(P < 0.05),分别于照射后5、14、14、14 d下降至最低值,然后回升;骨髓有核细胞数急剧下降(P < 0.05),于照射后5 d下降至最低值,而后逐渐上升。 结论 6.0 Gy X射线辐照可引起BALB/c小鼠造血系统损伤,其机体有一定的自我修复机制。
[关键词] X射线;BALB/c小鼠;外周血;骨髓有核细胞
[中图分类号] R14 [文献标识码] A [文章编号] 1673-7210(2017)05(a)-0013-04
Dynamic detection of 6.0 Gy X-irradiation induced the hematopoietic system damage in BALB/c mice
Guangzhou Women and Children's Medical Center, Guangzhou Medical University, Guangdong Province, Guangzhou 510623, China
[Abstract] Objective To observe the effects of 6.0 Gy X-irradiation on the hematopoietic system of BALB/c mice. Methods 80 BALB/c mice were randomly divided into control and irradiated groups, each group had 40 mice. The irradiated group mice received 6.0 Gy X-total body irradiation. Body weight and life condition were noted down everyday. Peripheral blood cell counts and bone marrow nucleated cell counts were measured before irradiation and at 1, 3, 5, 7, 14, 21, 28 d after total body irradiation. Results Compared with control group mice, the body weight of irradiated group mice decreased (P < 0.05), but slowly increased at 6 d post-irradiation. Compared with control group mice, the peripheral blood of irradiated mice had significant reduced in white blood cell, red blood cell, platelet counts and hemoglobin (P < 0.05), they respectively decreased to the lowest value at 5, 14, 14, 14 d post-irradiation and subsequently increased slowly. Compared with control group mice, the bone marrow nucleated cell counts of irradiated mice decreased sharply to the minimum value after 5 d post-irradiation (P < 0.05), and gradually increased. Conclusion 6.0 Gy X-irradiation can cause damage to the hemotopoietic system of BALB/c mice, and the body of mice has a certain self-repair mechanism.
[Key words] X-irradiation; BALB/c mice; Peripheral blood; Bone marrow nucleated cell
大劑量辐照能对机体产生一系列损伤效应,其中细胞分裂旺盛的造血系统对辐射损伤非常敏感,在机体受照射早期造血系统即可累及,且贯穿于照射损伤的始终,具有明显的时相性,射线所致造血功能障碍主要是由于造血干祖细胞增殖能力的抑制或丧失[1-4]。本实验旨在研究X射线辐照对BALB/c小鼠造血系统的损伤,通过对血液系统中白细胞、红细胞、血小板、血红蛋白及骨髓有核细胞数量进行密切监测,为建立造血系统辐射损伤小鼠模型提供新的实验资料。
1 材料与方法
1.1 试剂与仪器
无特定病原体级BALB/c小鼠80只,雌雄各半,8周龄,体重(20±2)g,由广东省医学实验动物中心提供,合格证号:SCXK(粤)2009-0011。辐照后的饲养、生长活动状态观察记录、血液和骨髓标本采集均在广东省医学实验动物中心完成。实验过程中,所有动物均在同等SPF级条件下饲养、自由饮水和摄食。血常规检测用Coulter-JT全自动血细胞分析仪(美国贝克曼库尔特)。辐照用瑞典ELEKTA公司生产的高能医用电子直线加速器治疗机由广东药学院附属第一医院放疗中心提供,型号:ELEKTA(5933)。
1.2 动物分组与处理
将BALB/c小鼠随机分成对照组及辐照组,每组各40只。对照组进行假照射,即搬运到照射地点但不进行X线照射;辐照组小鼠接受一次性剂量为6.0 Gy的X射线全身辐照,辐照条件:能量为8 Mev,源轴距(SAD)为100 cm,剂量率设为600 cGy/min。
1.3 指标观察
1.3.1 体重测量 辐射前和辐射后每天用电子天平称量并记录小鼠体重。
1.3.2 状态观察 辐射后每天早中晚定时观察并记录小鼠的生长活动状态,包括毛发光泽度、运动活力和精神状态。
1.3.3 血常规检测 分别于辐照前和辐照后1、3、5、7、14、21、28 d共8个时间点,在对照组及辐照组分别随机选择5只小鼠,眼球后静脉丛采集外周血100 μL,ETDA抗凝,用血细胞分析仪检测各时间点小鼠的血常规。
1.3.4 骨髓有核细胞测定 分别于辐照前和辐照后1、3、5、7、14、21、28 d共8个时间点,取血后采用颈椎脱臼法处死小鼠,取一侧股骨,去除肌肉组织,用1 mL细胞培养液将骨髓全部冲洗入抗凝管内,轻轻摇晃使得细胞分散均匀,制备成骨髓单细胞悬液,分别计数每只小鼠骨髓有核细胞数。
1.4 统计学方法
采用SPSS 16.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;以P < 0.05为差异有统计学意义。
2 结果
2.1 X射线辐射后小鼠体重的变化
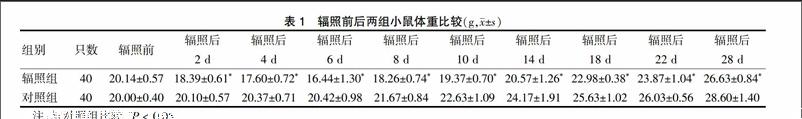
辐射组小鼠体重在辐照后先缓慢降低,在辐射后第6天达最低值,然后体重缓慢回升;辐照后的整个检测过程中,辐照组小鼠体重始终低于对照组,差异有统计学意义(P < 0.05)。见表1。
2.2 X射线辐射后小鼠生长活动状态的变化
与对照组相比,辐照组小鼠在辐射后3 d开始出现不同程度的被毛稀疏,精神萎靡;辐射后6 d部分小鼠出现脱毛,匍匐行走,体型消瘦;辐射后10 d小鼠脱毛处开始不同程度地长出新毛,活动能力增强;辐射后20 d小鼠基本恢复至正常水平。
2.3 X射线辐射后小鼠外周血血象的变化
2.3.1 X射线辐射后小鼠白细胞的数量变化 辐照后,辐照组小鼠外周血白细胞水平急剧下降,并且持续保持较低水平;辐照后第5天,白细胞水平达到最低值;辐照后7 d白细胞水平开始逐渐缓慢上升;但是整个检测过程中,辐照组小鼠外周血白细胞水平始终低于对照组,差异有统计学意义(P < 0.05);在辐照后28 d未能达到完全恢复。见表2。
2.3.2 X射线辐射后小鼠紅细胞的数量变化 辐照后,辐照组小鼠红细胞水平开始持续下降,直至辐照后14 d达最低水平,然后开始缓慢恢复。辐射组小鼠红细胞水平始终低于对照组,差异有统计学意义(P < 0.05)。见表2。
2.3.3 X射线辐射后小鼠血小板的数量变化 辐照后,辐照组小鼠血小板数量水平开始持续下降,第14天达到最低值,然后逐步上升;与对照组比较,辐照后1、3、5、7、14、21 d,两组差异有统计学意义(P < 0.05),直至28 d恢复至初始数量,两组差异无统计学意义(P > 0.05)。见表2。
2.3.4 X射线辐射后小鼠血红蛋白的数量变化 辐照组小鼠辐照后,血红蛋白的变化趋势类似红细胞的变化,第14天达到最低值,检测过程中,两组小鼠血红蛋白水平差异有统计学意义(P < 0.05)。见表2。
2.4 X射线辐射后小鼠骨髓有核细胞数的变化
X射线辐照后,BALB/c小鼠骨髓有核细胞数量急剧下降,在辐照后第5天下降至最低值,之后逐渐恢复,但在28天时,仍没有达到对照组水平。各时间点两组小鼠骨髓有核细胞数差异均有统计学意义(P < 0.05)。见表3。
3 讨论
目前,X射线广泛应用于生物医学领域中,大大推动了生物医学科研和临床的发展,如用于探测干细胞归巢的干细胞示踪和建立移植动物模型[5-6]。临床中,随着医疗设备的更新换代,原来临床使用的辐射源60Co已被更为精密控制的X线直线加速器所代替,X射线透视与X射线CT成像技术的应用更是挽救了成千上万人的生命[7-8]。放射诊断与治疗的新技术、新设备不断出现,在提高疾病诊治水平的同时,也增加了人们受电离辐射照射剂量的负担,从而会引起对人体不同程度的辐射损伤。本研究使用高能医用电子直线加速器治疗机一次性6.0 Gy剂量全身辐照BALB/c小鼠后,通过对辐照组和对照组BALB/c小鼠血液系统中白细胞、红细胞、血小板、血红蛋白及骨髓单核细胞数量进行密切监测,观察辐照对BALB/c小鼠造血系统的损伤,为造血系统辐射损伤小鼠模型建立提供新的实验资料,以期为干细胞移植修复辐射损伤后的造血系统研究提供基础理论数据。
X射线产生的电离辐射可使机体发生生理、病理和生化等方面的改变[9]。已有研究表明,电离辐射主要通过直接作用和间接作用两种方式对生物机体造成损害。直接作用是指电离辐射能量直接作用在生物体内大分子上,产生一系列破坏细胞膜的结构,降低酶类活性,甚至致使DNA单链或双链断裂等生物效应。间接作用是指电离辐射能量使生物体内的水分子生成两个自由基OH-和H+,进而通过一系列自由基链式反应,对生物体内活性大分子造成破坏,或产生各种氧化能力很强的自由基和过氧化物而破坏DNA合成[10-14]。
BALB/c小鼠的胃肠道对X射线的电离辐射具有较高的敏感性[15]。辐照早期可引起小肠黏膜上皮细胞受到损伤,辐照后期会导致小肠的运动、分泌功能降低,其中,小肠上皮隐窝细胞对辐射损伤最为敏感,大剂量的电离辐射导致小肠上皮隐窝细胞分裂停止、上皮细胞被破坏以及绒毛被覆上皮剥脱[16-17]。本研究中,6.0 Gy辐照组小鼠在辐照后各检测时间点的体重均低于对照组(P < 0.05),这与大剂量电离辐射后小鼠小肠上皮细胞受损,破坏了小鼠的胃肠道结构,导致BALB/c小鼠的小肠对营养吸收产生障碍,以及电离辐射对其他各相关组织器官损伤的综合影响有关。但在辐射6 d后小鼠体重逐步增加,有一定程度的恢复趋势,表明机体在辐射后有自我修复营养吸收功能能力。
造血系統是辐射损伤的敏感靶器官,机体受到照射后,造血祖细胞、造血干细胞以及造血微环境等都会产生与照射剂量相关的损伤,导致造血功能损害。辐射的直接损伤可加速血液系统细胞死亡。另外,当机体受到辐射时,在抗原刺激第一信号和第二信号的共同作用下,产生一系列的特异性和非特异性免疫应答,这种持久、过强的应答进一步加重组织细胞的损伤。高强度的辐射直接造成免疫系统损伤效应,而其修复功能又不足以弥补高剂量率辐射的损伤作用,从而出现CD3和CD4下调,CD25、CD69和CD95上调,以及一些免疫因子(如肿瘤坏死因子、白介素等)和免疫球蛋白的变化,使细胞凋亡明显增多。当血细胞数目下降,其抗感染、供能、止血等功能随之下降,可对机体造成不同程度的损伤[18]。白细胞减少是辐射损伤最为经典的指标。本研究中小鼠接受6.0 Gy X射线照射后白细胞急剧下降,而且恢复缓慢,红细胞、血红蛋白、血小板也有下降但没有白细胞显著,同时恢复也比白细胞快。同国内路璐等[19]报道的小鼠电离辐照后,血小板下降快,恢复慢不一致,可能是小鼠品种和射线种类不同所致。
骨髓对辐射高度敏感,辐射引起骨髓损伤必将导致骨髓造血细胞的变化。骨髓是主要的造血组织,骨髓有核细胞水平在一定程度上反映了骨髓造血能力。骨髓中的造血干细胞对辐照具有较高的敏感性,这些细胞绝大部分存在于骨髓组织内,少量存在于外周血循环中,具有高度自我复制及多向分化潜能,可维持重建造血功能[20]。射线照射既能降低造血干细胞的数量,引起骨髓储备力下降,削弱宿主的免疫功能,阻断有丝分裂,抑制细胞增殖,又能对组成造血微环境的血窦、内皮细胞、外膜网状细胞及吞噬细胞造成损伤,呈现细胞器肿胀、变形等超微结构的变化,导致造血干细胞出现缺陷,使自身复制的速率低于分化率,进而影响红细胞、白细胞及血小板的生成,诱发再生障碍性贫血。造血功能障碍是辐射损伤的主要表现之一,放射性骨髓损伤常导致骨髓抑制,造血功能衰竭,外周血细胞下降,导致生物体抗感染能力下降,明显出血、乏力、代谢紊乱等症状[21]。本研究中,辐照后,骨髓有核细胞数量急剧下降,导致血细胞数量的下降,5 d后骨髓有核细胞数量回升,是机体自我修复的结果,也是产生各种血细胞的前提条件。
综上所述,本研究动态观察了辐射损伤后BALB/c小鼠的体重、外周血血象和骨髓有核细胞数的变化以及其生活状态,X射线辐照对小鼠外周血象、骨髓细胞均造成了损伤,具有一定的时间效应关系,研究结果丰富了造血系统辐照损伤研究的实验资料。
[参考文献]
[1] 路璐,孟爱民.HSCs辐射损伤机制研究进展[J].生命科学,2015,27(2):161-167.
[2] Li D,Lu L,Zhang J,et al. Mitigating the effects of Xuebijing injection on hematopoietic cell injury induced by total body irradiation with γ rays by decreasing reactive oxygen species levels [J]. Int J Mol Sci,2014,15(6):10541-10553.
[3] Zhang H,Zhai Z,Wang Y,et al. Resveratrol ameliorates ionizing irradiation-induced long-term hematopoietic stem cell injury in mice [J]. Free Radic Biol Med,2013,54(1):40-50.
[4] Chang J,Feng W,Wang Y,et al. Whole-body proton irradiation causes long-term damage to hematopoietic stem cells in mice [J]. Radiat Res,2015,183(2):240-248.
[5] Liu J,Hao H,Xia L,et al. Hypoxia pretreatment of bone marrow mesenchymal stem cells facilitates angiogenesis by improving the function of endothelial cells in diabetic rats with lower ischemia [J]. PLoS One,2015,10(5):e0126715.
[6] Tong J,Ding J,Shen X,et al. Mesenchymal stem cell tran-splantation enhancement in myocardial infarction rat model under ultrasound combined with nitric oxide microbubbles[J]. PLoS One,2013,8(11):e80186.
[7] Chen T,Burke KA,Zhan Y,et al. IL-12 facilitates both the recovery of endogenous hematopoiesis and the engraftment of stem cells after ionizing radiation [J]. Exp Hematol,2007, 35(2):203-213.
[8] Halm BM,Franke AA,Lai JF,et al. γ-H2AX foci are increased in lymphocytes in vivo in young children 1 h after very low-dose X-irradiation:a pilot study [J]. Pediatr Radiol,2014,44(10):1310-1317.
[9] 周睿卿,何慧清,郭子文,等.X射线照射对小鼠辅助性T细胞相关细胞因子的影响[J].中华放射医学与防护杂志.2015,35(3):183-186.
[10] 林艳云,王峰,王海波,等.氮氧自由基化合物对60Co射线致BALB/c小鼠辐射损伤的防护作用[J].中华放射医学与防护杂志,2016,36(6):401-405.
[11] Eriksson D,Stigbrand T. Radiation-induced cell death mechanisms [J]. Tumour Biol,2010,31(4):363-372.
[12] Nugent SME,Mothersill CE,Seymour C,et al. Increased mitochondrial mass in cells with functionally compromised mitochondria after exposure to both direct gamma radiation and bystander factors [J]. Radiat Res,2007,168(1):134-142.
[13] Yamamori T,Yasui H,Yamazumi M,et al. Ionizing radiation induces mitochondrial reactive oxygen species production accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint [J]. Free Radic Biol Med,2012,53(2):260-270.
[14] Yamamori T,Ike S,Bo T,et al. Inhibition of the mitochondrial fission protein dynamin-related protein 1(Drp1)impairs mitochondrial fission and mitotic catastrophe after x-irradiation [J]. Mol Biol Cell,2015,26(25):4607-4617.
[15] 孙晓冬,刘春铃.低剂量电离辐射对组织器官影响的形态学实验研究[J].牡丹江医学院学报,2001,22(1):9-10.
[16] 丁桂榮,郭国祯,田芙蓉,等.电离辐射对小鼠小肠和结肠细胞凋亡的影响[J].辐射研究与辐射工艺学报,2000, 18(1):63-67.
[17] Gubina NE,Merekina OS,Ushakova TE. Mitochondrial DNA transcription in mouse liver,skeletal muscle,and brain following lethal x-ray irradiation [J]. Biochemistry,2010,75(6):777-783.
[18] Zhao QL,Kondo T,Noda A,et al. Mitochondrial and intracellular free-calcium regulation of radiation-induced apoptosis in human leukemic cells [J]. Int J Radiat Biol,1999,75(4):493-504.
[19] 路璐,张俊伶,李德冠,等.6Gy 137Cs射线照射对小鼠造血功能损伤的动态观察研究[J].国际放射医学核医学杂志,2015,39(5):393-396.
[20] Bigas A,Waskow C. Blood stem cells: from beginning to end [J]. Development,2016,143(19):3429-3433.
[21] 李德冠,樊赛军,孟爱民.辐射导致长期骨髓抑制的研究进展[J].国际放射医学核医学杂志,2015,39(4):324-327.
(收稿日期:2016-12-30 本文编辑:程 铭)
