不同细胞系表达的抗EGFR单抗糖基化结构对比分析
2017-07-01王冲郭怀祖
王冲,郭怀祖
不同细胞系表达的抗EGFR单抗糖基化结构对比分析
王冲1,郭怀祖2
1 上海药品审评核查中心,上海 201203 2 抗体药物与靶向治疗国家重点实验室,上海 201203

王冲, 郭怀祖. 不同细胞系表达的抗EGFR单抗糖基化结构对比分析. 生物工程学报, 2017, 33(6): 1018–1027.Wang C, Guo HZ. Characterization of N-glycosylation in an anti-EGFR monoclonal antibody produced by different expression systems. Chin J Biotech, 2017, 33(6): 1018–1027.
真核表达系统造就了单克隆抗体药物的广泛异质性,这些异质性通常是由翻译后修饰引起,而糖基化修饰则是关键的翻译后修饰,其对治疗性蛋白的安全性和有效性有着深远的影响,为探索细胞表达系统的改变对单抗糖基化所带来的影响,应用液相色谱-电喷雾离子化四极杆飞行时间质谱技术 (LC-ESI-Q-Tof),通过交替高低碰撞能量扫描、源内诱导解离及二级质谱的方法从释放的寡聚糖水平研究聚糖结构,对比分析由两种不同细胞系制备的抗表皮生长因子受体 (EGFR) 单抗,然后结合外切糖苷酶逐级消化的方法对两种蛋白的糖链结构作进一步确证分析。分析结果表明,在Fc区域的糖基化修饰,两种表达系统表达的该抗体未发生明显的改变,而在Fab区域,由小鼠骨髓瘤细胞SP2/0制备的抗EGFR单抗的聚糖结构中含有大量α半乳糖(α-Gal),且末端唾液酸形式主要是N-羟乙基神经氨酸 (NGNA),具有极高的免疫原性风险。而通过中国仓鼠卵巢细胞CHO表达系统制备的抗EGFR单抗Fab区域聚糖结构中不含有α-Gal,且末端唾液酸形式主要是N乙酰神经氨酸 (NANA),免疫原性风险极大降低。本研究在一定程度上可以预测由CHO 表达系统制备的抗EGFR单抗具备较好的临床耐受性,超敏反应发生风险低,CHO细胞可以作为该抗体改良型生物类似药 (Biobetter) 的优选表达系统。
细胞表达系统,糖基化,α半乳糖,免疫原性
糖基化是蛋白质的一种重要的翻译后修饰。蛋白质分子表面的糖链可对蛋白质分子的结构和功能产生深远的影响,糖基化作为重要的翻译后加工过程,对蛋白质的正确折叠、定位、免疫原性以及生物学活性有很大的影响[1]。单克隆抗体的糖基化聚糖结构与抗体效应功能之间密切相关,Fc段作为单抗的效应功能区与FcRs结合发挥抗体依赖细胞毒 (ADCC) 作用、激活Clq发挥补体依赖的细胞毒 (CDC) 作用、与新生儿受体 (Neonatal Fc receptor,FcRn) 结合介导清除作用,糖基化修饰通过影响功能区的结合来调节ADCC、CDC以及半衰期[2]。糖基化作用还会影响单抗的安全性,特别是非人源聚糖,具有潜在的免疫原性[3]。特别是存在于 Fab功能区的聚糖可以同时影响此类药物的安全性和有效性特征,某些情况下还可以影响单抗的聚集性[4]。糖基化修饰高度依赖于细胞表达系统和亚克隆选择,细胞培养过程中的诸多因素,如培养基的成分、培养条件均会影响糖基化[5],进而影响治疗性蛋白的生物学活性、疗效、免疫原性以及药代动力学[6-7]。
中国仓鼠卵巢细胞 (Chinese hamster ovary,CHO)和小鼠骨髓瘤细胞 (NS0,SP2/0) 表达系统已经成为当前治疗性抗体和Fc-融合蛋白的金标准哺乳动物工程细胞[8]。据统计,目前已批准上市的治疗性单抗中,48%表达于CHO细胞、而45%表达于鼠源细胞 (21% NS0细胞、14% SP2/0细胞、10%杂交瘤细胞)。尽管多肽链的完整性在不同的表达系统和培养条件下一般不会发生变化,但翻译后修饰特别是糖基化类型以及比例的重大改变仍不容忽视[9]。
Cetuximab (商品名Erbitux®),是一种特异性靶向细胞表皮生长因子受体 (EGFR) 的重组人鼠嵌合单克隆抗体,被多个国家批准用于转移性结直肠癌和头颈鳞状细胞癌治疗。然而有研究报道,该药在临床应用中超敏反应发生率极高,大多数发生超敏反应的患者血清中存在药物特异性的IgE抗体,该IgE抗体特异性抗α-Gal[10]。进一步的研究发现,Erbitux®由哺乳动物细胞 (小鼠骨髓瘤细胞SP2/0) 培养制备获得,这种鼠源细胞系含有一种额外的α-1,3半乳糖苷转移酶,主要介导半乳糖残基从α构象的UDP-Gal转移到末端半乳糖残基上,进而生成α-Gal。α-Gal是一种不良的非人类二糖,发现存在于某些单抗的聚糖上,特别是鼠源细胞系内表达的单抗中[11-13]。某些患者体内存在高水平的抗α-Gal IgE抗体,如果使用聚糖中含有α-Gal单元的单抗进行治疗,就会出现严重的超敏反应。
中国仓鼠卵巢细胞CHO糖基化的机制同人类的IgG糖基化机制作用十分相似,早期研究认为CHO细胞缺乏合成含有α-Gal表位糖蛋白的生物合成机制[14],新近研究报道CHO细胞中存在α-1,3半乳糖苷转移酶基因,但在克隆选择过程中此基因处于无表达或低表达状态[15],α-1,3半乳糖苷转移酶基因在CHO细胞系中的激活机制尚不清楚,推测可能同其他糖苷转移酶相似,与转染过程相关[16]。而对于Cetuximab在两种表达系统中的糖型研究的报道还比较少,正是基于此,我们选择CHO表达系统制备出和Cetuximab一致氨基酸序列的抗 EGFR 单抗,从而用于评估抗EGFR单抗在两种不同的表达系统中的糖基化差异。在糖基化修饰的评估中,我们应用液相色谱-电喷雾离子化四极杆飞行时间质谱技术 (LC-ESI-Q-Tof),通过交替高低碰撞能量扫描、源内诱导解离及二级质谱的方法在游离寡聚糖水平研究聚糖结构,同时进行对比分析,并结合外切糖苷酶逐级消化的方法对两种不同的细胞表达系统制备的单抗的糖链结构作进一步确证分析。结构解析证实由小鼠骨髓瘤细胞SP2/0制备的Erbitux®(以下简称Cetuximab-SP2/0) 的聚糖结构中含有大量α-Gal,且末端唾液酸形式主要是NGNA,具有极高的免疫原性风险。而通过CHO表达系统制备的抗EGFR单抗 (以下简称Cetuximab-CHO) 的聚糖结构中未检出α-Gal,且糖链末端唾液酸形式主要是NANA,免疫原性风险极大降低。随着Cetuximab-CHO进一步的临床开发,可在大规模的临床试验中予以进一步验证,有望为潜在的超敏反应患者带来最大的益处,同时Cetuximab-CHO有望成为一种改良型生物类似药,而CHO细胞具有作为该抗体改良型生物类似药优选表达系统的潜力。
1 材料与方法
1.1 材料
氨水、乙酸、甲醇购自国药化学试剂公司;乙腈(ACN, MS级)、甲酸(FA, MS级) 购自美国Fisher Scientific公司;碘化钠、亮氨酸脑啡肽、血纤肽、DTT购自美国Sigma公司;超纯水 (18.2M) 取自Millipore公司Milli-Q系统;PNGase F、Endo F2购自上海迈泰君奥生物技术有限公司;α-galactosidase购自Megazyme,Erbitux®购自Merck KgaA公司。
1.2 主要仪器设备
Agela SPE-01自动固相萃取系统、固相萃取柱Cleanert HILIC柱购自天津艾杰尔公司;Sephadex G-25 Fine脱盐胶及XK26/40柱购自美国GE公司;Amide柱 (Acquity UPLC BEH)、质谱仪(Xevo G2 QTof)、数据处理软件 (Biopharmalynx)、超高效液相色谱系统 (Acquity UPLC) 购自美国Waters公司;SORVALL RC-6离心机购自美国Thermo公司;真空冻干机 (CHRIST真空冻干机) 购自德国Christ公司。
1.3 实验方法
取两个蛋白样品各1.0 mg,在20 mmol/L PB pH 7.0的缓冲液中分别加入糖苷酶PNGase F、EndoF2及α-galactosidase,37 ℃水浴24 h,分别取上述酶切产物,加入3倍体积冰乙醇,冰浴20 min,13 000 r/min高速离心5 min,弃沉淀,取上清,冻干。将冻干好的各寡糖样品,在30 %醋酸+70 % DMSO反应体系中进行2-AB标记寡糖,65 ℃避光干浴3–4 h后终止。以HILIC固相萃取柱脱盐,同时去除过量的2-AB。ACQUITY UPLC BEH Amide 1.7 μm 2.1 mm×100 mm正相柱,柱后质谱分析。液相条件:0–40 min,流动相 50 mmol/L甲酸胺,流速为0.5 mL/min,柱温保持在60 ℃。Ion Mode离子化模式ESI+,质谱扫描范围(/):50–4 000。
2 结果与分析
单抗在糖苷酶作用下得到游离糖链,经荧光标记后分别通过LC/MS、MS/MS及寡糖外切酶分析。研究结果表明,两种不同的细胞表达系统制备的单抗均具有两个糖基化位点,且均发生了糖基化;两种不同的表达系统,其Fc段上的糖链种类及比例未发生明显的变化,均以G0F、G1F以及G2F为主,符合CHO细胞的常见糖型[17];但在Fab区域的糖基化修饰,两种表达系统表达出的抗EGFR抗体的糖链结构具有显著的差别,不仅糖型比例具有差异性,在糖型的种类上也具有显著差异。由CHO表达系统制备的单抗Fab段上的糖链结构以唾液酸NANA为主,且糖链不含有α-Gal;而SP2/0表达系统的单抗Fab段上的糖链结构以唾液酸NGNA为主,且糖链含有大量的α-Gal。
2.1 LC/MS分析重链Fc段的糖链结构
重链Fc段上的寡糖经糖苷酶PNGase F酶切获得 (在非变性的条件下,Cetuximab Fab区域的糖基化修饰由于空间位阻不能被PNGase F酶切,仅有Fc区域的糖基化可以被PNGase F酶切),酶切下来的糖链用2-AB进行标记 (还原胺化) 后经过UPLC HILIC柱液相分离,进入荧光检测器。通过串联的质谱,正离子模式下使2-AB标记的寡糖离子化后带正电荷,进行质谱分析测定各寡糖峰的质量,进而对糖链的结构进行初步定性。
如图1所示,两种不同的细胞表达系统制备的抗EGFR单抗的重链Fc段上具有相同的糖链结构,同时具有相似的各糖型组分比例,在高甘露糖 (Man5) 的比例上,Cetuximab-CHO含量更少,提示其具有更小的免疫原性及血浆清除风险[18]。主要为9种主要的寡糖:G0F-GlcNAc、G0、G0F、Man5、(1,6)G1、(1,3)G1、(1,6)G1F、(1,3)G1F以及G2F。重链Fc段上的各寡糖色谱峰保留时间几乎完全一致,各寡糖实测分子量几乎完全一致,并且同理论质量一致。

总之,通过LC/MS方法初步表明两种不同的细胞表达系统制备的单抗的重链Fc段上具有相同的糖链结构,均为岩藻糖化的复杂型双触角结构,以2个、1个、0个3种半乳糖存在形式为主,符合文献报道的Fc段N-糖的特征[19]。
2.2 LC/MS分析重链Fab段的糖链结构
重链Fab段上的寡糖可以在非变性情况下经糖苷酶EndoF2酶切获得,酶切下来的糖链用2-AB进行标记 (还原胺化) 后经过UPLC HILIC柱液相分离,进入荧光检测器。通过串联的质谱,正离子模式下使2-AB标记的寡糖离子化后带正电荷,进行质谱分析测定各寡糖峰的质量,进而对糖链的结构进行初步定性。
如图2所示,Cetuximab-SP2/0的重链Fab段上主要为8种主要的寡糖:G0(F)、(1,6)G1(F)、(1,3)G1(F)、G2(F)、G2(F)+αGal、G2(F)+2αGal、G2(F)+αGalNGNA以及G2(F)+2NGNA. Cetuximab- CHO的重链Fab段上则主要为6种主要的寡糖:G0(F)、(1,6)G1(F)、(1,3)G1(F)、G2(F)、G2(F)+NANA以及G2(F)+2NANA。两种不同的细胞表达系统制备的单抗重链Fab段上的各寡糖实测质量均与理论分子量一致。
总之,通过LC/MS方法检测,初步表明两种不同的细胞系统制备的单抗重链Fab段上具有不同的糖链结构,由CHO表达系统制备的单抗Fab段上的糖链结构以唾液酸NANA为主,且糖链不含有α-Gal;而SP2/0表达系统的单抗Fab段上的糖链结构以唾液酸NGNA为主,且糖链含有大量的α-Gal、NGNA和α-Gal均为非人寡糖,具有较大的免疫原性风险,特别是α-Gal处在Fab区域时,其免疫原性风险更大,而在Fc区域时由于空间位阻效应,其免疫原性风险则比较低[20]。

2.3 寡糖外切酶分析重链Fab段的糖链结构
上述研究结果初步表明,Cetuximab-CHO单抗Fab段上的糖链不含有α-Gal,而Cetuximab-SP2/0单抗Fab段上的糖链含有大量的α-Gal。本研究中,在通过糖苷酶切获得重链Fab段上的寡糖基础上,进一步应用寡糖外切酶α半乳糖苷酶,酶切产物用2-AB进行标记 (还原胺化) 后经过UPLC HILIC柱液相分离,进入荧光检测器。通过串联的质谱,正离子模式下使2-AB标记的寡糖离子化后带正电荷,进行质谱分析测定各寡糖峰的质量,通过对比分析α半乳糖苷酶切前后的各寡糖峰的变化对糖链的结构作进一步定性,以进一步确证Cetuximab-SP2/0单抗中α-Gal的存在及Cetuximab-CHO单抗中α-Gal的缺失。
如图3所示,Cetuximab-SP2/0单抗Fab段上的寡糖在经过α半乳糖苷酶切前后,其各寡糖峰发生了变化,含有α-Gal的寡糖因丢失了末端α-Gal而导致寡糖峰消失。其中,G2(F)+αGal和G2(F)+2αGal寡糖在α半乳糖苷酶的作用下丢失了末端α半乳糖,变成G2(F),因此,在α半乳糖苷酶切后,G2(F)+αGal和G2(F)+2αGal寡糖峰消失,而G2(F)寡糖峰峰高增加;而G2(F)+αGalNGNA寡糖在α半乳糖苷酶的作用下丢失了末端α半乳糖,变成G2(F)+NGNA,因此,在α半乳糖苷酶切后,G2(F)+αGalNGNA寡糖峰消失,而出现G2(F)+NGNA这个新的寡糖峰(图4)。


图4 荧光色谱图积分法定量对比分析Cetuximab-SP2/0重链Fab段上的寡糖经α半乳糖苷酶处理前后的相对比例
同样,采用α半乳糖苷酶对Cetuximab-CHO 单抗Fab段上的寡糖进行处理。如图5所示,Cetuximab-CHO单抗Fab段上的寡糖在经过α半乳糖苷酶切前后,其各寡糖峰没有发生明显的糖型种类变化 (图6)。说明在Cetuximab-CHO上不存在可检测的α-Gal修饰。总之,通过寡糖外切酶α半乳糖苷酶的方法进一步表明:Cetuximab-CHO单抗Fab段上的糖链不含有α-Gal,而Cetuximab-SP2/0单抗Fab段上的糖链含有大量的α-Gal。

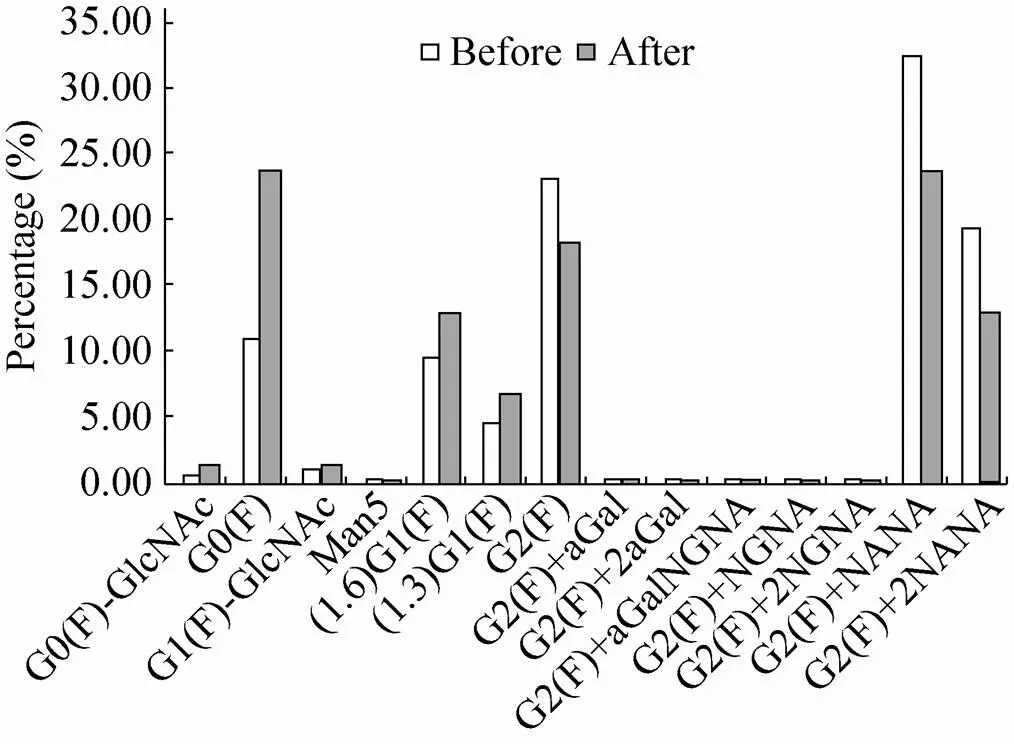
图6 荧光色谱图积分法定量对比分析Cetuximab-CHO重链Fab段上的寡糖经α半乳糖苷酶处理前后的相对比例
3 讨论
ESI-MS和MALDI-MS质谱方法常常用于寡糖结构的分析,并且通常与UPLC、HPLC、CE等分离技术相串联[21]。为了进一步确证寡糖的结构信息,如连接、分支、差向异构等,通过MS/MS获得寡糖的碎片信息以及寡糖外切酶法均被广泛应用于寡糖的结构研究领域[22-23]。本研究分别通过LC/MS及寡糖外切酶法对比分析两种不同的细胞系表达抗EGFR抗体的重链Fc段和Fab段上的寡糖结构,以进一步探索细胞表达系统的改变对单抗Fc区域以及Fab区域糖基化所带来的影响。研究表明不同的表达系统 (SP2/0和CHO) 对于抗EGFR单抗Fc区域糖型的影响显著性不大,而Fab区域的糖型发生了显著性改变,非人类二糖α-Gal寡糖以及唾液酸NGNA大量存在于SP2/0细胞表达的单抗中,而CHO细胞表达的单抗中未发现α-Gal寡糖及NGNA,仅存在唾液酸NANA。
另外,鼠源细胞系糖基化同人IgG糖基化的不同之处在于,一方面具备产生α-Gal表位的蛋白生物合成机制[24],另一方面鼠源细胞系产生NGNA,而并不是产生NANA。NGNA和NANA的区别是NGNA有1个额外的氧原子,并且,糖蛋白中若含有NGNA残基,被认为与其在人体中的免疫原性密切相关[25]。一些已上市的治疗型糖蛋白因为含有NGNA残基而在病人体内引起严重的不良反应。本研究通过对比研究表明由SP2/0细胞表达的单抗末端唾液酸以异常的唾液酸NGNA为主,而由CHO细胞表达的单抗末端唾液酸以正常唾液酸NANA为主。
关于通过SP2/0作为细胞表达系统的抗EGFR单抗的结构研究,Qian等应用oMALDI Qq-TOF MS的方法对Erbitux®的寡糖结构进行具体的表征,研究结果表明其寡糖结构多样,含有不同程度的唾液酸NGNA和α-Gal[26]。Ghaderi等研究结果证实了该单抗中NGNA的存在,并发现来自正常人血清中的抗NGNA抗体能够与单抗发生NGNA特异性反应并在体外产生免疫复合物;通过给NGNA合成缺陷的小鼠体内注射该单抗,小鼠体内能够产生抗NGNA抗体,并且体内循环抗NGNA抗体能够促进药物清除。Yang等通过对该单抗电荷异质性的研究中发现其含有NGNA和α-Gal。本研究中关于由小鼠骨髓瘤细胞SP2/0制备的抗EGFR单抗的糖基化研究结果同文献报道的结果一致。
本研究开发了一套有效的方法通过LC/MS及寡糖外切酶法对比分析两种不同细胞表达系统的抗体重链Fc段和Fab段上的寡糖结构,结果表明由CHO细胞表达系统制备的抗EGFR单抗Fc区域的糖型种类及比例和SP2/0差异性不大,高糖甘露糖型比例稍低;但对于Fab区域的糖型影响较大,主要为不含有α-Gal寡糖结构,且末端唾液酸以正常唾液酸NANA为主。抗体的结构与功能是不可分的两个方面,在CHO细胞系统表达的该单抗产物Fab糖基化修饰 (糖链结构) 的不同也许会导致它们的功能不同,特别是其抗原性发生巨大差别直至影响其安全性和有效性,从糖型的类型来看,其改变是朝着降低免疫原性的方向进行,但最终还是要靠临床结果来检验。目前CHO细胞表达的该药物正处在临床试验阶段,安全性和有效性的确切结果还有待最终的临床结论予以进一步确证,其有望为潜在的超敏反应患者带来益处,同时Cetuximab-CHO有望成为一种改良型生物类似药,而CHO细胞则具有作为该抗体改良型生物类似药优选表达系统的潜力,该系统也可以应用于其他改良型生物类似药的开发。
[1] Zhang PQ, Woen S, Wang TH, et al. Challenges of glycosylation analysis and control: an integrated approach to producing optimal and consistent therapeutic drugs. Drug Discov Today, 2016, 21(5): 740–765.
[2] Higel F, Seidl A, Sörgel F. N-glycosylation heterogeneity and the influence on structure, function and pharmacokinetics of monoclonal antibodies and Fc fusion proteins. Eur J Pharm Biopharm, 2016, 100: 94–100.
[3] Batra J, Rathore AS. Glycosylation of monoclonal antibody products: current status and future prospects. Biotechnol Prog, 2016, 32(5): 1091–1102.
[4] Courtois F, Agrawal NJ, Lauer TM, et al. Rational design of therapeutic mAbs against aggregation through protein engineering and incorporation of glycosylation motifs applied to bevacizumab. MAbs, 2016, 8(1): 99–112.
[5] Zhu JW. Mammalian cell protein expression for biopharmaceutical production. Biotechnol Adv, 2012, 30(5): 1158–1170.
[6] Pacis E, Yu M, Autsen J, et al. Effects of cell culture conditions on antibody-linked glycosylation-what affects high mannose 5 glycoform. Biotechnol Bioeng, 2011, 108(10): 2348–2358.
[7] Hossler P, Khattak SF, Li ZJ. Optimal and consistent protein glycosylation in mammalian cell culture. Glycobiology, 2009, 19(9): 936–949.
[8] Beck A, Wagner-Rousset E, Bussat MC, et al. Trends in glycosylation, glycoanalysis and glycoengineering of therapeutic antibodies and Fc-fusion proteins. Curr Pharm Biotechnol, 2008, 9(6): 482–501.
[9] Kunert R, Reinhart D. Advances in recombinant antibody manufacturing. Appl Microbiol Biotechnol, 2016, 100(8): 3451–3461.
[10] Chung CH, Mirakhur B, Chan E, et al. Cetuximab-induced anaphylaxis and IgE specific for galactose-α-1,3-galactose. N Eng J Med, 2008, 358(11): 1109–1117.
[11] Galili U. The α-gal epitope (Galα1-3 Galβ1-4GlcNAc-R) in xenotransplantation. Biochimie, 2001, 83(7): 557–563.
[12] Dor FJMF, Cheng J, Alt A, et al. Gal1,3Gal expression on porcine pancreatic islets, testis, spleen, and thymus. Xenotransplantation, 2004, 11(1): 101–106.
[13] Magnusson S, Månsson JE, Strokan V, et al. Release of pig leukocytes during pig kidney perfusion and characterization of pig lymphocyte carbohydrate xenoantigens. Xenotransplantation, 2003, 10(5): 432–445.
[14] Jenkins N, Parekh RB, James DC. Getting the glycosylation right: implications for the biotechnology industry. Nat Biotechnol, 1996, 14(8): 975–981.
[15] Bosques CJ, Collins BE, Meador JW, et al. Chinese hamster ovary cells can produce galactose-α-1,3- galactose antigens on proteins. Nat Biotechnol, 2010, 28(11): 1153–1156.
[16] Potvin B, Kumar R, Howard DR, et al. Transfection of a human alpha-(1,3)fucosyltransferase gene into Chinese hamster ovary cells. Complications arise from activation of endogenous alpha-(1, 3)fucosyltransferases. J Biol Chem, 1990, 265(3): 1615–1622.
[17] Reusch D, Haberger M, Maier B, et al. Comparison of methods for the analysis of therapeutic immunoglobulin G Fc-glycosylation profiles-part 1: separation-based methods. mAbs, 2015, 7(1): 167–179.
[18] Abès R, Teillaud JL. Impact of glycosylation on effector functions of therapeutic IgG. Pharmaceuticals, 2010, 3(1): 146–157.
[19] Jefferis R. Glycosylation of recombinant antibody therapeutics. Biotechnol Prog, 2005, 21(1): 11–16.
[20] Lammerts van Bueren JJ, Rispens T, Verploegen S, et al. Anti-galactose-α-1,3-galactose IgE from allergic patients does not bind α-galactosylated glycans on intact therapeutic antibody Fc domains. Nat Biotechnol, 2011, 29(7): 574–576.
[21] Ruhaak LR, Zauner G, Huhn C, et al. Glycan labeling strategies and their use in identification and quantification. Anal Bioanal Chem, 2010, 397(8): 3457–3481.
[22] Kamoda S, Ishikawa R, Kakehi K. Capillary electrophoresis with laser-induced fluorescence detection for detailed studies on-linked oligosaccharide profile of therapeutic recombinant monoclonal antibodies. J Chromatogr A, 2006, 1133(1/2): 332–339.
[23] Fernández LEM, Kalume DE, Calvo L, et al. Characterization of a recombinant monoclonal antibody by mass spectrometry combined with liquid chromatography. J Chromatogr B, 2001, 752(2): 247–261.
[24] Sheeley DM, Merrill BM, Taylor LCE. Characterization of monoclonal antibody glycosylation: comparison of expression systems and identification of terminal α-linked galactose. Anal Biochem, 1997, 247(1): 102–110.
[25] Tangvoranuntakul P, Gagneux P, Diaz S, et al. Human uptake and incorporation of an immunogenic nonhuman dietary sialic acid. Proc Natl Acad Sci USA, 2003, 100(21): 12045–12050.
[26] Qian J, Liu T, Yang L, et al. Structural characterization of N-linked oligosaccharides on monoclonal antibody cetuximab by the combination of orthogonal matrix-assisted laser desorption/ionization hybrid quadrupole-quadrupole time-of-flight tandem mass spectrometry and sequential enzymatic digestion. Anal Biochem, 2007, 364(1): 8–18.
(本文责编 郝丽芳)
Characterization of N-glycosylation in an anti-EGFR monoclonal antibody produced by different expression systems
Chong Wang1, and Huaizu Guo2
1 Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China 2 State Key Laboratory of Antibody Medicine and Targeted Therapy, Shanghai 201203, China
The use of mammalian expression systems results in a remarkable heterogeneity of mAb products, generally due to post-translational modifications, and glycosylation is a critical post-translation modification because it has a profound impact on the safety and efficacy of mAbs. The present study was designed to explore the impact of a different expression system on mAb N-glycosylation. The detailed structures of individual glycans between anti-EGFR monoclonal antibodies produced by different expression systems were successfully characterized at the level of free oligosaccharides using liquid chromatography electrospray ionization quadrupole time-of-fight mass spectrometry (LC-ESI-QTof MS). An alternating low and elevated collision energy scan, in source collision-induced dissociation and MS/MS in combination with exoglycosidase digestion method was also adopted. The combined data revealed that the Fab region of anti-EGFR antibody produced by CHO cell expression system had a pattern of glycosylation differing from that of the SP2/0 cell expression system whereas the Fc region remained basically unchanged. We confirmed that anti-EGFR antibody produced by SP2/0 cell expression system had a much more diverse mixture of glycans with α-Gal and an undesired, aberrant form of sialylation N-glycolylneuraminic acid (NGNA). The α-Gal was absent in mAb produced by CHO cell expression system containing sialic acid predominantly N-acetyl neuraminic acid (NANA) which is the desired, normal human-type sialylation. This study theoretically predicts that anti-EGFR antibody produced by CHO cell expression system may show better clinical tolerance, and very low potential for active hypersensitivity reactions, CHO cell lines can be the preferred expression system for producing anti-EGFR biobetter.
cell expression system, glycosylation, α-Gal, immunogenicity
10.13345/j.cjb.170074
February 26, 2017; Accepted:April 6, 2017
Chong Wang. Tel: +86-21-35325298; Fax: +86-21-50121712; E-mail: 18049823057@163.com
Supported by: R&D Public Service Platform (No. 16DZ2292900), Industry School Research Medicine (No. 16DZ1910400), Scientific Instrument Field (No. 16142201700), Enterprise International Cooperation Projects (No. 16430730400), Biological Medicine Field of Shanghai Science and Technology Support Program (Nos. 16431904100, 16431901200, 16431904700), The Shanghai “Phosphor” Youth Science and Technology Program (No. 16QB1404300).
研发公共服务平台 (No. 16DZ2292900),产学研医 (No. 16DZ1910400),科学仪器领域 (No. 16142201700),企业国际合作项目 (No. 16430730400),上海市生物医药领域科技支撑项目 (Nos. 16431904100, 16431901200, 16431904700),上海青年科技启明星项目 (No. 16QB1404300) 资助。
网络出版时间:2017-05-03
http://kns.cnki.net/kcms/detail/11.1998.Q.20170503.1658.006.html
