水稻基因ST1的克隆及原核表达
2017-06-28覃永华
覃永华,沙 干,明 金,丁 烨
(中南民族大学 生命科学学院,国家民委生物技术重点实验室,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
水稻基因ST1的克隆及原核表达
覃永华,沙 干,明 金,丁 烨
(中南民族大学 生命科学学院,国家民委生物技术重点实验室,武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
指出了基因ST1是决定水稻柱头和花柱形成的关键基因,属于水稻中的XHS基因家族. 将ST1的全长cDNA序列构建到原核表达载体pET-28a中,并转化了表达菌株大肠杆菌BL21. 经Western bolt验证表明:所表达80 kD蛋白即为目的蛋白,为后续的蛋白功能等研究提供了实验基础.
水稻;ST1基因;原核表达;聚丙烯酰胺凝胶电泳;蛋白免疫印记
XHS基因是植物中特有的基因[1],在其他的物种中尚未发现. 目前仅从大豆、拟南芥及水稻3种植物中完整地分离出XHS基因[2]. 逆境胁迫后组织表达谱分析发现,多数水稻OXHS基因在受干旱、盐、冷、ABA等多种胁迫后显著诱导[3],并在幼穗各发育时期和雄蕊、雌蕊等花器官中表达最强,表明OXHS基因在水稻幼穗发育和逆境中具有重要的功能.
ST1蛋白属于水稻OXHS家族,是一个典型的XHS蛋白,编码700个氨基酸,含有保守的XH、XS、Zf-XS以及Coiled-Coil 4个结构域[2]. 前期研究发现水稻ST1蛋白在水稻雌蕊发育中发挥着重要作用,缺失ST1导致水稻雌蕊发育严重退化.
本实验通过构建ST1的原核表达载体并转化大肠杆菌BL21菌株,诱导表达ST1蛋白为后续ST1的抗体制备以及深入研究ST1的调控网络提供重要基础.
1 材料与方法
1.1 材料
日本晴水稻幼苗、大肠杆菌DH5α、大肠杆菌BL21、原核表达载体pET-28a。
1.2 试剂
ReverTra Ace-α高效反转录试剂盒、及凝胶回收试剂盒(Axygen)、rTaq酶、NotⅠ和SalⅠ限制性内切酶以及 T4 连接酶(Takara).
1.3ST1全长cDNA序列的扩增
1.3.1 水稻幼叶总RNA提取和cDNA合成
使用Trizol试剂盒(Thermo Scientific 公司)提取水稻幼叶总RNA. 取3 μg总RNA,利用反转录试剂盒ReverTra Ace-α(TOYOBO 公司)得到水稻幼叶cDNA.
1.3.2ST1的全长cDNA序列的扩增
利用特异引物F: 5′Sal1 taaGTCGAC TGAGTTACAAGAGGCCAGA3'/R: 5′Not1 taaGCGGCCGC ATACCTAGCACCAATACCCA3′,以水稻幼叶cDNA为模板,PCR扩增目的片段. PCR反应程序:94 ℃变性 5 min;循环程序 94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸2 min,35个循环;72 ℃延伸8 min. 纯化回收PCR产物,连入中间载体PGEM-T,测序验证鉴定[4].
1.4 构建重组表达载体
利用SalⅠ和NotⅠ酶切载体pET28a,电泳检测后切胶回收对应大小的载体片段,使用T4 DNA连接酶连接外源片段与载体,16 ℃过夜连接. 重组质粒热激转化大肠杆菌DH5α,挑取阳性克隆提取质粒,使用PCR和酶切法检测重组载体[5,6].
1.5 融合蛋白的诱导表达
将pET28a-ST1重组质粒转入大肠杆菌BL21中,涂布1∶1000的Amp抗性的LB固体培养基,挑取单菌落至含有2 mL LB的试管内,37 ℃,180 r/min震荡培养至OD600到0.6左右,加入IPTG至终浓度为0.2 mmol/L,在15 ℃的培养温度下,分别诱导培养6、8、12、20 h后,收集菌体,同时以pET-30a空载体作为阴性对照[7-9].
1.6 融合蛋白的检测
收集菌体,弃上清. 使用2 mL PBS缓冲液重悬菌体细胞,超声波破碎细胞. 4 ℃12000 r/min 离心20 min,分别收集蛋白质上清和沉淀,SDS-PAGE电泳检测[10].
电泳结束后,将另一侧凝胶取出,用半干法[11]将蛋白样品转入NC膜中. 于50 mL封闭液中,脱色摇床封闭1 h. 转入杂交袋中,加入1∶1000的一抗杂交液,脱色摇床4 ℃孵育过夜,用TBST洗膜1次,再用TBS洗膜2次,每次10 min. 加入带有His标签的二抗,25 ℃杂交箱中杂交1 h,用TBST洗膜1次,再用TBS洗膜2次,每次10 min,洗脱背景. 杂交结束后,将滤膜置于凝胶成像仪内,避光均匀滴加1 mL ECLA 和ECLB的1∶1混合液,避光反应2~3 min后,曝光检测化学发光信号[12].
2 结果与分析
2.1 目的基因片段的获取
目的基因ST1片段经电泳检测,结果如图1所示,片段长度约为2100 bp,与目的基因片段理论长度一致. 外源片段连入中间载体pMD18-T,经测序验证序列与目的基因ST1完全一致.

M) DL 15000;1) 目的片段图1 目的片段ST1的扩增Fig.1 Amplification of the target fragment ST1
2.2 重组载体的构建
构建载体热激转化培养,挑单克隆在Kan抗性的LB培养液中过夜培养,提取质粒,经酶切检测得到阳性质粒(图2), 经测序验证序列与目的基因ST1完全一致,证明载体构建成功.

M) DL 15000;1) 阳性质粒的酶切检测图2 阳性质粒的酶切检测Fig.2 Detection of positive plasmids
2.3 ST1蛋白的诱导表达和鉴定
活化表达重组菌,分别经过0.2 mmol/L IPTG的诱导6、8、12、20 h后,聚丙烯酰胺凝胶电泳检测发现(图3),相比对照,各诱导表达ST1蛋白的条带并没有观察到明显的目的条带,无法判断ST1蛋白是否表达. 进一步通过His标签抗体,利用Western blot鉴定ST1是否真实表达(图4). 各诱导表达条件下在80 kD处均能观察到单一的条带,与预期蛋白大小一致,同时发现沉淀中融合蛋白比上清中的中的略大. 随着培养时间的增加,融合蛋白的表达呈现先上升后下降,在12 h时有最高的表达量. 实验结果表明目的蛋白在大肠杆菌中通过不同浓度的IPTG的诱导均能表达. 在SDS-PAGE胶观察不明显可能是由于80 kD处内源蛋白的干扰,无法通过肉眼观察到.
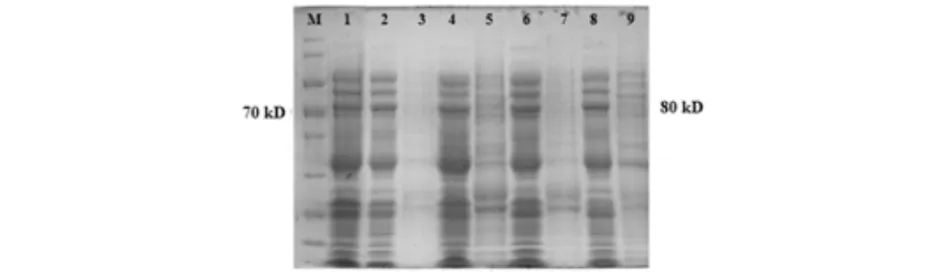
1)空载体pET-28a;2)6 h 上清;3)6 h 沉淀;4)8 h 上清; 5)8 h 沉淀;6)12 h 上清;7)12 h 沉淀;8)20 h 上清;9)20 h 沉淀图3 蛋白ST1在大肠杆菌中的诱导表达Fig.3 Inducible expression of protein ST1 in E.coli
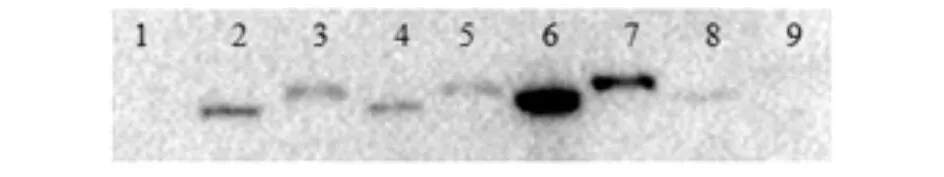
1)空载体pET-28a;2)6 h上清;3)6 h沉淀;4)8 h清; 5)8 h沉淀;6)12 h上清;7)12 h沉淀;8)20 h上清;9)20 h 沉淀图4 Western blot鉴定结果图Fig.4 Results of Western blot identification
3 讨论
ST1基因是水稻XHS家族的典型保守成员,生物信息学分析显示ST1蛋白是一个核蛋白. 前期研究发现ST1是参与水稻雌蕊发育的关键调控因子,但其具体作用机制仍不太清楚.
本实验发现在15 ℃、12 h、IPTG浓度为0.2 mmol/L的条件下,ST1蛋白在重组菌的表达量最高. 且上清液中蛋白的表达量高于沉淀的表达量,由此可以推测ST1蛋白为可溶性蛋白质[13].
值得关注的是,Western blot检测结果发现上清和沉淀中表达的目的融合蛋白分子量大小存在差异,沉淀中表达蛋白的分子量比上清中的蛋白分子量要大,推测其原因应该是由于蛋白表达定位不同,在细胞内不同区域的蛋白由于在翻译的过程中处于不同的环境,所以表达的产物会有不同的修饰过程,或特定的氨基酸序列的剪切,导致最终表达蛋白大小存在差异[14].
本次实验成功表达出所需的目的蛋白ST1,为后续大量表达与纯化,抗体的制备,以及蛋白的功能研究提供了实验基础.
[1] 陈红梅.大豆XHS基因家族生物信息学分析[J].大豆科学, 2015, 34(3):384-388.
[2] Qin Y, Ye H, Ning T, et al. Systematic identification of X1-homologous genes reveals a family involved in stress responses in rice [J]. Plant Molecular Biology, 2009, 71(4):483-496.
[3] Zhang Z, Chen Y, Zhao D, et al. X1-homologous genes family as central components in biotic and abiotic stresses response in maize (ZeamaysL.) [J]. Functional & Integrative Genomics, 2014, 14(1):101-110.
[4] 王 宁,谷守芹,范永山,等.玉米大斑病菌STK1原核表达载体的构建及其表达[J].中国农业科学,2010,34(18):3876-3881.
[5] 姚国新,卢 磊.水稻粒重基因定位克隆研究[J].安徽农业科学,2007,35(27):8468-8478.
[6] 丁 勇,常 玮,刘小烛.甘蓝型油菜BnClo1基因克隆、表达载体的构建及原核表达[J].中国农业科学,2010, 34(2):10-15
[7] 周佳平. 绿竹及拟南芥SEP3蛋白原核表达、纯化及寡聚体分析[D].杭州:浙江农林大学, 2013.
[8] 张国辉,仵均祥.梨小食心虫普通气味结合蛋白2(GmolGoBP2)cDNA的克隆与原核表达[J].西北农林科技大学学报(自然科学版), 2016, 44(6):111-115.
[9] 郑丽洁,林 军,黄先忠.小拟南芥双键还原酶基因OPDBR的克隆及表达分析[J].石河子大学学报(自然科学版)2015(2):251-258.
[10] 邵吉民,郑 树,耿礼仪.大肠癌相关基因ST13的原核表达及鉴定[J].浙江大学学报(医学版), 2001, 30(6):252-255.
[11] 戈林泉,周国鑫,王 祺,等.水稻β-石竹烯合成酶基因OsCAS的克隆鉴定、原核表达及其遗传转化[J].浙江大学学报(自然科学版), 2009, 35(4):365-371.
[12] 吴云华, 肖 虔. 重组拟南芥细胞色素P450 707A3在大肠杆菌中的原核表达[J]. 中南民族大学学报(自然科学版), 2017(1):28-31.
[13] 刘新琼, 徐玮玉, 刘早利,等. 水稻 OsAAA1蛋白的原核表达载体构建及其可溶性表达研究[J]. 中南民族大学学报(自然科学版), 2015(2):18-22.
[14] 李双红, 谌 鑫, 程 钢,等. 水稻可溶性OsVDAC5蛋白的外源表达及鉴定[J]. 湖北农业科学, 2016(11):2921-2925.
Cloning and Prokaryotic Expression of Rice GeneST1
QinYonghua,ShaGan,MingJin,DingYe
(Hubei Province Key Laboratory for the Plant Germplasm Conservation and Utilization of Wuling Mountainous Area,Key Laboratory for Biotechnology of National Commission for Nationalities, College of Life Sciences,South-Central University for Nationalities,Wuhan 430074,China)
Rice geneST1, a member ofXHSfamily, is a key gene in development of rice stigma and style. In this paper, prokaryotic expression vector pET-28a with full-length cDNA of geneST1was constructed and transformed into expression strainE.coliBL21. One 80 kD protein was expressed inE.coliand identified to be ST1 protein by Western bolt with GST antibody. The results provide important preparation for ST1 antibody and further research for molecular mechanism of ST1 in development of rice stigma and style in protein level.
rice;ST1 gene; prokaryotic expression; SDS-PAGE ; Western blot
2017-03-31
覃永华(1979-),男,副教授,博士,研究方向:水稻逆境分子生物学,E-mail:qinyonghua@mail.scuec.edu.cn
国家自然科学基金青年基金资助项目(31201091),中央高校专项重点项目(CZZ17005)
Q785
A
1672-4321(2017)02-0035-03
