对苯二胺功能化磁性氧化石墨烯吸附双酚A的应用研究
2017-06-27汤小胜董昌金
汤小胜 ,汤 平,董昌金
(1.食用野生植物保育与利用湖北省重点实验室 &生命科学学院,湖北师范大学,湖北 黄石 435002;2. 湖北理工学院环境科学与工程学院,矿区环境污染控制与修复湖北省重点实验室, 湖北 黄石 435003)
对苯二胺功能化磁性氧化石墨烯吸附双酚A的应用研究
汤小胜1,汤 平2,*,董昌金1
(1.食用野生植物保育与利用湖北省重点实验室 &生命科学学院,湖北师范大学,湖北 黄石 435002;2. 湖北理工学院环境科学与工程学院,矿区环境污染控制与修复湖北省重点实验室, 湖北 黄石 435003)
完成了对苯二胺(PPD)功能化的磁性氧化石墨烯复合纳米粒子(PPD-MGO)的合成及应用于吸附去除水体中双酚A的研究。考察了吸附时间、溶液温度和pH值等对吸附双酚A过程的影响,以及吸附动力学和热力学参数。结果表明,PPD-MGO纳米材料对于双酚A具有良好的吸附效果和重复性。在45°C,pH为7的条件下对双酚A的最大吸附量达155.0 mg/g . 采用新的纳米材料经过三次连续吸附,对双酚A可达99.2%的去除率。在循环使用五次后,纳米材料的吸附容量保持为初始吸附容量的94%. 实验显示对双酚A的吸附过程符合准二级动力学方程以及Freundlich吸附等温线模型。
对苯二胺;磁性氧化石墨烯;双酚A ;吸附
面对目前水环境污染的问题,将废水进行处理回收利用是解决水短缺问题的办法之一。而在废水回收过程中,将其中的污染物,特别是微量污染物进行去除是很有必要的[1~3]。微量污染物虽然浓度低,但是大都不易降解,容易通过食物链进行富集,从而对动物和人类产生危害[4]。
双酚A是一个典型的环境干扰化合物,它是一个重要的化工产品中间体,主要是作为合成聚碳酸酯类化合物和环氧树脂的原料,以及阻燃剂等其它特殊产品[5]。双酚A的应用较为普遍,在世界范围的许多产品中都有它的存在,特别是许多的塑料制品,如塑料杯、金属罐、手机等物品。根据许多的文献报道,双酚A对人体具有极大的危害,通过塑料杯子、包装袋、纸张和塑料盘等制品逐步释放到环境中[6]。双酚A具有雌激素活性,这种雌激素潜力可以干扰或者模拟人体的雌激素行为并产生副作用,从而影响人体的生长发育[7]。越来越多的证据也表明低浓度的双酚A依然对环境存在危险,因此,需要研究出高效的吸附分离材料对废水中的双酚A进行有效地吸附分离,从而最大程度地降低其对环境和人体的影响[8]。
复合磁性纳米材料将若干不同的纳米材料通过各种方式复合,使其具有多种功能,有效地复合可以使各个纳米材料发挥各自的作用,从而达到实验目的[9]。磁性纳米粒子由于具有独特的磁响应功能,响应结束后可以通过外加磁场,如一个简单的磁铁进行磁分离,磁性纳米粒子的使用可以大大缩减实验的工作量,简化操作步骤。氧化石墨烯材料具有非常大的比表面积、热稳定性以及独特的二维结构,是一类很好的吸附载体[10,11]。对苯二胺的修饰可以使得纳米材料表面有较多的氨基,通过正负电荷的吸引作用可以提高对目标物,诸如双酚A的吸附作用。磁性复合纳米材料在吸附及分离方面已有不少报道,许多功能化的复合纳米材料都达到了很好的效果,被广泛用在废水处理,污染物监测等领域,具有很高的研究及应用价值[12]。
本文研究了对苯二胺(PPD)功能化的Fe3O4磁性纳米粒子(PPD-MN)的合成,将其复合在氧化石墨烯表面形成PPD修饰的磁性氧化石墨烯(PPD-MGO),并应用于水体中双酚A的吸附研究。由于PPD含有苯环和氨基基团,PPD在复合纳米材料的功能化修饰可以提高吸附材料与目标物的相互作用。本文考察了pH值、温度和时间对双酚A吸附作用的影响,以及PPD-MGO复合纳米材料在吸附方面的重复性,测定了PPD-MGO复合纳米材料吸附双酚A的吸附动力学和热力学参数。实验结果表明PPD-MGO复合纳米材料对于双酚A具有较高的吸附容量和可再生性能。
1 实验部分
1.1 仪器及试剂

表1 主要仪器
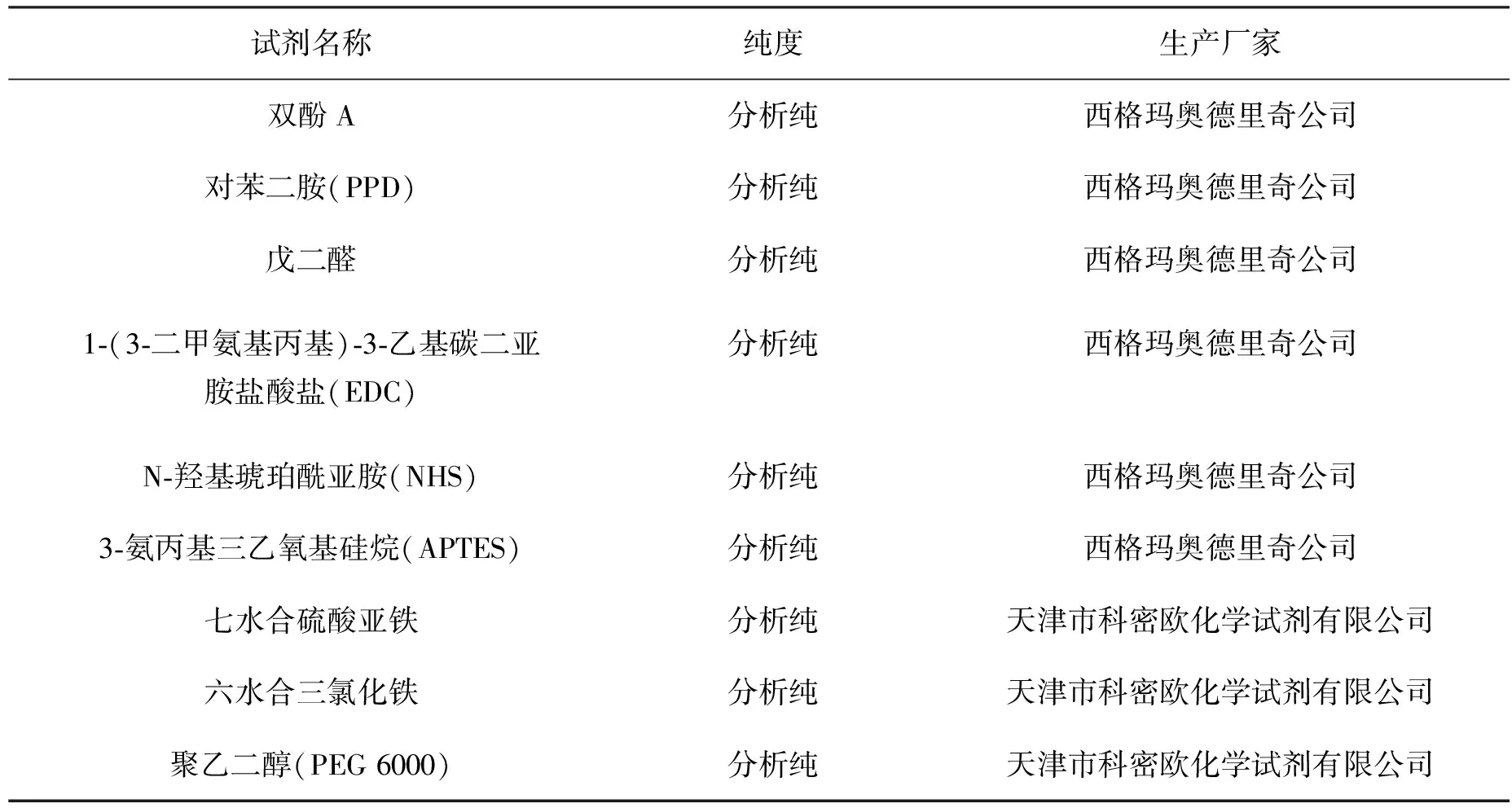
表2 主要试剂
1.2 PPD-MN的制备
分别称取2.000g的聚乙二醇(6000)、1.390g的七水合硫酸亚铁和2.700g六水合氯化铁,用乙二醇(80mL)作溶剂将三者溶入其中搅拌混匀1h后,然后在60°C下逐滴加入40mL氨水(1mol/L)下充分反应12h。然后通过磁铁的磁性吸附分离得到黑色的四氧化三铁纳米颗粒,最后利用水和乙醇反复洗涤3次,除去颗粒表面的可溶性物质。
在40mL的乙醇溶液中加入0.200g的四氧化三铁纳米颗粒并将其充分分散开来,然后将这种混合液放入烧杯中用搅拌器搅拌1h,然后再逐滴加入4mL的APTES,在室温条件下继续搅拌,让其充分反应12h。然后将氨基化的四氧化三铁纳米颗粒用水和乙醇反复冲洗3次,在30℃条件下真空中干燥3h,最终获得干燥脱水的氨基化的四氧化三铁纳米粒。
在40mL含5%戊二醛的水溶液中加入0.200g氨基化的四氧化三铁纳米粒并通过机械搅拌1h,然后在混合溶液中加入0.200g的PPD,继续搅拌混匀1h后,通过磁铁将磁性颗粒和PPD溶液分离,并用水和乙醇分别对所获得的颗粒洗涤3次,在40°C条件下真空干燥4h后,最终得到干燥的PPD-MN纳米颗粒。
1.3 氧化石墨烯的制备
根据经过改进后的Hummers方法制备氧化石墨烯。在26mL磷酸、12g高锰酸钾,240mL浓硫酸混合溶液中,加入2.000g的鳞片石墨,通过磁力搅拌器不断搅拌,同时将反应温度升到50°C并保持稳定,让其充分反应16h。然后将反应后的溶液转移到260mL双氧水(30%)的冰中。静置20min后,然后在8000rpm下离心1h分离混合物,将上清液慢慢倒出,剩余的固体分别用盐酸(30%)和水各洗涤6次。每次洗涤完后,重复上述离心分离步骤。最后将洗涤纯化的固体物质在40°C条件下真空中干燥8h,从而获得干燥的氧化石墨烯。
1.4 PPD-MGO的制备
在100mL的水中加入0.120g的氧化石墨烯并通过搅拌快速分散,然后依次将0.1M的EDC和NHS加入到氧化石墨烯分散液中继续搅拌2h以激活氧化石墨烯表面的羧基基团,然后再加入0.400g的PPD-MN并利用超声波进行分散,反应1h后,所得到的磁性颗粒用磁铁收集聚拢,并在40°C条件下进行真空干燥6h,最终得到干燥的PPD-MGO颗粒。
1.5 PPD-MGO对双酚A的吸附实验
在一系列体积均为200 mL浓度依次从低到高的双酚A溶液(75~250 mg/L)分别加入0.3 g的PPD-MGO,并充分分散开来。将每一组混合物在温度25°C、35°C和45°C条件下依次振摇摇匀反应2h,然后各自用磁力实现固液分离,反应后的溶液在波长276 nm处利用紫外可见分光光度计测定各自吸光值,并最终得到各自双酚A的浓度。为了研究初始pH值对双酚A吸附的影响,通过加入相应的酸或碱调整溶液pH值在5~9之间,并在25°C下进行吸附实验。所有的实验结果均平行测定3次。
1.6 吸附动力学实验
在200 mL的双酚A溶液(250 mg/L)中加入0.3 g的PPD-MGO纳米颗粒,并在25°C条件下通过振荡进行反应,并每隔一定的时间测定双酚A的浓度。为了对吸附动力学特征进行描述,实验采用两种动力学吸附模型来评估吸附动力学情况,其中准一级动力学的计算公式如下所示:
ln(qe-qt)=lnqe-k1t
(1)
其中,qe(mg/g)是平衡时的吸附容量,qt(mg/g)是某一时间的吸附量,k1(g/mg/min)是吸附的速率常数。而准二级动力学的计算公式如下所示:
(2)
其中,kad(g/mg/min)是吸附的速率常数,qe(mg/g)是平衡时的吸附容量,qt(mg/g)是某一时间的吸附量。
1.7 吸附热力学实验
在200 mL的双酚A溶液(75~250 mg/L)中加入0.3 g的PPD-MGO纳米颗粒,并在25°C、35°C和45°C下通过振荡反应2h,利用最终测得的双酚A浓度来分析吸附等温线。实验通过Langmuir和Freundlich方程来评估吸附热力学过程,Langmuir等温方程可用下面方程来表示:
(3)
其中qm和b分别是最大吸附量(mg/g)及平衡吸附常数(L/mg)。而Freundlich等温方程可用下列等式来表示:
(4)
其中Ce(mg/L)是双酚A溶液平衡时的浓度,qe(mg/g)的平衡时的吸附容量,k(L/mg)和n是Freundlich常数。
1.8 PPD-MGO的重复性实验
为了研究PPD-MGO的重复利用情况,称取0.3 g的PPD-MGO加入在200 mL的双酚A溶液(250 mg/L)中,并将混合物在温度25°C条件下振荡摇匀反应2h。然后用磁铁进行固液分离,对双酚A溶液的最终浓度分别进行测定。通过乙醇和水分别洗涤分离出来的PPD-MGO颗粒3次,用以去除吸附在颗粒中的双酚A,洗涤好后再加入另一份同样体积的双酚A溶液(250 mg/L)进行新的循环吸附。实验通过对每次循环结束后双酚A的平衡吸附容量值来评价材料的可重复利用性能。所有实验均平行测定3次。
2 结果与讨论
2.1 吸附性能比较
为了确认改性后的PPD-MGO纳米颗粒吸附能力是否提高,在相同实验条件下分别测定了PPD-MN、氧化石墨烯和PPD-MGO对双酚A的吸附容量。在25°C下,氧化石墨烯、PPD-MN和PPD-MGO对于双酚A的吸附容量分别为127.0、42.0和150.0 mg/g。说明四氧化三铁磁性纳米颗粒通过PPD和氧化石墨烯修饰后对双酚A吸附能力不断增强。
2.2 pH对吸附作用的影响
反应溶液的pH值主要是通过改变染料和吸附材料表面之间的静电作用,来影响吸附材料的吸附容量大小,其它还有氢键或范德华力也会对磁性材料吸附染料产生影响。实验考察了pH在5~9之间的吸附结果(图1)。由实验结果可以看出,当pH值为7时,PPD-MGO对双酚A的最大吸附容量达到最大值。接下来无论pH值是增加还是降低,PPD-MGO对双酚A的吸附容量都有不同程度的下降。因此通过该实验将吸附反应的溶液pH值确定为7。
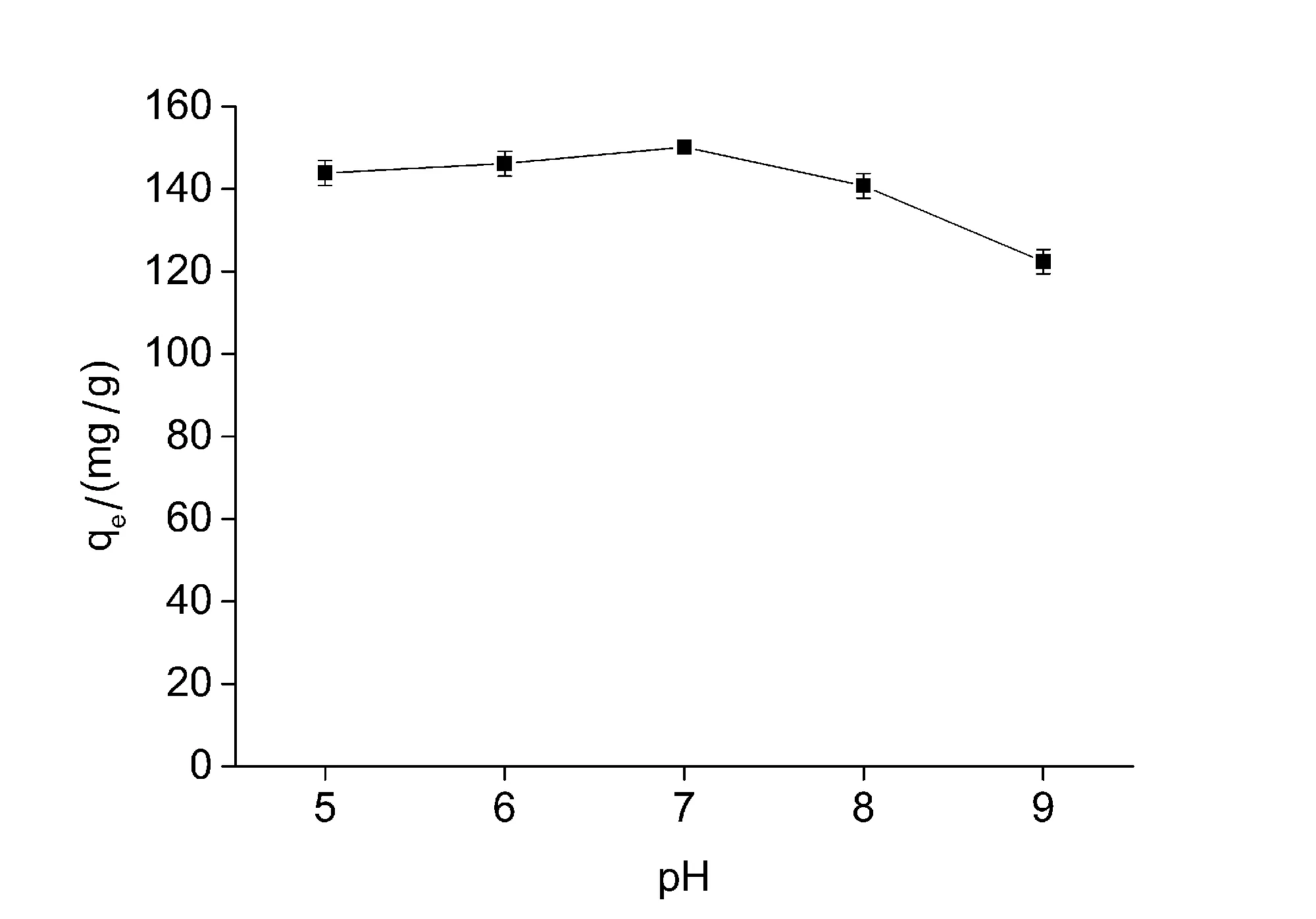
图1 pH对PPD-MGO吸附双酚A的影响
2.3 吸附动力学实验
图2a显示的是PPD-MGO对双酚A的吸附动力学性能。在前2h的反应中,双酚A的浓度随着反应时间的增加不断降低,纳米材料的吸附能力在2h后开始逐步下降,使得溶液中双酚A的浓度逐渐达到吸附平衡。当实验时间达到2.5h时,双酚A溶液的浓度并没有明显的下降,PPD-MGO的吸附量也趋于稳定。因此,本实验将2h选定为后续实验考察的时间。
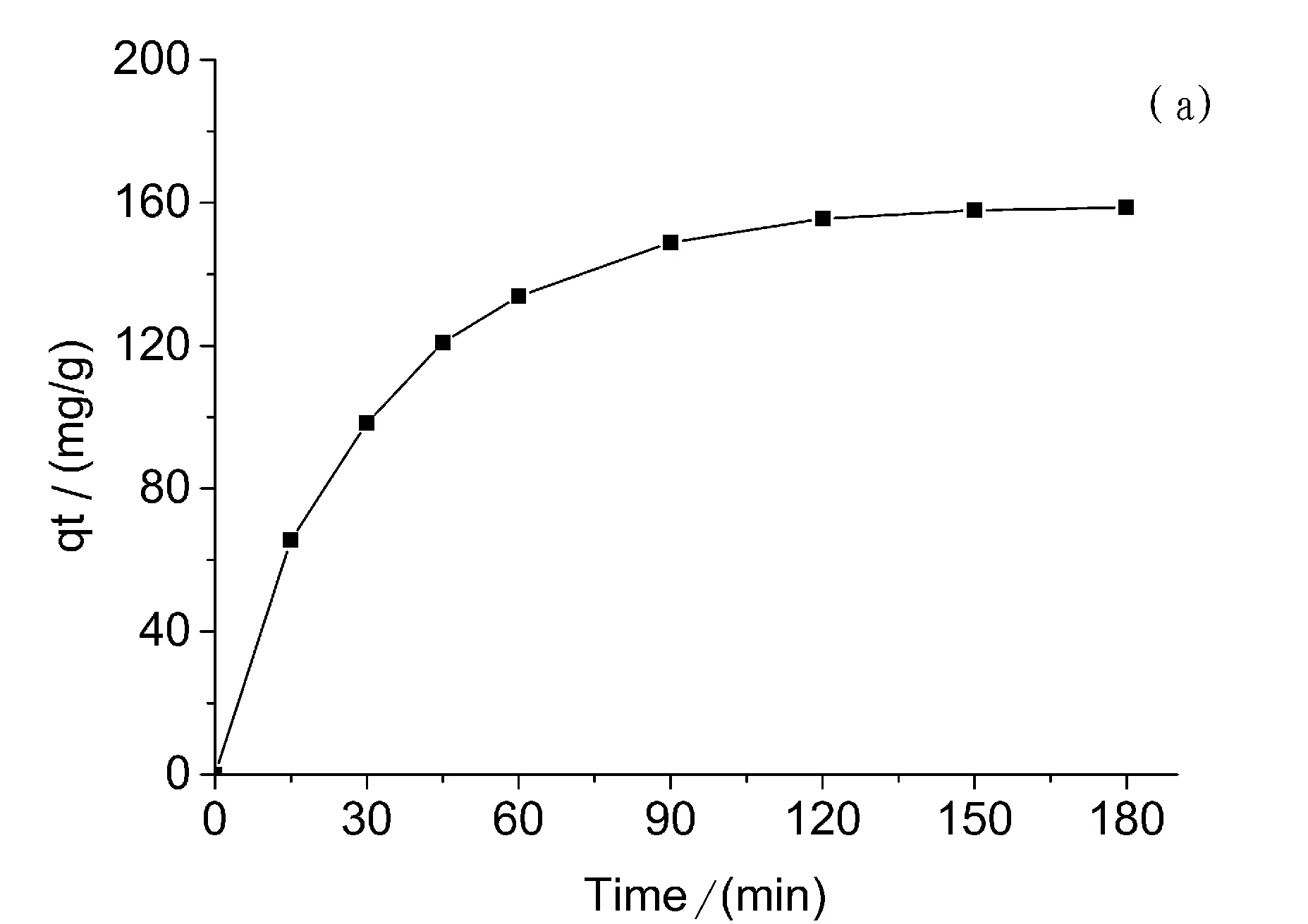

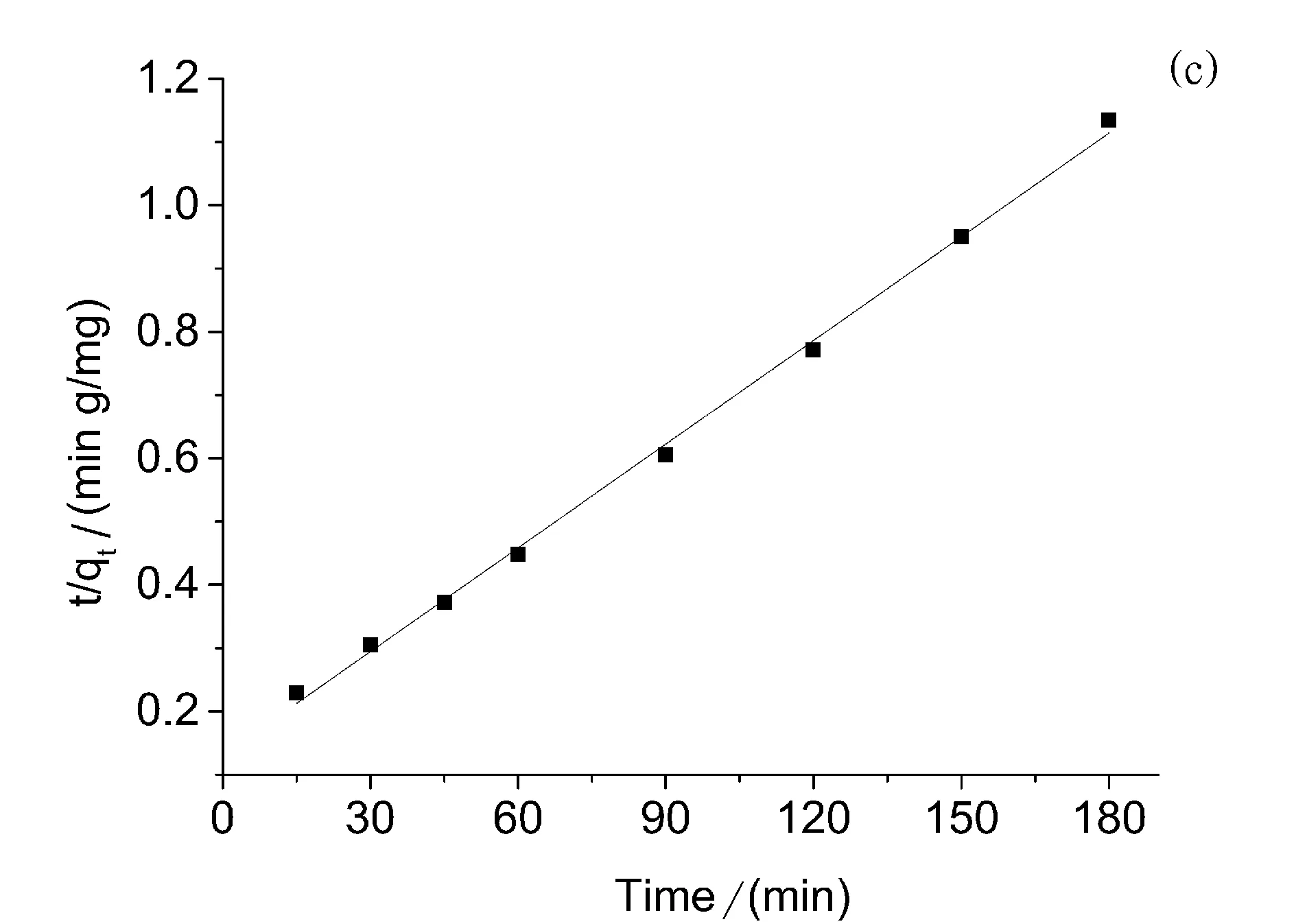
图2 (a) PPD-MGO吸附双酚A溶液的吸附动力学曲线、(b)准一级吸附速率、(C)准二级吸附速率
实验采用准一级动力学方程和准二级动力学方程分别尝试拟合PPD-MGO对双酚A的吸附过程,结果如图2(b)和图2(c)所示。经过拟合计算,其中准一级动力学方程中k1的结果为0.0343,拟合模型的相关系数为0.996;而准二级动力学方程中的kad的结果为0.0055,拟合模型的相关系数为0.999. 从结果中可以看出,本实验更加符合准二级动力学方程。
2.4 吸附热力学研究
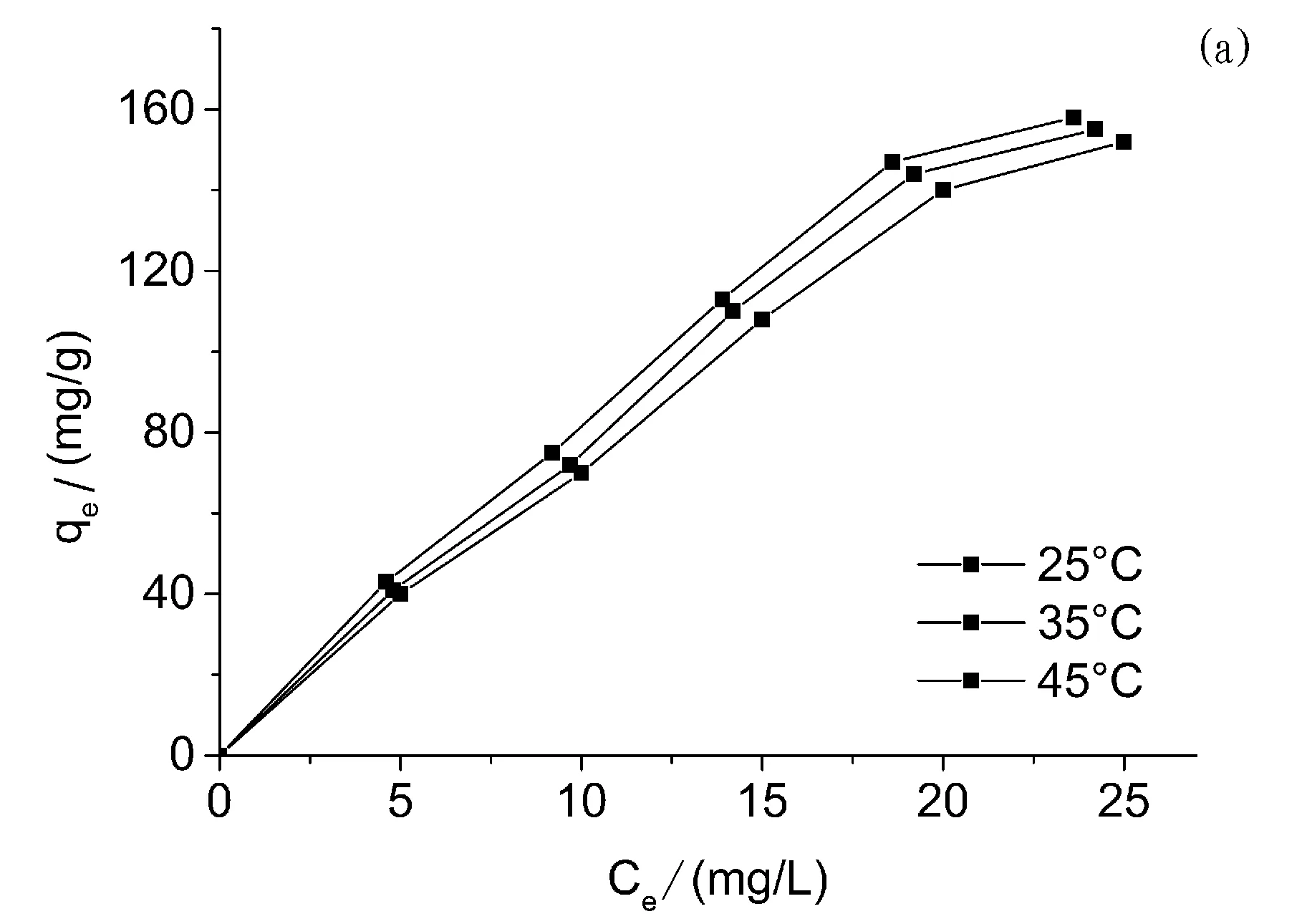
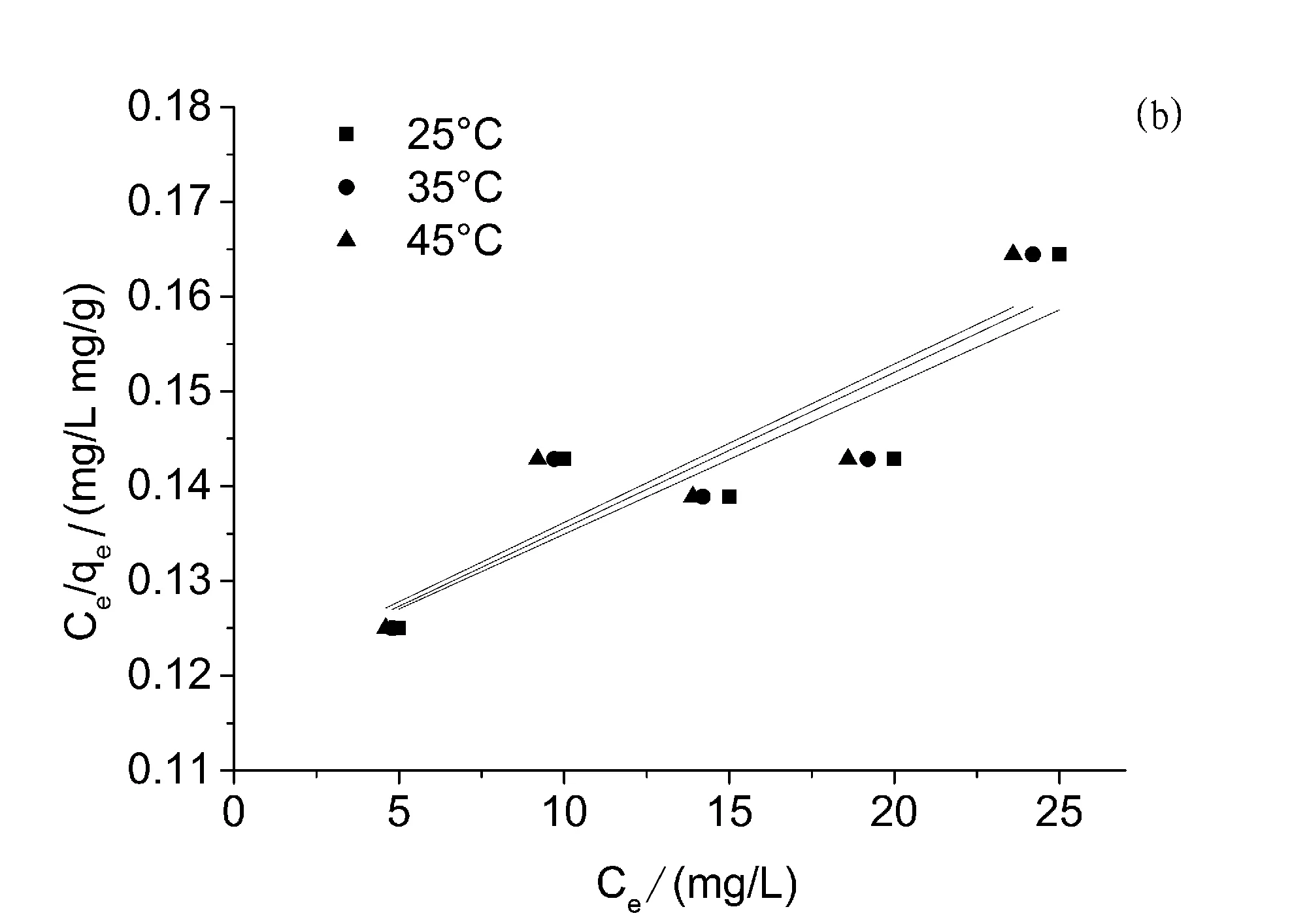
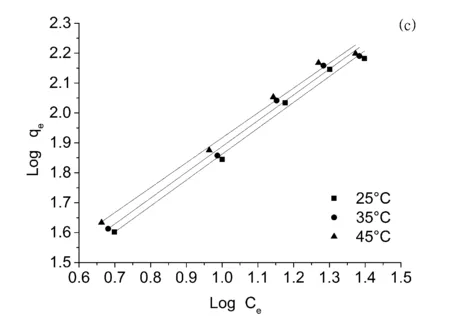
图3 (a)PPD-MGO对双酚A的吸附等温线,(b)Langmuir模型拟合曲线,(c)Freundlich模型拟合曲线
本实验对PPD-MGO对双酚A的吸附热力学性能进行了考察,并采用弗伦德利希和朗格缪尔这两种热力学吸附模型对相关实验数据进行拟合分析。图3和表3展示了相关的实验和拟合数据。通过结果不难看出PPD-MGO对双酚A的吸附热力学作用更加符合Freundlich等温吸附模型,这表明PPD-MGO对双酚A的吸附行为并非单分子层并且活性位点的表面能量并不均一。PPD-MGO在45°C下对双酚A的最大吸附容量达到155.0 mg/g。

表3 PPD-MGO吸附双酚A的热力学参数
2.5 PPD-MGO的重复性考察及去除双酚的研究
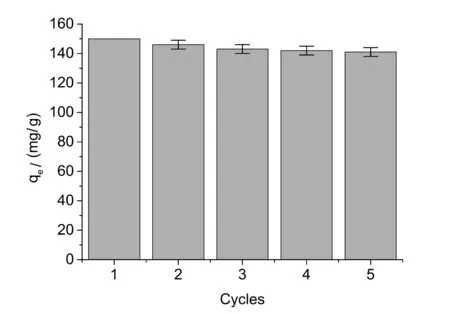
图4 PPD-MGO的可重用性考察
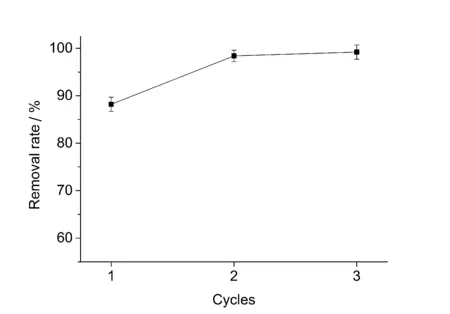
图5 PPD-MGO去除双酚A的考察
吸附材料的重复利用和再生能力在现实工艺中有着非常重要的意义。最关键一点是能够减少材料浪费,降低成本。图4反映的是PPD-MGO纳米颗粒重复吸附双酚A的结果。在循环重复使用5次的过程中,每一个新的循环中PPD-MGO的吸附能力都略有下降。循环使用5次后,PPD-MGO的最大吸附容量为141.0 mg/g,为初始吸附容量的94%。实验结果表明,PPD-MGO的吸附能力在重复使用过程中保持得较好。其满意的重复性,可以有效地降低在实际使用过程的成本。
实验通过连续使用PPD-MGO对同一双酚A溶液进行吸附以达到最终去除目的,当1次吸附结束后,将吸附剂通过磁力迅速分离,再加入新的吸附材料进行下1次循环吸附。实验考察连续吸附3次后的双酚A溶液的最终浓度。双酚A的去除率计算公式如下所示:
去除率(%)=(C0-Ce)/C0×100%
(5)
其中Ce(mg/L)是双酚A溶液的平衡浓度,C0(mg/L)是双酚A溶液反应前的初始浓度。实验结果如图5所示,使用PPD-MGO对双酚A连续吸附3次,可以使双酚A的去除率达到99.2%。实验结果表明,该吸附剂可有效地吸附环境水体中的双酚A。
3 小结
本文完成了利用PPD-MGO纳米材料吸附溶液中双酚A的研究,并对其吸附动力学和热力学性能进行了研究。分别对整个吸附过程进行了准一级动力学方程和准二级动力学方程拟合,发现PPD-MGO吸附双酚A过程更贴近准二级动力学方程。而热力学平衡数据拟合后显示其更加吻合Freundlich吸附等温线模型。在双酚A的吸附过程中PPD-MGO同样表现出良好的吸附去除性能和可重用性。在循环使用5次后,其吸附容量保持为141.0 mg/g,为初始吸附容量的94%;通过3次连续吸附,去除率可以达到99.2%。该实验充分说明PPD-MGO在吸附去除双酚A方面同样有着巨大的潜力。
[1]Altmann J, Rehfeld D, Träder K, et al. Combination of granular activated carbon adsorption and deep-bed filtration as a single advanced wastewater treatment step for organic micropollutant and phosphorus removal [J]. Water research, 2016, 92:131~139.
[2]Liu F, Guo Z, Ling H, et al. Effect of pore structure on the adsorption of aqueous dyes to ordered mesoporous carbons [J]. Microporous and Mesoporous Materials, 2016, 227:104~111.
[3]Wang K, Li C, Liang Y, et al. Rational construction of defects in a metal-organic framework for highly efficient adsorption and separation of dyes [J]. Chemical engineering journal, 2016, 289:486~493.
[4]Mailler R, Gasperi J, Coquet Y, et al. Removal of emerging micropollutants from wastewater by activated carbon adsorption: Experimental study of different activated carbons and factors influencing the adsorption of micropollutants in wastewater [J]. Journal of Environmental Chemical Engineering, 2016, 4(1):1102~1109.
[5]Liu C, Wu P, Zhu Y, et al. Simultaneous adsorption of Cd2+and BPA on amphoteric surfactant activated montmorillonite [J]. Chemosphere, 2016, 144:1026~1032.
[6]Li S, Zhang G, Wang P, et al. Microwave-enhanced Mn-Fenton process for the removal of BPA in water [J]. Chemical engineering journal, 2016, 294:371~379.
[7]Wang Z M, Ooga H, Hirotsu T, et al. Matrix-enhanced adsorption removal of trace BPA by controlling the interlayer hydrophobic environment of montmorillonite [J]. Applied Clay Science, 2015, 104:81~87.
[8]Sharma J, Mishra I M, Kumar V. Mechanistic study of photo-oxidation of Bisphenol-A (BPA) with hydrogen peroxide (H2O2) and sodium persulfate (SPS) [J]. Journal of Environmental Management, 2016, 166:12~22.
[9]Wang G, Hua Y, Su X, et al. Cr(VI) adsorption by montmorillonite nanocomposites [J]. Applied Clay Science, 2016, 124:111~118.
[10]Rong X, Qiu F, Qin J, et al. A facile hydrothermal synthesis, adsorption kinetics and isotherms to Congo Red azo-dye from aqueous solution of NiO/graphene nanosheets adsorbent [J]. Journal of Industrial and Engineering Chemistry, 2015, 26:354~363.
[11]Du Q, Sun J, Li Y, et al. Highly enhanced adsorption of congo red onto graphene oxide/chitosan fibers by wet-chemical etching off silica nanoparticles [J]. Chemical engineering journal, 2014, 245:99~106.
[12]Tajizadegan H, Torabi O, Heidary A, et al. Study of methyl orange adsorption properties on ZnO-Al2O3nanocomposite adsorbent particles [J]. Desalination and Water Treatment, 2016, 57(26):12324~12334.
Application studies of P-phenylenediamine functionalized magnetic graphene oxide for removal of bisphenol A
TANG Xiao-sheng1,TANG Ping2,DONG Chang-jin1
(1. Hubei Key Laboratory of Edible Wild Plants Conservation and Utilization & College of Life Sciences,Hubei Normal University, Huangshi, Hubei 435002, China; 2. School of Environmental Science and Engineering, Hubei Polytechnic University,Hubei Key Laboratory of Mine Environmental Pollution Control and Remediation,Huangshi, Hubei 435003, China)
P-phenylenediamine functionalized magnetic graphene oxide nanocomposites (PPD-MGO) were prepared and utilized in the adsorption and removal of bisphenol A in aqueous solution. The factors affected the adsorption of bisphenol A including adsorption time, temperature and pH of solution, adsorption kinetics and isotherms were all investigated. The results showed that PPD-MGO nanomaterial exhibited good adsorption ability for bisphenol A and good reusability. The maximum adsorption capacity reached 155.0 mg/g at 45°C and pH 7. The removal rate was 99.2% after three times of adsorption with new nanomaterials. After five-cycle adsorption, the adsorption capacity of PPD-MGO remained at 94.0 %. The adsorption of bisphenol A was found that fitted pseudo second order kinetics equations and the Freundlich adsorption model.
P-phenylenediamine; magnetic graphene oxide; bisphenol A; adsorption
2016—10—11
湖北师范大学2015年度校人才引进项目
汤小胜(1971— )女,湖北省蕲春人,讲师,主要研究方向为污水处理.
汤平(1973— )男,博士,e-mail:376765353@163.com.
X703.1
A
2096-3149(2017)01- 0001-07
10.3969/j.issn.2096-3149.2017.01.001
