树莓中花色苷的超声提取工艺以及抗氧化活性研究
2017-06-24王煜伟索有瑞
王煜伟,胡 娜 , 索有瑞
(1.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016;2. 中国科学院 西北高原生物研究所藏药重点实验室,青海 西宁 810001;3.中国科学院大学,北京 100049)
研究报告(081~086)
树莓中花色苷的超声提取工艺以及抗氧化活性研究
王煜伟1,2,3,胡 娜1,2, 索有瑞1,2
(1.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016;2. 中国科学院 西北高原生物研究所藏药重点实验室,青海 西宁 810001;3.中国科学院大学,北京 100049)
在单因素试验的基础上选择提取次数、提取试剂、料液比、超声时间4个因素为自变量,以树莓花色苷的提取率为响应值,进行Box-Behnken中心组合试验设计,采用响应面法(RSM)评估了这些因素对花色苷提取率的影响. 并分别采用1,1-二苯基苦基苯肼(DPPH)和2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)法对花色苷的抗氧化活性进行研究. 结果表明,超声辅助提取树莓中花色苷的最佳工艺条件为:超声提取3次,料液比1∶46 g/mL,超声时间44 min,在此条件下预测花色苷的得率为6.79%. 花色苷对于DPPH的清除率达到13.68 μmol/g,对于ABTS的清除率达到8.37 μmol/g.
树莓;花色苷;响应面法;抗氧化
树莓(RubusCorchorifoliusL. f),也称覆盆子、马林、悬钩子,属于直立灌木. 广泛分布于海拔200~2200 m的向阳山坡、溪边、山谷、荒地和灌木丛中,其果实可供生食、制果酱以及酿酒. 树莓根、茎、叶、果实均可入药,有活血、解毒、止血之效[1]. 树莓果实酸甜可口,柔嫩多汁,营养丰富,风味独特,被誉为“黄金水果”[2]. 树莓中含有大量的人体所必需的维生素C、维生素E、花色苷以及超氧化物歧化酶(SOD)等营养物质, 能够有效改善人体新陈代谢,提高免疫力,具有很高的食用与药用价值[3-7].
花色苷具有抗氧化、抗变异、抗肿瘤、消除自由基、促进视网膜上视红素再合成以及降低血清胆固醇等功能,因其具有果香味、安全性高、水溶性好等优点,已被广泛使用[8-10]. 本试验采用超声优化提取树莓中的花色苷,在单因素试验的基础上采用pH示差法[11-12],通过响应面分析确定最佳提取工艺[13,14],并对其抗氧化活性进行研究. 以期为树莓工业化生产工艺的建立提供科学依据和理论参考.
1 试验部分
1.1 仪器与试剂
T6 新世纪紫外-可见分光光度计,北京谱析通用仪器有限责任公司生产; KQ-500E型超声波清洗器,昆山市超声仪器有限公司; AL204 电子天平,梅特勒-托利多仪器(上海) 有限公司;SHZ-3 型循环水多用真空泵,上海亚荣生化仪器; 101-1ES 型电热鼓风干燥箱,北京市永光明医疗仪器厂.
树莓样品,购于青海瑶池生物科技有限公司,商品名为秋英,又名嘉林一号,经中国科学院西北高原生物研究所索有瑞研究员鉴定为悬钩子属树莓. 1,1-二苯基苦基苯肼(DPPH)和2 ,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS )试剂购于美国 Sigma 公司,其他试剂均为市售分析纯.
1.2 溶液的配制
0.025 mol/L pH 1.0的氯化钾缓冲溶液:称取1.86 g KCl至烧杯中,加入蒸馏水980 mL左右,测量pH值并调节pH值至1.0 ± 0.05 (加入约6.3 mL HCl). 然后转移至1 L容量瓶中,加蒸馏水稀释至刻度,摇匀.
0.4 mol/L pH 4.5的醋酸钠缓冲溶液:称取54.43 g CH3CO2Na·3H2O至烧杯中,加入蒸馏水960 mL左右,测量pH值并调节pH值至4.5 ± 0.05(加入约20 mL HCl). 然后转移至1 L容量瓶中,加蒸馏水稀释至刻度,摇匀.
1.3 样品溶液制备
1.3.1 花色苷的提取
称取样品1.000 g,精密称定,置于50 mL棕色容量瓶中,准确加入提取液 (浓HCl∶80 %甲醇,体积比为4∶96) 200 mL,密塞,称定重量,40 ℃超声30 min,冷却至室温,再次称定重量,用提取液补足减失的重量,摇匀,即得样品溶液.
1.3.2 样品稀释溶液制备
按供试品溶液:缓冲溶液(体积比为1∶5)混合,制备2份样品稀释溶液,其中一份用氯化钾缓冲溶液 (0.025 mol/L, pH 1.0)稀释,另一份用醋酸钠缓冲溶液 (0.4 mol/L, pH 4.5)稀释,平衡20 min,待测.
1.4 花色苷的含量测定
用蒸馏水作为空白对照,分别在520和700 nm处测定用pH 1.0缓冲溶液稀释的样品溶液. 同理在两处测定用pH 4.5缓冲溶液稀释的样品,注意此处要在20~50 min内测定完样品的吸光度.
1.5 花色苷的计算
以锦葵色素-3,5-二葡萄糖苷,计算花色苷色素的浓度,公式表示如下:
(1)
其中:A=(Aλmax-A700 nm)pH 1.0-(Aλmax-A700 nm) pH 4.5;MW(分子量)=锦葵色素-3,5-二葡萄糖苷的摩尔质量655.2 g/mol;DF为稀释因子;103是将单位g换算为mg;ε为锦葵色素-3,5-二葡萄糖苷的消光系数,为 20 500 L/(mol×cm);l为比色杯厚度,cm.
1.6 超声辅助法提取树莓果实花色苷的单因素试验
1.6.1 超声次数对花色苷提取量的影响
称取新鲜树莓1.000 g分别加入7支试管,在每支试管中按照1∶20 g/mL的料液比加入酸化甲醇溶液,用保鲜膜封口,放置湿润,使溶液充分渗入到细胞组织中,超声处理30 min,分别重复1、2、3、4、5、6、7次. 每组做3次平行试验.
1.6.2 料液比对花色苷提取量的影响
称取新鲜树莓0.100 g分别加入7支试管,每支试管各按1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70 g/mL的料液比分别加入酸化甲醇溶液,用保鲜膜封口,放置湿润,使溶液充分渗入到细胞组织中,超声处理30 min,重复3次. 每组做3次平行试验.
1.6.3 提取试剂对花色苷提取量的影响
称取新鲜树莓1.000 g分别加入5支试管,每支试管分别按1∶20 g/mL的料液比加入水、酸性水、酸化乙醇、酸化甲醇以及丙酮溶液,用保鲜膜封口,放置湿润,使溶液充分渗入到细胞组织中,超声处理30 min,重复3次. 每组做3次平行试验.
1.6.4 超声时间对花色苷提取量的影响
称取树莓1.000 g分别加入7支试管,每支试管分别按1∶20 g/mL的料液比加入酸化甲醇,用保鲜膜封口,放置湿润,使溶液充分渗入到细胞组织中,分别超声处理10、20、30、40、50、60、70 min,重复3次. 每组做3次平行试验.
1.7 树莓中花色苷提取条件的优化设计
根据 Box-Behnken 中心组合试验设计原理,综合单因素试验结果,选取对花色苷影响较大的因素提取次数(A)、料液比(B) 和超声时间(C) ,进行中心组合试验,并结合单因素试验条件选取合理水平. 以花色苷的得率为响应值,通过响应面分析得出超声波提取树莓中花色苷的最佳提取工艺条件和方法. 试验设计因素编码及水平如表1所列.

表1 中心组合设计因素与水平表Table 1 Factors and levels in central composite design
1.8 DPPH法测定花色苷抗氧化活性
将上述花色苷提取液上大孔树脂柱,用70%乙醇洗脱,于真空干燥箱内至恒重,得树莓花色苷干粉,用于花色苷抗氧化活性的测定.
使用参考文献[15]方法并稍作修改. 用无水乙醇配置 0.1 mmol/L 的DPPH溶液,避光保存. 配置 0.5 mg/mL 的Vc溶液(作为对照). 将测试样品稀释至不同浓度. 将2 mL测试样品溶液及 2 mL DPPH 溶液加入到同一试管中,摇匀,室温下暗处静置 30 min 后测定其吸光度Asample,同时测定 2 mL DPPH溶液与2 mL溶剂(蒸馏水或者相应的缓冲溶液)混合后的吸光度Acontrol,以及2 mL测试样品溶液与2 mL无水乙醇混合后的吸光度Ablank. 自由基清除能力的表示:
DPPH清除率(%)=[1-(Asample-Ablank) /Acontrol]× 100%
(2)
根据浓度分别为 50、70、90、110、130、150、170 μmol/L trolox的 DPPH·清除率,绘制标准曲线,计算花色苷的 trolox 抗氧化能力. 其计算公式为:
K1=C×V×D/M
(3)
其中:C为花色苷的浓度,V为提取溶剂体积,D为稀释倍数,M为样品质量.
1.9 ABTS法测定花色苷抗氧化活性
使用参考文献[16]方法并稍作修改. 使用总抗氧化能力试剂盒,ABTS工作母液配制后,室温避光存放12~16 h. 将ABTS工作母液用PBS稀释,使ABTS工作液的吸光度减去相应的PBS空白对照后,A734 nm为0.7±0.02. 把 10 mmol/L Trolox 标准溶液稀释成 0.15、0.3、0.6、0.9、1.2 和 1.5 mmol/L,根据其ABTS+·清除率绘制标准曲线. 由此计算花色苷的 Trolox 抗氧化能力. 其公式为:
ABTS清除率(%)=[1-(Asample-Ablank) /Acontrol]× 100%
(4)
其中:Asample为加入样品的吸光度值,Ablank为样品的本底吸光度值,Acontrol为不加样品的吸光度值.
根据浓度分别为 10、30、50、70、90、100、120 μmol/L trolox 的ABTS+·清除率,绘制标准曲线,计算花色苷的 trolox 抗氧化能力. 其计算公式为:
K2=C×V×D/M
(5)
其中:C为花色苷的浓度,V为提取溶剂体积,D为稀释倍数,M为样品质量.
2 结果与讨论
2.1 提取次数对树莓中花色苷提取率的影响
固定料液比1∶20 g/mL,酸化甲醇溶液超声处理30 min,分别重复1、2、3、4、5、6、7次. 按照1.6.1进行试验. 结果如图1所示.

图1 超声次数对花色苷得率的影响Fig.1 Effect of extraction times on extraction yield of anthocyanins
由图1可知,超声提取3次时花色苷得率最高,随着提取次数的增大,花色苷得率变化不大,所以超声次数在3次为宜.
2.2 料液比对花色苷提取率的影响
在每支试管中按1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70 g/mL的料液比分别加入酸化甲醇溶液,超声处理30 min,按照1.6.2 进行试验. 结果如图2所示.

图2 料液比对花色苷得率的影响Fig.2 Effect of ratio of solid to liquid on extraction yield of anthocyanins
由图2可知,当料液比达到1∶40 g/mL左右时,花色苷基本溶出,再增加提取剂用量,提取率变化不大. 鉴于降低成本,料液比1∶40 g/mL左右为宜. 2.3 提取试剂对花色苷提取率的影响
在每支试管中分别按1∶20 g/mL的料液比加入水、酸性水、酸化乙醇、酸化甲醇以及丙酮溶液,超声处理30 min,按照1.6.3 进行试验. 结果如图 3所示.
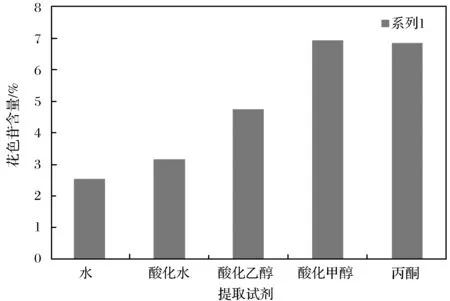
图3 提取试剂对花色苷得率的影响Fig.3 Effect of extracting agent on extraction yield of anthocyanins
由图3可知,酸化甲醇对花色苷提取效率最高.
2.4 超声时间对树莓中花色苷提取率的影响
在每支试中分别按1∶20 g/mL的料液比加入酸化甲醇,分别超声处理10、20、30、40、50、60、70 min,按照 1.6.4进行试验. 结果如图4所示.

图4 超声时间对花色苷得率的影响Fig.4 Effect of ultrasonic temperature on extraction yield of anthocyanins
由图4可知,超声时间越长越有利于提高提取率,因此花色苷的提取率随着时间的提高而提高. 但是30 min以后提取率增加并不明显,因此选择超声提取30 min为宜.
2.5 响应面分析试验结果与数据分析
利用 Design Expert8.0.7.1 软件,通过花色苷得率试验数据进行多元回归拟合,对试验结果进行响应面分析,得出回归模型方差分析表和响应曲面图,分别如表2所列、图5所示.
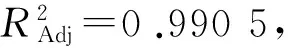
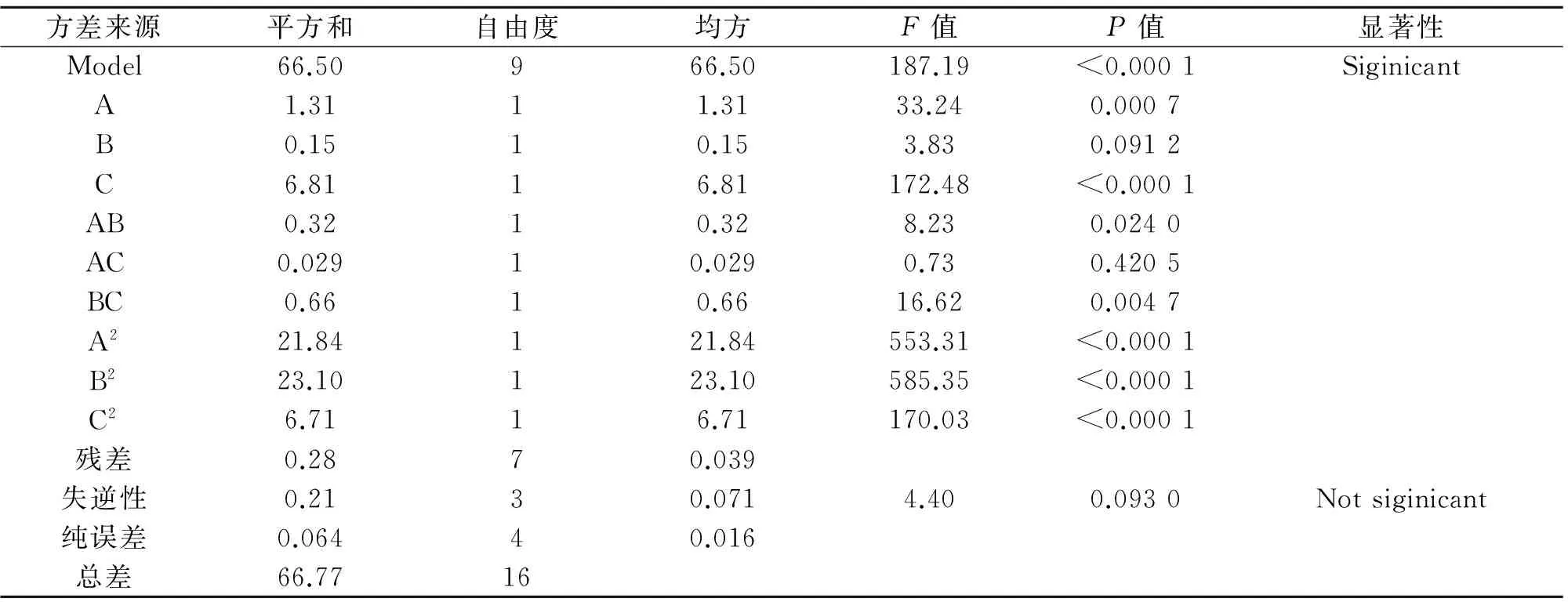
表2 拟合二次多项式模型的方差分析Table 2 Analysis of variance(ANOVA)for fitted quadratic polynomial model
注:P<0.01,差异极显著;P<0.05,差异显著.R2=0.993 8
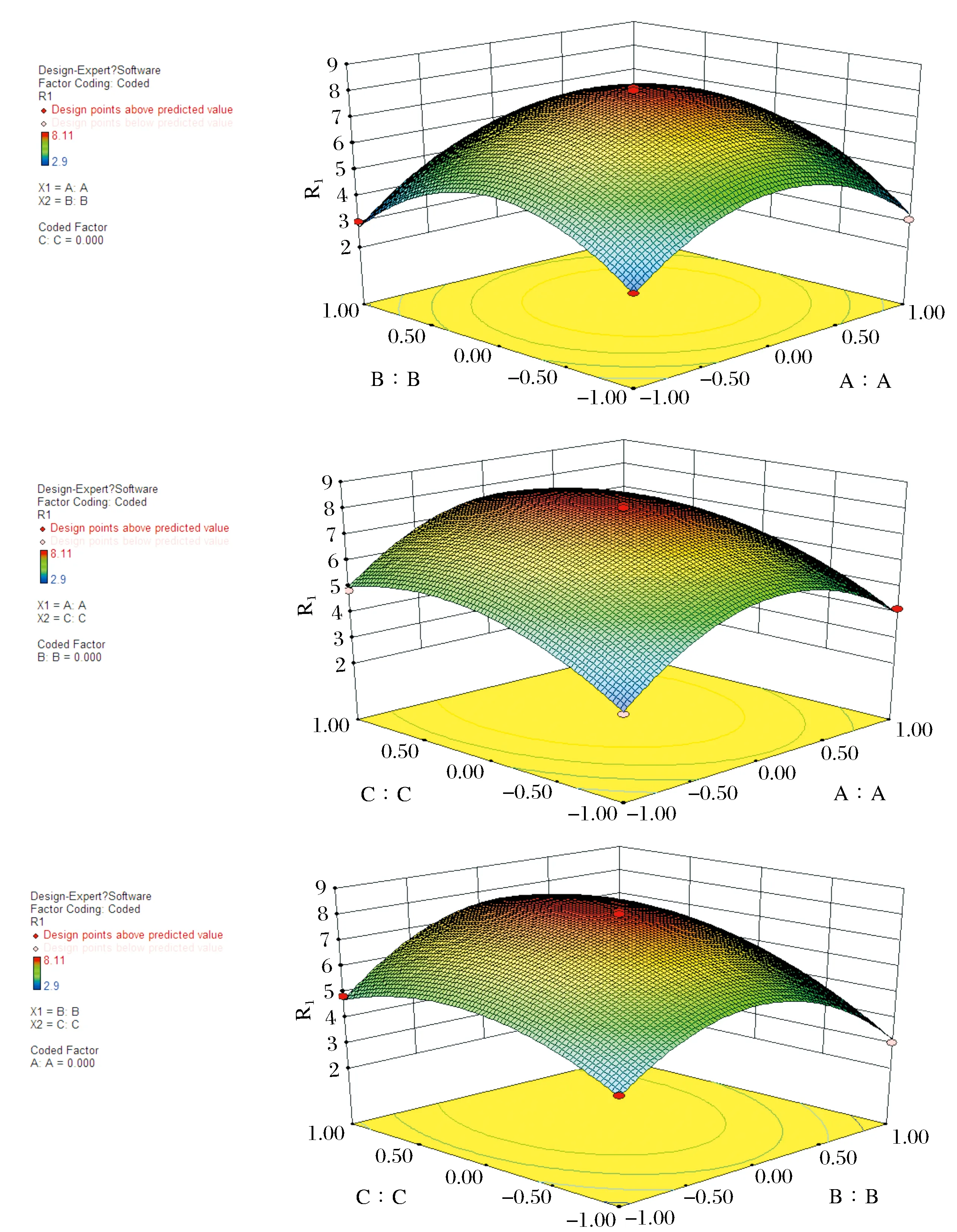
图5 各两因素交互作用对花色苷提取率影响的响应面图Fig.5 Response surface plots of mutual influences of extraction conditions on extraction yields of anthocyanins
通过拟合可求出影响因素的一次效应、二次效应及其交互效应的关联方程,多元回归拟合分析得到树莓中花色苷提取率R1与各因素变量(A提取次数,B料液比,C超声时间)的二次方程模型为:R1=7.95+0.41×A+0.14×B+0.92×C+0.28×A×B-0.085×A×C+0.41×B×C-2.28×A2-2.34×B2-1.26×C2.
根据DesignExpert 8.0.7.1软件对试验结果进行最优化分析,确定最佳的提取条件为:超声提取3次,料液比1∶46 g/mL,超声时间44 min,在此条件下预测花色苷的得率为6.79%.
3 结论
根据模型预测结果进行近似验证试验,但考虑到实际操作的便利,将最佳工艺条件修正为超声提取3次,料液比1∶46 g/mL,超声时间44 min,在此条件下花色苷提取率为6.76%(n=3).
根据试验结果分析可知,树莓花色苷对DPPH以及ABTS都有一定的清除作用,其中对于DPPH的清除率达到13.68 μmol/g,对于ABTS的清除率达到8.37 μmol/g. 明显高于Tulammen、USA 22、U46等其他树莓品种[17-20],说明本研究所选取的树莓品种具有更强的抗氧化活性,更好地开发前景.
[1] 中国科学院西北高原生物研究所.青海植物志[M]. 西宁:青海人民出版社,1997:393.
[2] 韩加,新华·纳比,阿里木·帕塔尔,等.新疆树莓果实营养成分及其提取物抗氧化性研究[J].营养学报,2008, 30(4): 410-413.
[3] 刘孟军.中国野生果树[M].北京: 中国农业出版社,1998: 227-231.
[4] 刘建华,张志军,李淑芳.树莓中功效成分的开发浅论[J].食品科学,2004, 25(10): 370-373.
[5] Mong Liu,Xinqi Li. Antioxidant and antiprolife -rative activities of raspberries[J]. J Agric Food Chem, 2002,50:2926-2930.
[6] ETIN EKIC, MUSTAFA ZGEN. Comparison of antioxidant capacity and phytochemical properties of wild and cultivated red raspberries(Rubusidaeus L.)[J]. Journal of Food Composition and Analysis,2009(10):1-21.
[7] CHEN Fang,SUN Yangzhao,ZHAO Guanghua, et al. Optimization of ultrasoundassisted extraction of anthocyanins in red raspberries and identification of anthocyanins in extract using high-performance liquid chromatography-mass spectrometry[J]. Ultrasonics Sonochemistry,2007(14):767-778.
[8] 李传欣,张华,李景琳.食用天然色素的应用及发展趋势[J].辽宁农业科学,2001(1) : 29-32.
[9] 徐俐,金毅.树莓红色素的提取及稳定性的研究[J].食品科学,2006,27(5):191-194.
[10] 白立敏,辛秀兰.树莓红色泰的提取与稳定性研究[J].食品工业科技,2007,28(12):179-195.
[11] 石岳,张秀玲,邹阳.pH 示差法测定黑莓残渣中花青素含量的研究[J].中国食品工业,2007,12(24):56-57.
[12] 冯建光, 谷之英. 葡萄皮色素的示差法测定[J].分析检测, 2001, 9(1): 85-86.
[13] 王煜伟,杨永晶,胡娜,等.响应面法优化树莓中总黄酮的超声提取工艺研究[J].天然产物研究与开发,2014,26(1):128-132.
[14] 王煜伟,杨永晶,胡娜,等.响应面法优化树莓中总黄酮的超声提取工艺研究[J].食品工业,2015,220(1):67-70.
[15] LUO W, ZHAO M M, YANG B, et al. Identification of bioactive compounds in Phyllenthusemblica L. fruit and their free radical scavengingactivities[J]. Food Chemistry, 2009, 114: 499-504.
[16] RE R, PELLEGRINI N, PROTEGGENTE A, et al. Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology & Medicine, 1999, 26: 1231-1237.
[17] 王睿婷,王 鑫,张富敏,等.树莓的抗氧化活性与主要化学成分的相关分析[J].沈阳药科大学学报,2013(11) : 901-905.
[18] 吴春.花色素抗氧化作用的研究[J].哈尔滨商业大学学报,2003, 4(3): 492-494.
[19] Mc CORD J M. Oxygen-derived free radicals in postischemic tissue injury[J]. New England Journal of Medicine, 1985, 312: 159-163.
[20] 肖军霞,黄国清,仇宏伟,等.红树莓花色苷的提取及抗氧化活性研究[J]. 食品科学,2011,32(8) :15-18.
Ultrasonic-Assisted Extraction of Anthocyanins fromRubusCorchorifoliusL. f and Antioxidant Activity
WANG Yu-wei1,2,3,HU Na1,2, SUO You-rui1,2
(1. State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, China; 2. Key Laboratory of Tibetan Medicine of Northwest Institute of Plateau Biology, Chinese Academy of Sciences,Xining 810001, China; 3. University of the Chinese Academy of Sciences,Beijing 100049, China)
Based on single factor experiments, extraction times, extraction reagent, solid-liquid ratio, ultrasonic time were selected for the Box-Behnken central composite design. Response surface method was employed to study the effect of these factors on the yield of anthocyanins and the antioxidant activity of anthocyanins. 2,2-diphenyl-1-picrylhydrazyl(DPPH) and 2,2'-Azinobis-(3-ethylbenzthiazoline-6-sulphonate)(ABTS)method were used, respectively to study the antioxidant activity of anthocyanins in raspberry. The results indicated that optimal conditions were: ultrasonic extraction for 3 times, 1∶46 g/mL as the ratio of liquid to solid with 44 min extraction. Under these optimized conditions, the extraction yield of anthocyanins was up to 6.79%. The clearance of DPPH was 13.68 μmol/g and the clearance of ABTS was 8.37 μmol/g. The study provides scientific and theoretical basis for the research and utilization ofRubusCorchorifoliusL. f.
RubusCorchorifoliusL. f;anthocyanins;response surface method;antioxidant
2017-02-16;
2017-04-28.
柴达木枸杞干果绿色加工技术示范推广(2014-NS-509)
王煜伟,女,博士在读,研究方向为植物化学
索有瑞(1960-),男,研究员,《分析测试技术与仪器》副主编,主要从事生物有机化学和天然药物化学方面的研究,E-mail: yrsuo@nwipb.cas.cn.
O657.3
A
1006-3757(2017)02-0081-06
10.16495/j.1006-3757.2017.02.003
