大田软海绵酸及快速检测技术应用进展
2017-06-23权浩然庞林江张宜明薛超波路兴花
权浩然,庞林江,张宜明,*,孙 瑛,薛超波,路兴花
(1. 浙江农林大学农业与食品科学学院,浙江临安 311300; 2.舟山市食品药品检验检测研究院,浙江舟山 316021)
大田软海绵酸及快速检测技术应用进展
权浩然1,庞林江1,张宜明1,*,孙 瑛2,薛超波2,路兴花1
(1. 浙江农林大学农业与食品科学学院,浙江临安 311300; 2.舟山市食品药品检验检测研究院,浙江舟山 316021)
大田软海绵酸是海洋毒素中腹泻型毒素的代表。目前的检测方法存在耗时耗力、设备昂贵、不能快速检测的缺点。本文就大田软海绵酸的结构、毒理、药理进行介绍,并对目前开发的大田软海绵酸的快速检测技术:胶体金免疫层析技术、生物传感器技术、化学发光免疫分析技术进行概述,并展望了大田然海绵酸快速检测方法的未来发展。
大田软海绵酸,贝毒,快速检测
我国是赤潮频发的国家,平均每年发生的频率和累计面积都有增加的趋势[1]。由于人类活动范围的扩大以及社会发展的需求,导致海洋污染越来越严重。海水富营养、近海的氮磷量增加促进了藻类的生长[2]。这不仅对海洋生物造成了极大威胁,也对人类的身体健康构成了较大的危害,同时阻碍了我国海鲜产业的发展。
大田软海绵酸(Okadaic acid简称OA)作为常见的一种主要存在于藻类植物中的小分子腹泻型贝类毒素。其分布较广,几乎在每片海域都有存在。如今已被确定的能产生OA毒素的产毒藻主要包括鳍藻属(Dinophysisspp.)和原甲藻属(Prorocentrumspp.)的甲藻,如:倒卵形鳍藻(D. fortii)、尖锐鳍藻(D. acuta)、帽状鳍藻(D.mitra)、三角鳍藻(D. triposs)、具尾鳍藻(D. caudata)、圆形鳍藻(D. rotundata)、渐尖鳍藻(D. acuminata)、微小原甲藻(P. minimum)、利玛原甲藻(P. lima)等[3]。贝类,鱼类摄食后多富集于体内。海鲜类食品被OA污染后食用会引起急性中毒,虽没有致死报道,但威胁人类的身体健康。本文通过简要介绍OA结构性质,毒理药理,国内外限定含量以及快速检测技术进行阐述,并展望OA的快速检测。
1 大田软海绵酸结构以及性质
OA(Okadaic acid)又名软海绵酸,冈田酸,黑海绵酸。分子式为C44H68O13(如图1)。其拥有17个手性中心及3个螺环缩酮前体基团[6],分子量为805.00。OA是一种脂溶性物质,对于一般性的加热烹调处理较稳定[5]。OA是DSP(Diarrhetic Shellfish Poisoning)的主要组成部分,无色晶体,能溶于甲醇、乙醇、氯仿和乙醚等有机溶剂,不溶于水[4],辐射光对组织内的OA影响甚小,但对饮用水中的OA具有显著效果[7]。OA中毒患者出现的中毒症状主要是肠胃失调,如腹泻、腹痛、恶心、呕吐等。潜伏期短,一般在 48 h内基本康复[5]。

图1 大田软海绵酸结构图Fig.1 Structure of okadaic acid
由于其标准品昂贵,难以获得,且多为国外产品,因此检测和提取都相当困难。目前针对OA中毒并无有效的药物治疗方法,但有研究表明茶多酚能够显著改善OA诱导的大鼠海马神经元损伤[9],这也为针对OA药物的研发奠定了基础。
2 大田软海绵酸的毒理与药理特性
OA是一种丝氨酸/苏氨酸蛋白磷酸酶抑制剂[8]。OA对不同的蛋白磷酸酶抑制程度不同:PP2A(蛋白磷酸酶2A)抑制最强烈,其次是PP1(蛋白磷酸酶1)和PP2B(蛋白磷酸酶2B)[10]。OA具有促进多种细胞凋亡的作用[11]。张锐[12]发现,OA对还原性谷胱甘肽(GSH),超氧化物歧化酶(SOD),过氧化氢酶(CAT)均有显著抑制作用。但也有研究证明OA 具有诱导癌变和促进凋亡双重效应。OA能够引起人肝癌细胞,人肺癌细胞凋亡[11,13]。近期发现calyculin-A(CA)与okadaic acid(OA)联合作用能够抑制类乳腺癌细胞MCF-7和MDA-MB-231[14]。吕丽丽[15]运用多种方法已初步验证OA对人肺腺癌A549细胞系具有明显的杀伤作用。可以看出OA对癌细胞具有一定的杀伤力,因此可考虑潜在的药用价值。
3 各国对海洋产品中OA浓度的限制
随着腹泻性贝毒危害发生频率的不断增加,物流行业的不断发展,OA分布区域从沿海不断扩大到内陆,对人们的生活造成严重影响,也对各国海产品进出口造成严重影响。如今已成为国际上高度关注的食品安全问题。在日本,OA的检测方法是生物法,其最低检出限是0.05 MU/g。在欧洲,根据(EC)853号/2004法规,已经建立最大允许水平160 μg/kg贝肉[16]。但欧洲食品安全局(EFSA)提出了将OA的最大允许水平从160 μg/kg减少至45 μg/kg(欧洲食品安全局,2008)[17]。我国通过参考各国的标准,并运用小鼠生物检测的方法确定OA含量大于0.05 MU/g的样品即被认为是有害的[18]。
4 快速检测方法
传统测定OA浓度的方法有很多,包括小鼠生物测定、高效液相色谱(HPLC)技术、蛋白磷酸酶抑制(PPI)检测等方法[19-22]。由于缺乏特异性、费时、其他物质的干扰产生假阳性以及生物伦理问题,因此其他的方法很受期待。例如高效液相色谱耦合其他各种检测器,包括质谱,串联质谱(MS/MS)都是有效识别和定量OA的方法[23-24],但是其样品准备费时费力,而且需要昂贵的设备和熟练的操作人员。因此需要发展快速检测的方法以及现场检测。
4.1 胶体金免疫层析技术(Colloidal gold immuno chromatography)
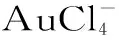
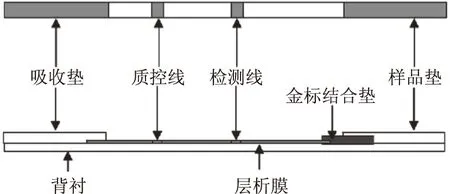
图2 免疫层析试纸条结构图Fig.2 Structure of Immune chromatography test strip
胶体金免疫层析技术就是运用免疫学中抗原抗体特异性结合的原理,在层析过程中实现这一反应,从而能够定量或半定量[29-30]检测,其准确性高,特异性强,稳定性好。与传统的小鼠生物法和 HPLC方法相比,其成本大大降低,且易于制备,价格低廉,样品只要简单的提取即可用于检测,具有检测时间短、且易于观察,也不需要专业人员操作等优点。胡乐琴[31]使用自制的腹泻性贝毒OA单克隆抗体与BSA偶联物为胶体金标记底物研究OA胶体金免疫检测术。使用粒径为30 nm的胶体金标记OA抗体依据免疫竞争法原理,建立了快速检测OA的免疫层析试纸条方法,该方法在3~5 min 即可目测判断结果,灵敏度为6.25 ng/mL。
胶体金免疫层析技术作为一种新型快速检测与诊断技术,通过不断地改进和完善,控制胶体金的稳定性与存放时间,提高整体检验的灵敏度或将对水产品中OA的检测得到快速的发展。
4.2 生物传感器技术(Biosensor technology)
生物传感器是一门由生物、化学、物理、医学、电子技术等多种学科互相融合发展起来的高新技术,在生物医学、环境检测、食品、医药以及军事医学等领域有着重要应用价值。生物传感器通过固定化的生物活性物质(酶、抗原、抗体等)作为生物敏感单元,对待测物质具有高度选择性的检测工具。生物传感器主要通过两个单元组成:识别元件与转换元件。识别元件通常为生物体分子,组织或者个体细胞分子辨认组件作为信号接收或产生部分。转换元件属于硬件仪器组件,主要是物理信号转换组件(电信号或光信号等)。其通过物理、化学型信号转换器捕获目标物与酶感基元之间的反应,再用离散或连续的电信号将反应程度表达出来,从而得出被测物的浓度。当待测物质与识别元件特异性结合后,形成复合物或产生光、电、热、声、电位等,通过换能器将转变为与待测物浓度有关的电信号或光信号输出,达到分析检测目的,如图3[32]。

图3 生物传感器的基本原理Fig.3 Basic principles of biosensors
酶电极是最早的生物传感器原型,是在20世纪60年代由Clark教授最先提出的酶电极设想[33]。但酶电极的寿命一般比较短暂,且高纯度的酶也相当昂贵。因此,人们开始对酶电极进行衍生,如微生物电极、细胞器电极以及新型的传感器。随后生物传感器技术作为不断发展的对象,生物传感器也日新月异。如今在OA检测上也得到了巨大的发展。Xi Z[34]研制出一种基于Love波的HepG2细胞传感器,结果表明,该传感器对OA的检测具有广泛的线性检测范围(10~100 μg/L),并且能够实时便捷的检测OA。Hayat A[35]以超顺磁珠纳米技术为基础研制一种间接竞争酶联免疫传感器。其检测限为0.38 μg/L,检测时间也只需要60 min,达到快速、高效检测的效果。Kaiqi Su[36]利用酶联免疫吸附实验ELISA定量检测的方法,研制了一种定量检测试剂盒-生物酶传感器,并研发出配套的现场快速检测仪器-仿生电子眼(Bionic e-Eye),研制出拥有我国自主知识产权的 OA 定量检测试剂盒,其检测限为0.19 μg/L,检测范围为0.2~5.0 μg/L,达到了国外同类试剂盒的技术指标,同时配套研发的基于移动终端的 Bionic e-Eye用于OA毒素的现场检测,能够达到商用酶标仪在实验室环境下的检测水平。填补了OA毒素现场检测仪器的空白,因此具有良好的研究价值和实际应用前景。
随着生物传感器的不断发展,多科学相互融合,生物传感器具备选择性好,灵敏度高,特异性强,分析速度快,成本低廉,能在复杂的体系中进行连续监测,具有高度的自动化,微型化,集成化,减少对使用环境和技术的要求,也适合在现场分析,在多科学领域都有相当大的应用价值,也在食品检测行业得到显著的发展。
4.3 化学发光免疫分析技术(chemiluminescence immunoassay,CLIA)
化学发光免疫分析是由免疫分析技术和化学发光技术融合而成的一种快速检测技术,是利用仪器分析化学反应产生光的强度来确定待测物的浓度。化学发光免疫分析技术是化学发光物质标记抗原抗体物质,在与待测的抗原或抗体结合后,将被标记的结合物提取出来,再与相关物产生化学发光,从而对抗原或抗体进行定量或定性检测[37]。目前在食品行业多检测生物毒素[38],微生物[39],兽药残留[40],农药残留[41]等。
化学发光免疫分析技术根据方法可分为三类:化学发光标记免疫分析、酶标化学发光免疫分析以及电化学发光免疫分析。化学发光标记免疫分析是在抗原或抗体上直接标记化学发光物质,再与待测抗原或抗体结合,通过检测发光物质的光强度进行定性或定量分析。通常用鲁米诺类,吖啶类和铱复合物物质作为发光物[42]。酶标化学发光免疫分析是用酶作为标记物,标记在抗原抗体上,在酶与发光底物的作用下产生光信号。一般使用的酶主要是碱性磷酸酶(ALP)以及辣根过氧化物酶(HRP)。这两种酶均有相应的化学发光底物,利用一些胺类,酚类以及他们的衍生物能够增强发光的作用[43]。王权[44]等人建立了酶促化学发光检测技术并初步研制出试剂盒,样品检测限为1.232 ng/kg。刘威等[45]人建立了更加可靠的DSP细胞F-肌动蛋白荧光检测法,其利用鬼比环肽标记F-肌动蛋白,通过酶标仪检测荧光强度检测样品样品中的OA,通过发光强度定量地检测毒素的含量。并与ELISA结果进行比较。该方法比ELISA方法的检出率高出5%。电化学发光免疫分析技术是由电化学反应引起的化学发光过程。是在电流或电压的条件下,在电极上发生电化学反应而产生激发态,当激发态转变成基态时所产生的发光现象。电化学发光的底物一般多为钌联吡啶[Ru(bpy)3]2+,能与抗原抗体结合成标记抗原抗体。电化学发光技术具有灵敏度高,准确快速而且可进行重复检测,自动化等优点[46]。
5 展望
随着科学的发展,对OA的毒理、药理研究不断的深入,对OA检测发展有重要的意义。高灵敏,高通量,现场检测是OA检测发展趋势,如今在OA检测中多用酶作为显色媒介,由于酶具有不稳定性,研制取代酶的发光媒介是未来OA检测的发展方向。
[1]石琛,刘美玲,王丽坤. 赤潮的产生和对环境的影响[J]. 绿色科技,2015(11):210-210.
[2]杨斌,石华先,钟秋平,等. 中国边缘海生态环境演变及其影响因素研究[J]. 钦州学院学报,2016,31(1):1-10.
[3]冯振洲. 腹泻性贝毒OA与DTX1制备方法的初步研究[D]. 青岛:中国科学院研究生院(海洋研究所),2010.
[4]李晨望. 基于GNPs-SiNRs试纸条的大田软海绵酸快速检测技术研究[D]. 福州:福建农林大学,2016.
[5]李琳. 大田软海绵酸免疫亲和柱的开发及初步应用[D]. 吉林:吉林大学,2015.
[6]李美慧,李爱峰,曹际娟,等. 我国常见的几种脂溶性贝毒的研究进展[J]. 生命科学,2016(1):33-43.
[7]王合叶,赵永富,崔彦兵,等.γ辐照对水和扇贝中大田软海绵酸降解效果的研究[J]. 核农学报,2016,30(4):704-709.
[8]Broetto N,Hansen F,Brolese G,et al. Intracerebroventricular administration of okadaic acid induces hippocampal glucose uptake dysfunction and tau phosphorylation[J]. Brain Research Bulletin,2016,124:136-143.
[9]Li H,Wu X,Wu Q,et al. Green tea polyphenols protect against okadaic acid-induced acute learning and memory impairments in rats[J]. Nutrition,2014,30(3):337-342.
[10]Pivovarov A,Murzina G,Tret’Yakova M,et al. The Role of Serine/Threonine and Tyrosine Protein Phosphatases in Common Snail Command Neurons in a Cellular Analog of Habituation[J]. Neuroscience & Behavioral Physiology,2014,44(6):640-648.
[11]Wang R,Lv L,Zhao Y,et al. Okadaic acid inhibits cell multiplication and induces apoptosis in a549 cells,a human lung adenocarcinoma cell line[J]. International Journal of Clinical & Experimental Medicine,2014,7(8):2025-2030.
[12]张锐,兰文升,贺秀媛,等. 贝类毒素大田软海绵酸OA对小鼠肝脏还原型谷胱甘肽GSH、过氧化氢酶CAT、超氧化物岐化酶SOD的影响[J]. 生物学杂志,2014,31(1):11-14.
[13]Ikema S,Takumi S,Maeda Y,et al. Okadaic acid is taken-up into the cells mediated by human hepatocytes transporter OATP1B3.[J]. Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2015,83:229-236.
[14]Surmeli Z,Gursoy P,Erdogan A P,et al. Combination of zoledronic acid and serine/threonine phosphatase inhibitors induces synergistic cytotoxicity and apoptosis in human breast cancer cells via inhibition of PI3K/Akt pathway[J]. Tumor Biology,2015,37(3):3665-3673.
[15]吕丽丽. 大田软海绵酸对人肺腺癌细胞A549增殖的影响及凋亡诱导作用研究[D]. 曲阜:曲阜师范大学,2014.
[16]EU Regulation 853/2004. Regulation(EC)No 853/2004 of the European Parliament and of the Council of 29 April 2004 laying down specific hygiene rules for food of animal origin[J]. Off J Europ Union,2004,226:22-82.
[17]Chain E P O C I. Marine biotoxins in shellfish - Yessotoxin group - Scientific Opinion of the Panel on Contaminants in the Food chain[J]. Efsa Journal,2009,7(2):n/a-n/a.
[18]GB/T 5009.212-2008 《贝类中腹泻性贝类毒素的测定》[S].2008.
[19]Prassopoulou E,Katikou P G D,Kyritsakis A. Detection of okadaic acid and related esters in mussels during diarrhetic shellfish poisoning(DSP)episodes in Greece using the mouse bioassay,the PP2A inhibition assay and HPLC with fluorimetric detection.[J]. Toxicon,2009,53(2):214-227.
[20]Wu ZQ,Wang BC,Sun YB,et al. Improvement of determination method of okadaic acid in shellfish by liquid chromatography-tandem mass spectrometry[J]. J Food Saf Qual,2015(1):265-271.
[21]Uchida H,Watanabe R,Matsushima R,et al. A convenient HPLC method for detection of okadaic acid analogs as 9-anthrylmethyl esters with automated sample cleanup by column switching.[J]. Journal of Aoac International,2014,97(2):391-397.
[22]朱昱. 贝类毒素检测技术现状与进展[J]. 科技风,2015(6):114-114.
[23]Li XJ,Peng RF,Yu H,et al. Simultaneous determination of azaspiracid and okadaicacid in shellfish by ultra performance liquid chromatography tandem mass spectrometry[J]. Chin J Health Lab Technol,2014,19:2757-2758.
[24]李晓晶,彭荣飞,于鸿,等. 超高效液相色谱-串联质谱法同时测定贝类水产品中原多甲藻酸类和大田软海绵酸类毒素[J]. 中国卫生检验杂志,2014(19):2757-2758.
[25]Lu F,Doane T L,Zhu J J,et al. Gold nanoparticles for diagnostic sensing and therapy[J]. Inorganica Chimica Acta,2012,393(12):142-153.
[26]Faulk W,Taylorn GM.An irmnunocolloidal gold method for thee lectron microscope. Immunochemistry,1971,8:1081-1087
[27]Romano EL,Stolinski C,Hughes-Jones NC.An antiglobalin reagent labelled with colloidal gold for use in electron microscopy.Immunochem,1974,11(8):521-522.
[28]杨鼎,赵世华,孙海莲,等. 胶体金免疫层析技术研究进展[J]. 畜牧与饲料科学,2013(12):31-33.
[29]Qu X,Lin H,Du S,et al. Development of a Nano-Gold Capillary Immunochromatographic Assay for Rapid and Semi-Quantitative Detection of Clenbuterol Residues[J]. Food Analytical Methods,2016,9(9):1-10.
[30]Zeng N,Wang Z,Zhang H,et al. Deep Belief Networks for Quantitative Analysis of a Gold Immunochromatographic Strip[J]. Cognitive Computation,2016,8(4):684-692.
[31]胡乐琴,马晓康,吴春燕. 抗腹泻性贝毒软海绵酸胶体金免疫快速检测技术研究[J]. 江西农业大学学报,2015,37(5):909-913.
[32]司士辉.生物传感器[M].北京:化学工业出版社,2002:12.
[33]史建国,李一苇,张先恩. 我国生物传感器研究现状及发展方向[J]. 山东科学,2015,28(1):28-35.
[34]Xi Z,Fang J,Ling Z,et al. A novel sensitive cell-based Love Wave biosensor for marine toxin detection[J]. Biosensors & Bioelectronics,2016,77:573-579.
[35]Hayat A,Barthelmebs L,Marty J L. Enzyme-linked immunosensor based on super paramagnetic nanobeads for easy and rapid detection of okadaic acid[J]. Analytica Chimica Acta,2011,690(2):248-252.
[36]Su K,Qiu X,Fang J,et al. An improved efficient biochemical detection method to marine toxins with a smartphone-based portable system-Bionic e-Eye[J]. Sensors & Actuators B Chemical,2016(2).
[37]金茂俊,王静,杨丽华,等. 化学发光免疫分析方法在食品安全检测中的研究进展[J]. 食品安全质量检测学报,2014(3):840-845.
[38]Lin C,Liu Z S,Wang D X,et al. Sensitive and reliable micro-plate chemiluminescence enzyme immunoassay for okadaic acid in shellfish[J]. Analytical Methods,2014,6(18):1.
[39]Zhang Y,Tan C,Fei R,et al. Sensitive chemiluminescenceimmunoassay for E. coli O157∶H7 detection with signal dual-amplification using glucose oxidase and laccase.[J]. Analytical Chemistry,2014,86(2):1115-1122.
[40]Tao X,Zhou S,Yuan X,et al. Determination of chloramphenicol in milk by ten chemiluminescent immunoassays:influence of assay format applied[J]. Analytical Methods,2016,8(22):4445-4451.
[41]Liu Z J,Wei X,Xu H,et al. Sensitive detection of thiacloprid in environmental and food samples by enhanced chemiluminescent enzyme immunoassay[J]. Rsc Advances,2016,6(35):29460-29465.
[42]张燕,杨金易,曾道平,等. 化学发光免疫分析技术及其在食品安全检测中的研究进展[J]. 食品安全质量检测学报,2013(5):1421-1427.
[43]于秀霞. 化学发光功能化纳米材料在新型生物传感器中的应用[D]. 合肥:中国科学技术大学,2014.
[44]王权. 海产品中大田软海绵酸和水产品中药物残留快速检测新技术的研究及应用[D]. 南京:南京农业大学,2011.
[45]刘威,孟繁霞,黄海燕,等. 腹泻性贝类毒素细胞F-肌动蛋白荧光检测法条件优化[J]. 卫生研究,2015,44(5):857-859.
[46]代润泽,邓建成. 化学发光免疫分析方法与应用进展[J]. 化工设计通讯,2016,42(1):106-106.
Progress in application of okadaic acid and rapid detection technology
QUAN Hao-ran1,PANG Lin-jiang1,ZHANG Yi-ming1,*,SUN Ying2,XUE Chao-bo2,LU Xing-hua1
(1.School of Agricultural and Food Science,Zhejiang A & F University,Lin’an 311300,China; 2.Zhoushan Institute for Food and Drug Control,Zhoushan 316021,China)
The okadaic acid is the representative of the diarrhetic shellfish poisoning in Marine toxin.Currently,detection methods of okadaic acid have drawbacks that consuming time and energy,expensive equipment,being incapable of rapid detection.This paper introduces the structure,toxicity and pharmacology of okadaic acid.The author introduces rapid detection technology of okadaic acid:colloidal gold immuno chromatography,biosensor technology,chemiluminescence immunoassay,and looks forward to the future development of rapid detection method of okadaic acid.
okadaic acid;shellfish toxins;rapid detection
2016-10-19
权浩然(1993-),男,在读硕士研究生,研究方向:食品检测与安全研究,E-mail:450782713@qq.com。
*通讯作者:张宜明(1973-),男,博士,副教授,主要从事食品检测与安全研究,E-mail:40293866@qq.com。
浙江省科技计划项目(2016C32082)。
TS201.1
A
1002-0306(2017)11-0391-05
10.13386/j.issn1002-0306.2017.11.067
