压热-酶解法制备青芒果抗性淀粉
2017-06-23池明亮冯丽敏聂红梅陈玲玲廖夏云
池明亮,岑 莹,冯丽敏,聂红梅,陈玲玲,廖夏云
(广西中医药大学,广西南宁 530299)
压热-酶解法制备青芒果抗性淀粉
池明亮,岑 莹,冯丽敏,聂红梅,陈玲玲,廖夏云
(广西中医药大学,广西南宁 530299)
本研究采用压热-酶解法制备青芒果抗性淀粉,实验以青芒果淀粉为原料,在压热条件和α-淀粉酶作用的基础上,研究普鲁兰酶酶浓度、酶解温度、酶处理pH和酶解时间对青芒果抗性淀粉含量的影响。正交实验结果表明,压热-酶解法制备青芒果抗性淀粉的最佳条件为鲁兰酶添加量30 U/g、酶解pH5、酶解时间15 h、酶解温度60 ℃,该条件下,青芒果抗性淀粉产率最高可达7.368%。
青芒果,抗性淀粉,普鲁兰酶
抗性淀粉(RS)是一种不被人体小肠所吸收的淀粉及其降解产物[1],能够改善人体的肠道功能。抗性淀粉作为一类新型的膳食纤维,具有广泛的研究和发展前景。
制备抗性淀粉的基本原理是改变淀粉的分子结构,降低部分淀粉链长度,使其结晶结构发生变化,从而达到抗消化的作用。常用的抗性淀粉制备方法有压热处理法、酶或酸水解法(脱支法)、挤压法、超声波法等[2]。
压热法是用水调配好一定浓度淀粉乳,预糊化后经过高温高压处理,再经冷却使淀粉老化,最后干燥粉碎可制得RS3(回生或重结晶淀粉)。在压热过程中破坏了淀粉颗粒的结构,直链淀粉逐渐从淀粉颗粒中溶解出来,在冷却和凝沉过程中淀粉分子链相互靠近及重排,出现淀粉凝沉的现象,逐渐形成有序的重结晶淀粉。在结晶区会出现阻止淀粉酶活性部分结合的部分,从而对酶产生抗性。孙冉等[3]采用淀粉乳浓度为30%,压热温度为120 ℃处理60 min,制备的玉米抗性淀粉含量为11.37%。
芒果是仙人掌漆树科芒果属的多年生植物[4-5]。芒果原产于印度,唐代时被从印度引种至我国。目前我国已成为世界上第二大芒果生产国。现我国主要栽种品种有金煌芒、台农1号、凯特芒、贵妃芒、桂热芒82号、紫花芒等,不同地区主要栽种的品种不同,主产地有海南、广东、广西、云南、福建、台湾等省区[6-7]。芒果营养丰富,外形美观,香气撩人,有“热带水果之王”和“希望之果”的美称。其含有人体必需的碳水化合物、蛋白质和脂肪以及丰富的维生素A、B、C,其中维生素A的含量近4%,是果蔬之中含量最高的[8]。
青芒果的成熟度低于50%~70%,不宜鲜食。由于催熟复杂,大部分都作为废物被丢弃,浪费严重[9]。本实验对利用青芒果制备抗性淀粉的方法行了初步探究,以期利用废弃物、提高得率,并为其在淀粉工业中的应用提供一定的参考,可为抗性淀粉的提取工艺提供一定的依据,拓宽抗性淀粉的应用范围,对实现抗性淀粉商品化以及我国淀粉产业有重要的意义。
1 材料与方法
1.1 材料与仪器
青芒果 市售;耐高温α-淀粉酶、普鲁兰酶 江苏锐阳生物科技有限公司;胃蛋白酶 国药集团化学试剂有限公司;葡萄糖淀粉酶 上海源叶生物科技有限公司。
759S紫外可见分光光度计 上海棱光技术有限公司;BA210数码显微镜 麦克迪奥实业集团有限公司;YXQ-LS-50SII立式蒸汽压力灭菌柜 上海博讯实业有限公司医疗设备厂;TDHG-9503A电热恒温鼓风干燥箱 上海柏欣仪器设备厂;HH-4数显恒温水浴锅 国华电器有限公司;TGL-16G高速台式离心机 上海安亭科学仪器厂;pHS-3CpH计 上海雷磁仪器厂;100目分样筛 上虞市金鼎标准筛具厂。
1.2 制备与测定方法
1.2.1 青芒果淀粉的制备 取一定质量的青芒果,用清水清洗去皮,切成小块,用打浆机按料液比1∶2匀浆、浆液调pH为7、浸提1.5 h、再离心,离心速度3000 r/min,离心10 min,取沉淀在鼓风干燥箱中40 ℃烘干,再用粉碎机粉碎,过100目筛,得到青芒果淀粉。
1.2.2 制备抗性淀粉 用蒸馏水配制25%的淀粉乳液,调节pH为6.0,加入5 U/gα-淀粉酶95 ℃水浴30 min后,121 ℃、100 kPa高温高压处理30 min,冷却。加入普鲁兰酶(酶浓度、作用温度、pH、作用时间为进行优化的因素)进行脱支,高温灭菌后冷却4 ℃放置24 h。80 ℃烘干,粉碎过100目筛后备用。
1.2.3 抗性淀粉含量测定 参考Goni法[10],并作适当改进,具体步骤为:称取100 mg干燥样品置于50 mL离心管中,加10 mL KCl-HCl缓冲液(pH1.5),再加0.2 mL胃蛋白酶(1 g胃蛋白酶溶解于10 mL KCl-HCl缓冲液),40 ℃恒温震1 h。冷却至室温,加9 mL 0.1 mol/L马来酸缓冲液,调pH为6.0后加1 mLα-淀粉酶2000 U/mL,95 ℃恒温30 min,保持不断振荡。离心15 min(3000 r/min),倒出上清液,用蒸馏水洗涤之后,重复离心,所剩残留物加3 mL水浸润,再加3 mL 4 mol/L KOH,加入5.5 mL 2 mol/L HCl和3 mL 0.4 mol/L醋酸钠缓冲溶液,调pH为4.75,葡萄糖淀粉酶溶液0.1 mL,60 ℃恒温45 min,保持不断振荡。离心15 min(3000 r/min),沉淀用10 mL蒸馏水清洗两次并收集,与上清液合并后定容至50 mL。
用DNS法测定还原糖,称取100 mg葡萄糖,用蒸馏水溶解,定容至100 mL。选取6支25 mL具塞试管按表1所示混合,并分别加入1.5 mL DNS溶液,将各试管摇匀后沸水浴5 min,取出后迅速流水冷却,以蒸馏水定容至25 mL,在540 nm下以1号管调零,测试2到6号管的吸光度,以吸光度为横坐标,葡萄糖含量为纵坐标,绘制标准曲线。
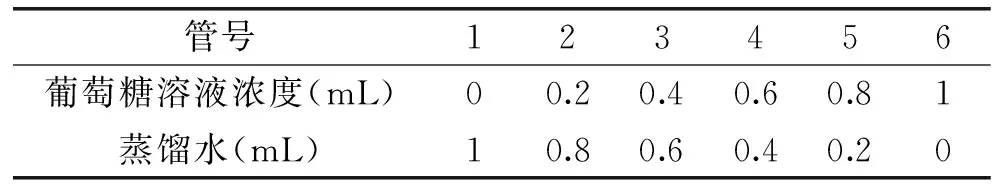
表1 葡萄糖与蒸馏水的混合量Table 1 Mixture of glucose and distilled water
取1 mL上清液至25 mL试管中,加入1.5 mL DNS,摇匀后沸水浴5 min,取出后迅速流水冷却,以蒸馏水定容至25 mL在540 nm下测定其吸光度,利用标准曲线计算出葡萄糖的含量。
1.2.4 抗性淀粉含量计算 根据葡萄糖的含量可计算得出抗性淀粉的含量
抗性淀粉含量(%)=待测液体积(mL)×葡萄糖含量(mg/mL)×0.9/分析样本的质量(g)×100
1.3 单因素实验设计
1.3.1 酶浓度 压热处理后,样品调节pH为5.0,分别添加普鲁兰酶浓度为(10、20、30、40、50 U/g),在60 ℃水浴中反应12 h条件下处理,烘干后测定RS含量。
1.3.2 酶作用温度 压热处理后,样品调节pH为5.0,添加普鲁兰酶浓度为30 U/g,分别在(50、55、60、65、70 ℃)水浴中反应12 h条件下处理,烘干后测定RS含量。
1.3.3 酶处理pH 压热处理后,样品调节pH分别为(3.0、4.0、5.0、6.0、7.0),添加普鲁兰酶浓度为30 U/g干物质,在60 ℃水浴中反应12 h条件下处理,烘干后测定RS含量。
1.3.4 酶作用时间 压热处理后,样品调节pH为5.0,添加普鲁兰酶浓度为30 U/g,在60 ℃水浴中反应时间分别为(6、9、12、15、18 h)处理,烘干后测定RS含量。
1.4 正交实验设计
在单因素实验的基础上,以抗性淀粉含量为指标,采用正交实验对普鲁兰酶作用的条件和工艺进行优化。选择酶浓度、酶作用pH、酶处理时间、酶处理温度进行4因素3水平的正交实验,利用正交表L9(34)进行实验。
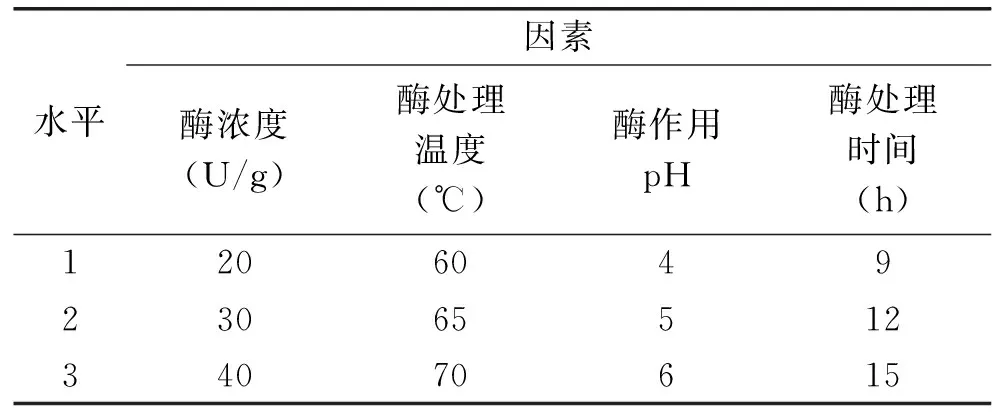
表2 正交实验因素水平表Table 2 Factors and levels of orthogonal experiment
2 结果与分析
2.1 酶浓度、温度、pH和处理时间对抗性淀粉含量的影响
2.1.1 酶浓度 普鲁兰酶酶浓度对抗性淀粉得率的影响如图1所示。由图1可知,抗性淀粉的得率随着普鲁兰酶酶浓度的增加呈现先增加后下降的趋势,且当普鲁兰酶酶浓度为30 U/g时,含量最高达7.245%。这是因为添加30 U/g的酶量时,酶的作用饱和,淀粉脱支完全,继续增加酶用量时,RS产量没有升高,反而趋于下降。

图1 酶浓度对RS含量的影响Fig.1 Effects of enzyme concentration on the yield of RS
2.1.2 酶作用温度 普鲁兰酶酶解温度对抗性淀粉含量的影响见图2。由图2可知,抗性淀粉的含量随着酶处理温度的增加呈现先增加后下降的趋势,且当酶处理温度为65 ℃时,得率最高达5.341%。这是由于普鲁兰酶的活性随着温度的升高而增强,其对淀粉的脱支作用增强,支链淀粉比例下降,直链淀粉含量上升,使得抗性淀粉含量增加;而当温度高于65 ℃,导致酶活性逐渐减弱,所以得率不会持续上升,反而得率下降。
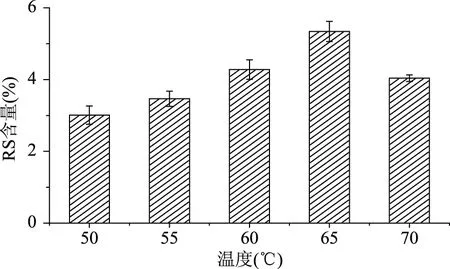
图2 酶处理温度对RS含量的影响Fig.2 Effects of enzyme hydrolysis temperature on the yield of RS
2.1.3 酶处理pH 普鲁兰酶作用pH对抗性淀粉含量的影响见图3。由图3可知,pH为5时,抗性淀粉含量最高达5.469%。这是由于普鲁兰酶的活性随pH的升高而增强,其对淀粉的脱支作用增强,使得抗性淀粉含量增加;而当pH大于5时,导致酶的活性受到抑制,其对淀粉的脱支作用减弱。
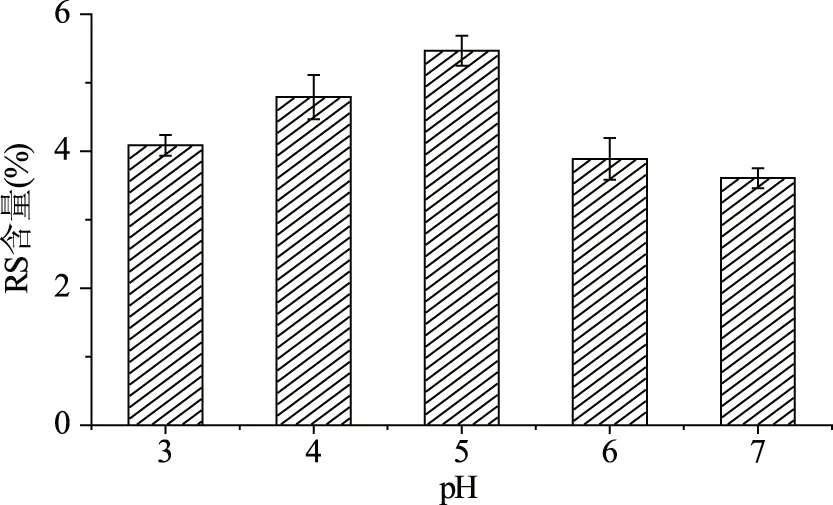
图3 酶处理pH对RS含量的影响Fig.3 Effects of enzyme pH value on the yield of RS
2.1.4 酶处理时间 普鲁兰酶作用时间对抗性淀粉含量的影响见图4。由图4可知,当酶解时间为12 h时,抗性淀粉含量最高达3.885%。这是由于普鲁兰酶能够充分作用于直链淀粉,随时间的增多而RS含量升高,其对淀粉的脱支作用增强,支链淀粉比例下降,直链淀粉含量上升,使得RS含量增加。
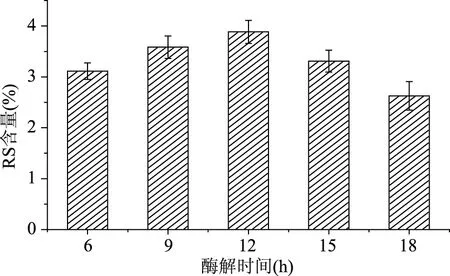
图4 酶处理时间对RS含量的影响Fig.4 Effects of enzyme hydrolysis time on the yield of RS
2.2 正交实验
由表3可知,本实验所得RS含量最高可达到7.368%。由极差分析可得影响抗性淀粉产率的各因素主次为:A(酶浓度)>C(酶处理pH)>B(酶处理温度)>D(酶处理时间),最优因素水平组合为A2B1C2D3,即添加酶浓度为30 U/g,处理温度为60 ℃,酶处理pH为5,酶处理时间15 h,采用此工艺参数所制备的抗性淀粉产率为7.368%。
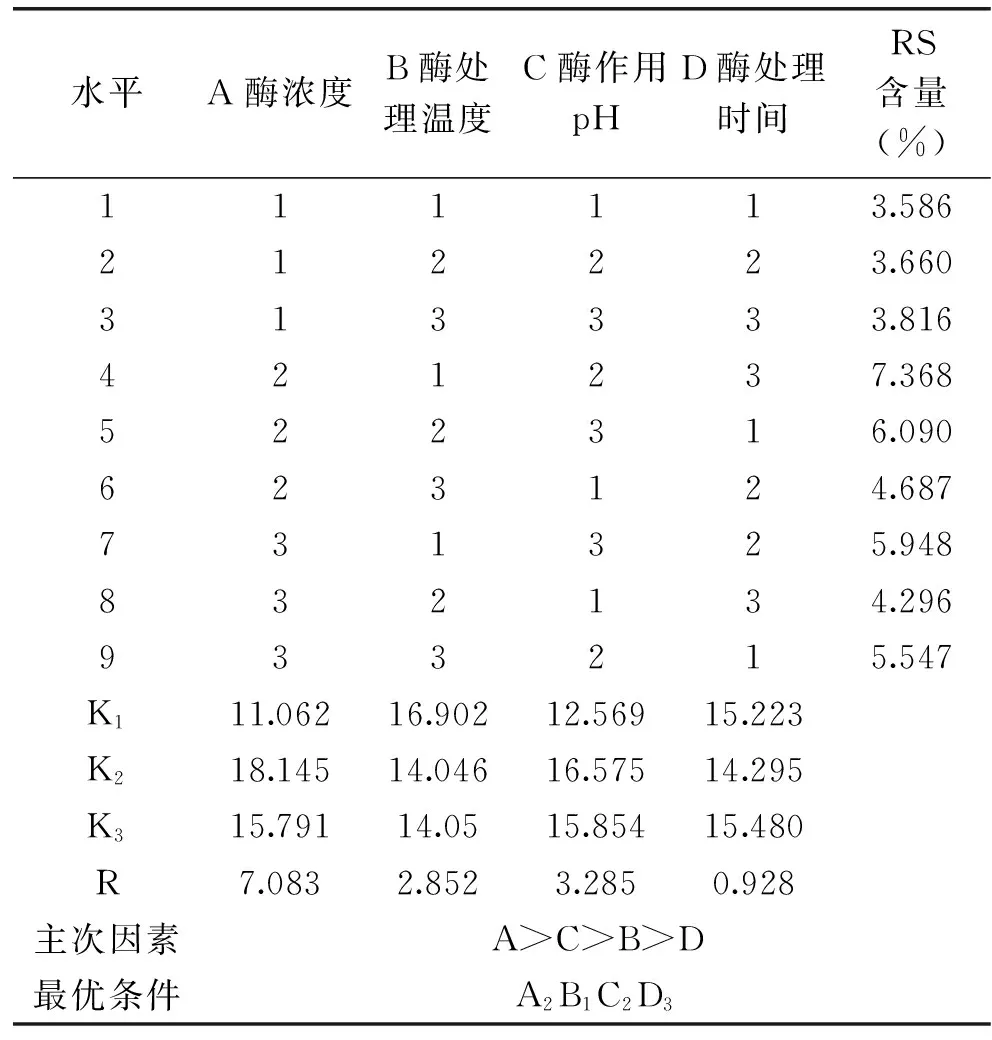
表3 正交实验结果Table 3 Results of orthogonal experiment
3 结论
本文主要研究压热处理和酶解法结合对青芒果抗性淀粉形成的影响,考察了酶浓度、酶处理时间、酶处理pH、酶处理温度对抗性淀粉得率的影响,研究结果表明,在单因素实验基础上进行正交实验得出普鲁兰酶作用各因素对抗性淀粉得率影响的主次顺序为:酶浓度>酶处理pH>酶处理温度>酶处理时间。普鲁兰酶作用最优条件:添加酶浓度为30 U/g,处理温度为60 ℃,酶处理pH为5,酶处理时间15 h,此条件下制备的青芒果抗性淀粉含量为7.368%,相比July C等人利用单螺杆挤出机生产芒果抗性淀粉[11]所采用的温度较低。
[1]Englyst H N,Trowell H,Southgate D A,et al. Dietary fiber and resistant starch[J]. American Journal of Clinical Nutrition,1987,46(6):873-874.
[2]别同玉,许加生,别同德. 我国抗性淀粉制备工艺研究进展[J]. 高分子通报,2011(5):34-37.
[3]孙冉,刘崑热. 压法制备玉米抗性淀粉[J]. 辽宁医学院学报,2012,33(4):340-342.
[4]Engel K H,Tressl R. Studies on the volatile components of two mango varieties[J]. Journal of Agricultural and Food Chemistry,1983,31(4):796-801.
[5]广州百科全书编纂委员会[M]. 广州百科全书. 北京:中国大百科全书出版社,1994:506.
[6]罗丰雷. 芒果果实活性物质分离纯化、鉴定及生物活性研究[D]. 杭州:浙江大学,2014.
[7]李日旺,黄国弟,苏美花,等. 我国芒果产业现状与发展策略[J]. 南方农业学报,2013,44(5):875-878.
[8]Andrade E,Maia J,Zoghbi M. Aroma volatile constituents of Brazilian varieties of Mango fruit[J]. Journal of Food Composition and Analysis,2000,13(1):27-33.
[9]郭安,赵粹. 一种青芒果腌菜的制作工艺[J].农产品加工·学刊,2007,6(103):22.
[10]Goni I,Garcia-Diz L,Manas E. Analysis of resistant starch:a method for foods and food products[J]. Food Chemistry,1996,56(4):445-449.
[11]Augustiniano J,González R,Flores E,et al. Resistant starch production from mango starch using a single-screw extruder[J]. Journal of the Science of Food and Agriculture,2005,85(12):2105-2110.
Preparation technology of green mango resistant starch by autoclaving-enzyme method
CHI Ming-liang,CEN Ying,FENG Li-min,NIE Hong-mei,CHEN Ling-ling,LIAO Xia-yun
(Guangxi University of Chinese Medicine,Nanning 530299,China)
In this study,green-mango-resistant starch was prepared by autoclaving-enzyme method,and green mango starch was used to produce the resistant starch. Under conditions of autoclaving and the enzymatic hydrolysis ofα-amylase,the effects of temperature,enzyme temperature,enzymatic temperature,enzyme activity and enzyme activity were studied. The results of orthogonal test showed that the optimum conditions for preparing green mango-resistant starch were 30 U/g,pH5,15 h and 60 ℃,respectively. The yield of resistant starch was up to 7.368%.
green mango;resistant starch;Pullulanase
2016-12-02
池明亮(1996-),男,本科,研究方向:食品质量与安全,E-mail:13152644921@163.com。
广西高校中药制剂共性技术重点实验室系统课题(ZJGX201403002)。
TS235.4
B
1002-0306(2017)11-0255-04
10.13386/j.issn1002-0306.2017.11.040
