催化式红外辐射预处理对糙米贮藏稳定性的影响
2017-06-23姚豪杰马海乐潘忠礼吴本刚
姚豪杰,马海乐,*,潘忠礼,吴本刚,洪 晨,王 珂
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.美国加州大学戴维斯分校生物与农业工程系,美国戴维斯 95616)
催化式红外辐射预处理对糙米贮藏稳定性的影响
姚豪杰1,马海乐1,*,潘忠礼2,吴本刚1,洪 晨1,王 珂1
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.美国加州大学戴维斯分校生物与农业工程系,美国戴维斯 95616)
本文研究了催化式红外辐射预处理对糙米贮藏稳定性的影响。先考察红外辐射时间、辐射距离和糙米初始水分含量对糙米品质的影响,得到最佳处理条件为:红外辐射时间6 min、处理距离35 cm,初始水分含量14.50%。随后在35 ℃、85% RH(相对湿度)下贮藏,通过测定贮藏期间游离脂肪酸、虫害、霉菌等来比较不同环境的贮藏效果。结果显示,红外辐射气调包装组的糙米贮藏效果最好,游离脂肪酸仅增加15.45 mg KOH/100 g,霉菌总数保持在180 cfu/g左右,未有虫害发生。以上结果表明,红外辐射预处理能有效的减缓糙米游离脂肪酸的生成,降低水分含量,并抑制虫害和霉变现象。
糙米,催化式红外,游离脂肪酸,霉菌,虫害
稻谷脱壳后即得到糙米,由果皮、种皮、糊粉层、胚乳及胚组成。糙米含有多种生物活性物质[1-2],如神经酰胺、γ-氨基丁酸、米脂纤维等,同时,糙米具有很强的生理活性,酶类丰富,呼吸旺盛[3]。因此,虽然糙米中仅含有2%的脂类,但若贮藏不当,极易在脂肪酶和微生物的共同作用下发生脂类酸败[4-5]与霉变。目前,国内外众多专家致力于改善糙米储藏稳定性的研究,近年来有微波处理法[6-7]、蒸汽法[8]等。但微波法、蒸汽法耗能严重,不利于推广。催化式红外技术是近年来国际上新兴的一种以天然气为热源的辐射加热技术,具有热效率高、快速升温、节约能耗的优点[9]。该技术已用于农副产品的杀青干燥[10]、灭菌[11]和稻谷杀虫、防霉[12]等研究工作。目前,红外辐射用于改善糙米储藏稳定性的研究仍鲜有报道。
本研究拟采用催化式红外辐射的方法处理糙米,分析红外辐射时间、辐射距离及糙米初始水分含量对糙米脂肪酶活性和发芽率的影响,在此基础上研究红外辐射预处理对糙米贮藏稳定性的影响,为糙米的安全储藏提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜粳稻(水分含量为14.50%±0.10%):江苏泰州2015年产;正辛酸(分析纯) 北京北纳创联生物技术研究院;Tween-20、橄榄油、异辛烷、乙酸铜、吡啶、孟加拉红培养基,均为分析纯 国药集团化学试剂有限公司。
催化式红外辐射设备 堪萨斯催化工业集团有限公司(图1);TM 350+红外测温仪 香港泰克曼电子仪器控股有限公司;手提式高速中药粉碎机 温岭市林大机械有限公司;低速冷冻离心机 上海安亭科学仪器厂;LRH系列生化培养箱、恒温恒湿培养箱 上海一恒科学仪器有限公司;IS-RDD3坐式恒温振荡器 上海良壹科学仪器有限公司;JLGJ45-B砻谷机 台州沃粮粮用器材有限公司;JNNJ3B检验型碾米机 浙东粮检仪器有限公司;DDS-11A电导率仪 上海雷磁新泾仪器有限公司;SW-CJ-2FD型双人单面净化工作台 苏州净化设备有限公司;T-6新世纪紫外可见光分光光度计 北京普析通用仪器有限责任公司;101-3电热恒温干燥箱、HH-S2数显恒温水浴箱 金坛市医疗仪器厂。
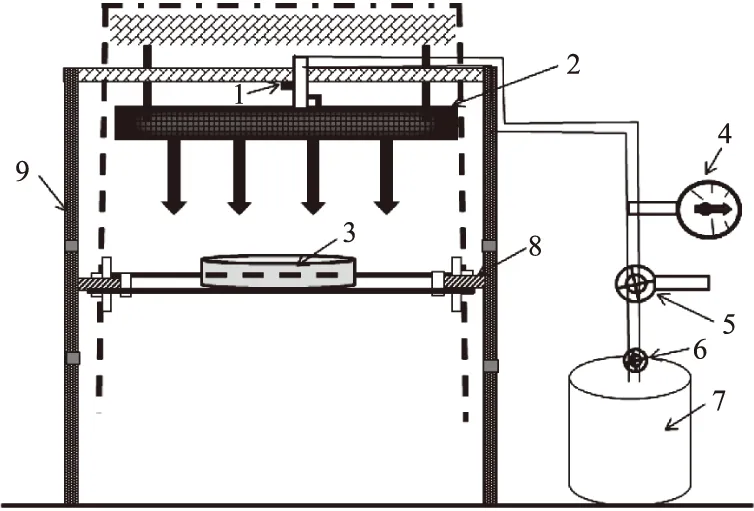
图1 催化式红外装置示意图Fig.1 Flameless gas infrared catalytic heater注:1.燃气点火开关;2.红外辐射板;3.样品盘;4.压力表;5.压力控制阀;6.燃气开关;7.液化气;8.距离调节阀;9.保温盖。
1.2 实验方法
1.2.1 红外辐射预处理 打开红外辐射装置,燃气压力1.5 kPa,待红外辐射板温度稳定(385±12) ℃后,准确称取100 g糙米,将样品放在直径20 cm的托盘中(糙米厚度0.8 cm)并置于红外发生器正下方,红外处理期间,手动晃动托盘。加水调质至糙米水分含量为16.0%~19.0%,保鲜膜密封,于4 ℃冰箱中静置、平衡12 h,实验前将样品取出在室温下放置约2 h使之温度平衡。调节红外辐射距离30~50 cm,处理3~7 min,用红外测温仪测量处理后糙米的表面温度;随即将糙米装入密封小袋,置于60 ℃烘箱中缓苏100 min。
1.2.2 强化贮藏 称取经红外辐射预处理和未经红外辐射预处理的糙米,分装在PE保鲜袋中气调包装(85% N2、15% CO2)和普通包装(橡皮筋捆扎)中。每包180 g,置于35 ℃、85% RH的恒温恒湿箱中,每隔15 d测定游离脂肪酸、脂肪酶活性、水分、电导率等指标(糙米在强化贮藏前放置两个月,导致水分降低,游离脂肪酸含量增大:水分从14.50%降至11.90%,游离脂肪酸从28.52 mg KOH/100 g增至35.76 mg KOH/100 g)。
第一组:未红外+气调包装;第二组:未红外+普通包装;第三组:红外+气调包装;第四组:红外+普通包装。
1.2.3 水分测定 水分含量采用GB 5497-1985中105 ℃恒重法测定。
1.2.4 霉菌总数的测定 按照GB 478915-2010食品安全国家标准 食品微生物学检验 霉菌和酵母计数的方法测定霉菌。
式(1)
1.2.5 脂肪酶活性的测定 参照刘洁[13]的方法,对粗酶浸提液略作修改。
粗酶浸提液的制备:选取新鲜饱满、无损伤的成熟糙米19 g,经碾米机处理后,糠粉过40目筛,称取糠粉100 mg,加入1 mL 0.1 mol/L pH7.5 Tris-HCl缓冲液,混合均匀后浸提30 min。
残余脂肪酶活性(%)=红外处理后脂肪酶活性/红外处理前脂肪酶活性×100
式(2)
1.2.6 脂肪酸吸光度标准曲线的绘制 配制不同浓度的正辛酸/异辛烷5 mL于10 mL离心管中,加1 mL脂肪酸显色剂,在混匀器上充分振荡1 min。离心后取上层有机相在710 nm以异辛烷作参比测定吸光度。
1.2.7 发芽率的测定 参照杨靖东[14]和GBT 5520-2011粮油检验 籽粒发芽实验方法,对浸泡预处理略作修改。
浸泡预处理:取经挑选、除杂、均匀的糙米将其漂洗干净,用1%的次氯酸钠溶液浸泡30 min左右(对其表面消毒),然后用去离子水冲洗5次,并用去离子水浸泡,在30 ℃恒温培养箱放置24 h,然后按照国标操作。
1.2.8 电导率的测定 参照贾少英[15]提出的方法,对浸泡预处理略作修改。
浸泡预处理:选取40粒外观无损伤的糙米,1.01 g等重,先用蒸馏水冲洗3次,然后用滤纸吸干浮水置于带塞试管中,加入50 mL蒸馏水浸泡,空白样作对照。30 ℃恒温水浴13 h后,用DDS-11A电导率仪于室温下(25 ℃)测定浸泡液的电导率。
1.3 数据统计分析
用SPSS Statistics 19软件进行差异性显著分析,利用Origin Pro 2015软件进行数据处理及绘图。
2 结果与分析
按照1.2.6的方法测定脂肪酸含量,以脂肪酸浓度为横坐标,吸光度为纵坐标绘制标准曲线。根据实验数据绘制标准曲线如图2所示。
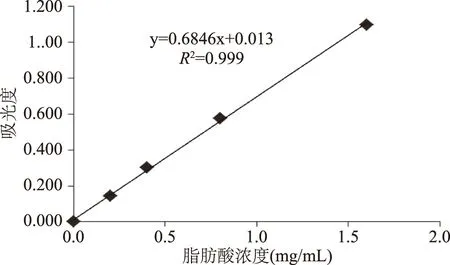
图2 脂肪酸浓度与吸光度关系标准曲线Fig.2 Standard curve of absorbance-concentration of fatty acids
由图2可知,脂肪酸浓度与吸光度两者之间的线性方程为y=0.6846x+0.013(R2=0.999),可用于测定糙米中游离脂肪酸。
2.2 红外辐射时间对糙米的影响
在糙米初始水分含量为14.50%,红外辐射距离为40 cm的条件下,处理时间对糙米脂肪酶活性和贮藏品质的影响如表1所示。
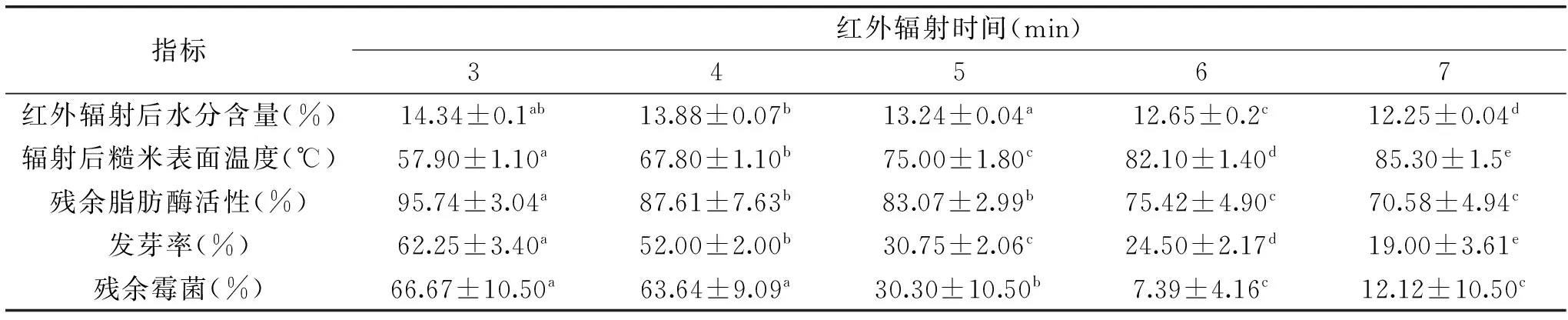
表1 处理时间对糙米的影响Table 1 Effects of treatment time on the brown rice
注:同一行的不同上标字母表示显著性差异,p<0.05(n=5),表2、表3同。
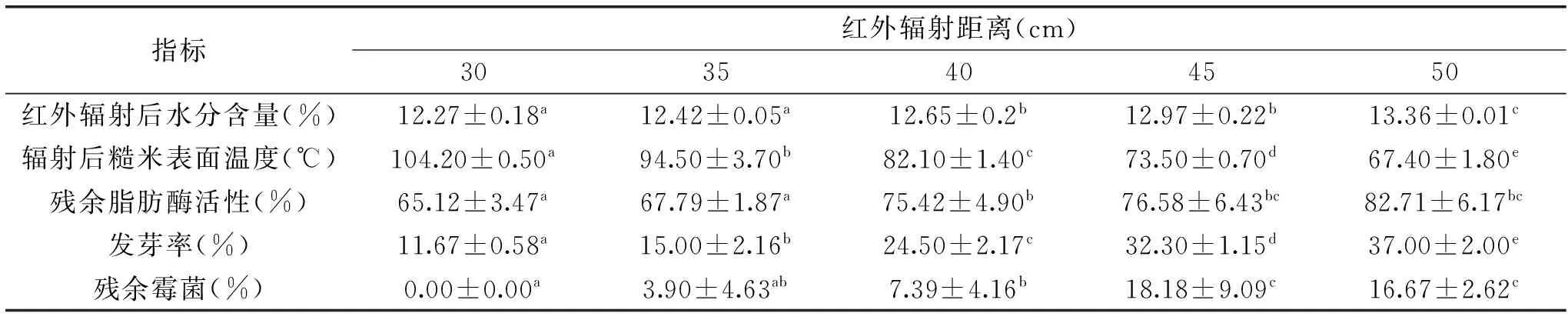
表2 红外辐射距离对糙米的影响Table 2 Effects of IR irradiation distances on the brown rice
在一定的初始水分含量与红外辐射距离情况下,经红外辐射处理后,脂肪酶活性显著下降(p<0.05)。红外辐射时间越长,糙米表面温度升高越快(p<0.05)、水分含量降低显著(p<0.05),4~5 min发芽率降低变化率最高,可能与胚的耐受程度有关;辐射时间越长,温度越高,5 min后,由于糙米内部温度梯度和湿度梯度的加大,从而加速了水分迁移的速率[16],加速水分散发;在处理6 min之后,温度约达到82 ℃,杀死大部分霉菌。综合考虑各项指标的变化规律,着重考虑脂肪酶活性的稳定和发芽率的变化情况,选择红外辐射时间6 min为最佳处理时间,在此条件下残余脂肪酶活性为75.42%,发芽率为24.50%。
2.3 红外辐射距离对糙米的影响
在糙米初始水分含量为14.50%,红外辐射时间为6 min时,红外辐射距离对糙米生理活性和贮藏品质的影响如表2所示。随着辐射距离的减小,脂肪酶活性、发芽率及水分含量均显著降低(p<0.05),这是因为红外辐射热效应加强。随着辐射距离的减小,温度越高,杀菌效果越强,与易志的结果相一致[12]。辐射距离30 cm时,杀菌效果达到100%。因此,综合考虑各项指标的变化规律,着重考虑脂肪酶活性和发芽率的稳定情况,选择红外辐射距离35 cm为最佳辐射距离,在此情况下残余脂肪酶活性为67.79%,发芽率为15.00%。
2.4 初始水分含量对糙米的影响
在红外辐射距离为35 cm,处理时间为6 min时,糙米初始水分含量对其生理活性和贮藏品质的影响如表3所示,随着初始水分的增加,脂肪酶活性显著性变化(p<0.05),但规律不明显;水分含量越高,糙米表面温度越低,可能是因为初始水分含量高造成温度、湿度梯度大,易升温,表面水分散发快速,从而降低了表面温度。初始水分越高,处理后糙米的发芽率与霉菌总数越低,可能与水分子与热的共同作用结果有关[17]。初始水分越高,红外辐射后水分含量越高,考虑到高水分不利于糙米的贮藏,因此选择糙米初始水分含量为14.50%,在此条件下,残余脂肪酶活性为67.79%,发芽率为15.00%。
2.5 强化贮藏对虫害的影响
虫害不仅使粮食受到损失,而且还能引起粮堆局部发热,从而促使霉变加剧。从图3中可以看出,强化贮藏30 d后,只有第2组的糙米中发生了虫害(米象),达到0.48头/克;继续强化贮藏后发现,第2组的虫害呈增长趋势,在60 d时达到4.12头/克,其余3组仍未检测出虫害。
2.6 强化贮藏对霉菌的影响
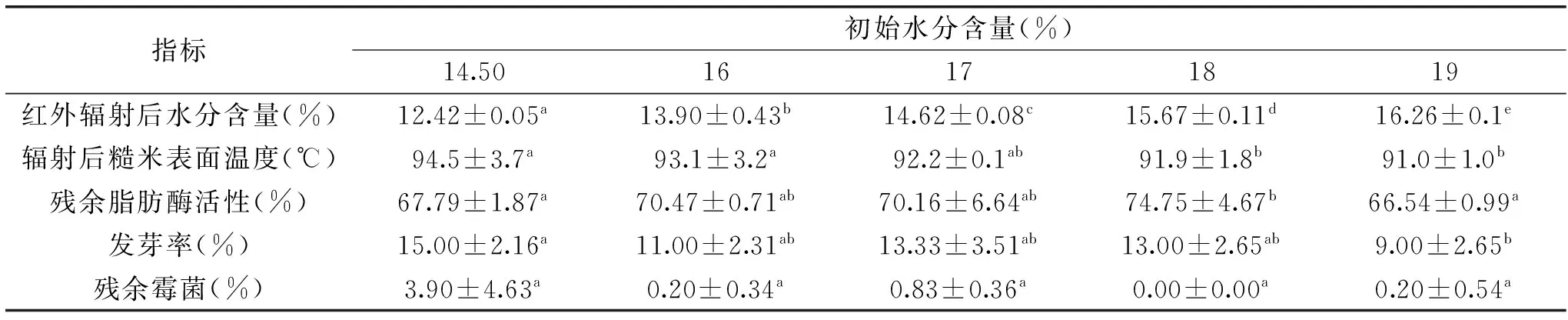
表3 初始水分含量对糙米的影响Table 3 Effects of initial water content on the brown rice

图3 强化贮藏对虫害的影响Fig.3 Effects of enhanced storage on insect pests注:第1组:未红外+气调包装;第2组:未红外+普通包装;第3组:红外+气调包装;第4组:红外+普通包装,图4~图9同。
糙米在贮藏期间易受霉菌的侵染,甚至产生霉变影响食用品质。由图4中可知,随着贮藏时间的延长,第1、2组霉菌总数基本呈升高趋势;第3、4组霉菌总数保持在180 cfu/g左右,远低于1、2组(p<0.05)。红外预处理能使霉菌在贮藏过程中保持在一个较低的程度,提高糙米贮藏稳定性。
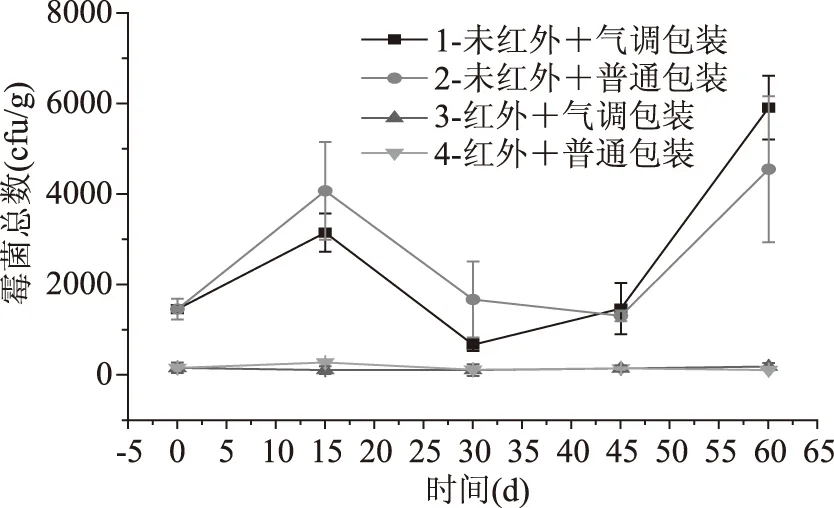
图4 强化贮藏对霉菌的影响Fig.4 Effect of enhanced storage on mould
2.7 强化贮藏对发芽率的影响
发芽率是鉴定种子生命力和新鲜程度的重要指标,可用于评定粮食在贮藏过程中的品质变化及其新鲜程度。从图5中可以观察到,随着贮藏时间的延长,红外组与未红外组的发芽率均呈下降趋势(p<0.05),但无论糙米是否经过红外辐射预处理,发芽率均在60 d左右全部丧失。这与糙米本身的耐受性有关,高温对籽粒的胚部长时间的作用,严重损伤了籽粒的发芽能力[18]。第4组糙米发芽率虽然与第2组相比下降很多,但在贮藏30 d时仍具有一定的发芽率,又未发生虫害,适宜长期贮藏。

图5 强化贮藏对发芽率的影响Fig.5 Effects of enhanced storage on germination rate
2.8 强化贮藏对电导率的影响
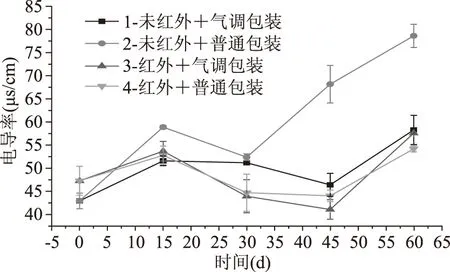
图6 强化贮藏对电导率的影响Fig.6 Effects of enhanced storage on electric conductivity
细胞膜是细胞与外界环境隔离的屏障和沟通的桥梁,在细胞代谢活动中起着重要的作用。它不仅调节细胞的物质交流和运输,还可以影响代谢途径中的酶活性[19]。细胞膜完整性的丧失使膜上的各种酶与底物接触发生酶促反应,使得糙米营养成分被降解,脂肪酸值升高[20]。因此,维持细胞膜结构的完整性,对于改善糙米贮藏稳定性非常重要。从图6中看出,电导率整体呈先升高再下降最后上升的趋势,与张玉荣所描述的现象一致[21]。这种现象可能和细胞的自我修复能力有关:在高温下,细胞膜受损导致电解质渗出;但由于细胞的自我修复能力,细胞膜得到修复,电解质渗出减少;最后由于糙米的陈化程度加深,细胞膜的通透性逐渐增大,电解质从胞内大量渗出。贮藏60 d后,第2组细胞膜的完整性最低,电导率最大,其值为78.73 μs/cm/g。而第4组电导率值仅为54.27 μs/cm/g,与第1组相比相差不大。说明红外辐射预处理能稳定糙米细胞膜完整性,间接达到改善贮藏稳定性的目的。
2.9 强化贮藏对水分含量的影响
糙米在贮藏过程中受环境因素影响而造成的失水或吸水,将会严重影响糙米的品质。从图7中可以看出,由于环境温度高、湿度大,糙米吸湿,水分含量总体呈上升趋势(p<0.05)。周玉龙[22]指出糙米水分含量一直增加,可能是糙米中水分含量低,与环境中的水分未趋于平衡所致。不同包装方式对未红外辐射糙米的水分影响显著(p<0.05),第2组水分高于第1组的原因可能与虫害现象有关,糙米内部暴露,淀粉等更易吸水。不同包装方式对红外辐射预处理糙米的水分影响不显著(p>0.05),红外预处理能使水分在贮藏过程中保持在一个较低的程度,减少游离脂肪酸的产生[23]。
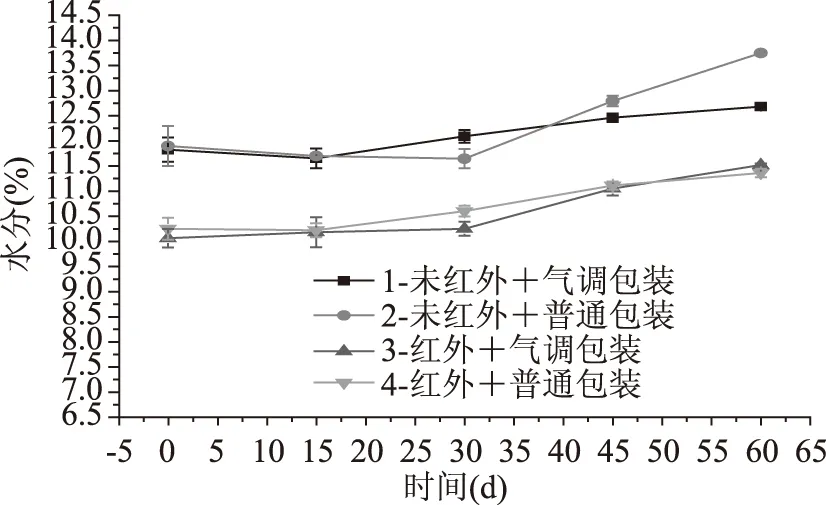
图7 强化贮藏对水分含量的影响Fig.7 Effects of enhanced storage on water content
2.10 强化贮藏对脂肪酶活性的影响
脂肪酶是脂肪分解代谢中第一个参与反应的酶,一般认为它对脂肪的转化速率起着调控的作用[24],是稻谷贮藏过程中脂肪酸败变质的主要原因之一。从图8中可以看出,在高温高湿环境下,第1、3、4组脂肪酶活性整体上呈上升趋势[25](p<0.05),第2组脂肪酶活性基本不变。随着贮藏时间延长,第3、4组脂肪酶活性仍保持在1组脂肪酶活性的70%左右,说明经红外辐射预处理后的糙米脂肪酶活性稳定;第2组与第1组相比,第2组受恶劣的高温高湿环境影响,破坏脂肪酶活性,因此脂肪酶活性没有升高。
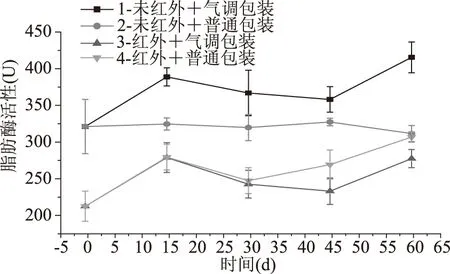
图8 强化贮藏对脂肪酶活性的影响Fig.8 Effects of enhanced storage on lipase activity
2.11 强化贮藏对游离脂肪酸的影响
游离脂肪酸常常作为糙米优劣的灵敏指标,通过游离脂肪酸的测定,可以判断糙米的贮藏情况和贮藏品质[26]。从图9中可以看出糙米贮藏过程中游离脂肪酸含量逐渐增加,红外预处理能显著调控游离脂肪酸的生成。贮藏60 d后,糙米的脂肪酸值由初始的35.76、37.49 mg KOH/100 g分别增至56.36、66.05、52.94、58.28 mg KOH/100 g。第2组游离脂肪酸值变化最大,增加30.29 mg KOH/100 g;第3组游离脂肪酸值变化最小,仅增加15.45 mg KOH/100 g;第1、4组游离脂肪酸值增加量相差不大,分别为20.60、20.79 mg KOH/100 g。
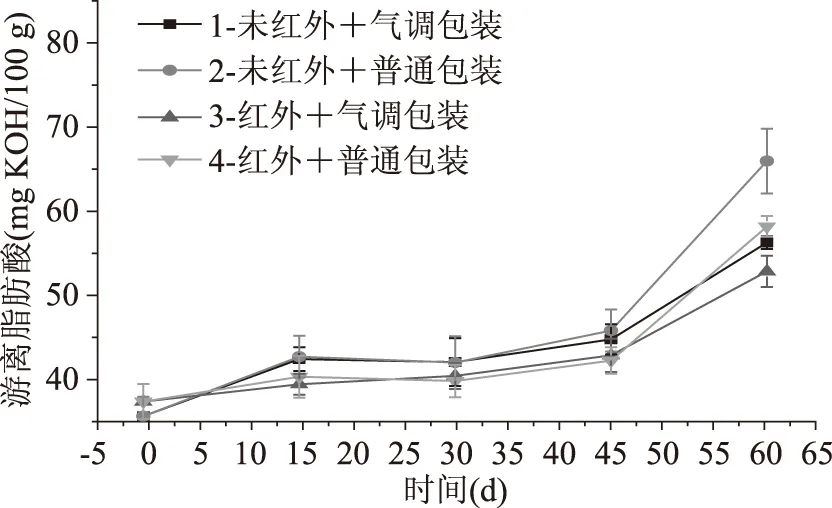
图9 强化贮藏对游离脂肪酸的影响Fig.9 Effects of enhanced storage on free fatty acids
3 结论
催化红外辐射预处理糙米,得到辐射最佳处理条件为:红外辐射时间6 min、辐射距离35 cm,初始水分含量14.50%,在此条件下,糙米的残余脂肪酶活性为67.79%,发芽率为15.00%,残余霉菌为3.90%,水分含量为12.42%。
在强化贮藏过程中,催化式红外辐射预处理使糙米水分含量维持在较低的程度,抑制霉变和虫害,显著调控游离脂肪酸的生成。催化式红外辐射可作为改善糙米贮藏稳定性的有效技术手段。
[1]张守文. 糙米的营养保健功能[J]. 粮食与饲料工业,2003(12):38-41.
[2]Zhang X,Wang L,Cheng M,et al. Influence of ultrasonic enzyme treatment on the cooking and eating quality of brown rice[J]. Journal of Cereal Science,2015,63:140-146.
[3]包金阳. 不同水分的糙米储藏品质的变化及其机理研究[D].郑州:河南工业大学,2011.
[4]张瑛. 脂肪酶和脂肪氧化酶影响稻谷储藏的作用机制研究[D].北京:中国科学院,2007.
[5]吴本刚,何荣海,潘忠礼,等.米糠微波灭酶及提油工艺研究[J].食品工业科技,2011(10):298-301.
[6]郑铁松,周瑞芳. 微波处理对稻米酶活力及品质的影响[J]. 郑州粮食学院学报,1996,17(1):1-5.
[7]张习军,熊善柏,赵思明.微波处理对稻谷品质的影响[J]. 中国农业科学,2009,42(1):224-229.
[8]张森旺,徐刚,顾震,等. 米糠的高温高压蒸汽短时钝化研究[J].粮油加工,2007(6):101-103.
[9]Z ZYP. Processing and quality characteristics of apple slices under simultaneous infrared dry-blanching and dehydration withcontinuous heating[J]. Journal of Food Engineering,2014,121:135-142.
[10]吴本刚. 胡萝卜催化式红外干法杀青-红外热风顺序联合干燥技术研究[D].镇江:江苏大学,2014.
[11]张鑫,曲文娟,马海乐,等.脱水菠菜的催化式红外辐射灭菌研究[J].食品科学,2013,34(23):133-137.
[12]易志. 稻谷催化式红外辐照防霉杀虫研究[D].镇江:江苏大学,2014.
[13]刘洁,张瑛,宋美,等.水稻种胚脂肪酶酶活的精确定量分析技术研究[J].高技术通讯,2007,17(10):1077-1081.
[14]杨靖东,姜雯翔,史晓媛,等.不同包装方式对高含水量萌芽糙米储藏的影响[J].中国粮油学报,2013,28(11):63-68.
[15]贾少英. 糙米储藏品质评价模型的建立[D].郑州:河南工业大学,2011.
[16]刘春山. 远红外对流组合谷物干燥机理与实验研究[D]. 长春:吉林大学,2014.
[17]于小禾,孙嘉文,黄卉卉,等.远红外加热对麦胚品质稳定性影响[J].现代面粉工业,2011,25(4):21-23.
[18]Han JG,Kim K,Kang KJ,et al. Shelf-life prediction of brown rice in laminated pouch by n-hexanal and fatty acids during storage[J]. Korean Journal of Food Science & Technology,1996,28(5).
[19]马成仓. Hg对油菜叶细胞膜的损伤及细胞的自身保护作用[J]. 应用生态学报,1998(3):100-103.
[20]周显青,张玉荣,王锋. 稻谷储藏中细胞膜透性、膜脂过氧化及体内抗氧化酶活性变化[J]. 中国粮油学报,2008(2):159-162.
[21]张玉荣,贾少英,周显青. 糙米储藏品质评价数学模型的建立[J]. 河南工业大学学报(自然科学版),2011(6):1-7.
[22]周玉龙,贾富国,付倩,等.贮藏条件对糙米水分变化的影响规律[J].农业工程学报,2011(7):383-386.
[23]王玉凤,孙培玲,夏吉庆. 糙米保鲜储藏技术实验研究[J]. 中国粮油学报,2009(5):95-98.
[24]李清华,郑苹立,吴方喜,等.优质耐储藏水稻的初步研究和探讨[J].中国农学通报,2009(17):47-51.
[25]叶霞. 稻谷储藏过程中重要营养素变化的动力学研究[D].重庆:西南农业大学,2003.
[26]屠洁. 科学鉴别粮食陈化及大米优劣[J]. 监督与选择,2006(6):66-67.
Effect of catalytic infrared radiation pretreatment on stability of brown rice
YAO Hao-jie1,MA Hai-le1,*,PAN Zhong-li2,WU Ben-gang1,HONG Chen1,WANG Ke1
(1.School of Food and Biological Engineering,Jiangsu University,301 Xuefu Road,Zhenjiang 212013,China;2.Department of Biological and Agricultural Engineering,University of California - Davis,Davis,CA 95616,USA)
Effect of catalytic infrared radiation pretreatment on stability of brown rice was investigated. The effects of exposure time,radiation distance and initial moisture content were determined. The optical infrared processing condition was time of 6 min,distance of 35 cm,and initial moisture content of 14.50%. The insect pest,mould,germination rate,free fatty acids were determined with enhanced storage of 35 ℃ and 85% RH(relative humidity). The results indicated that pretreatment brown rice with MAP(modified atmosphere packaging)had the best preservation effect. Free fatty acids were increased only by 15.45 mg KOH/100 g,the total number of mould remained at about 180 cfu/g,while no pest occurred. The present findings indicated that catalytic infrared radiation pretreatment effectively delayed the formation of free fatty acids,maintained low moisture content,inhibited pests and mildew formation.
brown rice;catalytic infrared radiation;free fatty acids;mould;insect pest
2016-12-08
姚豪杰(1992-),男,硕士研究生,研究方向:粮油储藏,E-mail:406220019@qq.com。
*通讯作者:马海乐(1963-),博士,教授,研究方向:食品物理技术加工,E-mail:mhl@ujs.edu.cn。
国家公益性行业(农业)科研专项(201003077);江苏高校优势学科建设工程资助项目。
TS201.1
A
1002-0306(2017)11-0102-06
10.13386/j.issn1002-0306.2017.11.011
