响应面法优化多汁乳菇多糖提取工艺及抗氧化活性研究
2017-06-23黄燕燕刘冬梅陈素芹潘伟才
黄 娟,黄燕燕,刘冬梅,*,陈素芹,潘伟才
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.深圳市大百汇技术有限公司,广东深圳 518081)
响应面法优化多汁乳菇多糖提取工艺及抗氧化活性研究
黄 娟1,黄燕燕1,刘冬梅1,*,陈素芹2,潘伟才2
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.深圳市大百汇技术有限公司,广东深圳 518081)

多汁乳菇,多糖,提取,响应面,抗氧化活性
多汁乳菇(LactariusvolemusFr.),俗名牛奶菇,是可食用的野生真菌,隶属于担子菌纲、伞菌目、红菇科、乳菇属,是树木的外生菌根菌,由于其独特的风味而被广泛地应用于烟草及食品中[1-3]。研究发现,多汁乳菇含16种氨基酸,总量为14335.3 mg/100 g,其中8种为人体必需氨基酸,含量为5938. 2 mg/100 g,含有Si、Fe、Na、Zn、Mg、Mn、Cu、Al、Ti等多种人体必需的矿物质元素且其水提物可以增强人体免疫力、对小白鼠肉瘤S-180、艾氏癌的抑制率分别达到了80%和90%[4-6]。
大量研究表明多糖具有广泛的抗菌、抗氧化、抗疲劳、降血糖血脂、抗病毒、抗癌等生理活性,但多汁乳菇多糖(Lactariusvolemuspolysaccharide,LVP)作为一种新型活性物质,却鲜少有关于其提取工艺、化学结构、构象、构效关系、生理活性等方面的报道[7-8]。多糖的提取方法较多,常见的有酶提法、水提法、酸提法、碱提法、微波辅助及超声波辅助法[9]。酶制剂价格昂贵,不适宜工业制备应用;酸提和碱提会对多糖的活性造成一定的破坏作用;虽然水提法费时长、耗能高,但其能最大程度地保护多糖的生物活性;微波和超声波辅助是一种新型的辅助技术。近年,超声波技术广泛应用于天然活性物质的提取,可节省浸提溶剂,提高效率,已经被国内外很多提取工业应用[10]。目前,国内外有关应用超声波技术对 LVP提取及抗氧化活性的研究报道较少,目前仅张水花[8]等人通过正交设计法优化了多汁乳菇多糖的微波辅助提取工艺并对多汁乳菇多糖的DPPH自由基清除活性进行了测定。

1 材料与方法
1.1 材料与仪器
多汁乳菇干子实体 云南市场采购;无水乙醇 广州卯林仪器有限公司;抗坏血酸(VC)、二苯基苦味酰基苯肼(DPPH)、2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、H2O2、焦棓酸、三羟基甲基氨基甲烷(Tris)、HCl、磷酸二氢钠、磷酸氢二钠、FeSO4、水杨酸、过硫酸钾 广州蓝泽生物科技有限公司(所有试剂均为分析纯)。
RT-25超细粉碎机 上海比仪器制造有限公司;RE-5299旋转蒸发仪 上海亚荣仪器有限公司;SJIA-10N冷冻干燥机 宁波市双嘉仪器源头厂家;7200紫外分光光度计 尤尼克(上海)仪器有限公司。
1.2 实验方法
1.2.1 多汁乳菇多糖的提取与精制 多汁乳菇干子实体粉碎过200目筛→无水乙醇、石油醚90 ℃下回流脱除脂溶性成分→抽滤→滤渣烘干→100 W超声波辅助提取10 min[10]→离心取滤液→减压蒸发浓缩→乙醇过夜沉淀→离心得粗多糖沉淀→75%乙醇洗涤沉淀→复溶于水→(单因素实验检测用的多糖样品溶液Y1)→Sevag试剂(正丁醇∶氯仿=1∶4(v/v))除蛋白→离心取上层多糖水相→二次醇沉→离心→洗涤多糖沉淀→复溶于少量水→真空冷冻干燥→复溶于水→离心除不溶物→多汁乳菇多糖精品Y2。
1.2.2 多汁乳菇多糖检测方法
1.2.2.1 葡萄糖标准曲线的制作 参照文献采用苯酚-硫酸法[11]完成,得到葡萄糖标准曲线方程:y=8.4986x-0.0186,y表示糖溶液在490 nm下的吸光值,x表示糖溶液的浓度,在0~0.05 mg/mL范围内,其线性相关系数为0.9902。
1.2.2.2 多汁乳菇多糖测定 移取少量的1.2.1中所述的Y2溶液,分别采用I2-KI、α-萘酚对淀粉及多糖进行检测验证,并采用凯氏定氮法[12]对多糖粗品中的蛋白质含量进行检测,采用上述苯酚-硫酸法对Y1和Y2样品中的多糖含量进行检测,分别按式(1)和式(2)计算多糖得率和多糖的纯度。
多糖得率(%)=c1n1V1/m×100
式(1)
多糖纯度(%)=c2V2/m1×100
式(2)
其中,c1为Y1样品稀释液对应的多糖浓度(mg/mL),V1为Y1样品稀释液体积(mL),n1为Y1样品稀释倍数,m为原材料菇粉的质量(mg);c2为精制品Y2稀释液浓度(mg/mL),V2为精制品Y2稀释液体积(mL),m1为精制品Y2的质量(mg)。
1.2.3 单因素实验 精确称取(2.0±0.01) g多汁乳菇子实体粉末于锥形瓶,按液料比为30∶1 mL/g的比例加入水浸提溶剂,分别于40、50、60、70、80、90、100 ℃的磁力搅拌水浴锅中恒温浸提3 h,探究浸提温度对多汁乳菇多糖得率的影响;同样地,按液料比为30∶1 mL/g的比例加入水浸提溶剂,在90 ℃的磁力搅拌水浴锅中分别恒温浸提0.5、1.0、1.5、2.0、3.0、3.5、4.0、5.0 h,探究浸提时间对多汁乳菇多糖得率的影响;分别按液料比为10∶1、15∶1、20∶1、25∶1、30∶1、35∶1、40∶1、45∶1、50∶1 mL/g依次加入水浸提溶剂,在90 ℃的磁力搅拌水浴锅中恒温浸提3 h,探究液料比对多汁乳菇多糖得率的影响。所有实验组别均按照1.2.1所述工艺进行。
1.2.4 响应面法实验设计 依据1.2.3实验结果,按表1进行三因素三水平的CCD中心组合实验,包含了20组,所得数据通过式(3)进行曲面拟合[13-14]。
Y=k0+k1A+k2B+k3C+k4AB+k5AC+k6BC+k7A2+k8B2+k9C2
式(3)
其中,Y为响应值,k1~k9均为多项式系数,在实际响应面和等值线图基础上回归分析确立,A、B、C为独立变量的水平编码值。
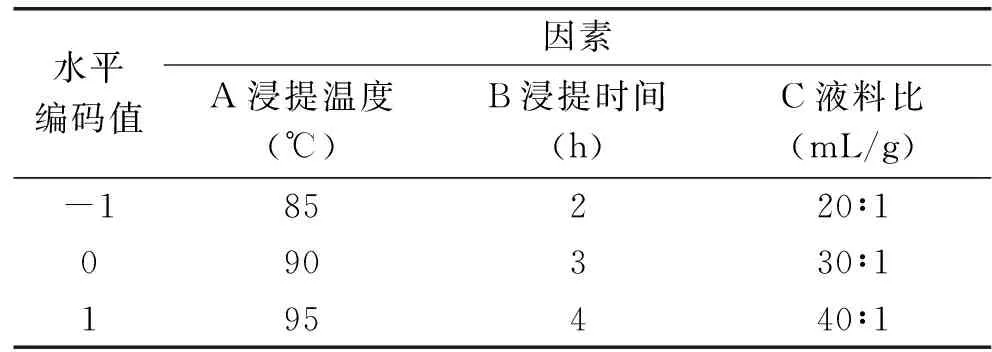
表1 多汁乳菇多糖提取CCD因素水平设计Table 1 Factors and levels in response surface designfor extraction of crude polysaccharides from wild Lactarius volemus
1.2.5 多汁乳菇粗多糖的抗氧化活性研究


式(4)
其中,A2为加入了焦棓酸与样品的实验组所得吸光值,A0只加入焦棓酸的对照组,A1仅加入了样品的对照组,均以不加样品不加焦棓酸的Tris-HCl作空白对照,且所用样品溶液分别为0~5000 μg/mL的多糖溶液和0~2000 μg/mL的VC溶液,VC作阳性对照用。
1.2.5.2 ·OH清除活性的测定 在文献[15]基础上改进实验条件,移取2 mL的9 mmol/L的FeSO4与2 mL的9 mmol/L的水杨酸-乙醇溶液混合,加入2 mL样品溶液及2 mL 0.024%(w/w)H2O2溶液,室温下放置3 min后于560 nm下测定各组吸光值,并计算其清除活性:
·OH清除活性(%)=100×[1-(B2-B1)/B0]
式(5)
其中,B2为加入了H2O2与样品的实验组所得吸光值,B1为仅加入了样品的对照组,B0则为仅加入了H2O2的对照组,均以不加样品不加H2O2的组别作空白对照,且所用样品溶液分别为0~500 μg/mL的多糖溶液和0~1000 μg/mL的VC溶液,VC作阳性对照用。
1.2.5.3 DPPH自由基清除活性的测定 在文献[15]基础上改进实验条件,移取2 mL的10 μmol/L DPPH·与2 mL样品液混合,室温黑暗条件下放置3 min,于517 nm下测定各组吸光值,并计算其清除活性:
DPPH自由基清除活性(%)=100×[1-(C2-C1)/C0]
式(6)
其中,C2为加入了DPPH·与样品的实验组所得吸光值,C0只加入DPPH·的对照组,C1仅加入了样品的对照组,均以不加样品不加DPPH·的H2O作空白对照,且所用样品溶液分别为0~20 μg/mL的多糖溶液和0~1000 μg/mL的VC溶液,VC作阳性对照用。
1.2.5.4 ABTS自由基清除活性的测定 在文献[16]基础上改进实验条件,配制7.4 mmol/L ABTS和2.6 mmol/L K2S2O8水溶液,等体积混合于黑暗条件下放置12 h,稀释40~50倍使其在734 nm下的吸光值达0.700±0.002,即为ABTS+·液,移取此ABTS+·液2.4 mL与0.6 mL的样品液混合,于室温下放置1 min,于734 nm下测定各组吸光值,并计算其清除活性:
ABTS+自由基清除活性(%)=100×[1-(D2-D1)/D0]
式(7)
其中,D2为加入了ABTS+·与样品的实验组所得吸光值,D0只加入ABTS+·的对照组,D1仅加入了样品的对照组,均以不加样品不加ABTS+·的无水乙醇作空白对照,且所用样品溶液分别为0~20 μg/mL的多糖溶液和0~800 μg/mL的VC溶液,VC作阳性对照用。
1.2.6 统计分析 实验分析所用数据是三组平行实验的均值±标准差,采用SPSS 17.0进行平行数据及组间数据之间的显著性分析,并利用Origin 9.0软件进行绘图。
2 结果与讨论
2.1 单因素实验结果分析
如图1A所示,在40~100 ℃ 浸提温度范围内,多糖得率随着温度的升高而升高,可能原因是在此温度范围内作用多汁乳菇子实体粉末,升高温度加快了真菌细胞质壁分离的速度,此时,液泡中的物质(包括多汁乳菇多糖)穿过细胞壁,扩散到外部溶剂水中的速度也随之加快[17-18]。在80~100 ℃ 浸提温度范围内,多汁乳菇多糖得率达到2.12%~2.29%相对较高水平,表明浸提温度是影响多汁乳菇多糖得率的关键因素之一。
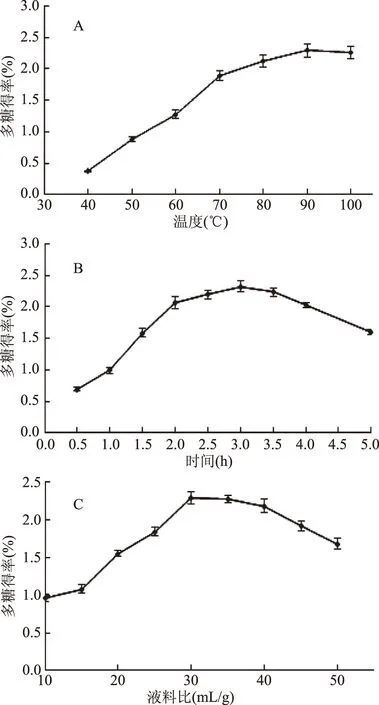
图1 浸提温度(A)、浸提时间(B)、液料比(C)对多糖得率的影响Fig.1 Effect of temperature(A),time(B)and ratio of water to material(C)on yield of LVP
如图1B所示,在0.5~5 h 浸提时间范围内,多糖得率随着时间的推移先升高后有所降低,可能原因是作用时间越长,对多汁乳菇子实体细胞壁的破坏越充分,促使了多糖的释放,但超出一定的作用时间,多糖结构将受到一定程度的破坏而降低多糖得率[17-18]。在2~4 h浸提时间范围内,多汁乳菇多糖产量达到2.06%~2.32%相对较高水平,表明浸提时间是影响多汁乳菇多糖得率的关键因素之一。
如图1C所示,在10~50 mL/g液料比范围内,随着液料比的增大,多糖得率先升高至2.29%,后降低至1.68%,可能原因是,液料比增大促使多汁乳菇子实体粉末与提取溶剂的接触面积增加,从而使得多糖在水中的溶解量增加,但当液料比超出一定范围时,多汁乳菇多糖在水中的溶解量达到饱和状态[17-18],从而导致多糖得率有所降低。在20~40 mL/g液料比范围内,多汁乳菇多糖得率达到1.55%~2.29%相对较高水平,表明液料比是影响多汁乳菇多糖得率的关键因素之一。
2.2 响应面法设计对多汁乳菇多糖得率的影响
依据CCD模型,评判浸提温度、浸提时间及料液比三因素对多糖得率的影响程度,结果如表2所示。多重回归分析揭示了多糖得率响应值与实验变量之间的关系,可通过如下的表达式进行描述:
Y(%)=2.24+0.043A+0.095B+0.098C-0.14AB+0.17AC+0.087BC-0.33A2-0.049B2-0.26C2
式(8)
其中,A、B、C分别取浸提温度、浸提时间及液料比的编码值。
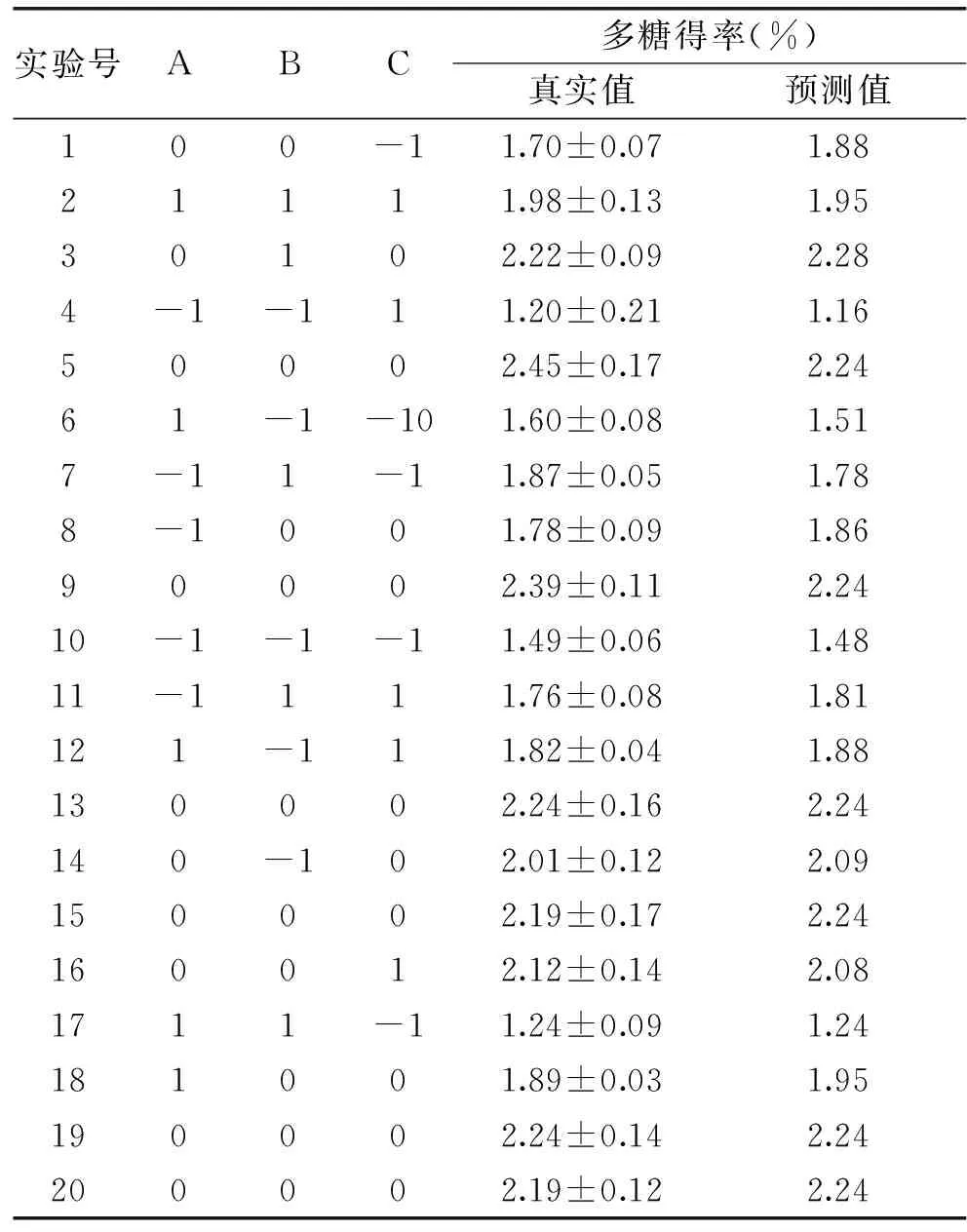
表2 CCD实验真实值与拟合方程预测值Table 2 Forecast values by fitting equation and real values of CCD experiments
式(8)中的三个变量参数对多糖得率影响的显著性可通过表3中的F值和p进行表征,当F值绝对值越大时,p越小,两组数据之间具有明显的一致性。按p<0.05进行筛选,易知,对于多糖得率影响较大的有B、C、AB、AC、A2、C2。模型对应的显著性水平远小于0.01,说明此模型用于拟合分析A、B、C三因素对多糖得率的影响是具有显著性的,即该模型是适宜的。该模型缺少的拟合值的显著性为0.3307,远远大于0.05,这说明缺乏的拟合值并不重要。该模型对应的R2为0.9344,接近于1,表明此模型与真实数据之间具有良好的适用性。综上可知,该回归模型较好地定义了该系统中各因素与多糖得率之间的关系及任意两个变量之间的相互联系。图2为三维响应曲面和等高线图,如图2a所示,当液料比处于0这个中间层次时,观察浸提温度和浸提时间之间形成的等高线图,呈明显的椭圆形状,表明二者的交互作用对多糖得率有显著性的影响(p<0.05),同样的现象可在图2b中观察到,这表明浸提温度和液料比的交互作用对多糖得率也有显著的影响,与表2中的实验结果一致。
通过建立这个CCD模型进行多糖得率的预测分析,得出多汁乳菇多糖最高得率预测值为2.32%,对应于如下条件:89.69 ℃的浸提温度,4 h的浸提时间,33.42 mL/g 的液料比,根据实验的可操作性,实际采用参数为:浸提温度90 ℃,浸提时间4 h,液料比33∶1 mL/g,对应实际多糖得率为2.18%,与预测值无显著性差异(p>0.05)。并采用I2-KI溶液、α-萘酚对所得多汁乳菇多糖提取物进行了淀粉及多糖验证分析,结果显示,多汁乳菇多糖提取物中不含有淀粉,确实含有多糖;分别采用凯氏定氮法、苯酚-硫酸法检测所得提取物,显示蛋白含量为11.37%,多糖纯度为55.40%。

表3 CCD实验结果的方差分析Table 3 Variance analysis of CCD experimental results
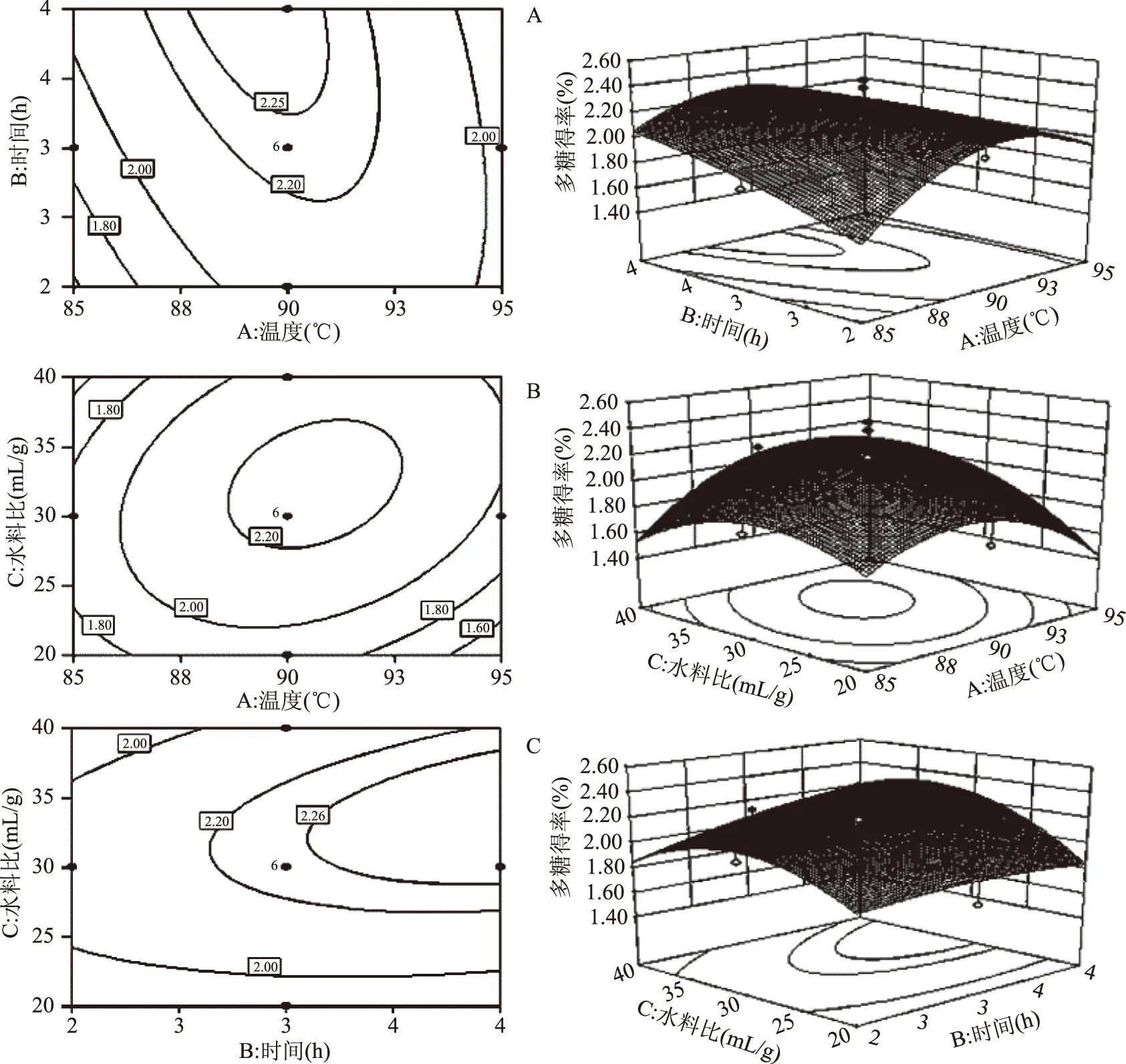
图2 多糖提取因素实验的CCD拟合响应曲面分析图及等高线图Fig.2 CCD fitting response surface and contour plots analysis for polysaccharide extraction factor experiments
2.3 多汁乳菇粗多糖的抗氧化活性
2.3.2 多汁乳菇多糖对·OH的清除活性 ·OH很容易穿过细胞膜,导致组织病理特征的出现和细胞死亡,因此清除·OH尤为重要。VC和多汁乳菇多糖清除·OH的活性在图3B中给出,结果表明,·OH清除活性随着多糖浓度的增加而增加,当多糖浓度为1000 μg/mL时,其清除活性高达95.56%,多汁乳菇多糖及VC对·OH清除活性的IC50值分别为:280.00、178.10 μg/mL,低于文献[20]报道的新型冬虫夏草多糖的IC50值0.76 mg/mL,表明多汁乳菇多糖具有良好的·OH清除活性。
2.3.3 多汁乳菇多糖对DPPH自由基的清除活性 DPPH自由基很容易接受抗氧化剂而被清除,是一种在517 nm下有最大吸收的稳定自由基,其被广泛地应用于天然分子自由基清除活性的测定反应中。多汁乳菇多糖和VC分子清除DPPH自由基的活性见图3C,结果表明,其清除活性也与样品的浓度有关,且样品的清除活性低于VC,当多糖浓度为1000 μg/mL时,其清除活性高达95.62%,多汁乳菇多糖及VC对DPPH清除活性的IC50值分别为:342.06、5.90 μg/mL,二者分别低于文献[7]中的报道值665、18 μg/mL,表明多汁乳菇多糖具有良好的DPPH自由基清除活性。
2.3.4 多汁乳菇多糖对ABTS自由基的清除活性 VC和多汁乳菇多糖清除ABTS自由基活性如图3D所示,在多糖浓度为100~800 μg/mL的范围内,其清除活性与多糖的浓度呈正相关作用,且清除活性最高为98.89%,多汁乳菇多糖及VC对ABTS清除活性的IC50值分别为:167.65、10.57 μg/mL,稍低于文献[20]报道的新型冬虫夏草多糖的IC50值0.22 mg/mL,表明多汁乳菇多糖具有良好的ABTS自由基清除活性。

图3 样品对各种自由基的清除活性分析Fig.3 The scavenging activity of samples on four radicals
3 结论
本文对多汁乳菇多糖的提取条件进行了CCD优化处理,最终确立了其最优提取条件为:浸提温度90 ℃,浸提时间4 h,液料比33∶1 mL/g。在最优提取条件下,多汁乳菇多糖得率达2.18%,与预测值一致,且稍高于文献[7]报道值2.09%±0.03%,证明本文对多汁乳菇多糖的提取工艺采取的优化处理是有效的。
通过对多汁乳菇多糖粗品检测验证分析,证实此粗品确实含有多糖,且多糖纯度为55.40%。
[1]王俊燕,蒋世铮. 阿尔泰山的优质食用菌-多汁乳菇[J]. 食用菌,2002,24(5):4.
[2]计红芳,杨谦,宋瑞清. 乳菇属真菌应用研究进展[J]. 林业科技,2006,31(3):28-30.
[3]胡先运,王传明,江家志,等. 多汁乳菇的研究及应用[J]. 北方园艺,2014,18(5):157-160.
[4]刘佳,高敏,殷忠. 贵州野生多汁乳菇氨基酸成分及致小鼠突变性实验[J]. 预防医学情报杂志,2007,23(2):230-232.
[5]柯丽霞. 红汁乳菇和多汁乳菇的化学成分及其开发利用前景[J]. 安徽师范大学学报:自科版,2000,23(4):391-394.
[6]胡先运,王传明,张根,等. 多汁乳菇人工繁育及抗肿瘤活性[J]. 中国实验方剂学杂志,2014,20(22):161-164.
[7]Xie M H,Luo Z Z,Hu Y T,et al. Extraction and Antioxidant Activity Analysis of Crude Polysaccharides from Wild Lactarius volemus Fr. in Yunnan Province[J]. Agricultural Biotechnology,2015,4(6):53-56.
[8]张水花,江永刚,赵红艳. 多汁乳菇多糖的微波辅助提取工艺及其清除DPPH自由基研究[J]. 北方园艺,2016,14:135-138.
[9]董汝晶. 多糖提取方法的研究进展[J]. 农产品加工(学刊),2014,(8):46-48,51.
[10]何雪梅,孙健,李丽,等. 响应面法优化蔗梢多糖超声波提取工艺[J]. 南方农业学报,2014,(3):458-462.
[11]张志军,刘建华,李淑芳,等. 灵芝多糖纯度的苯酚硫酸法检测研究[J]. 食品工业科技,2006,34(2):193-195.
[12]陈智慧,史梅,王秋香,等. 用凯氏定氮法测定食品中的蛋白质含量[J]. 新疆畜牧业,2008,12(5):22-24.
[13]Tahmouzi S. Optimization of polysaccharides from Zagros oak leaf using RSM:antioxidant and antimicrobial activities[J]. Carbohydrate Polymers,2014,106(1):238-246.
[14]柳杨,罗瑞明. 长枣多糖水提工艺参数的响应面分析及优化[J]. 食品与机械,2010(5):128-130.
[15]Huang X Q,Tu Z C,Jiang Y,et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of lentinan[J]. International Journal of Biological Macromolecules,2012,51(5):926-932.
[16]张乃珣,尹红力,赵鑫,等. 红松多酚与真菌多糖联合清除ABTS自由基活性比较[J]. 北京林业大学学报,2016,35(10):104-111.
[17]张颖,潘俊羽. 枇杷叶多糖水提醇沉法的提取条件优化[J]. 贵州农业科学,2014(6):161-163,167.
[18]陈建斌,李冲伟. 响应面法优化紫苏多糖的水提工艺[J]. 食品研究与开发,2014(9):27-31.
[19]Du X J,Zhang Y,Mu H M,et al. Structural elucidation and antioxidant activity of a novel polysaccharide(TAPB1)from Tremella aurantialba[J]. Food Hydrocolloids,2015,43(4):459-464.
[20]Li Y T,Meng S L,Shi M,et al. Bioactivity Evaluation of Crude Polysaccharide from Rice Bran Fermented by Preussia Aemulans and the Changes in its Nutritional Contents[J]. Journal of Food Biochemistry,2016,40(5):664-672.
Optimization of extraction process of polysaccharides from wildLactariusvolemusby response surface method and investigation of antioxidant activity
HUANG Juan1,HUANG Yan-yan1,LIU Dong-mei1,CHEN Su-qin2,PAN Wei-cai2
(1.Institute of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China;2.DaBaihui Company of Technology,Shenzhen 518081,China)
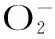
LactariusVolemus;polysaccharides;extraction;response surface design;antioxidant activity
2016-12-29
黄娟 (1991-),女,硕士,研究方向:食品微生物利用与控制,E-mail:juanhuangscut@126.com。
*通讯作者:刘冬梅 (1972-),女,博士,副教授,主要从事食品微生物利用与控制研究,E-mail:liudm@scut.edu.cn。
深圳市未来产业专项资金项目(CXZZ20140902155219302);国家自然科学基金项目 (31101254);广东省科技计划项目(2014A020208019)。
TS201.1
A
1002-0306(2017)11-0055-06
10.13386/j.issn1002-0306.2017.11.002
