组合型人工肾对维持性血液透析患者矿物质代谢的影响
2017-06-23杨福燕宋娟段坤
杨福燕 宋娟 段坤
·论著·
组合型人工肾对维持性血液透析患者矿物质代谢的影响
杨福燕 宋娟 段坤
目的 探讨组合型人工肾技术对维持性血液透析(maintenance hemodialysis,MHD)患者矿物质代谢的影响。方法 选择2012年1月至2013年8月在新乡市血液净化中心行MHD治疗3个月或以上的患者110例。按照随机数字表法将110例患者分为常规血液透析(hemodialysis,HD)组55例和组合型人工肾组55例。HD组患者每周行3次血液透析治疗,而组合型人工肾组患者每周行2次常规HD治疗加1次组合型人工肾治疗[将HD管路与血液灌流(hemoperfusion,HP)管路串联,选用透析模式,2 h后用盐水将灌流器及管路的血冲洗干净后迅速撤掉,再继续进行2 h的HD]。监测治疗前和治疗3个月后MHD患者外周血中血钙、血磷、血全段甲状旁腺素(intact parathyroid hormone,iPTH)及碱性磷酸酶(alkaline phosphatase,ALP)等矿物质代谢的评估指标。结果 2组患者治疗前血钙、血磷、iPTH及ALP水平比较,差异无统计学意义(均P>0.05)。治疗3个月后,HD组血钙、iPTH和血ALP与治疗前比较,差异无统计学意义(均P>0.05);而血磷低于治疗前水平,差异有统计学意义(P<0.05)。组合型人工肾组治疗后血磷、iPTH和血ALP较治疗前均明显下降(P均<0.01),血钙明显上升(P<0.05)。2组治疗后比较,组合型人工肾组的血钙水平较HD组明显升高(P<0.05),ALP明显降低(P<0.05),而血磷、iPTH明显降低(P<0.01)。结论 与常规血液透析比较,组合型人工肾治疗能有效清除血磷,降低血iPTH和ALP,升高血钙水平,从而改善MHD患者的矿物质代谢异常。
血液透析;血钙;血磷;全段甲状旁腺素;碱性磷酸酶
维持性血液透析(maintenance hemodialysis, MHD)是尿毒症患者维持生存的重要手段,心脑血管并发症是MHD患者的主要死因之一,其发生与矿物质代谢异常密切相关,而矿物质代谢异常又是MHD患者常见的并发症之一,并且已经成为MHD患者高病死率的一个新危险因素[1-2]。因此,有效治疗矿物质代谢异常对于提高MHD患者的生活质量、减少并发症、降低病死率尤为重要。组合型人工肾是血液透析联合血液灌流(hemoperfusion associated with hemodialysis,HP+HD)。本研究通过观察组合型人工肾对MHD患者矿物质代谢的影响,探讨治疗MHD患者矿物质代谢紊乱的方法,以提高MHD患者生存质量和生活质量。
资料与方法
一、研究对象与分组
选择2012年1月至2013年8月在新乡市血液净化中心行MHD治疗3个月或以上患者110例,男62例,女48例,年龄18~79岁,平均年龄(55.0±12.0)岁,平均透析时间(35.9±27.8)个月。入选患者均无恶性肿瘤、严重感染、严重营养不良、手术、外伤病史。原发病为慢性肾小球肾炎43例,糖尿病肾病30例,高血压肾损害21例,多囊肾病4例,梗阻肾4例,风湿病1例,其他7例。将110例MHD患者按随机数字表法分为常规血液透析(hemodialysis,HD)组55例和HP+HD组55例。HD组男33例,年龄18~75岁,平均年龄(52.0±10.0)岁;女22例,年龄20~79岁,平均年龄(55.0±12.0)岁。HP+HD组男29例,年龄19~78岁,平均年龄(53.0±13.0)岁;女26例,年龄19~76岁,平均年龄(51.0±14.0)岁。2组患者的性别构成比、年龄、原发病构成比差异无统计学意义(P>0.05),具有可比性。
二、方法
HD组患者行常规HD治疗,采用日本产尼普洛(Nippro)NCU-12,日机DBB-27c,日本东丽TR-800XUGA透析机及NipproSUREFLUX-150G,血流量250~300 ml/min,透析液流量500 ml/min,每次4 h,每周行3次HD,连续治疗3个月。组合型人工肾组每周行2次普通HD治疗,另外进行1次HP+HD治疗,采用珠海健帆生物科技有限公司生产的树脂血液灌流器HA130,首先100 mg普通肝素注入灌流器,静置30 min后,将灌流器与透析器及管路连接,用生理盐水 1 500 ml冲洗,同时用血管钳轻拍灌流器以排除气泡及除去微粒;血流速度200 ml/min,2 h灌流器饱和后给予生理盐水方法回血并取下灌流器,再继续以250~300 ml/min速度透析2 h。2组患者血管通路动静脉内瘘89例,长期中心静脉置管21例。2组患者均采用碳酸盐无糖透析液,透析用水为双级反渗水。2组患者均辅助药物治疗,包括降压、纠正贫血、补充钙剂和活化维生素D3等。2组患者服用钙剂和活化维生素D3的人数比(HD组∶HP+HD组=40.2%∶41.7%),差异无统计学意义(P>0.05),具有可比性。本治疗通过医院伦理委员会批准,取得患者知情同意。
三、诊断标准
参照美国肾脏病基金会(NKF-KDOQI)的标准[3]。尿毒症血液透析患者血钙达标值2.11~2.37 mmol/L,血磷达标值1.13~1.78 mmol/L,血全段甲状旁腺素(intact parathyroid hormone,iPTH)达标值150~300 ng/L。矿物质代谢异常的评估指标包括血iPTH、血钙、血磷、碱性磷酸酶(alkaline phosphatase,ALP)等,矫正钙(mmol/L)=血清总钙(mmol/L)+3.2×[4-血清白蛋白(g/L)][4]。
四、检测指标
入选患者均在透析当日透析前及治疗3个月后空腹抽血,离心取血清。采用日立7600-020全自动生化分析仪(比浊法)检测血清透析前、后尿素氮及血肌酐、血钙、血磷及ALP等。瑞士罗氏电化学发光仪(自动免疫分析法)检测iPTH。
五、统计学处理
应用SPSS 17.0统计软件进行分析。计数资料的比较采用χ2检验,计量资料以均数±标准差表示,2组间比较采用t检验,多组间计量资料比较采用方差分析,P<0.05为差异有统计学意义。
结 果
2组治疗前各项指标(血钙、血磷、iPIH、ALP等)无统计学差异(P均>0.05),具有可比性。治疗前血钙水平:HD组为(2.01±0.33)mmol/L,HD+HP组为(2.04±0.39) mmol/L。血磷水平:HD组为(2.24±1.38)mmol/L,HD+HP组为(2.26±1.43)mmol/L。iPTH水平:HD组为(509.47±345.60)ng/L,HD+HP组为(512.34±350.39)ng/L。HD组治疗前、后的血钙、iPTH和 ALP无统计学差异(P>0.05),血磷较治疗前有统计学差异(P<0.05)。HD+HP组治疗后血磷、iPTH和ALP与治疗前比较有统计学差异(P均<0.01),血钙较治疗前明显升高(P<0.05)。2组治疗后比较,HP+HD组血钙水平较HD组明显升高(P<0.05),ALP较HD组明显降低(P<0.05),而血磷、iPTH明显降低(P<0.01)。(表1)
讨 论
随着血液净化技术的快速发展,MHD患者的生存率和生活质量明显提高,但是血液透析的各种并发症还是影响患者生活质量和生存质量的主要因素。钙磷代谢紊乱是慢性肾脏病(chronic kidney disease,CKD)患者常见并发症。由于衰竭引起的维生素D缺乏、磷排泄减少等多种机制导致的低钙高磷是肾衰竭患者最常见的钙磷紊乱表现,也是导致继发性甲状旁腺功能亢进症、慢性肾脏病-矿物质和骨异常及骨外组织钙化等多个矿物质代谢异常组分发生的直接原因或是其加重因素。
研究证实,矿物质代谢紊乱导致MHD患者全因和心血管病死率明显增加。大多数MHD患者都存在骨、矿物质代谢紊乱[4],其血清学指标紊乱表现为血钙、血磷、iPTH、ALP和维生素D等代谢异常,并且60%的透析患者血钙、血磷、iPTH水平未得到适当的控制[5]。高磷血症广泛存在于CKD 4~5期的患者中,尤其是MHD患者。长期高磷血症除了引起继发性甲状旁腺功能亢进、矿物质和骨代谢异常外,还是导致心脏瓣膜、血管和软组织等转移性钙化的始动因素,也是透析患者死亡的独立危险因素[6-7]。有研究报道,高磷血症与CKD患者矿物质代谢紊乱发生、发展和恶化密切相关[8],且严重影响了透析患者的生活质量和生存期[9]。因此,控制MHD患者钙磷代谢紊乱有非常重要的意义。我国血液透析患者的高磷血症患病率高,血磷的达标率较低。2012年DOSPPS研究显示,我国血液透析患者的高磷血症患病率为57.4%,而血磷控制的达标率为38.5%,与欧美相比有较大差距[10-11]。本透析中心显示,高磷血症患病率为72.1%,血磷控制的达标率仅有20.4%[12]。新近的一项Meta分析显示,患者的血清磷增高与死亡风险增加相关,血磷水平每增加0.323 mmol/L,其死亡风险增加18%[13]。因此,积极控制MHD患者的血磷是纠正矿物质代谢紊乱的关键。本研究显示,普通的血液透析对血磷有一定的清除作用,但是与HD联合HP治疗相比有很大的差距。分析原因是单纯的HD对小分子毒素的清除作用较理想,但对中、大分子毒素清除效果则欠佳[14-15],而血磷虽然是小分子毒素,但其周围有水分子包绕,所以清除机制类似于中分子物质[16]。组合型人工肾综合了HD和HP的优点,HD通过弥散作用清除患者体内的尿素氮、血肌酐等小分子水溶性毒物。HP是通过疏松、多孔、表面积大的合成树脂的吸附作用,通过体外循环吸附血液中的中、大分子毒素。因此,HD+HP可以更有效清除血磷,改善钙磷代谢异常。使用磷结合剂的血液透析患者较未使用磷结合剂的患者病死率明显降低[17],但欧洲的一项前瞻性队列研究(7 970例MHD患者,随访21个月)发现,血磷水平低于1.13 mmol/L会增加患者的病死率[10]。因此,我们需要严格检测血磷水平。含钙磷结合剂不仅有增加高钙血症的风险,还有加重血管钙化的风险。一些研究表明,含钙磷结合剂治疗高磷血症能明显降低PTH水平,因此对于有血管钙化和(或)持续性低iPTH和(或)无动力型骨病的高磷血症患者,应限制含钙磷结合剂。碳酸镧是近年研发出的不含铝和钙的新型磷结合剂,吸收入血的碳酸镧主要通过肝脏而非肾脏途径排泄,尤其适用于透析者,是迄今为止较为理想的磷结合剂,可以使血磷水平有效降低,不影响活性维生素D的用量,且不影响血钙水平[18]。本研究缺乏应用碳酸镧的经验。近期一项Meta分析结果显示,长时透析(每次透析≥5.5 h)及长时频繁透析(每次透析≥5.5 h,每周透析≥5次)有利于降低血磷及减少磷结合剂的使用[19]。因此,增加透析频率和延长透析时间可以更有效清除血磷,改善钙磷代谢紊乱。本研究缺乏延时透析与频繁透析矿物质代谢的研究,有待进一步进行深入研究,以寻求更好的清除血磷的血液净化方法。Blayney等[20]研究提示高血清ALP和高住院风险与病死率相关,并且这个相关性独立于血钙、血磷及iPTH水平,血清ALP主要来源于肝脏和骨骼,在肝脏和骨骼疾病时都会出现ALP升高。有研究显示,骨特异性碱性磷酸酶(b-ALP)可以显著影响近期存活率[20],且b-ALP检查特异性高,但由于价格昂贵,大多数医院目前尚未常规开展。因此,《慢性肾脏病矿物质与骨代谢异常诊治指导》建议将总ALP作为慢性肾脏病-骨代谢异常诊断和评估的辅助手段。本研究显示,HD不能清除ALP,但HP能有效清除ALP。继发性甲状旁腺功能亢进不仅可导致骨骼的严重损害,还可以引起钙磷代谢异常、皮肤瘙痒、贫血、神经系统损害及心血管疾病等[21],严重影响患者的生存质量和生活质量[22]。K/DOQI指南将iPTH作为肾性骨病的预测指标,将iPTH目标值确定为150~300 ng/L,多项研究表明iPTH水平与透析患者的死亡风险和骨折风险存在相关性,表现为U型曲线[23-26],可见iPTH无论过高或过低均使死亡风险增加。目前多项研究显示,拟钙剂可以影响骨密度、减少骨折,联合小剂量维生素D可改善血液透析不适症状,减少甲状旁腺切除率及心血管住院率[27]。因此,K/DOQI指南建议对于CKD 5期患者的继发性甲状旁腺功能亢进症,在使用传统治疗方法无法将iPTH控制在目标范围时,建议可选择性使用拟钙剂。本研究显示,HD不能清除iPTH,但HP能清除iPTH,因iPTH是含有84个氨基酸残基的多肽,相对分子质量为94 000,属于中、大分子毒素,能被HP清除,分析原因为血液透析是利用溶质的浓度差和半透膜的弥散作用达到清除小分子毒素的作用,但传统的血液透析对中分子和大分子毒素清除不足。血液灌流是将患者的血液引出体外经过灌流器,对大分子和中分子物质具有非特异性的吸附作用,能弥补常规血液透析不能清除中、大分子毒素的不足。HA型树脂血液灌流器采用中性大孔树脂吸附剂,具有吸附容量大、吸附速率快的优点,而一般透析不能有效清除血磷和iPTH,只有依靠对流和吸附才能达到较好的清除效果[28]。
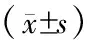
表1 HD与HD+HP对患者矿物质代谢影响的比较
注:与同组治疗前比较,aP<0.05,bP<0.01;与HD组治疗后比较,cP<0.05,dP<0.01
综上所述,HD+HP能有效地清除血磷,降低iPTH和ALP水平,从而改善MHD患者的矿物质代谢异常。本研究缺乏延时透析、血液透析滤过或高通量透析对血磷、血钙、iPTH和ALP影响的研究,有待进一步深入研究,以寻求更好的清除矿物质代谢紊乱的血液净化方法。
[1] Tentori F, Blayney MJ, Albert JM, et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study(DOPPS)[J]. Am J Kidney Dis, 2008, 52(3): 519-530.
[2] Block GA,Wheeler DC, Persky MS, et al. Effects of phosphate binders in moderate CKD[J]. J Am Soc Nephrol, 2012, 23(8): 1407-1415.
[3] Kim WY, Lef JB, Kim HY, et al. Achievement of the National Kidney Foundation Kidney disease Outcome Quality Initiative: recommended serum calcium, phosphate and parathyroid hormone values with parathyroidectomy in patients with secondary hyperparathyroidism[J]. J Korean Surg Soc, 2013, 85(1): 25-29.
[4] Kidney disease:Improving Global Outcome(KDIGO)CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis evaluation, prevention and treatment of Chronic Kidney Disease-Mineral and Bone Disorder(CKD-MBD)[J]. Kidney Int Suppl, 2013, 3(1):S1-S150.
[5] 赵丹, 罗星, 张金平, 等. 维持性血液透析患者钙磷代谢知识的调查与分析[J]. 新疆医学, 2016, 46(11): 1416-1419.
[6] Adeney KL, Siscovic DS, Ix JH, et al. Association of serum phosphate with vascular and valvular calcification in moderate CKD[J]. J Am Soc Nephrol, 2009, 20(2): 381-387.
[7] Kendric J, Chonchol M. The role of phosphorus in the development and progression of vascular calcification[J]. Am J Kidney Dis, 2011, 58(5): 826-834.
[8] Slatopolsky E, Moe S. 50 years of research and discovery in chronic kidney disease and mineral&bone disorder: the central role of phosphate[J]. Kidney Int, 2011, 121(Suppl): S1-S2.
[9] Kim WS, Lee DH, Youn HJ. Calcium-phosphorus product concentration is a risk factor of coronary artery disease in metabolic syndrome[J]. Atherosclerosis, 2013, 229(1): 253-257.
[10]Kong XL, Zhang LX, Zhang L, et al. Mineral and bone disorder in Chinese dialysis patients: a multicenter study[J]. BMC Nephrol, 2012, 13(9): 116-122.
[11]Francesco, Lucia L, Vecchio D. Optimal phosphate control: still unmet need chronic kidney disease patients[J]. Expert Opin Pharmacother, 2014, 15(3): 307-309.
[12]杨福燕, 庞家亮, 魏崇一. 维持性血液透析患者矿物质代谢研究[J]. 国际移植与血液透析杂志, 2014, 12(3): 13-16.
[13]Zhou C, Wang F, Wang JW, et al. Mineral and bone disorder and its association with cardiovascular parameters in Chinese patients with chronic kidney disease[J].CMJ, 2016, 19(129): 2275-2280.
[14]Palmer SC, Hayen A, Macaskill P, et al. Serum levels of phosphorus, parathyroid hormone and calcium and risks of death and cardiovascular disease in individuals with chronic kidney disease: a systematic review and meta-analysis[J]. JAMA, 2011, 305(11): 1119-1127.
[14]Salehi M, Sohrabi Z, Ekramzadeh, et al. Selenium supplementation improves the nutritional status of hemodialysis patients: a randomized, doubled-blind, placebo-controlledtrial[J]. Nephrology, dialysis, transplantation, 2013, 28(3): 716-723.
[15]Delporte C, Franck T, Noyon C, et al. Simultaneous measurement of protein-bound 3-chlorotytosine and homocitrulline by LC-MS/MS after hydrolysis assisted by microwave: application to the study of myeloperoxidase activity during hemodialysis[J]. Talanta, 2012, 9(13): 603-609.
[16]Drechsler C, Verduijn M, Pilz S, et al. Bone alkaline phosphatase and mortality in dialysis patients[J]. Clin J Am Soc Nephrol, 2011, 6(7): 1752-1759.
[17]Isakova T, Gutierrez OM, Chang Y, et al. Phosphorusbinders and survival on hemodialysis[J]. J Am Soc Nephrol, 2009, 20(2): 388-396.
[18]Xu J, Zhang YX, Yu XQ, et al. Hnthamum carbonate for the treatment of hyperphosphatemia in CKD 5: muhicenter, double blind, randomized, controlled trial in mainland China[J]. BMC Nephrol, 2013, 14(1): 1-29.
[19]Zimmerman DL, Nesrallah GE, Chan CT, et al. Dialysate calcium concentration and mineral metabolism in long and long-frequent hemodialysis: a systematic review and meta-analysis for a Canadian Society of Nephrology Clinical Practice Guideline[J]. Am J Kidney Dis, 2013, 62(1): 97-111.
[20]Blayney MJ, PisoniRL, Bragg-Gresham JL, et al. High alkaline phosphatase levels in hemodialysis patients are associated with higher risk of hospitalization and death[J]. Kidney Int, 2008, 74(5): 655-663.
[21]Floege J, Kim J, Ireland E, et al. Serum iPTH, calcium and phosphate, and the risk of mortality in a European haemodialysis population[J]. Nephrol Dial Transplant, 2011, 26(6): 1948-1955.
[22]Naves-Diaz M,Passlick-Deetjen J,Guinsburg A,et al. Calcium, phosphorus, PTH and death rates in a large sample of dialysis patients from Latin America:the CoRES Study[J]. Nephrol Dial Transplant, 2011, 26(6): 1938-1947.
[23]Jean G, Lataillade D, Genet L, et al. Association between very low PTH levels and poor survival rates inhaemodialysis patients: results from the French ARNOS cohort[J]. Nephron Clin Pract, 2011, 118(2): 211-216.
[24]Naves-Diaz M, Passlic-Deetjen J, Guinsburg A, et al. Calcium phosphorus, PTH and death rates in a large sample of dialysis patients from Latin Amerrica: the CORES Study[J]. Nephrol Dial Transplant, 2011, 26(6): 1938-1947.
[25]Tsuruta Y, Okano K, Kikuchi K, et al. Effects of cinacalcet on bone mineral density and bone markers in haemodialysis patients with secondary hyperparathyroidism[J]. Clin Exp Nephrol, 2013, 7(1): 120-126.
[26]Cunningham J, Danese M, Olson K, et al. Effects of the xalcimimetic cinacalcet HCL on cardiovascular disease, fracture, and health-related quality of life in secondary hyperparathyroidism[J]. Kidney Int, 2005, 68(4): 1793-1800.
[27]Chertow GM, Lu ZJ, Xu X, et al. Self-reported symptoms in patients on hemodialysis with moderate to severe secondary hyperparathyroidism receiving combined therapy with cinacalcet and low-dose vitamin D sterols[J]. Hemodial Int, 2012, 16(2): 188-197.
[28]蓝天座, 闵亚丽, 樊丰夷, 等. 高通星透析联合不同频率血液灌流对维持性血液透析患者微炎症状态和钙磷代谢的影响. 实用医院临床杂志, 2016, 13(3): 50-52.
Effects of hemoperfusion associated with hemodialysis on the mineral metabolism of maintenance hemodialysis patients
YANGFu-yan,SONGJuan,DUANKun.
DepartmentofNephrology,theFirstPeople’sHospitalofXinxiang,Xinxiang453000,China
Objective To investigate the effects of hemoperfusion(HP) associated with hemodialysis(HD) on the mineral metabolism of maintenance hemodialysis(MHD) patients with uremia.Methods 110 MHD patients in the Hemopurification Center of Xinxiang from January 2012 to August 2013 were enrolled in this study. According to random number table method, 110 cases of MHD were divided into two groups. Fifty-five patients with uremia in hemodialysis (HD) group
3 times of routine HD treatments per week, and 55 patients with uremia in HP+HD group received one time of HP plus HD (HP+HD) and 2 times of routine HD treatment. The routine treatment time was 4 h. The evaluation indexes of all patients were collected one day before HD and 3 months after treatment, including serum calcium, serum phosphorus, intact parathyroid hormone(iPTH) and alkaline phosphatase(ALP).Results There were no statistically significant differences in the levels of serum calcium, phosphorus, iPTH and ALP between two groups before treatment(P>0.05 for all). After treatment for 3 months, the level of serum phosphorus was significantly lower than that before treatment in the HD group. In the HP+HD group, the levels of serum phosphorus, iPTH and ALP were significantly decreased after treatment (P<0.01), and the level of serum calcium was higher than that before treatment. The level of serum calcium was higher in HD group than that in HD+HP group(P<0.05), and the level of serum ALP was obviously decreased in HD+HP group(P<0.05) after treatment. The levels of serum phosphorus and iPTH in HP+HD group were decreased significantly after treatment (allP<0.01).Conclusions As compared with ordinary HD, HP+HD can effectively remove serum phosphorus and decrease the iPTH and ALP, thus improving the abnormal mineral metabolism of MHD patients with uremia.
Hemodialysis; Serum calcium; Serum phosphorus; Intact parathyroid hormone; Alkaline phosphatase
10.3969/j.issn.1671-2390.2017.05.005
河南省卫生科技创新型人才工程专项经费资助课题;2013年新乡市重点科技攻关计划项目(No.ZG13032)
453000 河南省新乡市第一人民医院肾脏科
2016-11-17
2017-04-06)
