Sonic hedgehog蛋白在糖尿病肾脏病肾间质纤维化中的表达及临床意义
2017-06-23侯世会李艺官涛刘军辉赵景宏黄云剑
侯世会 李艺 官涛 刘军辉 赵景宏 黄云剑
·论著·
Sonic hedgehog蛋白在糖尿病肾脏病肾间质纤维化中的表达及临床意义
侯世会 李艺 官涛 刘军辉 赵景宏 黄云剑
目的 探讨Sonichedgehog(Shh)在糖尿病肾脏病(diabetic kidney disease,DKD)中的表达及其与肾间质纤维化的关系及临床意义。方法 收集40例DKD、12例正常肾脏组织的病理切片标本,并收集患者糖化血红蛋白(glycosylated hemoglobin,HbA1c)、血清白蛋白(serum albumin,Alb)、血肌酐(SCr)、尿素氮(BUN)水平、24 h尿蛋白定量等临床数据。通过CKD-EPI公式估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。Masson染色观察肾脏病理形态并依据肾间质纤维化及肾小管病变评分分为4组,分别为正常、1级、2级、3级纤维化。免疫组化检测Shh、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)在DKD中的表达,分析DKD患者中Shh与α-SMA表达的相关性以及与HbA1c、24 h尿蛋白定量、血肌酐、eGFR的相关性。结果 正常肾脏Shh的表达很少,而DKD患者中Shh表达显著增加,主要表达在近端、远端肾小管上皮细胞,以近端小管为著。随着间质纤维化程度加重,Shh阳性强度逐渐增加(P<0.05)。α-SMA主要表达于肾间质中,随着纤维化分级增加,α-SMA在肾间质中的表达增加,各组间差异均有统计学意义(P<0.05)。Shh在DKD肾间质纤维化中的阳性程度与α-SMA呈正相关(rs=0.82,P<0.001),与HbA1c呈正相关(rs=0.54,P<0.001),与血肌酐呈正相关(rs=0.67,P<0.001),与24h尿蛋白定量呈正相关(rs=0.61,P<0.001),与eGFR呈负相关(rs=-0.65,P<0.001)。结论 DKD患者中肾小管上皮细胞高表达Shh,提示Shh信号通路被激活,可能是DKD肾间质纤维化发展的一个重要因素。
糖尿病肾脏病;肾间质纤维化;Sonic hedgehog蛋白;α-平滑肌肌动蛋白
糖尿病肾脏病(diabetic kidney disease,DKD)是糖尿病的主要并发症之一,也是近年来终末期肾脏病(end stage renal disease,ESRD)的主要病因,在全球范围内其发病率呈逐渐上升趋势[1]。糖尿病性肾损害的经典表现是肾小球病变,但是随着研究的深入,发现肾小管间质病变与DKD肾脏功能恶化之间的关系较肾小球损害更为密切,且肾小管间质损伤在DKD早期即可出现,可能较肾小球损伤更早[2-3]。因此,深入研究DKD肾小管间质纤维化有着重要的临床意义。
Sonichedgehog(Shh)信号通路在人类胚胎发育过程中起着重要作用,参与血管新生、肢体发育、神经管分化等多种进程,在胚胎成熟以后该通路处于关闭状态[4-5]。但是研究发现胰腺癌、胃癌、肝纤维化等病理过程中,Shh信号通路异常活化[6-7]。近年来Shh在肾间质纤维化的作用开始得到广泛关注。在IgA肾病、膜性肾病中,肾脏组织中Shh的表达水平明显升高,并且主要定位于肾小管上皮细胞[8],在单侧输尿管梗阻的老鼠肾纤维化模型中,抑制Shh后能够显著减轻肾间质纤维化的程度[9]。但是人DKD肾组织中Shh表达变化是否参与了DKD肾间质纤维化的进展尚不清楚,它们之间的关联目前也未见报道。本研究主要通过观察DKD患者肾穿刺活检组织中Shh的表达变化,结合临床检验生化指标探讨Shh在DKD肾间质纤维化的发生、发展中的作用及其可能的临床意义。
资料与方法
一、研究对象与分组
收集2011年9月至2016年10月第三军医大学新桥医院收治的DKD患者的临床资料及肾脏病理活检标本,依据2010年Tervaer’s糖尿病肾病病理分型标准[2],在光镜下观察肾组织形态学变化,并对肾小管萎缩和肾间质纤维化进行分级。正常组:肾小管无明显改变及无纤维化组织增生;1级纤维化组:肾小管上皮细胞轻度萎缩、变形,呈局灶分布,纤维组织增生呈小灶性、少量分布,病变范围0~25%;2级纤维化组:肾小管上皮细胞中度萎缩、变性,纤维组织中度增生,病变范围26%~50%;3级纤维化组:肾小管上皮细胞萎缩、变性和坏死较严重,成片分布,纤维组织增生呈束状、多灶或网片状,病变范围>50%。根据纤维化评分筛选出40例DKD患者,其中1级纤维化13例,2级纤维化13例,3级纤维化14例。对照组共12例,均来自于肾肿瘤患者切除肾脏的远端正常肾组织。上述DKD患者均排除合并心功能衰竭、肿瘤、孕妇及哺乳期妇女及合并其他慢性肾脏疾病。本研究通过我院伦理委员会批准,患者均签署知情同意书。
二、临床及实验数据
肾脏病理资料均为患者在我院首次肾脏病理活检资料。临床收集指标包括性别、年龄;生化检测指标包括糖化血红蛋白(glycosylated hemoglobi,HbA1c)、血肌酐(SCr)、血尿素氮(BUN)、24h尿蛋白定量、肾小球滤过率(estimated glomerular filtration rate,eGFR);eGFR根据CKD-EPI公式计算:eGFR[ml·min-1·(1.73 m2)-1]=a×(血肌酐浓度/b)c×(0.993)年龄,a值根据性别与人种采用不同数值;黑人:女性=166,男性=163;除黑人外的其他人种:女性=144,男性=141;b值根据不同的性别采用如下数值:女性=0.7,男性=0.9;c值根据年龄与血肌酐值的大小分别采用如下数值:血肌酐≤0.7 mg/dl时,女性=-0.329,男性=-0.411;血清肌酐≥0.7 mg/dl时,女性=-1.209,男性=-1.209[10]。
三、主要试剂
Masson染色试剂盒购自碧云天生物技术有限公司,人Sonic hedgehog(Shh)多克隆抗体、α-平滑肌动蛋白(a-smooth muscle actin,α-SMA)兔多克隆抗体购于美国Abcam公司,PV-6000免疫组化试剂盒及浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司。
四、肾组织Masson染色、免疫组化检测Shh、α-SMA的表达
全部肾组织病理标本经10%甲醛固定,石蜡包埋,2.5 μm厚切片;肾组织石蜡切片进行Masson染色,实验步骤依据试剂盒说明书进行。Shh、α-SMA免疫组化依据试剂盒说明书进行操作,阴性对照以PBS代替一抗,二抗由北京中杉金桥生物技术有限公司提供。切片染色成功后在光学显微镜下观察并拍照,每张切片随机抽选5个高倍镜视野(×400)的图像,使用Image-Pro 6.0彩色图像分析处理系统对Shh、α-SMA在肾脏的表达用累积光密度值(IOD)进行分析,取平均值反映样本指标的表达量。
五、统计学分析
采用SPSS 22.0统计软件,计量资料以均数±标准差表示,组间比较采用单因素方差分析(One-Way ANOVA)或Kruskal-Wallis秩和检验,进一步多重比较采用LSD-t检验或Nemenyi检验,相关性分析采用Spearman等级相关,P<0.05为差异有统计学意义。
结 果
一、病例的临床资料
收集临床病例共52例,其中正常组12例,1级纤维化组13例,2级纤维化组13例,3级纤维化组14例。各组间年龄差异无统计学意义。DKD组HbA1c、eGFR、24h尿蛋白均高于正常对照组,差异有统计学意义(P<0.05)。随着DKD肾间质纤维化程度加重,24h尿蛋白定量均逐渐增加。(表1)
二、光镜下观察患者肾脏病理形态并对肾小管间质纤维化分级
Masson染色对收集的病例进行肾小管间质纤维化程度的分级。正常:肾小管无明显改变及无纤维化组织增生;1级纤维化:肾小管上皮细胞轻度萎缩、变形,呈局灶分布,纤维组织增生呈小灶性、少量分布,病变范围0~25%;2级纤维化:肾小管上皮细胞中度萎缩、变性,纤维组织中度增生,病变范围26%~50%;3级纤维化:肾小管上皮细胞萎缩、变性和坏死较严重,成片分布,纤维组织增生呈束状、多灶或网片状,病变范围>50%。(图1)
三、各组肾小管间质组织中Shh和α-SMA蛋白的表达
免疫组化结果显示,对照组肾脏几乎无Shh表达,而DKD中Shh表达显著增加,主要表达在近端、远端肾小管上皮细胞,以近端肾小管为著。随着间质纤维化程度加重,Shh阳性强度逐渐增加(P<0.05)。α-SMA表达于肾间质中,其表达量随着肾间质纤维化程度而增加,各组间差异均有统计学意义(P<0.05)。(图2)
四、DKD组中肾小管上皮细胞Shh的表达与α-SMA、HbA1c、SCr、24h尿蛋白以及eGFR的相关性分析
相关分析结果显示,Shh在DKD肾小管上皮细胞中的阳性程度与α-SMA呈正相关(rs=0.82,P<0.001),与HbA1c呈正相关(rs=0.54,P<0.001),与血肌酐呈正相关(rs=0.67,P<0.001),与24h尿蛋白呈正相关(rs=0.61,P<0.001),与eGFR呈负相关(rs=-0.65,P<0.001)。(图3)
讨 论
DKD系慢性高血糖引起的严重的肾脏病微血管并发症,在临床上以持续性白蛋白尿和(或)肾小球滤过率进行性下降为主要特征。当糖尿病患者合并慢性肾脏病(chronic kidney disease,CKD)时,不能盲目的将其归因为DKD,其肾脏损害可能是DKD、非DKD或DKD合并非DKD。因此,对于无法肯定高血糖与CKD因果关系或无法排除非DKD的患者,肾脏病理学诊断则是非常重要的。DKD的典型肾脏形态学改变包括肾小球系膜基质增宽、基底膜增厚、肾小球硬化、足细胞丢失,肾小管基底膜增厚、肾小管萎缩及肾间质炎性浸润、间质纤维化,出入球小动脉壁的玻璃样变,其中以K-W结节具有较特异的诊断价值[11]。
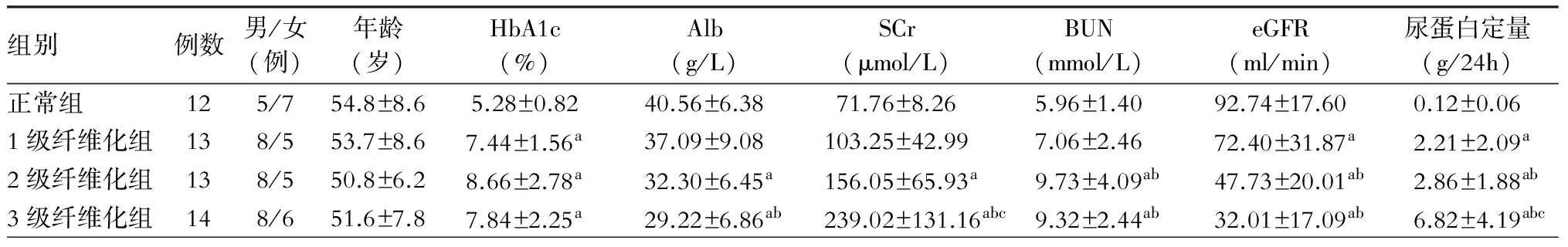
表1 各组病例的临床特点
注:与正常组比较,aP<0.05;与1级纤维化组比较,bP<0.05;与2级纤维化组比较,cP<0.05
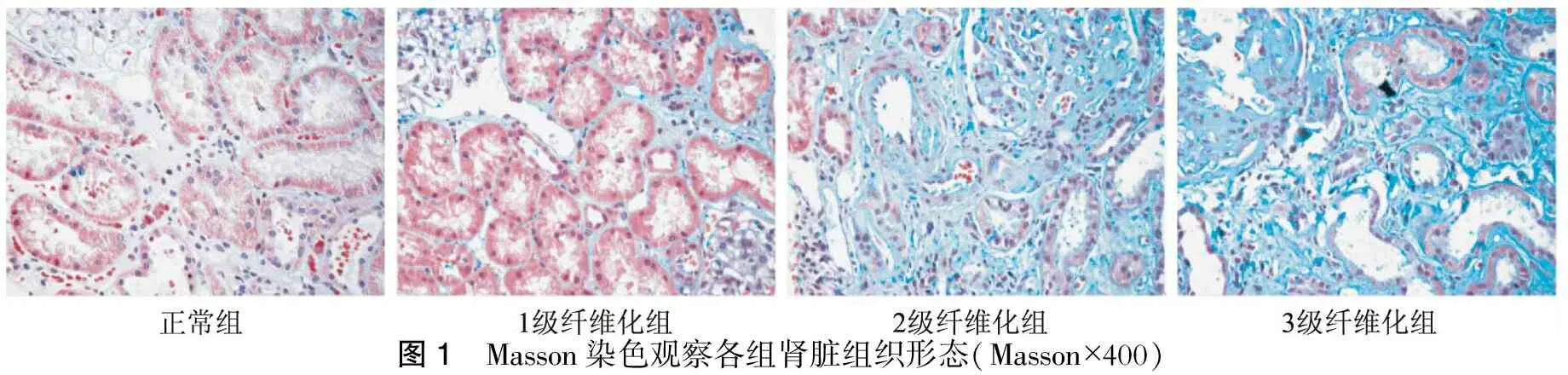
图1 Masson染色观察各组肾脏组织形态(Masson×400)
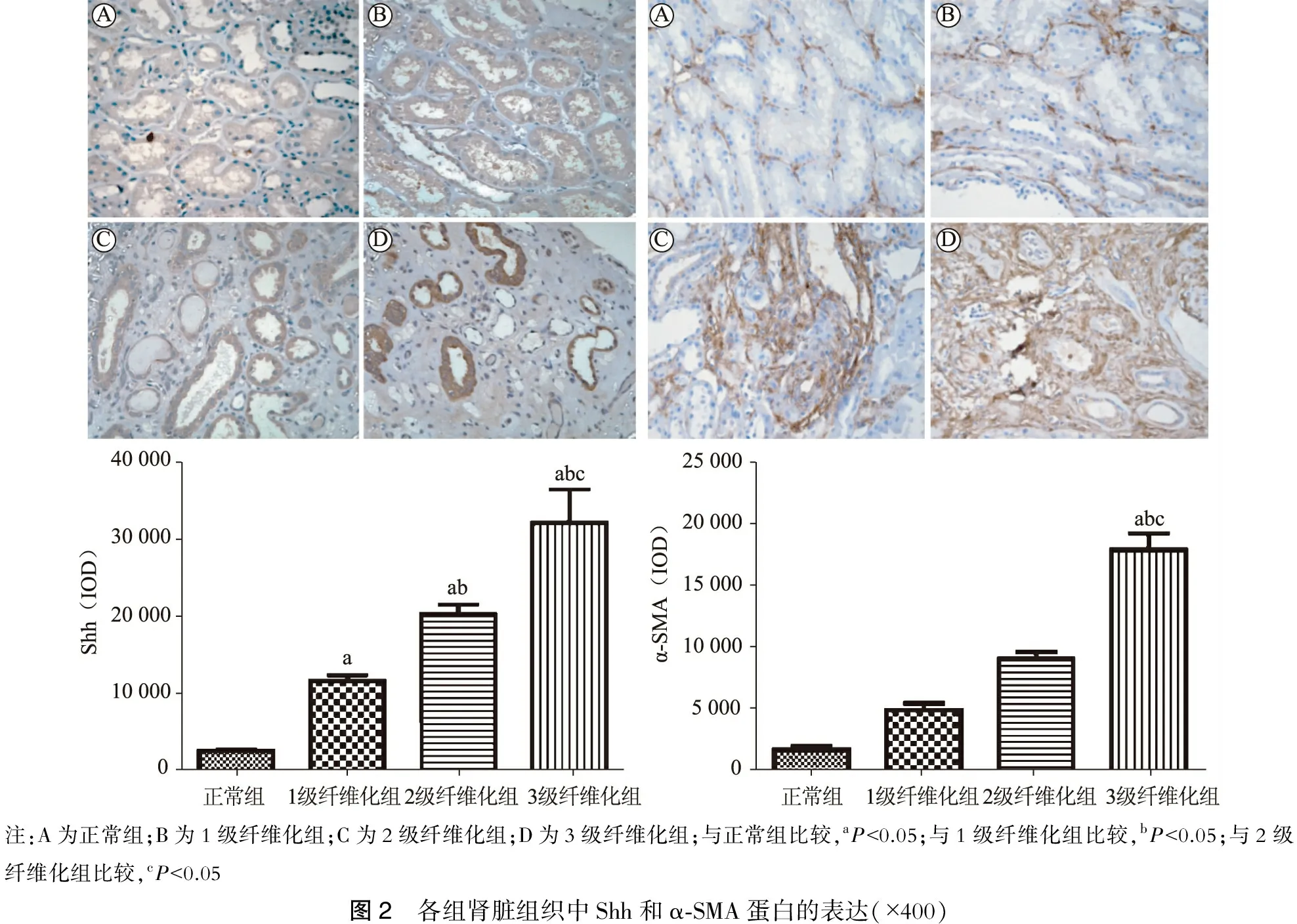
注:A为正常组;B为1级纤维化组;C为2级纤维化组;D为3级纤维化组;与正常组比较,aP<0.05;与1级纤维化组比较,bP<0.05;与2级纤维化组比较,cP<0.05图2 各组肾脏组织中Shh和α⁃SMA蛋白的表达(×400)
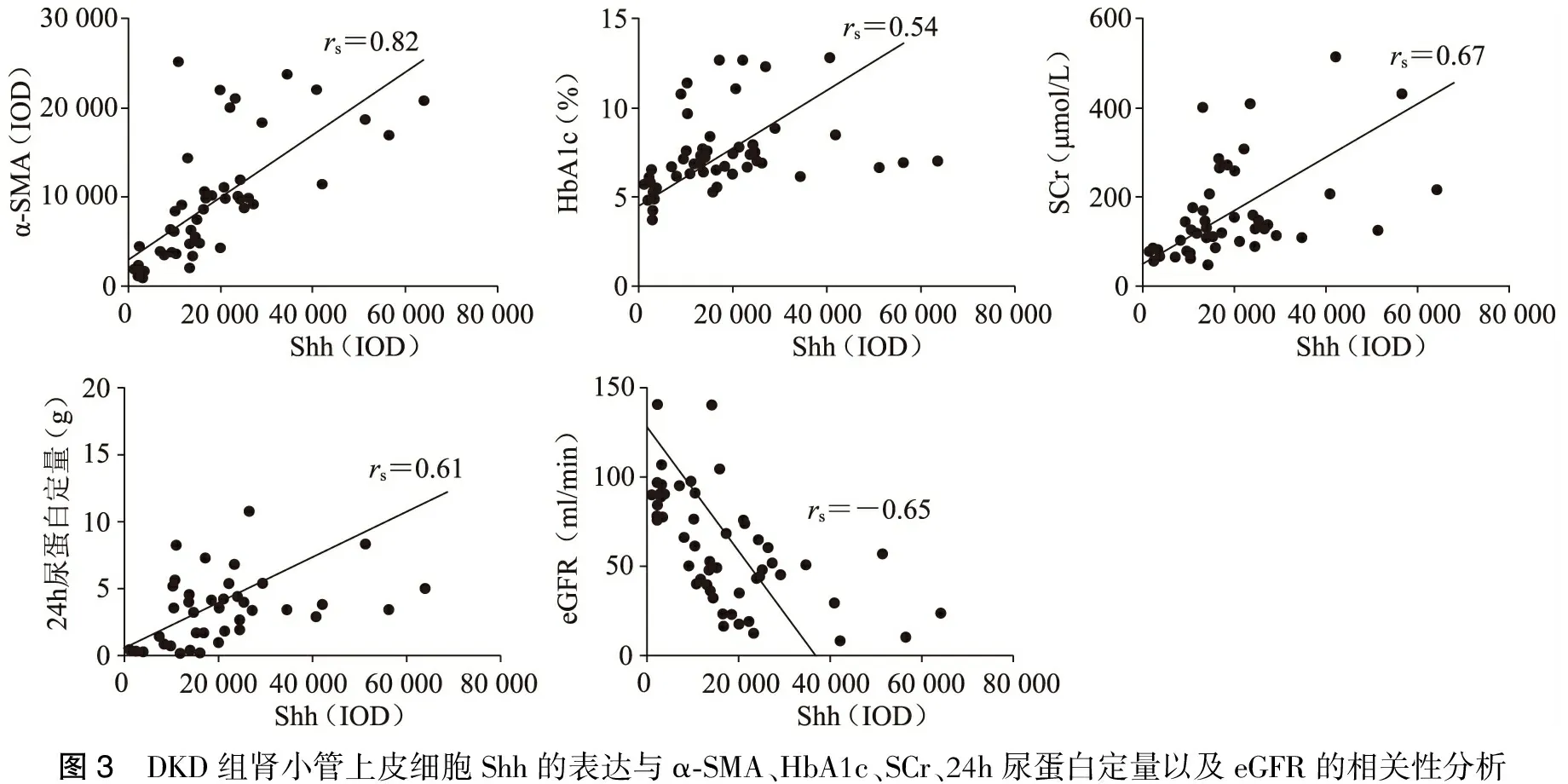
图3 DKD组肾小管上皮细胞Shh的表达与α⁃SMA、HbA1c、SCr、24h尿蛋白定量以及eGFR的相关性分析
虽然肾小球病理改变是DKD的主要特征,但是新近研究发现在糖尿病肾小球病变发生同时或者之前,小管间质已经损伤。研究发现,在不同程度肾小球硬化的DKD中,肾间质纤维化病变越重的患者其远期生存率越低,说明肾间质纤维化是DKD的一个相对独立的发病机制,不依赖于肾小球病变,与肾功能损害密切相关[12-13]。既往研究[14]表明肾小管上皮细胞发生上皮-间充质细胞转分化以及间质成纤维细胞增殖和活化为肌成纤维细胞,导致大量的细胞外基质聚集是肾间质纤维化的主要途径。已经知道肾小管上皮细胞损伤或转分化时释放的一些炎性因子如白细胞介素6、转化生长因子β等可能是成纤维细胞增殖与活化的诱因,但肾小管和成纤维细胞之间是否还存在Shh信号通路活化尚不清楚。文献报道,成纤维细胞是Shh的效应细胞,肾小管源性Shh在肾间质纤维化的过程中起着重要作用[15]。因此,探讨DKD肾间质Shh的表达及其与DKD肾间质纤维化的关系,可能为寻找DKD的发病机制提供新的思路。Hedgehog蛋白首先在果蝇中发现的一种外分泌蛋白家族,Shh是其中的一员,其信号通路主要由分泌型蛋白Shh配体、跨膜蛋白受体Ptch和另一跨膜蛋白Smoothed组成的复合物以及下游转录因子Gli蛋白组成。在缺乏Shh配体时,Ptc同Smo蛋白结合抑制Smo的活性,该信号通路处于静止状态;当Shh 配体存在时,Shh通过同Ptc受体结合,解除Ptc对Smo的抑制作用,使得Smo进入细胞内,将信号传递并进一步激活下游Gli转录因子,使后者进入细胞核内,启动多种目的基因的表达,进而参与调控细胞增殖、分化、凋亡等过程[16-17]。在肾脏中,Shh主要表达于肾小管上皮细胞,是维持肾脏发育的关键,Shh(-)/(-)小鼠主要表现为肾脏缺失;当肾脏发育成熟后,该信号通路处于静止状态[18]。但在损伤刺激条件下,近端肾小管上皮细胞重新分泌Shh蛋白,分泌的Shh蛋白作用于成纤维细胞,引起该细胞的增殖、分化,从而加速肾间质纤维化,如在单侧输尿管梗阻、肾缺血再灌注损伤、5/6肾切除模型中,免疫组化染色显示近端肾小管上皮细胞出现高表达Shh[19]。体外培养肾成纤维细胞,给予不同浓度的重组Shh蛋白刺激,α-SMA、纤维连接蛋白、Ⅰ型胶原的表达明显增加,提示Shh在病理状态下可诱导肾成纤维细胞增殖与活化[20],但Shh是否也高表达于DKD肾小管间质尚无文献报道。本研究发现,Shh在DKD近端肾小管上皮细胞高表达,且随着肾间质纤维化的加重,表达强度呈现逐渐上升的趋势,这与其他CKD疾病中报道是一致的[8]。目前文献报道,在单侧输尿管梗阻模型中,Shh表达升高,通过Shh/Gli信号通路促进肾间质纤维化的发生[20]。但是在高糖条件下高表达Shh的机制尚需进一步研究。我们进一步分析DKD组中Shh的表达与α-SMA的关系,α-SMA是肌成纤维细胞的标志性表达蛋白,是成纤维化细胞增殖、活化的标志物之一。在TGF-β、结缔组织生长因子等促纤维化因子的作用下,成纤维细胞转化为肌成纤维细胞高表达α-SMA,参与肾间质纤维化[21-22]。本研究结果提示,Shh与α-SMA呈正相关,提示Shh可能促进了成纤维细胞的增殖、活化,参与DKD肾间质纤维化的进展。目前尚不清楚Shh通过何种机制参与肾间质纤维化的进程。研究显示,在肝纤维化过程中,Shh表达增加,可促进TGF-β表达,从而促进胆管纤维化,表明Shh的促纤维化作用可能与TGF-β相关[23];其次,我们相关分析发现Shh在肾小管上皮细胞中的阳性度与血清肌酐(rs=0.61,P<0.001)、与HbA1c(rs=0.54,P<0.001),24h尿蛋白定量(rs=0.61,P<0.001)呈正相关,与eGFR(rs=-0.51,P<0.001)呈负相关,提示肾功能越差,血糖控制越差,24h尿蛋白定量越多,Shh表达量越高。由此推测,Shh信号通路可能被激活,参与肾间质纤维化的进程,加速了肾功能的恶化。DKD肾小管间质纤维化中,肾小管细胞存在高表达Shh蛋白,且随病理分期的加重逐渐增加。Shh与α-SMA、HbA1c、血肌酐和24h尿蛋白定量呈正相关,与eGFR呈负相关,提示Shh可能参与了DKD肾间质纤维化进程,与病情恶化程度密切相关。但Shh信号通路在DKD肾小管间质成纤维细胞活化作用还需体内、体外实验进一步证实,如采用Shh基因敲除鼠评估Shh及其下游信号分子在DKD中的地位和作用机制。重要的是探讨阻断Shh信号通路是否可能成为DKD肾间质纤维化治疗的新方向。
[1] Afkarian M, Zelnick LR, Hall YN, et al. Clinical manifestations of kidney disease among US adults with diabetes, 1988-2014[J]. The Journal of the American Medical Associat ion, 2016, 316(6): 602-610.
[2] Tervaert TW, Mooyaart AL, Amann K, et al. Pathologic classification of diabetic nephropathy[J]. J Am Soc Nephrol, 2010, 21(4): 556-563.
[3] Fiseha T, Tamir Z. Urinary markers of tubular injury in early diabetic nephropathy[J]. Int J Nephrol, 2016, 2016(4): 1-10.
[4] Nagase T, Nagase M, Machida M, et al. Hedgehog signalling in vascular development[J]. Angiogenesis, 2008, 11(1): 71-77.
[5] Lopez-Rios J, Duchesne A, Speziale D, et al. Attenuated sensing of SHH by Ptch1 underlies evolution of bovine limbs[J]. Nature, 2014, 511(7507): 46-51.
[6] Gan H, Liu H, Zhang H, et al. SHh-Gli1 signaling pathway promotes cell survival by mediating baculoviral IAP repeat-containing 3(BIRC3) gene in pancreatic cancer cells. Tumour biology: the journal of the International Society for Oncodevelopmental[J]. Biology and Medicine, 2016, 37(7): 9943-9950.
[7] Asai A, Malladi S, Misch J, et al. Elaboration of tubules with active hedgehog drives parenchymal fibrogenesis in gestational alloimmune liver disease[J]. Human pathology, 2015, 46(1): 84-93.
[8] Fabian SL, Penchev RR, St-Jacques B, et al. Hedgehog-Gli pathway activation during kidney fibrosis[J]. The American journal of pathology, 2012, 180(4): 1441-1453.
[9] Zhou D, Tan RJ, Liu Y. Sonic hedgehog signaling in kidney fibrosis: a master communicator[J]. Sci China Life Sci, 2016, 59(9): 920-929.
[10]Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filration rate[J]. Ann Intern Med, 2009, 150(9): 604-612.
[11]中华医学会内分泌学分会. 中国成人糖尿病肾脏病临床诊断的专家共识[J]. 中华内分泌代谢杂志,2015, 31(5): 379-385.
[12]Loeffler I, Wolf G. Epithelial-to-mesenchymal transition in diabetic nephropathy: fact or fiction?[J]. Cells, 2015, 4(4): 631-652.
[13]Gilbert RE, Cooper ME. The tubulointerstitium in progressive diabetic kidney disease: more than an aftermath of glomerular injury?[J]. Kidney international, 1999, 56(5): 1627-1637.
[14]Lovisa S, Zeisberg M, Kalluri R. Partial epithelial-to-mesenchymal transition and other new mechanisms of kidney fibrosis[J]. Trends in Endocrinology & Metabolism Tem, 2016, 27(10): 681-695.
[15]Bai Y, Lu H, Lin C, et al. Sonic hedgehog-mediated epithelial-mesenchymal transition in renal tubulointerstitial fibrosis[J]. International Journal of Molecular Medicine, 2016, 37(5): 1317-1327.
[16]Kramann R, Schneider RK, DiRocco DP, et al. Perivascular Gli1+ progenitors are key contributors to injury-inducedorgan fibrosis[J]. Cell Stem Cell, 2015, 16(1): 51-66.
[17]Gill PS, Rosenblum ND. Control of murine kidney development by sonic hedgehog and its GLI effectors[J]. Cellcycle, 2006, 5(13): 1426-1430.
[18]Verheyden JM, Sun X. An Fgf/Gremlin inhibitory feedback loop triggers termination of limb bud outgrowth[J]. Nature, 2008, 454(7204): 638-641.
[19]Zhou D, Li Y, Zhou L, et al. Sonic hedgehog is a noveltubule-derived growth factor for interstitial fibroblasts after kidney injury[J]. J Am Soc Nephrol, 2014, 25(10): 2187-2200.
[20]Ding H, Zhou D, Hao S, et al. Sonic hedgehog signaling mediates epithelial-mesenchymal communication and promotes renal fibrosis[J]. J Am Soc Nephrol, 2012, 23(5): 801-813.
[21]Chebotareva NV, Bobkova IN, Varshavskii VA, et al. The role of smooth muscle alpha-actin in development of renal fibrosis in patients with chronic glomerulonephritis[J]. Ter Arkh, 2006, 78(5): 17-21.
[22]Kanwar YS, Sun L, Xie P, et al. A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J]. Annu Rev Pathol, 2011, 6(1): 395-423.
[23]Syn WK, Jung Y, Omenetti A, et al. Hedgehog-mediated epithelial-to-mesenchymal transition and fibrogenic repair in nonalcoholic fatty liver disease[J]. Gastroenterology, 2009, 137(4): 1478-1488.
Expression and clinical significance of Sonic hedgehog in renal interstitial fibrosis of patients with diabetic kidney disease
HOUShi-hui,LIYi,GUANTao,LIUJun-hui,ZHAOJing-hong,HUANGYun-jian.DepartmentofNephrology,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing400037,China
Correspondingauthor:HUANGYun-jian.E-mail:yun81@sina.com
Objective To investigate the expression of Sonic hedgehog (Shh) in diabetic kidney disease (DKD) and its correlation to renal interstitial fibrosis. Methods Forty patients with DKD were enrolled and 12 confirmed normal renal tissues adjacent to the renal angiomyolipoma were assigned as control group. The clinical data of glycosylated hemoglobin (HbA1c), serum albumin (Alb), serum creatinine (SCr), blood urea nitrogen (BUN), 24 h-urinary albumin (albuminuria) and estimated glomerular filtration rate (eGFR) by CKD-EPI equation were also collected. Masson staining was used to observe the morphology of renal tissues. According to the renal interstitial fibrosis and tubular atrophy (IFTA) scores, the tissues were divided into four groups: score 0, score 1, score 2, and score 3. Human kidney biopsies samples were immunohistochemically stained with specific antibody against Shh protein and α-smooth muscle Actin (α-SMA) protein and then the correlation of Shh expression with clinicopathological parameters (HbA1c, serum creatinine, albuminuria, eGFR) was determined using statistical software SPSS 22.0.Results (1) Shh and α-SMA were rarely expressed in normal renal tissues. In DKD group, Shh was mainly expressed in renal tubular epithelial cells, especially in the proximal tubule, while α-SMA was expressed in tubulointerstitium. As compared with the control group, the positive intensity of Shh and α-SMA in DKD group was increased significantly (P<0.05) and gradually with the increase in renal interstitial fibrosis pathological stage. (2) The positive intensity of Shh in renal tubular epithelial cells was positively correlated with α-SMA (rs=0.82,P<0.001), HbA1c (rs=0.54,P<0.001), serum creatinine (rs=0.67,P<0.001) and 24 h-urinary albumin (rs=0.61,P<0.001), and negatively correlated with eGFR (rs=-0.65,P<0.001). Conclusions Shh is highly expressed in renal tubular epithelial cells in patients with DKD, suggesting that Shh signal pathway is activated, which may be an important factor in the development of renal interstitial fibrosis in DKD.
Diabetic kidney disease;Renal interstitial fibrosis;Sonic hedgehog;A-smooth muscle actin
10.3969/j.issn.1671-2390.2017.05.004
国家自然科学基金(No.81600583)
400037 重庆,第三军医大学新桥医院肾内科
黄云剑,E-mail:yun81@sina.com
2017-04-19
2017-05-02)
