槲皮素抑制口腔鳞癌细胞增殖和迁移的机制
2017-06-23魏建宏乔丽萍
魏建宏 乔丽萍
(山西医科大学汾阳学院,山西 汾阳 032200)
槲皮素抑制口腔鳞癌细胞增殖和迁移的机制
魏建宏 乔丽萍1
(山西医科大学汾阳学院,山西 汾阳 032200)
目的 探讨槲皮素对人类口腔鳞癌(SAS)细胞增殖和迁移的影响及其作用机制。方法 体外培养SAS细胞,分别加入不同浓度的槲皮素进行处理后用MTT实验检测细胞增殖抑制情况;采用涂有Matrigel胶的Transwell 小室模型对SAS细胞进行体外侵袭力检测;划痕实验研究槲皮素对SAS细胞迁移的影响;明胶酶谱法测定SAS细胞中基质金属蛋白酶(MMP)-2和MMP-9的活性;蛋白质印迹法研究槲皮素与SAS细胞迁移和侵入相关的蛋白质表达水平的关系。结果 槲皮素可以浓度、时间依赖性抑制SAS细胞的增殖;划痕实验、Transwell小室迁移实验中,随着槲皮素浓度提高,SAS细胞迁移数目呈递减趋势、细胞侵袭能力呈递减趋势;槲皮素可以显著抑制MMP-2和MMP-9的蛋白表达;槲皮素抑制SAS细胞中核转录因子(NF)-κB蛋白的表达。结论 槲皮素抑制SAS细胞生长能力,通过抑制MMP-2和MMP-9的蛋白表达以及NF-κB蛋白的表达阻断SAS细胞迁移、运动以及侵袭。
口腔鳞癌细胞;核转录因子;基质金属蛋白酶;槲皮素
口腔鳞癌(SAS)发生于口腔,是头颈部常见的恶性肿瘤〔1〕。与SAS相关的因素有吸烟、饮酒、咀嚼槟榔、病毒感染、营养不良、饮食习惯和局部刺激等,其中吸烟、饮酒的危险性最大;在中国台湾地区,咀嚼槟榔与口腔癌的发生率关系最为密切〔2〕。手术(放疗或化疗)是目前治疗口腔癌的最主要手段,但是手术后的生存率与预后往往不能使口腔癌患者满意,并且癌细胞还会转移到其他器官或组织中。癌细胞转移过程中涉及细胞的骨架蛋白,改变细胞的黏附能力,从而影响细胞的运动,包括肿瘤细胞的侵入和迁移。文献〔3〕表明,癌细胞进行转移时,与细胞侵袭和迁移相关的基质金属蛋白酶(MMP)和尿激酶纤溶酶原激活物(uPA)会过分表达,因此,使用药物来抑制MMP和uPA(12-14)的表达或MMP酶活性(9-11)可预防癌症的转移。
槲皮素是一种多羟基黄酮类化合物,具有抗氧化、抗肿瘤等生物学活性及很高的医药用途〔4〕。槲皮素可抑制多种肿瘤细胞的增殖和诱导凋亡。研究表明〔5〕,槲皮素能通过降低凋亡抑制基因β淋巴细胞瘤(Bcl)-2表达、增加促凋亡蛋白(Bax)的数量、上调肿瘤细胞抑癌基因PTEN表达及抑制环氧合酶(COX)-2的表达来发挥诱导凋亡作用;槲皮素亦能通过表皮生长因子受体(EGFR)介导抑制肿瘤细胞中MMP-9的分泌,从而抑制肿瘤细胞侵袭能力。本文旨在探讨槲皮素如何抑制人SAS细胞迁移和侵袭。
1 材料和方法
1.1 材料与试剂 槲皮素、二甲基亚砜(DMSO)、碘化丙啶(PI)、核糖核酸酶-A、考马斯蓝和Tris-HCl购自Sigma-Aldrich Corp.(St.Louis,MO,USA)。Dulbecco改良的Eagle培养基(DMEM)、L-谷氨酰胺、胎牛血清(FBS)、青霉素-链霉素和胰蛋白酶-乙二氨四乙酸(EDTA)购自Life Technologies(Carlsbad,CA,USA)。MMP-9(cat.AB19016)购自Merck Millipore(Billerica,MA,USA),MMP-2、MMP-7、COX-2、诱导型一氧化氮合酶(iNOS)、活化B细胞的核因子κ轻链增强子(NF-κB)和二级抗体购自Cruz Biotechnology,Inc(Santa Cruz,CA,USA),使用前在PBSTween-20中稀释。
1.2 SAS细胞的培养 SAS细胞系购自上海酶研生物科技有限公司,将细胞立即置于75 cm2组织培养瓶中,用含有10% FBS、100 U/ml青霉素和100 μg/ml链霉素的2 mmol/L L-谷氨酰胺的DMEM培养基,然后37℃、5% CO2培养箱中进行常规培养,直到细胞生长至约50%~70%融合。接种于12孔板中24 h,每孔2×105个细胞,待细胞单层贴壁后,用浓度为25、50、100、150、200和400 μmol/L槲皮素处理24 h。然后收取细胞并用PI(4 μg/ml)染色,通过流式细胞术(FACS calibur流式细胞仪;BD Biosciences,San Jose,CA,USA)进行分析。
1.3 划痕实验 细胞在6孔板中以5×105个细胞/孔形成融合单层,然后采用Lai等〔6〕方法,用200 μl移液管尖端使细胞受伤,用磷酸盐缓冲液(PBS)洗涤2次后,将培养皿中的所有细胞用浓度为0、25、50 μmol/L的槲皮素处理,然后在含有1% FBS的新鲜DMEM培养基中温育24 h。使用相差显微镜拍摄照片,于24 h观察细胞迁移情况。通过倒置显微镜(OlympusIX71,Tokyo,Japan)观察和测量每种处理的培养皿中空白区域,细胞迁移计算为剩余空白区域与初始伤口面积相比的百分比,每个测试进行3次。
1.4 Transwell体外迁移实验 使用约30 μgⅠ型胶原(Merck Millipore)包被8 μm孔过滤器(Cat。PIEP12R48;Merck Millipore)1 h,将DMEM培养基中的细胞以2.5×104细胞/孔的密度置于Transwell上室中并加入0.5%DMSO(对照)和25、50 μmol/L槲皮素分别处理24、48 h。取出小室,取下滤膜,4℃下用5%戊二醛固定10 min,然后用2%结晶紫染液在水平摇床上染色30 min,PBS漂洗3次,棉签擦除膜上层未穿过的细胞,将Transwell小室底面朝上置200倍显微镜下观察细胞迁移情况并拍照计数。以上实验独立重复3次。
1.5 Transwell体外侵袭实验 细胞在无血清培养基中培养24 h,3 000 r/min离心,去除培养液,PBS清洗2次,用含0.1% FBS的DMEM培养为悬浮细胞,浓度5×104细胞/孔,置于Transwell的上室中并用0.5%DMSO(作为对照)、槲皮素(25和50 μmol/L)处理。将含有10%FBS的培养基置于下室中,然后将细胞在37℃,5%CO2中孵育24 h,用棉签擦除Matrigel以及上室内细胞,室温下多聚甲醛固定10 min,并用2%结晶紫染色10 min,清水漂洗4遍,将Transwell小室底面朝上置200倍显微镜下观察细胞迁移情况并拍照计数。
1.6 MMP-2/-9活性测定 通过明胶酶谱法测定SAS细胞中MMP-2和MMP-9的活性。将细胞(2×106个细胞/孔)接种在6孔板中,并分别在浓度为10、15、20、25和50 μmol/L的槲皮素无血清DMEM培养基中温育24 h,离心收集样品,然后在含有0.1%明胶的10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上电泳分离,然后25℃下将凝胶在2.5%Triton X-100的dH2O中浸泡2次,共60 min,然后37℃下在底物缓冲液(50 μmol/L Tris HCl、5 mmol/L CaCl2、0.02%NaN3和1%Triton X-100、pH8.0)中孵育18 h。0.3%考马斯蓝在50%甲醇和10%乙酸中的阴性染色与MMP-2和-9的活性条带进行对比。
1.7 Western印迹分析 将SAS细胞(1×106个细胞/孔)置于6孔板中,然后加入槲皮素(25和50 μmol/L)温育(24 h、48 h),当与培养物达到80%融合时收取细胞,重悬于PRO-PREP TM蛋白提取溶液(iNtRON Biotechnology,Seongnam-si,Gyeonggi-do,Korea)中。将每个样品的匀浆于4℃下以3 000 r/min离心10 min除去细胞碎片并收集上清液,使用Bio-Rad蛋白测定试剂盒(Hercules,CA,USA)测量每个上清液样品的总蛋白。提取总蛋白,测定蛋白浓度后每孔按40 μg蛋白上样。将蛋白经SDS-PAGE后转移到Immobilon-P膜上(IPVH00010;Merck Millipore)。使用一抗杂交1 h,漂洗后二抗染色,使用Immobilon Western化学发光辣根过氧化物酶(HRP)底物(WBKLS0500;Merck Millipore)和X射线胶片(GE Healthcare,Piscataway,NJ,USA)进行蛋白分析并拍照。
1.8 共聚焦激光扫描显微镜显示SAS细胞中的蛋白质易位 将细胞(5×104个细胞/孔)置于4孔板上,将浓度为25 μmol/L的槲皮素加入细胞中孵育24 h。孵育结束后,载玻片上的细胞用PBS中的4%甲醛固定15 min,然后使用2%BSA封闭非特异性结合位点,用PBS中的0.3%Triton-X 100透化1 h。
1.9 统计学方法 应用SPSS18.0软件行t检验。
2 结 果
2.1 槲皮素对SAS细胞存活率的影响 与对照组〔(100.0±3.8)%〕相比,槲皮素处理过的SAS细胞存活明显减少〔25、50、100、150、200、400 μmol/L组存活率分别为(82.5±6.4)%、(58.8±7.1)%、(42.5±6.6)%、(33.2±5.8)%、(31.2±7.3)%、(18.5±4.6)%,P<0.05〕,并且随着槲皮素浓度的增加,凋亡细胞数量明显增加,说明槲皮素与细胞凋亡数具有浓度依赖性。
2.2 槲皮素对SAS细胞迁移和侵袭的影响 见图1。细胞迁

图1 槲皮素对SAS细胞迁移和侵袭的影响(×200)
移实验结果表明,与对照组(100%)相比,浓度为25、50 μmol/L槲皮素对细胞迁移具有显著的抑制作用,并且当细胞分别用槲皮素处理24和48 h后,细胞迁移率分别为〔(56.4±4.2)%、(42.8±5.0)%〕和〔(51.9±4.4)%、(30.6±5.3)%〕,与对照组相比具有极显著差异(P<0.001)。细胞侵袭实验结果表明,与对照组相比,浓度为25、50 μmol/L槲皮素对细胞侵袭具有显著的抑制作用,并且当细胞分别用槲皮素处理24、48 h后,细胞迁移率分别为〔(35.7±8.8)%、(24.5±2.8)%〕和〔(41.6±5.5)%、(35.1±4.8)%〕,与对照组相比具有极显著差异(P<0.001)。且槲皮素对SAS细胞迁移和侵袭的抑制与浓度、作用时间有依赖性,浓度越大、作用时间越长槲皮素对SAS细胞迁移和侵袭的抑制能力越强。
2.3 槲皮素对SAS细胞划痕的影响 见图2。SAS细胞在0、25和50 μmol/L槲皮素中温育0、12和24 h。与对照组相比,槲皮素处理组的SAS细胞划痕面积较大,且不同浓度、不同作用时间槲皮素处理的SAS细胞划痕具有显著差异,浓度越大、作用时间越长槲皮素抑制SAS细胞划痕的愈合能力越强。


图2 槲皮素对SAS细胞划痕的影响(×40)
2.4 槲皮素对SAS细胞中MMP-2和MMP-9活性的影响 槲皮素能够抑制SAS细胞的MMP-9和MMP-2活性,并且浓度越大、作用时间越长抑制能力越强。见图3。
2.5 槲皮素对与SAS细胞迁移和侵入相关的蛋白质表达水平的影响 槲皮素能够降低MMP-2、-7、-9、-10和VEGF的表达,降低NF-κB p65、iNOS、COX-2和uPA的表达。见图4,图5。
2.6 槲皮素对SAS细胞中NF-κB表达的影响 SAS细胞在含有25 μmol/L槲皮素条件下温育24 h,然后用NF-κB p65标记的二抗(绿色荧光)染色,并且通过激光共聚焦显微镜(比例尺20 μm)检测蛋白表达情况。结果显示槲皮素抑制SAS细胞中NF-κB蛋白的表达。见图6。

图3 槲皮素对SAS细胞中MMP-2和MMP-9活性的影响
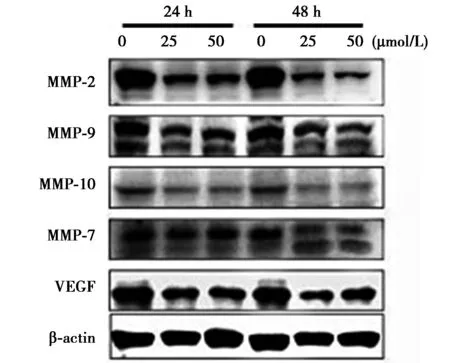
图4 槲皮素对与SAS细胞迁移相关的蛋白质 表达水平的影响

图5 槲皮素对与SAS细胞侵入相关的蛋白质 表达水平的影响

图6 槲皮素对SAS细胞中NF-κB表达的影响(×400)
3 讨 论
淋巴结扩散和远处转移相关的高发生率是导致SAS预后不良的根本原因。槲皮素是一种在自然界广泛分布的黄酮类化合物,其抗肿瘤及抗氧化方面的作用受到国内外学者的广泛关注。近年来研究发现〔7〕,槲皮素能够抑制多种肿瘤细胞的分裂和增殖,通过多种途径促进其凋亡,抑制肿瘤细胞迁移及侵袭。但对SAS癌细胞迁移转移能力的影响以及机制研究较少,因此,本研究探讨了槲皮素对SAS口腔癌细胞迁移和侵袭的影响,测定SAS口腔癌细胞迁移潜力,为抑制肿瘤细胞增殖、促进其凋亡、抗肿瘤血管生成等提供科学依据。
有研究表明〔8〕,癌细胞的迁移和侵入涉及MMP的表达,MMP-2和MMP-9可以降解Ⅳ型胶原,破坏细胞外基质的降解平衡,使癌细胞容易突破细胞外基质以及基底膜,从而使癌细胞发生侵袭和转移。因此,抑制MMP-2和MMP-9表达或酶活性可以用作预防癌症转移的早期靶标。本实验发现,槲皮素对SAS细胞的抑制作用具有浓度和时间依赖性,浓度越高、时间越
长其抑制能力越强,并且槲皮素通过抑制MMP-2和MMP-9的活性和表达来抑制SAS细胞的迁移和侵袭,从而抑制了肿瘤的转移。
NF-κB家族中p65的含量最丰富,p65/p50最早被发现而且也是存在最广泛的二聚体形式,可以调控下游多种靶基因的转录活性,参与细胞多种重要的生命活动〔9〕。细胞在静息状态下处于无活性状态,当细胞受到如寄生虫、病毒等生物因素刺激时,p50/p65 释放出来进入细胞核中,与基因上κB 结合位点特异性结合,成为活化的NF-κB信号通路,并且上调下游的靶基因环氧化酶(COX)-2,进而促进了肿瘤细胞的增殖和分化。本研究表明,槲皮素能够减少NF-κB蛋白的表达水平,使NF-κB信号通路的活性降低,并且下调下游的靶基因COX-2的活性,阻断信号通路,从而抑制了SAS口腔癌细胞的增殖和分化。
综上所述,槲皮素以浓度、时间依赖性方式抑制MMP-2和-9的活性,从而抑制SAS细胞中迁移和侵入的可能信号途径;槲皮素通过减少NF-κB蛋白的表达水平,阻断COX-2的信号通路,从而抑制了SAS细胞的增殖和分化。
1 Sanjiv K,Su TL,Suman S,etal.The novel DNA alkylating agent BO-1090 suppresses the growth of human oral cavity cancer in xenografted and orthotopic mouse models〔J〕.Int J Cancer,2012;130(6):1440-50.
2 Liu S Y,Lu CL,Chiou CT,etal.Surgical outcomes and prognostic factors of oral cancer associated with betel quid chewing and tobacco smoking in Taiwan.〔J〕.Oral Oncol,2010;46(46):276-82.
3 Gullu IH,Kurdoglu M,Akalin I.The relation of gelatinase(MMP-2 and-9)expression with distant site metastasis and tumour aggressiveness in colorectal cancer〔J〕.Br J Cancer,2000;82(1):249.
4 孙 涓,余世春.槲皮素的研究进展〔J〕.现代中药研究与实践,2011;25(3):85-8.
5 王 刚,杜士明,杨光义,等.槲皮素抗肿瘤的分子机制研究进展〔J〕.中国医院药学杂志,2011;31(4):322-4.
6 Lai KC,Huang AC,Hsu SC,etal.Benzyl isothiocyanate(BITC)inhibits migration and invasion of human colon cancer HT29 cells by inhibiting matrix metalloproteinase-2/-9 and urokinase plasminogen(uPA)through PKC and MAPK signaling pathway〔J〕.J Agric Food Chem,2010;58(5):2935-42.
7 孙 怡,顾 君.槲皮素抑制乳腺癌细胞迁移侵袭及分子机制研究〔J〕.中国中药杂志,2015;40(6):1144-50.
8 Coussens LM,Werb Z.Matrix metalloproteinases and the development of cancer〔J〕.Chem Biol,1996;3(11):895-904.
9 杨 雪,欧俐苹,王晓荣,等.PLCε基因通过NF-κB/p65途径抑制肾癌786-0细胞的增殖〔J〕.第三军医大学学报,2014;36(19):2010-5.
〔2017-01-22修回〕
(编辑 袁左鸣)
魏建宏(1972-),男,硕士生导师,副教授,主要从事神经毒理研究。
R73
A
1005-9202(2017)11-2646-04;
10.3969/j.issn.1005-9202.2017.11.020
1 山西省汾阳医院口腔科
