miRNA-425-5p促进胰腺癌细胞增殖、迁移与侵袭过程的分子机制
2017-06-23戴宇翃
蔡 洲 戴宇翃
(武汉科技大学城市学院医学部,湖北 武汉 430083)
miRNA-425-5p促进胰腺癌细胞增殖、迁移与侵袭过程的分子机制
蔡 洲 戴宇翃1
(武汉科技大学城市学院医学部,湖北 武汉 430083)
目的 探讨microRNA-425-5p(miR-425-5p)对胰腺癌细胞增殖、迁移和侵袭的影响。方法 将miR-425-5p及对照分别转染入胰腺癌细胞系PANC-1进行CCK-8增殖实验、Transwell迁移和Matrigel侵袭实验,观察miR-425-5p对胰腺癌细胞增殖、迁移和侵袭的影响。通过查阅文献寻找可能参与调节细胞增殖、迁移或侵袭过程的miR-425-5p的靶蛋白,然后将该蛋白过表达进行上述功能学实验。结果 CCK-8增殖实验、Transwell迁移和Matrigel侵袭实验发现:与对照组相比,miR-425-5p能够促进胰腺癌细胞增殖、迁移和侵袭。对过表达miR-425-5p的靶基因脑海绵状血管瘤3(CCM3)进行功能学实验发现,高表达的CCM3抑制细胞的增殖、迁移和侵袭能力。结论 miR-425-5p可能通过靶向下调CCM3促进胰腺癌细胞增殖、迁移和侵袭过程。
miR-425-5p;脑海绵状血管瘤3;增殖;迁移;侵袭
胰腺癌恶性程度非常高,早期症状不明显,易发生转移且对治疗的反应较差。许多患者在就诊时肿瘤已处于进展期或者发生转移,且放疗及化疗对胰腺癌的治疗效果不明显,如吉西他滨,患者很容易对其发生耐药反应〔1〕。microRNAs(miRNAs)是一类进化上高度保守的单链小分子非编码RNA,广泛存在于多种细胞生物中,参与基因转录后水平的调控〔2〕。而在胰腺癌组织中许多miRNAs的表达水平发生改变,通过调节一些原癌基因或者抑癌基因的表达,参与胰腺癌的发生发展过程〔3〕。有研究报道miR-425-5p在胃癌组织中高表达且参与胃癌的转移过程〔4〕。此外,在宫颈癌组织中miR-425-5p也处于较高的表达水平〔5〕,且可靶向作用于脑海绵状血管瘤3(CCM3)发挥生物学作用〔6〕。本文通过过表达miR-425-5p观察该miRNA对胰腺癌细胞增殖、迁移和侵袭的影响,并观察miR-425-5p的靶基因CCM3是否参与该过程。
1 材料和方法
1.1 细胞 人胰腺癌细胞PANC-1购自中国科学院上海细胞库,生长于含10%灭活胎牛血清(FBS)、2 mmol/L L-谷氨酰胺、青霉素(100 U/ml)和链霉素(100 μg/ml)的DMEM培养基中,在37℃、5%二氧化碳的细胞培养箱中培养。
1.2 试剂 转染试剂LipofectamineTM2000购自美国Invitrogene公司。八肽胆囊收缩素(CCK-8)化学试剂购自日本同仁化学。Transwell小室(8 μm)购于Millipore 公司。基质胶(BD MatrigelTMBasement Membrane Matrix)购自BD Biosciences公司。MiR-425-5p mimic和阴性对照(NC)由上海吉玛生物公司合成。CCM3过表达质粒及空载体对照质粒购自北京义翘神州生物科技有限公司。为了验证CCM3的作用,利用LipofectamineTM2000将CCM3过表达质粒及空载体对照质粒分别转染入过表达miR-425-5p和NC。
1.3 实时荧光定量聚合酶链反应(RT-qPCR)检测miR-425-5p的表达水平 实验前1 d分别将miR-425-5p和NC根据LipofectamineTM2000说明书推荐的操作,转染入PANC-1细胞,运用RT-qPCR检测miR-425-5p的表达水平。首先提取转染后的PANC-1细胞RNA为模板,加入500 nmol/L相应 miRNA 逆转录引物(RT引物)4 μl配置成模板-引物混合液。将上述混合液置70℃水浴10 min,0℃冰浴2~3 min。同时配置以下反应体系:2.5 mmol/L dNTP 4 μl,5×RT Buffer 10 μl,200 U/ml反转录酶1 μl,40 U/ml RNase inhibitor 1 μl。将冰浴后模板-引物混合液加入以上反应体系中,以无核酸酶ddH2O补足至总体积为50 μl。42℃水浴90 min后,95℃ 5 min终止反转录,立即0℃冰浴5 min,即获得cDNA。各引物序列见表1。该cDNA可用于相应microRNA RT-qPCR检测。95℃ 20 s预变性,按95℃ 10 s变性、60℃ 20 s退火、70℃ 10 s延伸过程循环40次,获得Ct值。获得的Ct值按Applied Biosystem公司ABI PRISM 7700 Sequence Detection System User Bulletin #2推荐方法进行计算并比较各样本中相应 miRNA的表达水平。

表1 microRNA RT-qPCR引物与PCR特异性引物
1.4 CCK-8增殖实验 将转染成功的细胞,次日用胰酶消化细胞以3 000个/孔细胞数接种于96孔板中,37℃ 5%二氧化碳培养箱中培养,分别在培养1 d、2 d、3 d、4 d和5 d后,每孔加入10 μl CCK-8,继续培养1 h,以空白孔调零,波长为450 nm下,用Bioteck DR-3506全自动酶标读数仪测出每孔OD值。
1.5 Transwell 迁移实验 将转染成功的细胞第2天进行Transwell迁移实验。首先于24孔板中加入500 μl 10%FBS DMEM培养基,将 Transwell小室置于孔上,放入细胞培养箱平衡30 min。然后将转染有miR-425-5p和NC的细胞消化,用纯DMEM培养基配制成5×105个/ml 的细胞悬液。每个小室加入200 μl细胞悬液,即每孔细胞约为1×105个。每组设置3个复孔,将24孔板放入细胞培养箱,分别于培养6 h和12 h后取
出小室染色固定,应用奥林巴斯显微镜进行拍照计数,观察进入下室的细胞数量以判断细胞迁移情况。
1.6 Matrigel侵袭实验 将转染成功的细胞第2天进行Matrigel侵袭实验。将基质胶和DMEM培养基按2∶1配成基质胶-DMEM 混合液,置于冰上备用。将Transwell 小室置于24孔板中,下室加入500 μl 10%FBS DMEM培养基,每个小室加入60 μl基质胶-DMEM混合液,于 37℃、5% CO2细胞培养箱中培养5 h。然后将转染有microRNA-425-5p和NC的细胞消化,用纯DMEM培养基配制成5×105个/ml 的细胞悬液。每个小室加入200 μl细胞悬液,即每孔细胞约为1×105个,每组设置3个复孔。将24孔板放入细胞培养箱,分别于6 h和12 h取出小室染色固定,显微镜下拍照计数,观察进入下室的细胞数量以判断细胞侵袭情况。
1.7 统计学方法 采用SPSS15.0软件,两组之间的比较行成组t检验,多组间行单因素方差分析、重复测量方差分析。
2 结 果
2.1 过表达miR-425-5p促进胰腺癌细胞的增殖 与NC相比,转染miR-425-5p组miR-425-5p的表达水平明显上升(图1A)。随即利用细胞进行功能学实验。CCK-8增殖实验结果显示,在实验第3、4、5天,过表达miR-425-5p后PANC-1细胞的增殖能力明显高于对照组(P<0.05)(图1B)。
2.2 过表达miR-425-5p促进胰腺癌细胞的迁移和侵袭 见图2。与NC比较,转染有miR-425-5p组细胞在6 h〔迁移细胞数:NC组(98±7),miR-425-5p组(152±18);侵袭细胞数:NC组(72±6),miR-425-5p组(115±9)〕或12 h〔迁移细胞数:NC组
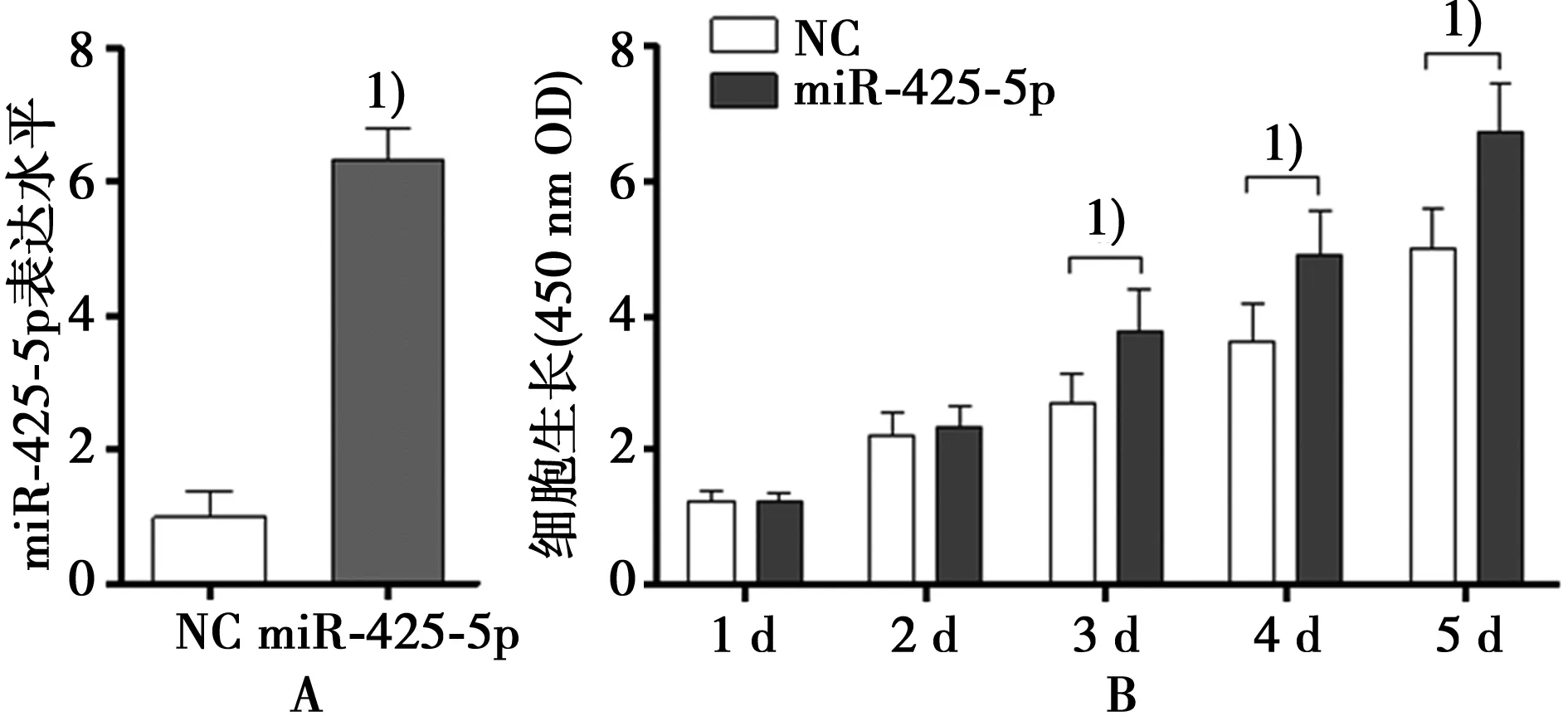
1)P<0.05 图1 过表达miR-425-5p促进胰腺癌细胞的增殖

图2 过表达microRNA-425-5p促进胰腺癌细胞的迁移和侵袭
(195±17),miR-425-5p组:(263±20);侵袭细胞数NC组(138±7),miR-425-5p组(285±15)〕迁移与侵袭到小室底部的细胞数明显增多(P<0.05)。
2.3 过表达CCM3抑制胰腺癌细胞的增殖过程 miR-425-5p+对照组细胞增殖能力>NC+对照组,与图1B结果一致,但当过表达CCM3后,细胞的增殖能力与相应的对照组相比均下降(P<0.05)。以上结果提示过表达CCM3后能明显抑制PANC-1细胞的增殖能力,而miR-425-5p可以靶向下调CCM3的表达水平,因此推测miR-425-5p通过下调CCM3的表达从而促进细胞的增殖。见图3。
2.4 过表达CCM3抑制胰腺癌细胞的迁移和侵袭过程 无论6 h还是12 h,miR-425-5p+对照组细胞迁移和侵袭能力>NC+对照组,与图2一致;但当过表达CCM3后,细胞的迁移与侵袭能力与相应的对照组相比均下降。以上结果提示过表达CCM3能明显抑制PANC-1细胞的迁移与侵袭能力(P<0.05),而miR-425-5p可以靶向下调CCM3的表达水平。见表2。因此推测miR-425-5p通过下调CCM3的表达从而促进细胞的迁移和侵袭。

1)P<0.05 图3 过表达CCM3抑制胰腺癌细胞的增殖过程
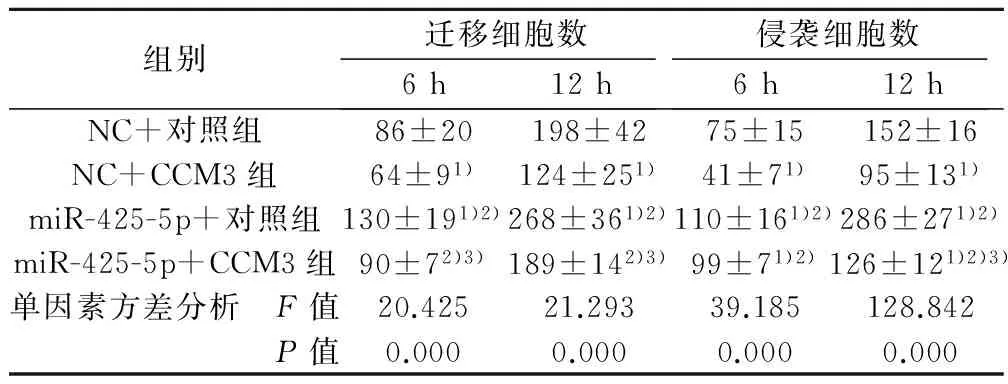
组别迁移细胞数6h12h侵袭细胞数6h12hNC+对照组86±20198±4275±15152±16NC+CCM3组64±91)124±251)41±71)95±131)miR-425-5p+对照组130±191)2)268±361)2)110±161)2)286±271)2)miR-425-5p+CCM3组90±72)3)189±142)3)99±71)2)126±121)2)3)单因素方差分析 F值20.42521.29339.185128.842 P值0.0000.0000.0000.000
与NC+对照组比较:1)P<0.05;与NC+CCM3组比较:2)P<0.05;与miR-425-5p+对照组比较:3)P<0.05
3 讨 论
胰腺癌较高的死亡率与其易发生转移密不可分,约80%的患者在确诊时已发生远处转移〔7〕。因此,关于胰腺癌转移机制的探索对发现新的诊断及治疗方案确有必要。许多miRNAs被发现在胰腺癌组织及癌旁组织中呈现差异性表达。例如,低表达的miR-96可以促进胰腺癌细胞的侵袭和肿瘤生长〔8〕;而高表达的miR-10a可以诱导肿瘤的转移〔9〕。因此,关于关键性miRNAs的研究发现可作为胰腺癌的诊断及新型治疗方案提出的理论基础〔10〕。本文研究发现miR-425-5p可以促进胰腺癌细胞的增殖、迁移和侵袭过程,且先前研究发现miR-425-5p可靶向下调CCM3,过表达CCM3再次进行功能学实验,发现高表达CCM3后胰腺癌细胞的增殖、迁移与侵袭过程明显受到抑制。本研究得出miR-425-5p同样通过抑制CCM3的表达参与胰腺癌的肿瘤生长及转移过程。CCM3又名程序性细胞死亡10(PDCD10),该基因主要与细胞凋亡有关〔11〕。miR-425-5p通过下调其表达水平,从而促进细胞的增殖过程。此外,CCM3还参与调节许多蛋白激酶的激活,比如可以调节细胞外信号调节激酶(ERK)信号通路〔12〕。本研究推测miR-425-5p通过CCM3间接调节蛋白激酶的改变从而调控一系列信号分子或者基质金属蛋白酶家族成员的表达从而促进胰腺癌的转移过程,但仍需进一步研究确认。综上所述,miR-425-5p通过靶向下调CCM3促进胰腺癌细胞的增殖、迁移和侵袭过程,这是首次关于miR-425-5p在胰腺癌中的报道。该结果提示靶向抑制miR-425-5p有可能成为阻止胰腺癌肿瘤生长与转移的潜在治疗方案。
1 文娣娣,张振华,任 静,等.胰腺癌发病的分子机制和诊断〔J〕.现代生物医学进展,2015;15(27):5384-7.
2 李衍训.microRNA:胰腺癌早期诊断的潜在标记物〔J〕.中国普通外科杂志,2014;23(3):367-71.
3 Li Y,Sarkar FH.MicroRNA targeted therapeutic approach for pancreatic cancer〔J〕.Int J Biol Sci,2016;12(3):326-37.
4 Zhang Z,Li Y,Fan L,etal.MicroRNA-425-5p is upregulated in human gastric cancer and contributes to invasion and metastasis in vitro and in vivo〔J〕.Exp Ther Med,2015;9(5):1617-22.
5 Zhang Y,Hu X,Miao X,etal.MicroRNA-425-5p regulates chemoresistance in colorectal cancer cells via regulation of programmed cell death 10〔J〕.J Cell Mol Med,2016;20(2):360-9.
6 Lerch MM,Mayerle J,Mahajan U,etal.Development of pancreatic cancer:targets for early detection and treatment〔J〕.Dig Dis,2016;34(5):525-31.
7 Dart A.Metastasis:CXCR2-targeted therapy for pancreatic cancer〔J〕.Nat Rev Cancer,2016;16(7):411.
8 Huang X,Lv W,Zhang JH,etal.miR96 functions as a tumor suppressor gene by targeting NUAK1 in pancreatic cancer〔J〕.Int J Mol Med,2014;34(6):1599-605.
9 Ohuchida K,Mizumoto K,Lin C,etal.MicroRNA-10a is overexpressed in human pancreatic cancer and involved in its invasiveness partially via suppression of the HOXA1 gene〔J〕.Ann Surg Oncol,2012;19(7):2394-402.
10 Lin SZ,Xu JB,Ji X,etal.Emodin inhibits angiogenesis in pancreatic cancer by regulating the transforming growth factor-β/drosophila mothers against decapentaplegic pathway and angiogenesis-associated microRNAs〔J〕.Mol Med Rep,2015;12(4):5865-71.
11 Stamatovic SM,Sladojevic N,Keep RF,etal.PDCD10 (CCM3) regulates brain endothelial barrier integrity in cerebral cavernous malformation type 3:role of CCM3-ERK1/2-cortactin cross-talk〔J〕.Acta Neuropathol,2015;130(5):731-50.
12 Zhu Y,Zhao K,Prinz A,etal.Loss of endothelial programmed cell death 10 activates glioblastoma cells and promotes tumor growth〔J〕.Neurol Oncol,2016;18(4):538-48.
〔2016-11-15修回〕
(编辑 袁左鸣)
蔡 洲(1977-),男,硕士,讲师,主要从事生物化学与分子生物学方面的研究。
R34
A
1005-9202(2017)11-2629-03;
10.3969/j.issn.1005-9202.2017.11.012
1 华中科技大学同济医学院附属同济医院肿瘤科
