以PNP酶为靶点的急性高尿酸血症小鼠模型组建
2017-06-22杨旭娟李鹏辉张建文
杨旭娟,黄 茜,田 周,王 萍,李鹏辉,张建文
(昆药集团股份有限公司 药物研究院生物学部,云南 昆明 650100)
◇实验方法学◇
以PNP酶为靶点的急性高尿酸血症小鼠模型组建
杨旭娟,黄 茜,田 周,王 萍,李鹏辉,张建文
(昆药集团股份有限公司 药物研究院生物学部,云南 昆明 650100)
目的 建立一种新的急性高尿酸血症小鼠模型并利用该模型对PNP酶抑制剂Ulodesine进行体内药效作用评价。方法 小鼠腹腔注射肌苷(inosine)和皮下注射氧嗪酸钾(oteracil potassium)诱导体内尿酸蓄积,在一定时间段内对小鼠进行内眦静脉或摘眼球采血,测定血清尿酸值,判断小鼠急性高尿酸血症模型成功与否;再利用酶动力学分析Ulodesine对PNP酶的体外抑制作用,并于造模前给予小鼠灌胃Ulodesine,造模后测定血清尿酸值,评价Ulodesine的降血尿酸作用。结果 小鼠腹腔注射200 mg·kg-1肌苷联合皮下注射200 mg·kg-1氧嗪酸钾在1.5 h时能形成较为稳定的急性高尿酸血症;酶动力学测定结果显示Ulodesine对PNP酶有极强的抑制作用,其IC50值为2.293 nmol·L-1;另外,Ulodesine的体内药效表明,Ulodesine能够明显减低急性高尿酸血症小鼠体内尿酸水平。结论 我们已经成功地建立了一种新的急性高尿酸血症小鼠模型,该造模制作方法更简单有效,且该模型可以应用于验证PNP酶抑制剂。
嘌呤核甘磷酸酶(PNP);高尿酸血症;Ulodesine:肌苷:小鼠;急性模型
正常嘌呤饮食状态下,非同日两次空腹血尿酸水平: 男>420 μmol·L-1,女>327 μmol·L-1,可诊断为高尿酸血症(HUA)[1]。近年来,全球HUA发病率明显增加,且发病年龄呈低龄化趋势,研究表明HUA与高血压、高血脂、动脉粥样硬化、肥胖、胰岛素抵抗的发生密切相关,已成为威胁人类健康的严重代谢性疾病。因此,控制尿酸水平是预防和治疗HUA的关键。目前对高尿酸血症的治疗药物主要包括三大类:抑制尿酸合成,促进尿酸排泄和促尿酸分解[2]。随着分子生物技术的快速发展和人们对高尿酸血症发病机制和遗传学认识的日益加深,除去黄嘌呤氧化酶、尿酸转运蛋白等[3],新的治疗靶点不断被发现,新型治疗药物也相继问世。以美国Biocryst公司研发的新型降血尿酸药物Ulodesine为例,它是针对PNP酶高度专一的抑制剂,其降尿酸机制主要通过抑制嘌呤核甘磷酸酶(PNP)活性,进而减少次黄嘌呤及黄嘌呤在体内的积累,以达到降低血尿酸的目的[4]。随着该药二期临床终点的到达,PNP靶点得到了广泛关注[5-6]。
肌苷(Inosine)是体内尿酸合成的起始原料,经过PNP 酶的水解作用形成次黄嘌呤再由黄嘌呤氧化酶(XO)氧化形成黄嘌呤进而生成尿酸[7]。由此可见PNP处于XO的上游,评价PNP抑制对尿酸合成影响的体内模型需要使用上游底物肌苷而非次黄嘌呤。通过补充嘌呤类药物(食物)建立的高血尿酸症动物模型并不适用于评价PNP酶抑制剂的降尿酸效果[8]。因此,我们迫切需要建立一种新的高尿酸血症动物模型,为靶向于PNP的新药筛选及药理药效学评价提供一种可靠的方法。
1 材料与方法
1.1 动物 SPF级ICR ♂小鼠,体质量20~22 g,由昆药集团实验动物室提供,生产许可证号SCXK(滇)K2014-0001,使用许可证号:SYXK(滇)K2014-0001。
1.2 药物与试剂 Ulodesine, 批号20150727,上海药明康德;氯化钠注射液,批号A141105 A1,昆明南疆制药有限公司;羧甲基纤维素钠(CMC-Na),批号20121127,西安德立生物化工有限公司;尿酸(UA)测定试剂盒:批号:20151019,南京建成生物工程研究所;氧嗪酸钾(Otp):批号BJ0909DA14,上海源叶生物科技有限公司; 肌苷(inosine,Ino),批号019K1124V,Sigma;黄嘌呤氧化酶,批号SLBB1574V,Sigma;嘌呤核甘磷酸酶,批号L16Y28A,上海源叶生物科技有限公司。
1.3 仪器 PowerWave XS2全波长酶标仪(BioTek),MiniSpin离心机(eppendorf),AdventurerTM天平(奥豪斯仪器上海有限公司)
1.4 Ulodesine对PNP酶的体外抑制作用 取50 μL不同浓度的Ulodesine溶液或空白溶液(50 mmol·L-1PBS)、50 U·L-1的PNP酶溶液、100 μL浓度为0.56 mmol·L-1肌苷底物(含XO浓度为0.165 kU·L-1),依次加入到96孔板中,置于酶标仪检测板上(全程温度控制在在25 ℃),中级震板10 s后在293 nm处每隔1 min测定吸光度值A,共计10 min;以吸光度值A对反应时间制作反应曲线,求出反应速率V。重复3次测定,取其平均值。
按下列公式计算Ulodesine对PNP酶的抑制率:抑制率(%)=[V(空白孔)-V(样品孔)]/V(空白孔)×100%
1.5 急性高尿酸血症小鼠模型的组建 取64只♂小鼠随机分为8组,每组8只,分别为肌苷低、中、高剂量组(即Ino 100、200、300 mg·kg-1组),联合造模低、中、高剂量组(即Ino 100 mg·kg-1+Otp 200 mg·kg-1、Ino 200 mg·kg-1+Otp 200 mg·kg-1、Ino 300 mg·kg-1+Otp 200 mg·kg-1组),氧嗪酸钾组(Otp 200 mg·kg-1)、空白对照组(NS),以上模型组中,按10 mL·kg-1容积腹腔(ip)注射肌苷或皮下(sc)注射氧嗪酸钾造模,空白组分别腹腔联合皮下给予等体积生理盐水。以上各组分别在造模后1.5 h摘除小鼠眼球采血,室温静置30 min后,4 000 r·min-1离心10 min,取血清,按试剂盒方法(磷钨酸法)测定尿酸值。为减小系统误差,试验采用平行操作。
1.6 Ulodesine体内降尿酸作用评价 取40只♂小鼠分为5组(每组8只):空白组、模型组、Ulodesine(20、10、5 mg·kg-1),均于造模前0.5 h按20 ml·kg-1体重灌胃给药1次,空白组与模型组给予等体积0.5% CMC-Na溶液。各组均按200 mg·kg-1剂量腹腔注射肌苷联合200 mg·kg-1剂量皮下注射氧嗪酸钾造模,空白组给予等体积氯化钠注射液。造模后1.5 h摘除小鼠眼球采血,室温静置30 min后,4 000 r·min-1离心10 min,取血清按试剂盒方法(磷钨酸法)测定尿酸值。为减小系统误差,试验采用平行操作。
2 结果
2.1 Ulodesine对PNP酶的体外抑制作用 实验结果显示,在测定时间0~10 min范围内,反应体系中随着Ulodesine浓度的增大,反应速率越小,终浓度大于6.25 nmol·L-1时,抑制率高达90%;经过GraphPad Prism 6.0软件对Ulodesine LogC-抑制率进行曲线拟合,IC50=2.293 nmol·L-1,见Tab 1及Fig 1。

Tab 1 Inhibition of Ulodesine on PNP

Fig 1 Fitting curve of Ulodesine inhibition rate to PNP
2.2 急性高尿酸血症小鼠模型组建 实验结果显示,在1.5 h采血时间点,单用肌苷或氧嗪酸钾造模,模型组动物血清尿酸水平与空白组不相上下,甚至低于空白组,造模并不理想,而二者联合造模3个剂量组动物血清尿酸水平明显高于空白组,差异具有统计学意义,提示模型均复制成功。且肌苷200 mg·kg-1联合氧嗪酸钾200 mg·kg-1造模与肌苷300 mg·kg-1联合氧嗪酸钾200 mg·kg-1造模相比,前者血清尿酸值略高;故综合以上实验情况,最终确定急性高尿酸小鼠造模条件为:肌苷(ip:200 mg·kg-1)联合氧嗪酸钾(SC:200 mg·kg-1),于造模后1.5 h采血。见Tab 2、Fig 2。
2.3 Ulodesine体内降尿酸作用评价 结果显示,模型组动物血清尿酸水平明显高于空白组,差异具有统计学意义(P<0.01);Ulodesine各剂量组均能剂量依赖性降低模型小鼠血清尿酸水平,与模型组相比,差异有统计学意义(P<0.01,P<0.05)。表明Ulodesine具有很好的降低模型小鼠血清尿酸作用,见Tab 3,Fig 3。
3 讨论
根据增加尿酸的来源和减少其去路的原理,常用以下方法构建高尿酸血症动物模型:① 直接摄入尿酸、高嘌呤食物或尿酸前体物质,增加黄嘌呤氧化酶的活性,促进尿酸产生,从而获得高尿酸血症模型;② 抑制尿酸的排泄: 体内的尿酸主要通过肾脏排出体外,抑制肾脏尿酸排泄,可以增加血尿酸浓度,形成高尿酸血症;③ 抑制尿酸酶活性: 尿酸酶催化尿酸氧化成过氧化氢和尿囊素等物质,抑制或消除尿酸酶的活性是造模的主要手段,常用药物为氧嗪酸钾;④ 基因改造模型:1994年国外报道通过胚胎干细胞同源性重组,破坏小鼠尿酸酶基因,获得尿酸酶缺乏的突变小鼠高尿酸血症模型[8-9]。现有高尿酸血症动物模型的建立方法很多,但尚无公认的最佳方法。因此应根据研究目的、实验条件来选择合适的造模动物和造模方法。

Tab 2 Effect of different doses of inosine combined with potassium oxonate modeling on uric acid level in ±s,n=8)
#P<0.05,##P<0.01vsvehicle
Tab 3 Effects of Ulodesine on the level

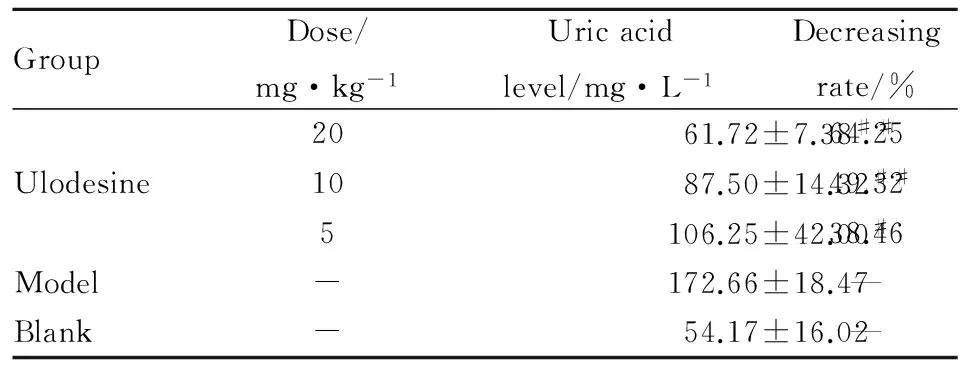
GroupDose/mg·kg-1Uricacidlevel/mg·L-1Decreasingrate/%2061.72±7.38##64.25Ulodesine1087.50±14.32##49.325106.25±42.00#38.46Model-172.66±18.47—Blank-54.17±16.02—
#P<0.05,##P<0.01vsmodel

Fig 2 Effect of different doses of inosine combined with potassium oxonate modeling on uric acid level in mice
1:Ino 100;2:Ino 200;3:Ino 300;4:Ino 100+Otp 200;5:Ino 200+Otp 200;6:Ino 300+Otp 200;7:Otp 200;8:NS,#P<0.05,##P<0.01vsNS

Fig 3 Effects of Ulodesine on level of uric acid in mice
1:U 20 mg·kg-1;2:U 10 mg·kg-1;3:U 5 mg·kg-1;4:Model group;5:Control group.#P<0.05,##P<0.01vsmodel
由于PNP酶处于XO酶的上游,评价PNP抑制剂对尿酸合成影响的体内模型需要使用上游底物肌苷而非次黄嘌呤。我们根据这些理论,从体内体外两个方面分别验证了Ulodesine对PNP酶的抑制作用及降尿酸作用。体外结果显示在测定时间0~10 min范围内,反应体系中随着Ulodesine浓度的增大,反应速率越小,终浓度大于6.25 nmol·L-1时,抑制率高达90%,其IC50为2.293 nmol·L-1,表明Ulodesine对PNP酶具有极强的抑制作用;另外在肌苷联合氧嗪酸钾造模的新高尿酸血症模型中,肌苷200 mg·kg-1联合氧嗪酸钾200 mg·kg-1造模在1.5 h时,小鼠血清尿酸值为空白组的4倍,与文献报道的次黄嘌呤腹腔加氧嗪酸钾皮下注射法形成急性小鼠高尿酸模型类似[10],而 5~20 mg·kg-1的Ulodesine均能剂量依赖性降低模型小鼠血清尿酸水平,与模型组比,差异有统计学意义。以上实验结果说明Ulodesine具有很好的降低高尿酸血症模型小鼠尿酸水平的作用,与报道一致。且肌苷加氧嗪酸钾造成的小鼠急性高尿酸血症模型可用于评价以PNP为靶点的药物的降尿酸效果。
该模型针对PNP靶点建立,由于PNP酶处于XO酶的上游,因此该模型不仅可以用于以PNP酶为靶点的降血尿酸药物新药开发,还可以用于评价以XO为靶点的药物药效学评价,以及尿酸生成过程中两种作用机制不同药物在体内的降血尿酸协同效应。
(致谢:参与实验帮忙的实习生袁云云、郝世颖、苏慧敏、刘威良。)
[1] 中国医师协会心血管内科医师分会.中国医师协会循证医学专业委员会. 无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J]. 中国当代医药, 2009,16(24):4-8.
[1] The Chinses medical doctor association cardivascular physician branch.The Chinese medical doctor association professional committee of evidence-based medicine.Chinese expert consensus on the diagnosis and treatment of asymptomatic hyperuricemia combined with cardiovascular disease[J].ChinaModMed, 2009,16(24):4-8.
[2] McDonagh E M, Thorn C F, Callaghan J T, et al. PharmGKB summary: uric acid-lowering drugs pathway, pharmacodynamics[J].PharmacogenetGenomics, 2014, 24(9):464-76.
[3] 吴新荣,臧路平,刘志刚.抗高尿酸血症药物作用靶点研究进展[J].中国药理学通报,2010,26(11):1414-7.
[3] Wu X R,Zang L P,Liu Z G. Research advances on drug therapy targets in hyperuricemia[J].ChinPharmacolBull.2010,26(11):1414-7.
[4] Bantia S, Harman L, Hollister A,Pearson P. BCX4208, a novel enzyme inhibitor for chronic management of gout, shows a low risk of potential drug-drug interactions[J].AnnRheumDis, 2013,71:450.
[5] Fitz-Patrick D,Drummond W,Pappas J,Hollister A. Effects of a purine nucleoside phosphorylase inhibitor, BCX4208, on the serum uric acid concentrations in patients with gout[J].ArthritisRheum, 2010,62:150.
[6] Hollister A, Dobo S, Maetzel A, et al. Longterm safety of BCX4208 added to allopurinol in the chronic management of gout: results of a phase 2 24-week blinded safety extension and vaccine challenge study[J].AnnRheumDis, 2013, 71: 442-43.
[7] Sattui S E,Gaffo A L. Treatment of hyperuricemia in gout: current therapeutic options, latest developments and clinical implications[J].TherAdvMusculoskeletDis, 2016, 8(4):145-59.
[8] 杨会军, 李兆福, 彭江云. 高尿酸血症动物模型研究概况[J]. 中医学报, 2013, 28(1):60-2.
[8] Yang H J,Li Z F,Peng J Y.Overview research of hyperuricemia animal model[J].ChinaJChinMed, 2013,28(1):60-2.
[9] 刘淑芬, 曾学军. 高尿酸血症动物模型研究进展[J]. 基础医学与临床,2011,31(3):344-7.
[9] Liu S F,Zeng X J.Advance in the research of animals of hyperuricemia[J].BasicClinMed,2011,31(3):344-7.
[10]徐 立,时 乐. 次黄嘌呤与氧嗪酸钾不同剂量配伍制备高尿酸血症大鼠模型[J]. 中国药理学与毒理学杂志, 2008,22(4):306-10.
[10]Xu L,Shi L.Establishment of hyperuricemia rat model with different doses of hypoxanthine and oxonic acid potassium salt[J].ChinJPharmacolToxicol, 2008,22(4):306-10.
Establishment of a novel hyperuricemia animal model using mice and assessment of hyporuricemia action of PNP inhibitor Ulodesine
YANG Xu-juan, HUANG Xi, TIAN Zhou, WANG Ping,LI Peng-hui, ZHANG Jian-wen
(KunmingPharmaceuticalGroupCorporation,BiologyDeptofInstituteofDrugDiscoveryandDevelopment,Kunming650100,China)
Aim To establish a novel acute hyperuricemia mouse model and apply it to evaluate the hyporucicemia effects of Ulodesine, a purine nucleoside phosphorylase(PNP) inhibitor.Methods The mice were intraperitoneal injected inosine and subcutaneous injected Oteracil potassium to induce accumulation of uric acid, and the animal blood was collected from eyeball or vena angularis in different time points.The levels of serum uric acid were measured and determined to test whether the acute hyperuricemia mouse model were successful or not. In order to verify the hyperuricemia seen in the model was associated with the accumulation of inosine, which was converted to uric acid by action of PNP,hyporucicemia effects of Ulodesine, a PNP inhibitor, was assessed in an enzyme assay and confirmed by using the newly established model.Result Accumulation of uric acid in the blood of mouse models was observed by combined injections of intraperitoneal 200 mg·kg-1inosine and subcutaneous 200 mg·kg-1Oteracil potassium respectively after 1.5 h. The enzyme assay indicated that Ulodesine was a potently PNP inhibitor with IC50of 2.293 nmol·L-1. IV injection of Ulodesine eliminated uric acid accumulations in blood of the mouse model, which was expected as theinvivoaction of Ulodesine.Conclusions A novel acute hyperuricemia mouse model is established. This is a relatively easy and more effective protocol to generate the hyperuricemia in mice, which will be a useful platform to assess the anti-hyperuricemia activity of PNP-target drugsinvivo.
purine nucleoside phosphorylase(PNP);hyperuricemia;Ulodesine;inosine;mice;acute animal model
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.054.html
2017-01-07,
2017-03-25
云南省科技厅高层次科技创新人才计划(No 2013HA018)
杨旭娟(1985-),女,工程师,研究方向:心血管药理学,E-mail:xujuan_0226@126.com; 张建文(1959-),男,博士,研究方向:心血管药理学,通讯作者,E-mail:zhanguab@yahoo.com
10.3969/j.issn.1001-1978.2017.06.027
A
1001-1978(2017)06-0883-04
R-332;R363-332;R589.9;R977.3
