四种新型农药对斑马鱼胚胎发育的毒性效应
2017-06-21吴玉琼陈莹胡永乐左正宏王重刚
吴玉琼陈莹胡永乐左正宏王重刚
(1. 武夷学院茶与食品学院,武夷山 354300;2. 厦门大学生命科学学院,厦门 361005)
四种新型农药对斑马鱼胚胎发育的毒性效应
吴玉琼1陈莹2胡永乐1左正宏2王重刚2
(1. 武夷学院茶与食品学院,武夷山 354300;2. 厦门大学生命科学学院,厦门 361005)
为了研究4 种农药(腈苯唑、吡唑醚菌酯、恶霜灵、戊菌隆)单独及联合作用对斑马鱼胚胎发育的影响,设计7个实验组(空白组、溶剂组、4种农药单独暴露组及联合暴露组)对斑马鱼胚胎暴露72 h,结果显示,浓度50 ng/L的4种农药单独暴露导致心包囊和卵黄囊水肿比率、脊柱弯曲率均显著高于对照组;腈苯唑、恶霜灵及联合暴露导致斑马鱼仔鱼心率显著下降,出现显著的心律不齐;斑马鱼胚胎的Na+/K+-ATP酶和Ca2+-ATP酶活性被显著诱导,而联合暴露表现出显著的抑制作用。结果说明,环境浓度的农药暴露对鱼类胚胎发育具有明显的毒性。
腈苯唑;吡唑醚菌酯;恶霜灵;戊菌隆;联合暴露;斑马鱼;胚胎发育
农药是化学品中毒性较高、降解缓慢的一种物质[1],其易随降雨、径流及灌溉水等进入地表水、地下水和土壤等不同区域[2]。农药进入水体后,易对水中的生物造成影响,严重时可引起水生生物急性中毒,即使未导致生物死亡,也可在生物体内富集,通过食物链危害人群健康[3]。随着人们环境保护意识的增强和生活质量的提高,农药功用逐渐从杀死转为调控,品种不断更新,全面进入高效化时代。据报道,不同农药在不同环境生物条件下降解速度、生物活性、环境风险等均存在差异[4]。新型农药的开发被认为是提高效率、减少用量的绿色化学之路[5],对于农业生产和环境保护具有重要意义。
腈苯唑(Fenbuconazole)属于唑类农药。唑类农药作为杀菌剂具有高效、广谱、低毒、持续时间长等特点,自1976年以来数10种唑类农药被推向市场[6],2003-2004年销售额年增长率为47.7%,在所有农药类别中高居第一位[7]。吡唑醚菌酯(Pyraclostrobin)属于甲氧基丙烯酸酯类杀菌剂,该类杀菌剂活性高,杀菌谱广,作用机制独特,对环境友好,是继三唑类杀菌剂之后一个新的里程碑[8]。恶霜灵(Metoxazon)属于酰胺类农药。酰胺类除草剂在市场中所占份额极大,2009年,我国酰胺类除草剂交易额达15亿元,占我国农用除草剂总金额的18%[9]。研究发现部分酰胺类农药残效期较长,且具有明显的致突变性[10,11]。戊菌隆(Pencycurone)属于脲类新型农药,由日本特殊农药公司和德国拜耳公司联合开发的脲类杀菌剂,无内吸性,其具有良好的保护和持效活性[12]。在法国的河流表面水中,唑类农药,包括腈苯唑,检出的浓度从几纳克水平到最大的微克水平(丙环唑1.75 μg/L,Propiconazole)[13]。吡唑醚菌酯在美国加利福尼亚的一个河口被频繁检出,每升浓度从几十到两百多纳克[14]。我国福建省九龙江流域水中农药污染,监测结果显示存在82种农药,普遍的污染浓度达到几十纳克甚至100纳克以上,最高的为腐霉利(Procymidone)(3 904 ng/L)[15]。孙广大[16]于2008年在九龙江口及厦门西海域表层水和沉积物中,检测出除传统的有机磷和有机氯农药,苯胺类、酰胺类、唑类、氨基甲酸酯类、拟除虫菊酯类、苯胺基嘧啶等“新型”农药也被大量检出,说明农业地区流域的水环境中存在多种类农药复合污染状况。
研究农药的急性、亚慢性与慢性毒性一般利用水中食物链的代表生物如藻类、蚤与鱼类等,并用得到的实验数据评价农药对水生生物的影响[17]。斑马鱼(Danio rerio)具有体型小、繁殖速度快、饲养管理简便、其胚胎的整个发育过程透明可见等优点,多数国际组织和国家已将斑马鱼作为制定环境毒性标准的模式动物[18-20]。经济合作与发展组织(OECD)于1996已制定了详细的操作指南[21]。
有研究认为斑马鱼胚胎比成鱼对有毒化合物更加敏感,用斑马鱼胚胎为受试生物进行急性毒性研究更为适宜[22]。近年来关于农药对斑马鱼胚胎发育影响的报道不为少见[23,24],其中关于唑类农药对斑马鱼的发育毒性有较深入的研究[25,26]。但是新型农药在环境浓度下的毒性作用比较鲜有报道。本实验研究腈苯唑、吡唑醚菌酯、恶霜灵、戊菌隆对斑马鱼胚胎发育的毒性作用,通过分析相同浓度分别单独作用及4种农药联合暴露后斑马鱼胚胎的存活率、孵化率、畸形发生率、ATP酶活性以及心脏功能各生理指标,比较常见的4种农药的毒性,为新型农药的合理使用提供科学依据,也为完善农药对水环境污染效应评估标准提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 戊菌隆(纯度≥96%)、吡唑醚菌酯(纯度≥96%)、腈苯唑(纯度≥96%)、恶霜灵(纯度≥96%)购于Sigma-Aldrich公司;先以丙酮为助溶剂溶解配制浓度为50 μg/L储备液,4℃避光保存。蛋白含量测定及ATP 酶活性测定试剂盒购于南京建成生物工程研究所;其他试剂均为分析纯试剂。
1.1.2 实验用鱼和鱼卵收集 斑马鱼(WT-U系)喂养根据Westerfield[27]的方法进行,饲养于厦门大学生命科学学院斑马鱼养殖中心。循环养殖水,水温26±1℃,光照周期14 h光照/10 h黑暗,每天喂食新鲜孵化的丰年虫(Artemia nauplii)2-3次。
实验前1 d晚上,将雌雄鱼按照2∶1比例放置在孵化槽中,并用隔板将雌雄分开,第2天早上9点左右打开隔板,开灯给予光照刺激使其交配产卵。0.5-1 h内收集鱼卵,用斑马鱼养殖液清洗并在显微镜下观察,选取受精胚胎用于暴露实验。
1.2 方法
1.2.1 暴露实验 实验前将农药储备液用培养液(3.5 g/L NaCl,0.05 g/L NaHCO3,0.05g/L KCl,0.05 g/L CaCl2)分别配制终浓度为50 ng/L的单种农药曝污液及4种农药混合曝污液(即4种农药分别为12.5 ng/L,总浓度为50 ng/L),共5个曝污组,并设空白组和对照组(丙酮浓度为0.1%。丙酮作为助溶剂适宜浓度为≤0.1%[28]),每个实验组设5个平行组。分别置于直径 90 mm 培养皿中,注入曝污培养液30 mL,每皿培养100枚斑马鱼胚胎。实验期间28±0.5℃恒温培养,每隔 12 h 更换等量等浓度的培养液并清理死亡胚胎。
1.2.2 相关形态学指标的统计及计算 分别于斑马鱼胚胎12、24、36、48、72 hpf(Hour postfertilization)时,观察胚胎的存活(肉眼观察胚胎变白或者显微镜下观察胚胎絮状凝结、心脏不跳动即可判定死亡),统计存活率。48 hpf时,统计孵化率(胚胎出膜并能游动视为已孵化),72 hpf时统计畸形率(主要指心包囊水肿、卵黄囊水肿和脊柱弯曲)。
存活率(%)=存活胚胎数/总胚胎数×100%
孵化率(%)=已孵化胚胎数/总胚胎数×100%
畸形率(%)=畸形胚胎数/存活胚胎数×100%
1.2.3 心率及相关功能指标的分析 根据Incardona等[29]、Chen等[30]的方法测量及计算。将斑马鱼仔鱼(每个处理组设5个平行,每个平行随机取3条),固定于6%的甲基纤维素中,并于28±0.5℃下静置5-10 min,直到仔鱼心跳稳定后于显微镜下对20 s内心房和心室的搏动次数进行记录并摄影,分别测量心室舒张/收缩末期的长轴(a),短轴(b)长,记录胚胎20 s内心跳次数,计算1 min心率(HR)、心室舒张/收缩容积(EDV/ESV)、每搏输出量(SV)、心输出量(CO)。采用Incardona[29]的方法,记录一个完整心跳所经历的时间帧数,每条仔鱼测3次,取3次所得到的数值的标准偏差作为这条仔鱼的心律参数,获得它们的心律参数分析心律不齐。
1.2.4 ATP 酶活性测定 选择 72 hpf 的仔鱼以超纯水荡洗后用液氮速冻,保存于-80℃冰箱。实验前将样品于冰盒上解冻,按1∶4的比例加入生理盐水,在匀浆器内仔细研磨。准备好的匀浆液在冷冻离心机上,4℃下,4 000 r/min 离心10 min,取上清液测定蛋白含量和酶活性。
蛋白含量测定、Na+/K+-ATP酶、Ca2+-ATP酶活性的测定均采用南京建成生物工程研究所的试剂盒。计算酶活力时,定义每小时每毫克组织蛋白的组织中ATP 酶分解ATP 产生1 μmoL 无机磷的量为一个ATP 酶活力单位,即微摩尔磷/毫克蛋白/小时(μmol Pi/mg pro/h)。
1.2.5 数据分析 应用SPSS软件对数据进行处理。结果采用平均值±标准误差(Mean±SE)表示,单因素方差分析(one-way ANOVA)的方法进行统计学分析,组间数据用Tukey HSD法进行显著性水平分析,设定P<0.05表示差异显著。
2 结果
2.1 四种农药暴露对斑马鱼胚胎存活率及孵化率的影响
斑马鱼胚胎分别经4种农药单独暴露及联合暴露72 h,胚胎的存活率与溶剂对照组相比无显著性差异(结果未显示)。胚胎孵化率,恶霜灵、腈苯唑及联合暴露组与溶剂对照组相比显著下降,吡唑醚菌酯、戊菌隆组无显著差异(图1)。

图1 暴露48 h对斑马鱼胚胎孵化率的影响
2.2 四种农药暴露对斑马鱼仔鱼囊肿率及脊柱弯曲率的影响
图2、图3显示,各暴露组的脊柱弯曲率显著上升,其中腈苯唑作用最明显。囊肿率在各农药单独暴露组也表现出明显上升,在戊菌隆、恶霜灵和腈苯唑组出现显著差异,但联合暴露组与对照组无显著差异。
2.3 四种农药暴露对斑马鱼仔鱼心脏功能指标的影响
除恶霜灵与对照组无差异,其他各暴露实验组显示心率显著下降(图4);从心室容量的变化而言,恶霜灵及联合作用导致EDV显著上升,戊菌隆、吡唑醚菌酯和腈苯唑没有产生显著的影响,而ESV在恶霜灵组及联合作用组与溶剂对照相比无差异,戊菌隆、吡唑醚菌酯和腈苯唑暴露使ESV下降(图5-A);恶霜灵暴露及联合暴露导致每搏输出量(SV)显著上升(图5-B);心输出量CO在恶霜灵组显著增加,在吡唑醚菌酯、戊菌隆和腈苯唑组显著下降,联合作用组与对照组无显著差异(图5-C)。各农药暴露组均导致仔鱼出现心律不齐,恶霜灵、腈苯唑及联合暴露组呈现心律不齐效应显著(图6)。
2.4 四种农药对斑马鱼仔鱼ATP酶活性的影响
斑马鱼胚胎经恶霜灵暴露72 h,其仔鱼组织的Na+/K+-ATP酶活性表现出显著上升,在联合作用组则出现显著降低,其它暴露组均与对照组无差异;Ca2+-ATP酶活性在吡唑醚菌酯、恶霜灵、腈苯唑暴露组显著上升,而联合作用组为显著下降(图7)。
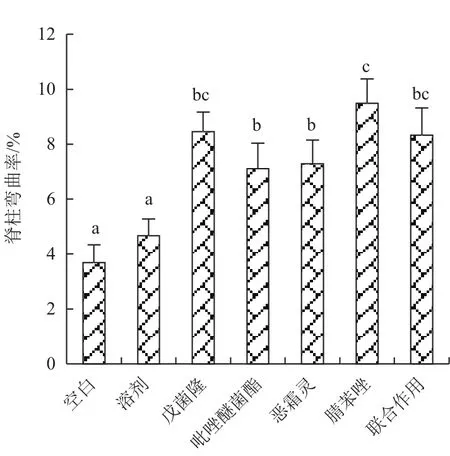
图2 暴露72 h对斑马鱼仔鱼脊柱弯曲率的影响

图3 暴露72 h对斑马鱼仔鱼囊肿率(含心包囊肿和卵黄囊肿)的影响
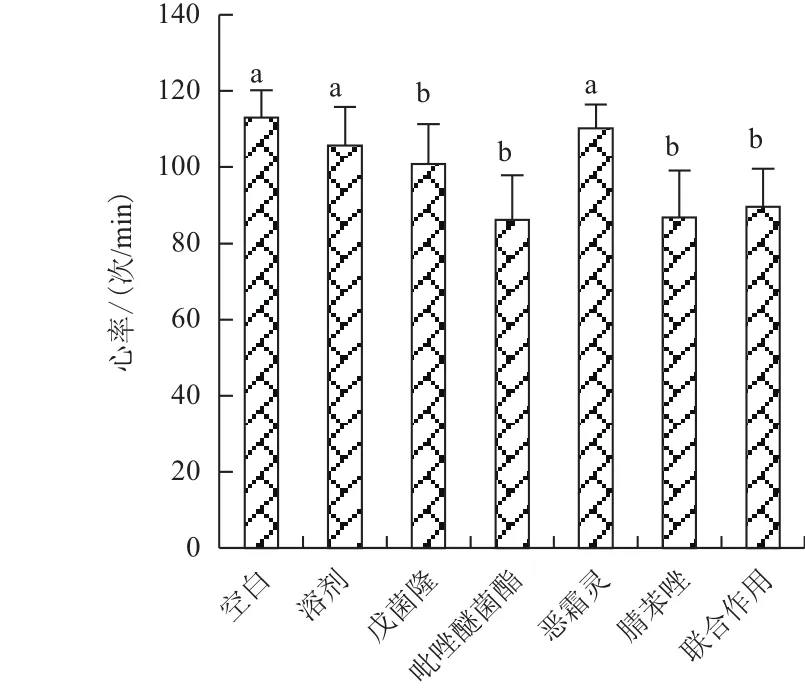
图4 胚胎暴露72 h对斑马鱼仔鱼心率的影响
3 讨论
鱼类是对化学污染物较敏感的脊椎动物之一,其胚胎发育阶段更为敏感,生理和器官形成方面更易受到外界环境影响[31]。心包囊肿、脊柱弯曲等是斑马鱼胚胎毒性检测实验中常出现的毒性反应[32]。已有研究表明,甲草胺、乙草胺、丙草胺、丁草胺等农药诱导斑马鱼胚胎出现心包囊水肿、躯干弯曲等症状[23];戊唑醇、烯唑醇、异丙甲草胺、阿特拉津等农药在高浓度时对斑马鱼胚胎发育显著表现出心包囊肿和脊柱弯曲[33];斑马鱼胚胎在β-氯氰菊酯暴露后幼鱼体轴表现出严重致畸效应[34];还有表面活性剂[35]、四溴联苯醚[36]、四氯二苯并-p-二噁英[37]、重金属铜、镉、汞[38,39]等都会引起斑马鱼胚胎发育畸形。本实验结果显示各农药暴露组对斑马鱼仔鱼出现显著的心包囊和卵黄囊水肿、脊柱弯曲等反应,表明4种农药对斑马鱼胚胎具有发育毒性。
Ca2+-ATP酶是质膜上钙离子转运系统中最重要的部分,可利用ATP水解的能量维持细胞内外钙离子浓度[40]。Na+/ K+-ATP 酶在水生生物体内普遍存在,是横跨质膜的一种固有蛋白,也是组成Na+/ K+泵活性的主要部分,对维持细胞内离子的转运以及能量代谢有着重要作用[40]。体轴的弯曲通常是由于体轴肌肉组织损坏,包括肌肉细胞坏死及肌纤维受损,或脊椎骨自身发生畸形所致[41]。此外,Ca2+通道功能紊乱也会导致脊柱弯曲[41]。本实验结果显示,斑马鱼胚胎在各农药暴露后Ca2+-ATP酶、Na+/ K+-ATP酶活性上升,联合作用中两种ATP酶活性下降,两种ATP酶活性的上升或下降引起Ca2+通道功能紊乱都引起脊柱弯曲[41]。所以,Na+/ K+-ATP 酶和Ca2+-ATP酶活性的改变可能是农药导致斑马鱼胚胎脊柱弯曲的原因之一。ATP 酶活性作为生态毒理学指标可以作为水体农药监测的生物标志物[42]。
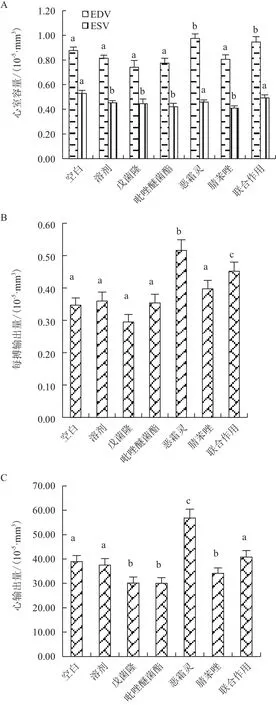
图5 暴露72 h对斑马鱼仔鱼心室容量(舒张/收缩容量)(A)、每搏输出量(B)、心输出量(C)的影响

图6 暴露72 h导致斑马鱼仔鱼心律不齐

图7 暴露72 h对斑马鱼仔鱼Na+/K+-ATP酶和Ca2+-ATP酶活性的影响
心脏作为胚胎发育过程中最早发挥功能的器官,其完善的循环功能对于胚胎正常发育起关键作用。斑马鱼发育过程中心血管在20 hpf 开始形成,能够收缩但尚未与发育中的血液循环系统相连,发育至30 hpf时心脏分化出心室和心房,36 hpf 时开始规律心跳[43]。正常生长条件下,48 hpf 时主要的器官系统完成形态发生并开始破膜孵化,此时心脏功能已相对比较完善,是斑马鱼胚胎发育进程的一个重要转折点。心率易受外界因素如温度、污染等影响,有研究表明化学污染物暴露会使斑马鱼心率上升或下降[44]。心律不齐是心血管疾病危害的病症之一,而引起心律不齐的原因很多,研究表明K+和Ca2+失调在心律不齐中有重要影响[45]。本实验结果显示4种农药单独暴露后表现心率下降趋势,心室容量有不同程度的上升或下降,致使每搏输出量及心输出量出现上升或下降,从而使各暴露组表现出心律不齐。4种农药的暴露均可致斑马鱼胚胎心脏功能异常。
生物处于胁迫条件下时,酶活性会随之变化,可表现为抑制或诱导,还能反映能量代谢的变化[46]。本实验结果中各农药单独暴露组Na+/ K+-ATP酶和Ca2+-ATP 酶的活性被诱导,联合作用则抑制了两种ATP酶活性,提示虽然农药的浓度相同,联合暴露对这两种ATP酶活性的影响更大。ATP酶在细胞内具有重要功能[47],在离子平衡和渗透压稳态的维持方面具有重要作用[48]。K+和Ca2+的转运相互协调和制约共同维持心肌细胞动作电位的稳定[49],Ca2+-ATP 酶活性的改变会影响心脏功能[50,51],所以Na+/ K+-ATP 酶和Ca2+-ATP酶活性的改变也是农药暴露影响鱼类胚胎心脏功能的原因。
4 结论
通过对腈苯唑、吡唑醚菌酯、恶霜灵、戊菌隆等4种新型农药在相同浓度下斑马鱼胚胎的暴露实验,结果表明,在低浓度下4种农药单独作用均可导致斑马鱼胚胎发育的毒性,尤其心脏发育受毒性影响较敏感;从导致脊柱弯曲及心律不齐效应来看腈苯唑毒性最强;Na+/ K+-ATP 酶和Ca2+-ATP酶是功能较广泛的酶,联合暴露抑制这两种ATP酶的活性,可能对斑马鱼许多生理活动产生不利的影响。
[1] 陈会柱, 聂文芳. 南漪湖农药污染现状分析及治理对策探讨[J]. 安徽农学通报, 2008, 14(13):182-183.
[2] 卢桂宁, 党志, 陶雪琴, 等. 农药污染土壤的植物修复研究进展[J]. 土壤通报, 2006, 37(1):189-193.
[3]单正军, 陈祖义. 农药对水生生物的污染影响及污染控制技术[J]. 农药科学与管理, 2007, 28(10):18-20, 14.
[4]唐梦龄, 王丹, 傅柳松, 等. 手性农药毒性机制的对映体选择性[J]. 农药学学报, 2011, 13(4):335-340.
[5]李朝阳, 张烨, 罗湘南, 等. 手性有机磷农药在土壤中对映体选择性降解特征[J]. 生态环境学报, 2009, 18(4):1247-1250.
[6]李进寿, 等. 多效唑暴露对褐菖鮋脾脏抗氧化防御系统的影响[J]. 厦门大学学报:自然科学版, 2013, 52(2):267-272.
[7]张一宾. 2004年世界农药品种市场概况及2009年各类农药市场趋向[J]. 农化新世纪, 2006, 10:11-12.
[8] 思彬彬, 杨卓. 甲氧基丙烯酸酯类杀菌剂作用机理研究进展[J]. 世界农药, 2007, 29(6):5-9.
[9] 刘铮铮. 环境中酰胺类除草剂的危害及检测方法[J]. 南方农业, 2015, 9(27):176-177.
[10]李龙雪, 郑晶, 徐艺华, 等. 乙草胺对大鼠肝脏氧化性应激状态的影响[J]. 中华疾病控制杂志, 2016, 20(1):54-57.
[11]张璇, 等. 手性除草剂异丙甲草胺毒理研究进展[J]. 西北农林科技大学学报:自然科学版, 2015, 43(1):152-158.
[12]徐妍, 刘苹苹, 等. 29%吡虫啉·戊菌隆悬浮种衣剂高效液相色谱分析[J]. 农药科学与管理, 2006, 27(7):5-7, 45.
[13]Institut Français de l’Environnement(IFEN). Pesticides in Water[R]. Fifth Annual Report, 2001:1-67.
[14]Smalling KL, Kuivila KM, Orlando JL, et al. Environmental fate of fungicides and other current-use pesticides in a central California estuary[J]. Marine Pollution Bulletin, 2013, (73):144-153.
[15]Zheng SL, Chen B, Qiu XY, et al. Distribution and risk assessment of 82 pesticides in Jiulong River and estuary in South China[J]. Chemosphere, 2016, 144:1177-1192.
[16]孙广大. 九龙江口及厦门西海域水环境中103种农药污染状况及其初步风险评价[D]. 厦门:厦门大学, 2009.
[17]Sanchez M. Physiological perturbations in several generations of Daphnia magna straus exposed to diszinon[J]. Ecotoxicol Environ Saf, 2000, 46:87-94.
[18]Schulte C, Nagel R. Test acute toxicity in the embryo of Zebrafish, Brachy Danio rerio, as an alternative to the acute fish test:Preliminary results[J]. ATLA, 1994, 22:12-19.
[19]Oberemm A. The use of a refined Zebrafish embryo bioassay for the assessment of aquatic toxicity[J]. Lab Animal, 2000, 29(7):32-40.
[20]OECD. Draft proposal for a new guideline fish two generation test guideline[Z]. Washington, PDMVF, 2002.
[21]OECD. Guideline for testing of chemicals:Fish, embryo toxicity test with the Zebrafish(Danio rerio)[S]. Paris:OECD, 1996:62-76.
[22]Nagel R, Dar T. The embryo test with the Zebrafish(Danio rerio)general model in ecotoxicology and toxicology[J]. Altex, 2001, 19:38-48.
[23]刘迎, 胡燕, 姜蕾, 等. 5种酰胺类除草剂对斑马鱼胚胎发育的毒性效应[J]. 农药, 2014, 53(11):806-808, 811.
[24]刘小宁. 烟嘧磺隆对斑马鱼胚胎孵化的影响[J]. 渭南师范学院学报, 2013, 28(12):130-132.
[25]Mu X, Chai T, Wang K, et al. Occurrence and origin of sensitivity toward difenoconazole in zebrafish(Danio rerio)during different life stages[J]. Aquat. Toxicol. 2015, 160:57-68.
[26]Mu XY, Pang S, Sun XZ, et al. Evaluation of acute anddevelopmental effects of difenoconazole via multiple stage zebrafish assays[J]. Environ Pollut, 2013, 175:147-157.
[27]Westerfield M. The Zebrafish Book. A guide for the laborstory use of zebrafish(Danio rerio)[M]. Eugene:University of Oregon Press, 2000.
[28] 王思锋, 等. 有机助溶剂对血管生成斑马鱼模型的适用性研究[J]. 实验动物与比较医学, 2008, 28(4):238-242.
[29]Incardona JP, Carls MG, Day HL, et al. Cardiac arrhythmia is the primary response of embryonic Pacific Herring(Clupea pallasi)exposed to crude oil during weathering[J]. Environ Sci Techonl, 2009, 43:201-207.
[30]Chen ZY, Huang W, Dahme T, et al. Depletion of Zebrafish essential and regulatory myosin light chains reduces cardiac function through distinct nechanisms[J]. Cardiovasc Res, 2008, 79:97-108.
[31]Peterson RE, Theobald HM, Kimmel GL. Developmental reproductive toxicity of dioxins and related compoumds:Cross species comparisons[J]. Crit Rev Toxicol, 1993, 23:283-335.
[32]Walker MK, Peterson RE. Aquatic toxicity of dioxins and related chemicals[M]. A. Schecter. Dioxins and Health. New York:Springer US, 1994:347-387.
[33] 周炳, 赵美蓉, 黄海凤. 4种农药对斑马鱼胚胎的毒理研究[J]. 浙江工业大学学报, 2008, 36(2):136-140.
[34] 徐永学, 刘丽丽, 等. β-氯氰菊酯对斑马鱼胚胎的发育毒性[J]. 中国药理学与毒理学杂志, 2013, 27(2):256-262.
[35]刘迎, 胡燕, 姜蕾, 等. 6种表面活性剂对斑马鱼胚胎发育的毒性效应[J]. 生态毒理学报, 2014, 9(6):1091-1096.
[36]Lema SC, Schultz IR, Scholz NL, et al. Neural defects and cardiac arrhythmia in fish larvae following embryonic exposure to 2, 2’, 4, 4’-tetrabromodiphenyl ether(PBDE 47)[J]. Aquat Toxicol, 2007, 82(4):296-307.
[37]Yamauchi M, Kim EY, Iwata H, et al. Toxic effects of 2, 3, 7, 8-tetrachlorodibenzo-p-dioxin(TCDD)in developing red seabream(Pagrus major)embryo:an association of morphological deformities with AHR1, AHR2 and CYP1A expressions[J]. Aquat Toxicol, 2006, 80(2):166-179.
[38]Johnson A, Carew E, Sloman KA. The effects of copper on the morphological and functional development of zebrafish embryos[J]. Aquat toxicol, 2007, 84(4):431-438.
[39]陈玉翠, 陈锦云. 重金属Cu2+、Cd2+、Hg2+对斑马鱼胚胎发育的毒性效应[J]. 南方水产科学. 2016, 12(3):35-42.
[40]韩春艳, 何晓琳, 李安文, 等. 酸碱胁迫对奥尼罗非鱼幼鱼鳃组织结构及Na+/ K+-ATP酶活力的影响[J]. 安徽农业科学, 2016, 44(11):273-276.
[41]Cheng SH, Wing KWA, Hung SC, et al. Cellular and molecular basis of cadmium-induced deformities in Zebrafish embryos[J]. Environ Toxicol Chem, 2000, 19:3024-3031.
[42] 卫涛涛. 质膜钙离子ATP 酶[J]. 生物物理学报, 2012, 28(7):549-564.
[43] Barrionuevo WR, Burggren WW. O2consumption and heart rate in developing zebrafish(Danio rerio):Influence of temperature and ambient O2[J]. Am J Physiol, 1999, 276(2):505-513.
[44] Limas CJ, Olivari MT, Goldenberg IF, et al. Calcium uptake by car-diac sarcoplasmic reticulum in human dilated cardiomyopathy[J]. Carkiovasc Res, 1987, 21(8):601-605.
[45]李云, 沈盎绿. 悬沙胁迫下熊本牡蛎的损伤及恢复[J]. 中国水产科学, 2012, 19(1):138-144.
[46]张玉, 张建明, 刘海涛, 等. 内蒙古不同水质湖泊瓦氏雅罗鱼Na+、K+-ATP 酶活性的研究[J]. 内蒙古农业大学学报, 2013, 34(1):1-4.
[47]Yadwad VB, Kallapur VL, et al. Inhibition of gill Na+K+-ATPase activity in dragonfly larva, Pantala flavesens, by endosulfan[J]. Bull Environ Contam Toxicol, 1990, 44:585-589.
[48]Richards JG, Semple JW, Bystriansky JS, et al. Na+/K+-ATPase aisoform switching in gills of rainbow trout(Oncorhynchus mykiss)during salinity transfer[J]. J Exp Bio, 2003, 206:4475-4486.
[49]Xu Y, Zhang Z, et al. The effects of intracellular Ca2+on cardiac K+channel expression and activity:novel insigyts from genetically altered mice[J]. J Physiol, 2005, 562(3):745-758.
[50]Kodde IF, Vander SJ, Smolenski RT, et al. Metabolic and genetic regulation of cardiac energn substrate preference[J]. Comp Biochem Physiol A, 2007, 146:26-39.
[51]Dash R, Frand KF, Carr AN, et al. Gender influences on sarcoplasmic reticulum Ca2+-handling in failing human myocardium[J]. J cell Cardiol, 2001, 33(7):1345-1353.
(责任编辑 李楠)
Toxic Effects of Four Currently-used Pesticides on Zebrafish Embryonic Development
WU Yu-qiong1CHEN Ying2HU Yong-le1ZUO Zheng-hong2WANG Chong-gang2
(1. College of Tea and Food Science,Wuyi University,Wuyishan 354300;2. School of life Sciences,Xiamen University,Xiamen 361005)
In order to study the effects of four pesticides(fenbuconazole,pyraclostrobin,metoxazon,and pencycurone),either individually or jointly,on the development of zebrafish embryos,seven experiments(blank control,solvent control,individual of 4 pesticides,and jointly combined four pesticides)were designed to treat zebrafish embryos for 72 h. The results showed that individual exposure to any of 4 pesticides at 50 ng/L led to the significant elevation on the rate of pericardial and yolk sac edema and the frequency of dorsal curvature in the larvae compared to the control. The exposure to fenbuconazole,metoxazon,and combined four pesticides resulted in a significant reduction in the heart rate and a significant increase in cardiac arrhythmia in the zebrafish larvae. The activities of Na+/K+-ATPase and Ca2+-ATPase of the embryos were significantly induced by the individual exposure to 4 pesticides,while the both activities were remarkably inhibited by the combined exposure. The results confirmed that these pesticides at environmental relevant concentration presented the clear toxicity to the development of fish embryo.
fenbuconazole;pyraclostrobin;metoxazon;pencycurone;combined exposure;Zebrafish;development of embryo
10.13560/j.cnki.biotech.bull.1985.2017-0032
2017-01-20
国家自然科学基金项目(41376118),福建省2011协同创新中心(闽教科[2015]75号)
吴玉琼,女,副教授,研究方向:环境毒理、食品营养与安全;E-mail:wyq93042@163.com
