复方板蓝根颗粒APCI-MS指纹图谱及化学成分的LC-APCI-MSn研究
2017-06-21李伯平刘志强郭冬发
闫 峻,刘 舒,李伯平,刘志强,郭冬发
(1.核工业北京地质研究院,北京 100029;2.中国科学院长春应用化学研究所,吉林 长春 130022)
复方板蓝根颗粒APCI-MS指纹图谱及化学成分的LC-APCI-MSn研究
闫 峻1,刘 舒2,李伯平1,刘志强2,郭冬发1
(1.核工业北京地质研究院,北京 100029;2.中国科学院长春应用化学研究所,吉林 长春 130022)
建立了复方板蓝根颗粒提取物的大气压化学电离质谱(APCI-MS)的指纹图谱分析方法,并利用液相色谱-大气压化学电离-串联质谱(LC-APCI-MSn)技术对主要指纹峰的归属进行确认。结果表明:质谱指纹图谱确定了10批不同来源复方板蓝根颗粒提取物的10个共有峰,各提取物的指纹图谱相似度均在97%以上。化学成分的LC-APCI-MSn分析鉴别了复方板蓝根颗粒提取物中吲哚类、奎唑酮类、有机酸类和卟啉类等12个化合物,并确定了5个质谱指纹峰的归属。采用体外实验研究对复方板蓝根颗粒提取物的抗病毒活性进行评价,结果表明,其具有一定的抗病毒活性。该指纹图谱的精密度、稳定性和重现性良好,化学成分分析快捷、灵敏,结合化学成分分析和药效学研究,可为复方板蓝根颗粒质量控制标准的制订奠定基础,同时也为深入研究其药效物质基础和谱效关系提供理论依据。
复方板蓝根颗粒;指纹图谱;液相色谱-大气压化学电离-串联质谱法(LC-APCI-MSn);抗病毒活性
板蓝根和大青叶为十字花科植物菘蓝(IsatisindigoticaFort.)的干燥根和叶,二者的主要化学成分相似,配伍后没有新的化合物生成[1-2]。不同产地的板蓝根和大青叶经提取分离后,其化学成分差异较小[3]。复方板蓝根颗粒是《中华人民共和国卫生部药品标准》所收载的中药成方制剂,由板蓝根和大青叶以2∶3比例经水醇法提取后,加淀粉和蔗糖等辅料制成,具有清热解毒、凉血之功效,用于治疗瘟病发热、出斑、风热感冒、咽喉肿烂、流行性乙型脑炎、肝炎和腮腺炎等病症[4]。目前,复方板蓝根颗粒的质量控制报道主要是对靛蓝、靛玉红成分进行定量分析[5]。而在药效学研究的基础上,对其化学成分和指纹图谱的研究报道较少,这不足以从整体上控制质量[6-7]。
中药指纹图谱能全面、综合地反映中药及其复方制剂所含成分的相对关系,具有特征明显、专属性强、重现性好等特点[5-7],是目前国内外广泛接受的中药评价技术。软电离质谱技术,如电喷雾电离(ESI)和大气压化学电离(APCI)等,具有样品处理简单、分析速度快等特点,是中药及天然产物化学成分分析和指纹图谱研究的有效手段[8-9]。高效液相色谱-质谱联用技术(如LC-ESI-MSn和LC-APCI-MSn等)具有高效、快速、灵敏度高等优点,可以同时完成成分分离和结构鉴定,现已广泛应用于中药及天然产物化学成分的定性定量分析[10-11]。
研究表明,板蓝根的主要有效成分之一是生物碱类化合物。它可通过与PK-15细胞表面受体相结合而增加病毒吸附和与机体融合的难度,也可通过抑制病毒核酸复制和影响蛋白合成而发挥抑制病毒在细胞内复制和增殖的作用[12]。随着中药现代化步伐的加快和人们对高效、低毒、低副作用中药需求的不断增加,生物碱类化合物有望成为一种低毒、高效的抗病毒药物[13]。
本研究拟建立复方板蓝根颗粒提取物的APCI-MS指纹图谱,利用高效液相色谱-质谱联用技术鉴定主要共有峰的结构,希望为复方板蓝根颗粒谱效关系的研究和质量控制标准的制定提供理论依据。
1 实验部分
1.1 主要仪器与装置
Waters 2695高效液相色谱仪:美国Waters公司产品;LCQ离子阱质谱仪:美国Finnigan公司产品;自动酶标仪:奥地利CliniBio公司产品。
1.2 主要试剂与药材
靛蓝、靛玉红对照品:由中国药品生物制品检定所提供;水杨酸、亚麻酸对照品:美国Sigma公司产品;新生小牛血清:大连生化试剂厂产品;利巴韦林注射液:天津药业集团新郑股份有限公司产品;单纯疱疹I型病毒(HSV-I)、呼吸道合胞病毒(RSV)和腺病毒B3型病毒(AD3):长春生物制品研究所产品;IMDM细胞培养液:美国HyClone公司产品;噻唑蓝(MTT):美国Sigma公司产品;甲醇、乙酸:均为色谱纯,美国Fisher公司产品;水为超纯水;其他试剂均为分析纯。
板蓝根和大青叶药材经长春中医药大学王淑敏教授鉴定为十字花科植物菘蓝(IsatisindigoticaFort.)的干燥根和叶,分别产自河北、安徽、黑龙江、甘肃、山西、吉林等地,详细情况列于表1。
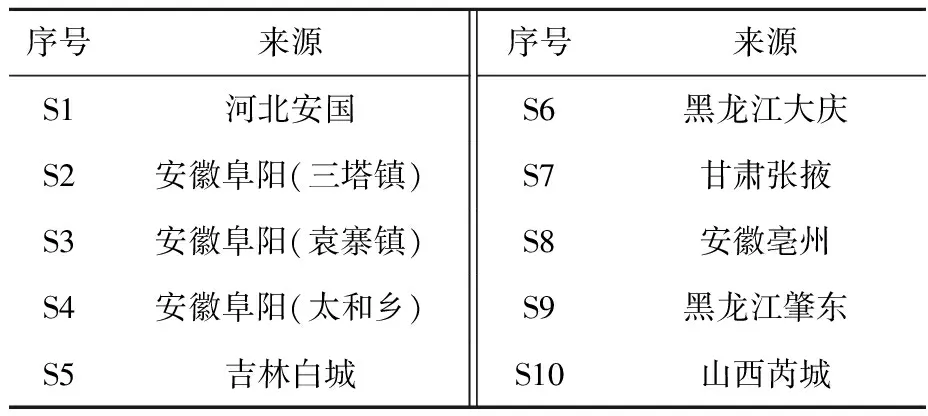
表1 板蓝根和大青叶药材的来源Table 1 Sources of Isatidis Radix and Isatidis Folium
1.3 样品制备
称取4 g板蓝根,6 g大青叶,加200 mL水煎煮2次,每次1 h,过滤,合并滤液,减压浓缩至50 mL;加入100 mL 95%乙醇,搅匀,静置24 h,减压抽滤并干燥,得到复方板蓝根颗粒总提取物浸膏。加50 mL水溶解该浸膏,置于分液漏斗中,用150 mL乙酸乙酯萃取5次,合并萃取液,减压浓缩并干燥,得到复方板蓝根颗粒提取物。
1.4 复方板蓝根颗粒提取物的APCI-MS指纹图谱研究
1) 供试品溶液的制备
取S1~S10号板蓝根和大青叶药材,按1.3节方法制备不同来源药材的复方板蓝根颗粒提取物。精密称取不同批次的复方板蓝根颗粒提取物各0.1 g,分别置于10 mL容量瓶中,加甲醇定容至刻度,即得复方板蓝根颗粒提取物的样品溶液。测试前取10 μL样品溶液,加甲醇稀释至400 μL,过0.45 μm滤膜,取续滤液,即得供试品溶液。
2) 质谱条件
大气压化学电离离子源,正离子模式检测,质量扫描范围m/z100~300,气化温度400 ℃,毛细管温度150 ℃,毛细管电压15.0 V,鞘气(N2)流速0.75 L/h,流动注射泵进样,进样流速5 μL/min。
1.5 复方板蓝根颗粒提取物化学成分的LC-APCI-MSn研究
1) 供试品溶液的制备
取S1号板蓝根和大青叶药材,按1.3节方法制备不同来源药材的复方板蓝根颗粒提取物。称取0.1 g复方板蓝根颗粒提取物,置于10 mL容量瓶中,加甲醇定容至刻度,过0.45 μm滤膜,取续滤液,即得供试品溶液。
2) 色谱条件
色谱柱:Kromasil C18分析柱(4.6 mm×250 mm×5 μm);流动相:0.15%乙酸-水溶液(A),甲醇(B);线性梯度洗脱;洗脱程序:0~45 min、40%~100%B,45~60 min、100%B;流速0.8 mL/min;柱温25 ℃;进样量10 μL;检测波长254 nm。
3) 质谱条件
大气压化学电离离子源,正负离子模式检测,质量扫描范围m/z50~1 000,气化温度450 ℃,毛细管温度150 ℃,鞘气(N2)流速 0.90 L/h,辅助气(N2)流速0.15 L/h。
1.6 复方板蓝根颗粒提取物的抗病毒活性研究
1.6.1 复方板蓝根颗粒提取物和阳性对照药物细胞毒性的测定 用含2%小牛血清的IMDM细胞培养液将由S1号药材制备的复方板蓝根颗粒提取物和阳性对照药物利巴韦林注射液分别配制成1 000、500、450、400、350、300、250、200、150、100、50、10、8、4、2、1、0.8、0.4、0.2、0.1、0.05和0.025 g/L的溶液。应用犬肾细胞(MDCK)和羊膜细胞(FL)分别测定复方板蓝根颗粒提取物和利巴韦林注射液的最大无毒浓度(TD0)。
1.6.2 病毒毒力的测定 将单纯疱疹-Ⅰ病毒(HSV-Ⅰ)、呼吸道合胞病毒(RSV)和腺病毒3型病毒(Ad3)分别从原液~10-5mg/L稀释成5个浓度,加入铺满MDCK/FL细胞的96孔板,并设立正常对照组,待24 h后观察致细胞病变效应(CPE),计算3种病毒的半数组织培养感染剂量(TCID50)。
1.6.3 实验分组 实验设正常细胞对照组,完全病毒感染组,阳性药物对照组和高、中、低3个浓度的实验药物组。
1.6.4 病毒感染细胞病变抑制实验 以2×105mg/L的密度将FL-MDCK细胞接种在96孔板上,每孔0.1 mL,置于37 ℃的CO2培养箱孵育,24 h后弃掉上清液。每孔以0.1 mL 1 000 TCID50的病毒感染相应的宿主细胞,置于37 ℃的CO2培养箱孵育,2 h后弃掉上清液。加入各实验组待测药物,置于CO2培养箱孵育,24 h后观察CPE,待完全病毒感染组CPE为“++++”时记录结果,并用MTT法测定各孔的OD570值,从而确定各实验组药物对病毒感染细胞的病变抑制程度,每个孔平行测定6次。
2 结果与讨论
2.1 APCI-MS指纹图谱的方法学考察
2.1.1 精密度实验 取S1号板蓝根和大青叶药材,按照1.4节方法制备复方板蓝根颗粒提取物APCI-MS指纹图谱供试品溶液,重复进样6次,记录质谱图。结果表明,各主要质谱峰的相对丰度RSD均小于0.07%,离子流强度RSD均小于0.09%,仪器精密度良好。
2.1.2 稳定性实验 取与2.1.1节实验相同的供试品溶液,分别在0、4、8、12、18、24 h进样,记录质谱图。结果表明,各主要质谱峰的相对丰度RSD均小于0.07%,离子流强度RSD均小于0.10%,说明样品至少在24 h内稳定。
2.1.3 重现性实验 平行取6份与2.1.1节实验相同的供试品溶液,分别进样,记录质谱图。结果表明,各主要质谱峰的相对丰度RSD均小于0.08%,离子流强度RSD均小于0.12%,说明该方法的重现性良好。
2.2 APCI-MS指纹图谱的建立
10批不同来源的复方板蓝根颗粒提取物的APCI-MS指纹图谱和共有模式图分别示于图1和图2。根据测定结果,标定共有指纹峰10个,分别为m/z120、146、149、163、181、187、239、249、263、279。不同来源的复方板蓝根颗粒提取物APCI-MS指纹图谱各共有峰的相对丰度列于表2。
采用夹角余弦值和相关系数两个参数对不同来源的复方板蓝根颗粒APCI-MS指纹图谱的相似度进行评价,详细情况列于表3。由表3可知,其相似度均在97%以上。

图1 复方板蓝根颗粒提取物的APCI-MS指纹图谱Fig.1 APCI-MS fingerprints of the extracts from Compound Indigowoad Root Granule

图2 复方板蓝根颗粒提取物的APCI-MS指纹图谱的共有模式图Fig.2 Common pattern chromatograms of APCI-MS fingerprints of the extracts from Compound Indigowoad Root Granule
2.3 复方板蓝根颗粒提取物化学成分的LC-APCI-MSn研究
采用HPLC-APCI-MSn技术,在正负离子模式下,对复方板蓝根颗粒提取物的化学成分进行鉴定,其总离子流图示于图3,详细数据列于表4。
2.4 APCI-MS指纹图谱主要共有峰的结构确认
经HPLC-APCI-MSn分析,判断各共有峰中,m/z146、239、249代表的化合物分别为3-醛基吲哚、3-羟苯基喹唑酮、色胺酮;m/z263代表的化合物为靛蓝和靛玉红,二者互为同分异构体;m/z279代表的化合物为羟基靛玉红和亚麻酸。其他共有峰所代表的化合物结构有待进一步研究。

表2 复方板蓝根颗粒提取物APCI-MS指纹图谱各共有峰的相对丰度Table 2 Relative abundance of common pattern chromatograms of the extracts from Compound Indigowoad Root Granule

表3 复方板蓝根颗粒提取物APCI-MS指纹图谱的相似度Table 3 Similarities of fingerprint chromatograms of the extracts from Compound Indigowoad Root Granule
2.5 复方板蓝根颗粒提取物的抗病毒活性研究
复方板蓝根颗粒提取物对FL/MDCK细胞均未见CPE的改变,当药物浓度低于1 g/L时,CPE观察视野很清晰,因此将1 g/L作为实验药物组的最大浓度;阳性对照药物利巴韦林注射液的最大无毒浓度(TD0)为800 mg/L。采用Reed-Muench法计算得到3种病毒的TCID50均为1 000。复方板蓝根颗粒提取物不同化学组分对HSV-Ⅰ、RSV和Ad3三种流感病毒的抑制作用情况列于表5。
由表5可知,复方板蓝根颗粒提取物高浓度组对HSV-Ⅰ、RSV和Ad3三种病毒均有明显的抑制作用;中浓度组对Ad3病毒有明显的抑制作用,对HSV-Ⅰ和RSV病毒有一定的抑制作用;低浓度组对HSV-Ⅰ、RSV和RSV均有一定的抑制作用。说明高浓度组对三种病毒的抑制作用与阳性药物组的抑制作用相当。

图3 复方板蓝根颗粒提取物的液相色谱图(a)和正离子模式(b)、负离子模式(c)下的总离子流图 Fig.3 LC chromatogram (a), positive TIC (b) and negative TIC (c) of the extract from Compound Indigowoad Root Granule
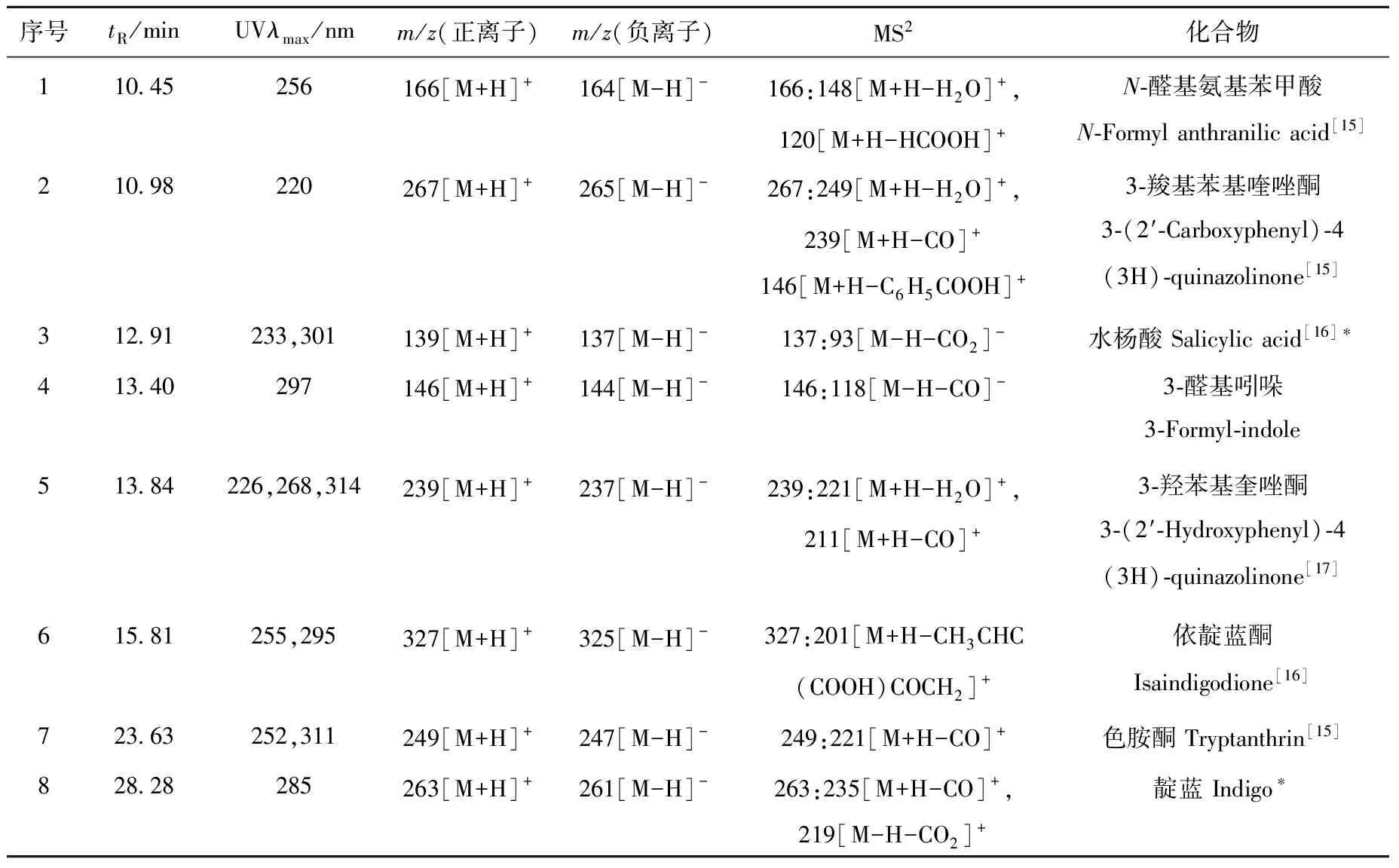
表4 复方板蓝根颗粒提取物的LC-APCI-MSn数据Table 4 LC-APCI-MSn data of the extracts from Compound Indigowoad Root Granule

续表4
注:*表示化合物3、8、9和11分别与相应的对照品具有相同的保留时间、质荷比和MS2谱

表5 复方板蓝根颗粒提取物对HSV-Ⅰ、RSV和Ad3病毒的抑制作用情况Table 5 Effects of the extracts from Compound Indigowoad Root Granule on HSV-Ⅰ,
注:与完全病毒感染组比较,*表示P<0.05,**表示P<0.01
3 结论
本研究建立了复方板蓝根颗粒APCI-MS指纹图谱分析方法,不同产地的板蓝根和大青叶配伍后制成的复方板蓝根颗粒提取物的APCI-MS指纹图谱具有较高的相似度,这说明了板蓝根和大青叶药材的同源性以及配伍后化学成分的相似性。该方法的精密度、稳定性和重现性良好,且样品制备简单、分析速度快,可作为复方板蓝根颗粒的质量评价方法,同时也可为深入研究复方板蓝根颗粒的质量标准和谱效关系提供理论依据。
[1] 中华人民共和卫生部国药典委员会. 中药成方制剂:第十二册[M]. 北京:中华人民共和国卫生部,1997.
[2] 孙立新,佟立今,毕开顺. 复方板蓝根颗粒定量方法的研究[J]. 中国现代应用药学杂志,2002,19(2):138-140.
SUN Lixin, TONG Lijin, BI Kaishun. A study on the quantitative method of indigo and lndirubin in Fufang Banlangen Keli[J]. Chinese Journal of Modern Applied Phaymacy, 2002, 19(2): 138-140(in Chinese).
[3] 武彦文,高文远,肖小河. 大青叶的研究进展[J]. 中草药,2006,37(5):793-796.
WU Yanwen, GAO Wenyuan, XIAO Xiaohe. Advances in studies on Folium Isatidis[J]. Chinese Traditional and Herbal Drugs, 2006, 37(5): 793-796(in Chinese).
[4] 李楚源,曾令杰. 板蓝根研究进展[J]. 现代中药研究与实践,2005,19(3):51-55.
LI Chuyuan, ZENG Lingjie. Advances in studies on Radix Isatidis[J]. Research and Practice of Chinese Medicines, 2005, 19(3): 51-55(in Chinese).
[5] 蔡宝昌,潘扬,殷武. 指纹图谱在中药研究中的应用[J]. 世界科学技术-中药现代化,2000,2(5):9-14.
CAI Baochang, PAN Yang, YIN Wu. Application of fingerprint chromatography technology into Chinese herbal medicine[J]. World Science and Technology-Modernization of Traditional Chinese Medicine, 2000, 2(5): 9-14(in Chinese).
[6] 陈林伟,秦昆明,徐雪松,等. 中药指纹图谱数据库的研究现状及展望[J]. 中草药,2014,45(21):3 041-3 047.
CHEN Linwei, QIN Kunming, XU Xuesong, et al. Research status and prospect of Chinese materia medica fingerprint database[J]. Chinese Traditional and Herbal Drugs, 2014, 45(21): 3 041-3 047(in Chinese).
[7] 李强,杜思邈,张忠亮,等. 中药指纹图谱技术进展及未来发展方向展望[J]. 中草药,2013,44(22):3 095-3 104.
LI Qiang, DU Simiao, ZHANG Zhongliang, et al. Progress in fingerprint technology on Chinese materia medica and prospect of its future development[J]. Chinese Traditional and Herbal Drugs, 2013, 44(22): 3 095-3 104(in Chinese).
[8] 刘舒,闫峻,李慧琳,等. 板蓝根化学成分的质谱研究[J]. 高等学校化学学报,2010,31(6):1 143-1 147.
LIU Shu, YAN Jun, LI Huilin, et al. Studies on chemical constituents ofCompoundIndigowoadRootGranuleby mass spectrometry[J].Chemical Journal of Chinese Universities, 2010, 31(6): 1 143-1 147(in Chinese).
[9] 周慧,宋凤瑞,刘志强,等. 刺五加叶的HPLC-UV和ESI-MS指纹图谱研究[J]. 质谱学报,2008,29(6):321-326.
ZHOU Hui, SONG Fengrui, LIU Zhiqiang, et al. The Fingerprints of leaves ofAcanthopanaxSenticosusby HPLC-UV and ESI-MS[J]. Journal of Chinese Mass Spectrometry Society, 2008, 29(6): 321-326(in Chinese).
[10]越皓,皮子凤,宋凤瑞,等. 生附片化学成分的HPLC/ESI-MSn研究[J]. 化学学报,2008,66(2):211-215.
YUE Hao, PI Zifeng, SONG Fengrui, et al. Studies on the components ofAconitumcarmichaeliby using HPLC/ESI-MSn[J]. Acta Chimica Sinica, 2008, 66(2): 211-215(in Chinese).
[11]黄鑫,宋凤瑞,刘志强,等. 五味子中木质素类成分的高效液相色谱-电喷雾质谱研究[J]. 化学学报,2008,66(9):1 059-1 066.
HUANG Xin, SONG Fengrui, LIU Zhiqiang, et al. Studies on the Lignans in extract of the fruits ofSchisandrachinensisandSchisantrasphenantheraby high performance liquid chromatography-electrospray ionization mass spectrometry[J]. Acta Chimica Sinica, 2008, 66(9): 1 059-1 066(in Chinese).
[12]陈瑞亮,王林青,崔保安,等. 板蓝根生物碱抗猪细小病病毒的作用[J]. 中国农学通报,2010,26(22):20-23.
CHEN Ruiliang, WANG Linqing, CUI Baoan, et al. Study on inhibitive effect of alkaloid extracted from Radix Isatidis in vitro on porcine parvovirus[J]. Chinese Agricultural Science Bulletin, 2010, 26(22): 20-23(in Chinese).
[13]陈达,孟晶晶,张芳,等. 海洋抗生素吲哚-2,3-二酮的抗病毒作用[J]. 中国海洋药物杂志,2006,25(4):30-33.
CHEN Da, MENG Jingjing, ZHANG Fang, et al. Study on antiviral effect of indole-2, 3-dine[J]. Chinese Journal of Marine Drugs, 2006, 25(4): 30-33(in Chinese).
[14]MHON T, PLITZKO I, HAMBURGER M. A comprehensive metabolite profiling of Isatis tinctoria leaf extracts[J]. Phytochemistry, 2009, 70(7): 924-934.
[15]XIAO S S, BI K S, SUN Y Q. Identification of chemical constituents in the root ofIsatisindigoticaFort. by LC/DAD/ESI/MS/MS[J]. Journal of Liquid Chromatography, 2007, 30(1): 73-85.
[16]刘云海,秦国伟,丁水平,等. 板蓝根化学成分的研究(Ⅲ)[J]. 中草药,2002,33(2):97-99.
LIU Yunhai, QIN Guowei, DING Shuiping, et al. Studies on chemical constituents in root ofIsatisindigoticaⅢ[J]. Chinese Traditional and Herbal Drugs, 2002, 33(2): 97-99(in Chinese).
Fingerprint Chromatograms and Chemical Components ofCompoundIndigowoadRootGranuleby APCI-MS and LC-APCI-MSn
YAN Jun1, LIU Shu2, LI Bo-ping1, LIU Zhi-qiang2, GUO Dong-fa1
(1.BeijingResearchInstituteofUraniumGeology,Beijing100029,China;2.ChangchunInstituteofAppliedChemistry,ChineseAcademyofSciences,Changchun130022,China)
A method of atmospheric pressure chemical ionization mass spectrometry (APCI-MS) was established for analyzingCompoundIndigowoadRootGranuleextract, and the main peaks in the fingerprints were confirmed by high performance liquid chromatography coupled to mass spectrometry hyphenated (LC-APCI-MSn). The fingerprint analysis was based on the atmospheric pressure chemical ionization ion source (APCI) with the positive mode. The separation was performed on a Kromasil C18 column (4.6 mm×25.0 mm×5 μm) under 25 ℃ with linear gradient elution of methanol (containing 0.15% acetic acid)-water as mobile phase at a flow rate of 0.8 mL/min. The detector is full wavelength ultraviolet detector (DAD) with the detection wavelength of 254 nm. Mass spectrometry analysis was required for atmospheric pressure chemical ionization ion source (APCI) with both positive and negative ions detection modes. Mass spectrometry fingerprint identified 10 common peaks from 10 batches of different sources ofCompoundIndigowoadRootGranuleextracts and the results showed that the similarities of each extract was covered over 97%. A total of 12 chemical compounds, including indoles, quinazolinones organic acids and porphyrins were identified using LC-APCI-MSn, and 5 common fingerprint peaks were identified. Pharmacodynamical studies have revealed that extracts ofCompoundIndigowoadRootGranuleown certain anti-viral activities. Hense, owing to its high precision, stability and reproducibility, the fingerprint method inCompoundIndigowoadRootGranuleis important and indispensable in the foundation of quality control standards as well as the further research in the relationships of material basis and spectrum effect.
CompoundIndigowoadRootGranule; fingerprint chromatograms; liquid chromatography-atmosphere pressure chemical ionization-mass spectrometry (LC-APCI-MSn); anti-viral activity
2016-04-07;
2016-06-10
闫 峻(1982—),男(汉族),吉林通化人,高级工程师,从事中药及天然产物化学成分和质量控制研究。E-mail: cnncyanjun@163.com
O657.6
A
1004-2997(2016)03-0320-08
10.7538/zpxb.youxian.2016.0057
