乙酰水杨酸水解动力学研究
2017-06-19张凯龙沈婷婷谭志文
张凯龙, 沈婷婷, 谭志文, 俞 超
(浙江万里学院 生物与环境学院, 浙江 宁波 315100)
乙酰水杨酸水解动力学研究
张凯龙, 沈婷婷, 谭志文, 俞 超
(浙江万里学院 生物与环境学院, 浙江 宁波 315100)

乙酰水杨酸是一种广泛使用的非甾体抗炎药物。基于水杨酸-铁(III)配合物显色反应,建立了可见分光光度法测定水杨酸含量和乙酰水杨酸水解动力学在线测定方法。结果显示,在pH 3.0的甲酸-氢氧化钠缓冲溶液中,水杨酸和铁(III)形成配位比为1∶1的稳定紫色配合物,最大吸收波长位于523 nm,表观稳定常数lgK=6.02,水杨酸浓度在0.05~0.5 mmol/L范围内呈线性,检出限(3 s/k)为2.2 μmol/L。对水杨酸样品进行分析,加标回收率在96.0%~100.5%,相对标准偏差在0.76%~1.10%。对乙酰水杨酸水解过程在线监测,通过动力学方程拟合求得乙酰水杨酸水解反应为一级反应,活化能为72.97 kJ/mol。该研究为化学反应动力学参数测定及研究方法提供了新的思路。
水杨酸; 乙酰水杨酸; 配合物; 可见分光光度法; 水解
0 引 言
乙酰水杨酸是水杨酸类非甾体抗炎药物阿司匹林的主要成分,随着临床研究深入,乙酰水杨酸治疗范围日益广泛[1-4]。
水杨酸具有消毒防腐功能,但是过量的水杨酸会造成严重的表皮腐蚀,消化道、胃黏膜刺激和损伤[5-6]。乙酰水杨酸分子中有易水解酯键,乙酰水杨酸类产品水解后形成水杨酸和乙酰水杨酸混合物,研究乙酰水杨酸水解动力学和水杨酸含量测定可为相关产品贮存、检测提供思路和方法。
目前测定水杨酸方法有分光光度法[7-8]、高效液相色谱法[9-10]、电化学方法[11]等,方法较为成熟。水杨酸和铁盐(III)配合物呈现紫色,常被用于水杨酸定性和目视半定量检测[12-13]。本文结合配合物显色和可见分光光度计普及率高、操作方便快捷特性,对配合物组成和稳定性进行研究,优化实验条件建立可见分光光度法测定水杨酸含量方法,并通过在线监测和动力学方程直接拟合获得乙酰水杨酸水解反应的宏观动力学参数。
1 材料与方法
1.1 仪器与试剂
(1) 仪器。双光束紫外-可见分光光度计(岛津,UV-2600);低温恒温循环器(施都凯仪,ILB-008-004);pH计(梅特勒-托利多,FE20)。
(2) 材料与试剂。乙酰水杨酸、水杨酸、高氯酸、硫酸铁铵、甲酸、氢氧化钠、乙醇、硫酸,均为分析纯。
1.2 实验方法
1.2.1 配合物组成及稳定性
10支20 mL容量瓶分别加入0.10~1.00 mL浓度为0.01 mol/L硫酸铁铵溶液(0.001 mol/L高氯酸配制),再加入0.90~0.00 mL浓度为0.01 mol/L的水杨酸乙醇溶液,0.001 mol/L的高氯酸定容,第10组为参比,在最大吸收波长下测定吸光度,计算配位数和表观稳定常数。
1.2.2 可见分光光度法测定水杨酸
20 mL容量瓶中依次加入一定体积的0.01 mol/L水杨酸乙醇溶液、1.60 mL浓度为0.01 mol/L硫酸铁铵溶液、5.00 mL的甲酸-氢氧化钠缓冲溶液(pH3.0),去离子水定容摇匀后在523 nm处测定吸光度,水杨酸空白为参比。
1.2.3 乙酰水杨酸水解动力学
测定前打开分光光度计恒温循环水,确保水温稳定,实验所需溶液在相应温度下保温备用。20 mL容量瓶分别加入一定体积新配0.2 mol/L乙酰水杨酸无水乙醇溶液,1.60 mL浓度为0.01 mol/L硫酸铁铵溶液、5.00 mL的甲酸-甲酸钠缓冲溶液(pH3.0),去离子水快速定容摇匀,快速移取部分到比色皿中,动力学模式下在523 nm处在线连续监测吸光度,乙酰水杨酸空白为参比。
2 结果与讨论
2.1 配合物组成及稳定性
采用连续变化法[14],通过逐渐改变硫酸铁铵-水杨酸组成,溶液颜色由浅入深再变浅,分别测定10组吸光度,作连续变化法曲线,如图1所示。
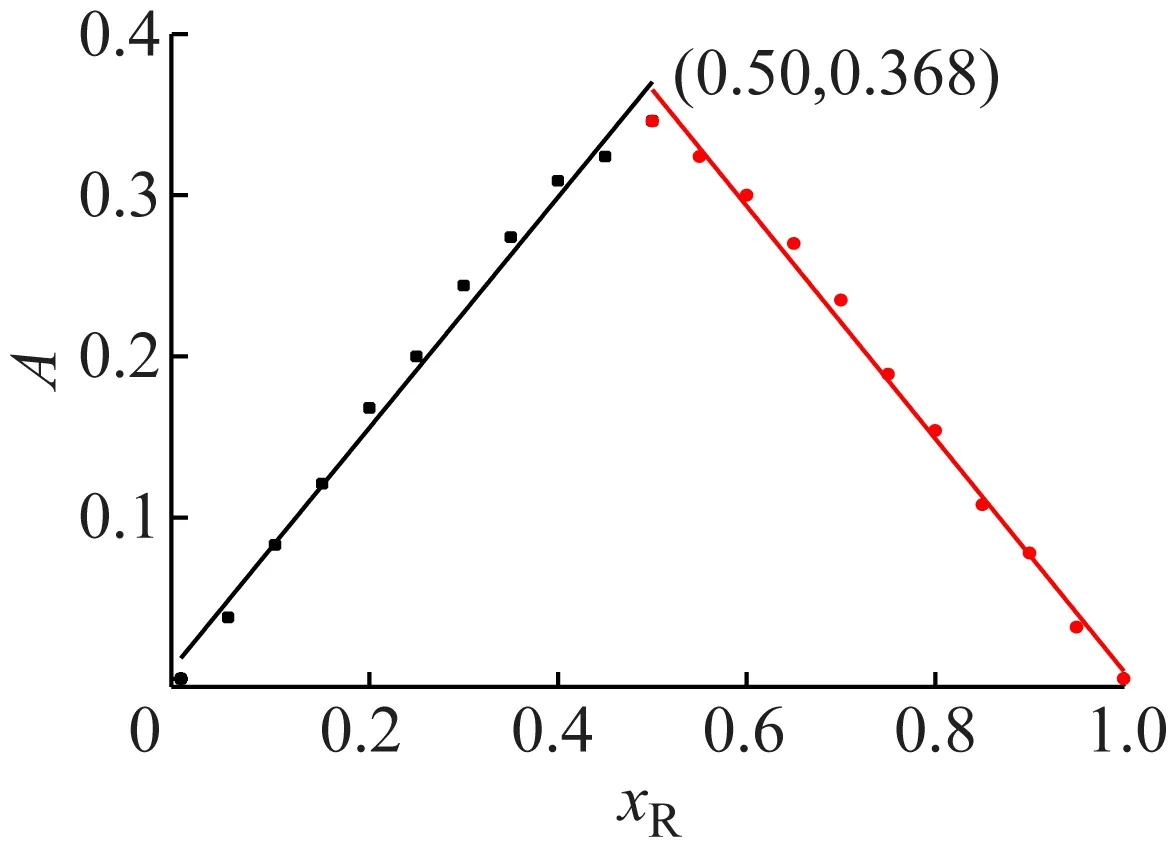
图1 连续变化法曲线
通过对数据点线性拟合并延伸,在物质的质量分数xR=0.5时吸光度达到最大A=0.368,即配合物配位比为1∶1,计算水杨酸-铁配合物解离度α=5.98%,不考虑铁(III)水解和水杨酸解离影响,计算得表观稳定常数K=1.05×106,lgK=6.02,该配合物表观稳定常数较大,稳定性高,可用于分光光度法分析。
吸光度最大的水杨酸-铁(III)配合物溶液在室温环境中保存,定期测定其吸光度,日内(12 h)吸光度RSD≤0.89%,日间(36 h)吸光度RSD≤0.97%,精密度高,表明水杨酸-铁(III)配合物稳定性良好。
2.2 条件优化和方法验证
2.2.1 pH及最大吸收波长
pH 2.0~6.0水杨酸-硫酸铁铵混合液颜色如图2所示。

图2 不同pH溶液中配合物颜色
pH2.0时,溶液颜色呈浅紫色,随着pH上升,紫色加深;3.0达到最深;4.0紫色明显变浅并伴有浅黄色;4.5及以上紫色完全消失呈现浅黄色,过夜静置发现4.0和较高pH的样品底部有黄色氧化铁沉淀生成。溶液pH直接影响水杨酸解离和铁(III)水解,pH过高、过低都不利于配合物生成,pH3.0最佳,吸光度数据进一步确认了该结果,如图3所示。
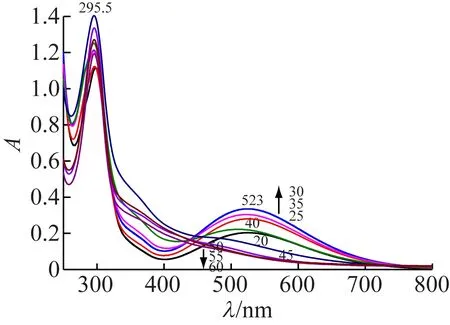
图3 不同pH水杨酸-铁(III)配合物波长扫描图
对9种不同pH溶液在200~800 nm进行波长扫描,溶液在紫外区有强烈吸收,且吸收峰形基本一致,最大吸收峰出现在λmax=295.5 nm, 200~250 nm吸收峰太大,未列出。在可见光区扫描曲线变化较大,可以分为两组,pH2.0~4.0的5种溶液吸光度从紫外区开始先下降,再上升下降,在可见光区形成峰状吸收,最大吸收波长λmax=523 nm,pH4.0为过渡曲线,紫外区下降和可见光区上升幅度都较小。pH4.5~6.0的4根曲线从紫外区开始单调下降,和前者区别显著。pH不同溶液本身颜色变化和可见光区吸收曲线一致,在可见光区进行分析时,选取最大吸收波长523 nm,溶液pH3.0,为了保证pH稳定,选用甲酸-氢氧化钠缓冲溶液。
2.2.2 显色剂用量
测定水杨酸含量选用铁(III)盐生成配合物进行显色,铁盐的浓度对配合物形成有直接影响。改变混合液中0.01 mol/L硫酸铁铵溶液加入体积,测定溶液的吸光度,结果如图4所示。
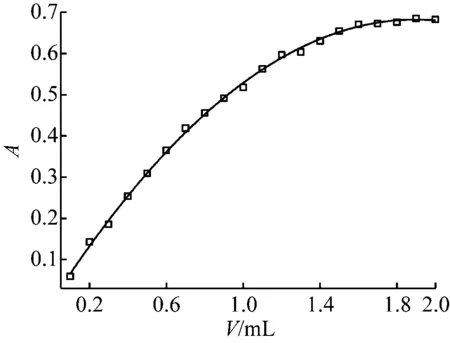
图4 显色剂用量
随着硫酸铁铵投加量增加吸光度逐渐变大,投加量大于1.6 mL,吸光度趋于稳定,故显色剂铁(III)盐最低用量为1.6 mL,铁(III)浓度为0.8 mmol/L。
2.2.3 显色时间
水杨酸和铁(III)盐在甲酸-氢氧化钠缓冲溶液中反应迅速,在混合瞬间即有紫色生成,从容量瓶定容后开始计时30 min,前10 min每2 min测定1次吸光度,后20 min每5 min测定1次,0.5 h测定吸光度RSD≤0.35%,表明显色反应速度且稳定,定容摇匀后即可测试。
2.2.4 标准曲线及检出限
在以上最佳实验条件下,对水杨酸标准溶液系列进行了测定,以吸光度A为纵坐标,浓度c(mmol/L)为横坐标绘制标准曲线,结果如图5所示。
水杨酸浓度在0.05~0.5 mmol/L范围内和吸光度成正比,线性回归方程为A=1.340c+0.006,相关系数R2=0.999 4。
对空白溶液平行进行12次测定,以测定结果的标准偏差3倍除以斜率得出方法的检出限(3 s/k)为2.2μmol/L。
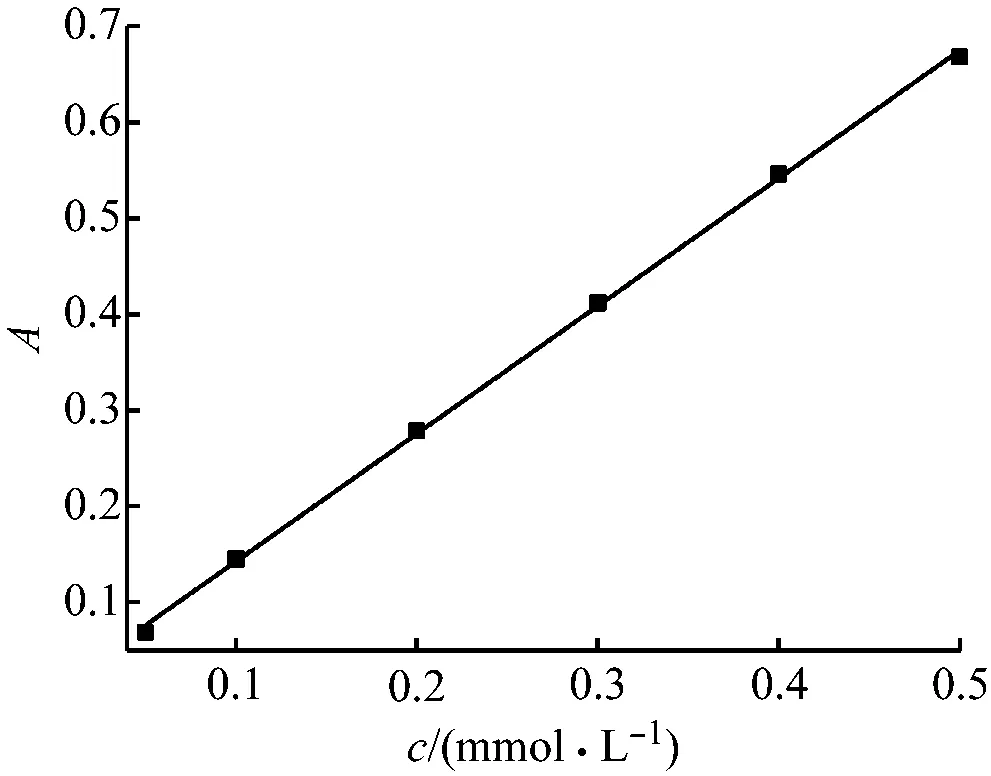
图5 标准曲线
2.2.5 样品测试
线性范围内,在低、中、高水平上对水杨酸溶液进行6次重复性测试,RSD分别为0.85%、0.66%、0.75%,重复性良好。
市售水杨酸软膏(含量5%,主成分水杨酸、辅料凡士林)适量,乙醇溶解后加入NaOH溶液,分出部分底层溶液HCl酸化,用石油醚萃取,分出上层氮吹,残留物乙醇溶解定容。移取适量该试样加入水杨酸标准溶液,按照分析方法进行回收率试验,结果见表1。

表1 回收率实验(n=6)
回收率在96.0%~100.5%,RSD在0.76%~1.10%,本方法测定水杨酸含量准确可靠,灵敏度高、操作简单、分析速度快,可用于食品、药品、化妆品等测定。
2.3 乙酰水杨酸水解动力学参数测定
乙酰水杨酸水解如下所示:
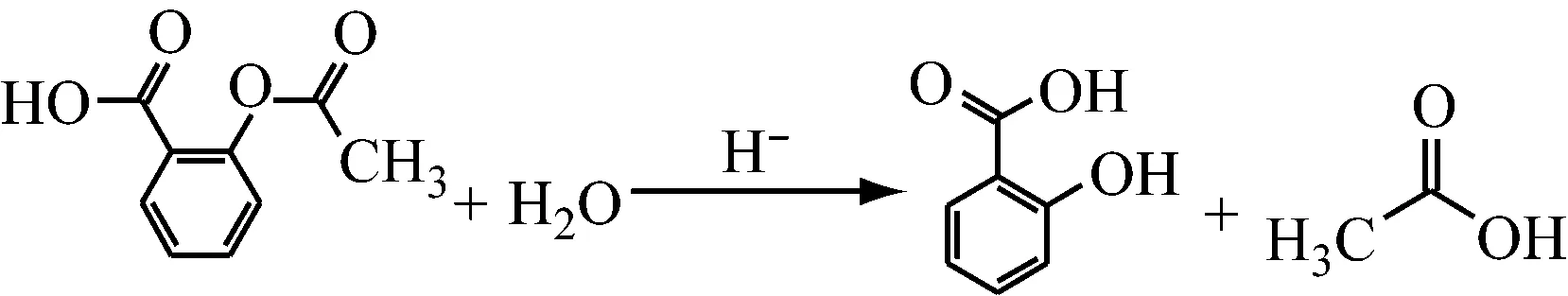
乙酰水杨酸水解生成水杨酸,水解速率与乙酰水杨酸、水和氢离子浓度有关,在缓冲体系中,氢离子浓度固定,水大量存在,反应速率方程式可以进一步简化为:
水解生成的水杨酸和铁(III)生成紫色配合物,通过测定吸光度可获得水杨酸浓度,对乙酰水杨酸水解动力学方程进行拟合可以获得该反应宏观动力学相关参数。
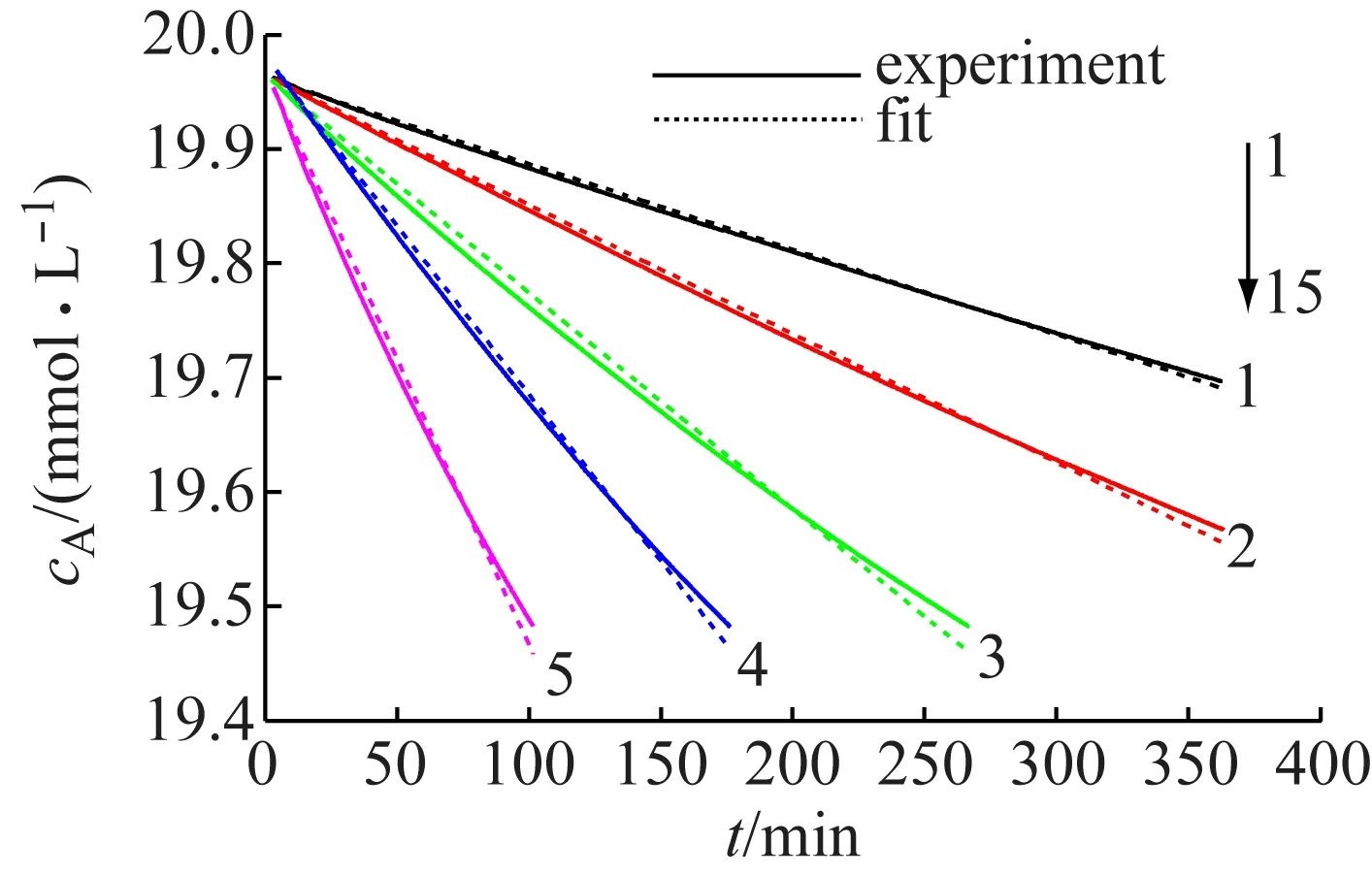
选定乙酰水杨酸初始浓度为0.02 mol/L,分别测定20~40 ℃温度下水解水杨酸-铁(III)配合物吸光度,如图6所示。

1-20 ℃; 2-25 ℃; 3-30 ℃; 4-35 ℃; 5-40 ℃
在实验温度下,溶液颜色和吸光度随时间逐渐增加,低温时吸光度曲线较为平缓,随着温度升高曲线斜率变大,达到同样的吸光度较高温度需时更短。表明乙酰水杨酸不断水解生成水杨酸,水杨酸-铁(III)配合物浓度增加,同时反应速率常数随温度逐渐增大。
根据乙酰水杨酸变化曲线对水解动力学方程进行参数拟合,拟合结果如图7所示,乙酰水杨酸反应级数平均值x=0.999 8,可视为一级反应;不同温度下表观反应速率常数:K20 ℃=3.77×10-5min-1;K25 ℃=5.70×10-5min-1;K30 ℃=9.60×10-5min-1;K35 ℃=1.49×10-4min-1;K40 ℃=2.55×10-4min-1。
1-20 ℃; 2-25 ℃; 3-30 ℃; 4-35 ℃; 5-40 ℃
根据不同温度下表观反应速率常数,对阿伦尼乌斯方程进行线性拟合,lnK=-Ea/(RT)+lnA,计算得乙酰水杨酸水解反应活化能Ea=72.97 kJ/mol,如图8所示。
基于水杨酸-铁(III)配合物显色反应在线监测和动力学方程直接拟合测定乙酰水杨酸水解动力学参数,方便快捷,改善以往离散取样测定操作次数多,数据少,误差大,假设拟合等缺点,有效提高了动力学参数测定的准确性[15-16]。

图8 乙酰水杨酸水解活化能
3 结 语
(1) 水杨酸-铁(III)配合物配位比为1∶1,表观稳定常数K=1.05×106,lgK=6.02。
(2) 水杨酸-铁(III)配合物最大吸收波长位于523 nm。水杨酸浓度在0.05~0.5 mmol/L范围内呈线性,检出限(3 s/k)为2.2 μmol/L。
(3) 乙酰水杨酸水解反应为一级反应,反应活化能为72.97 kJ/mol。
[1] 郭宗儒.经久不衰的阿司匹林[J].药学学报,2015,50(4):506-508.
[2] Patrignani P, Patrono C. Aspirin and cancer[J]. Journal of the American College of Cardiology, 2016,68(9): 967-976.
[3] Jiang M J,Dai J J,Gu D N,etal.Aspirin in pancreatic cancer: chemopreventive effects and therapeutic potentials[J]. Biochimica et Biophysica Acta ,2016,1866(2):163-176.
[4] Shiau Y F,Hu C J, Chiueh C C. Preventive effectiveness of aspirin on recurrent stroke[J]. Journal of Experimental & Clinical Medicine, 2012,4(4): 203-208.
[5] 季丹丹,刘艳红,祝 钧.化妆品用水杨酸酯类衍生物的制备及应用进展[J].日用化学工业,2015,45(11):648-652.
[6] 林旭楷,肖 咏,韩 坚,等. 胃舒散对实验性胃炎保护作用的研究[J].中国实验方剂学杂志,2015,15(6):47-49.
[7] 王术皓,季宁宁,杜凌云.甲基橙指示抑制光度法测定药物中水杨酸[J].理化检验·化学分册,2005,41(11):761-762.
[8] 潘自红,陈丽华,梁媛媛,等. 化学衍生显色法间接测定乙酰水杨酸的含量[J].分析实验室,2013,32(9):116-119.
[9] 段沅杏,王 璐,贺 兵,等.高效液相色谱法测定食品添加剂中水杨酸[J].理化检验·化学分册,2012,48(2):152-154.
[10] 刘洪蛟,雷 鸣,胡艳丽,等. HPLC 法测定链荚豆根中水杨酸的含量[J].沈阳药科大学学报,2013,30(5):356-358.
[11] 高 从,杨 宁,黄 力.库仑滴定法测定水杨酸醇溶液中水杨酸的含量[J].中国医院药学杂志,2014,34(6):494-496
[12] AOAC官方方法[S].第17版.975,30.
[13] Londa L, Edward Barry. Experiments with aspirin[J]. J Chemical Education,2000, 77(3):354-355.
[14] 武汉大学化学与分子科学学院实验中心.无机化学实验[M].2版. 武汉:武汉大学出版社,2012:139-141.
[15] 符小文,张惠琼.乙酰水杨酸水解反应速率及活化能的测定[J].海南医学院学报,1996,2(2):58-60.
[16] 曹玉华,汪 云.毛细管电泳电化学检测测定阿司匹林水解反应速率常数[J].分析科学学报,2004,20(2):187-189.
Hydrolysis Kinetics of Acetylsalicylic Acid
ZHANGKailong,SHENTingting,TANZhiwen,YUChao
(College of Biological and Environmental Sciences, Zhejiang Wanli University, Ningbo 315100, Zhejiang, China)
Acetylsalicylic acid is a widely used non-steroidal anti-inflammatory drugs. A method of visible spectrophotometric was developed for the determination of salicylic acid and hydrolysis kinetics of acetylsalicylic acid based on the fact that salicylic acid and ferric complex with voilet color. In the buffer solution of HCOOH-NaOH with pH of 3.0, a type of 1∶1 stable complex of salicylic acid and ferric was formed and apparent stability constant (lgK) was calculated to be 6.02. Absorption maximum of the complex was found at the wavelength of 523 nm. Linear relationship was kept in the range 0.05-0.5 mmol/L and detection limit(3 s/k) was 2.2 μmol/L. The recovery rates measured were in the range of 96.0%-100.5%, and RSD were in the range of 0.76%-1.10% when the methods was applied to sample. Results of kinetics equation fitting with online monitoring data show that acetylsalicylic acid hydrolysis accorded with first order reaction and activation energy was 72.97 kJ/mol. It would be helpful to study and determine parameters of chemical kinetics.
salicylic acid; acetylsalicylic acid; complex; visible spectrophotometric; hydrolysis
2016-08-29
浙江省高等教育课堂教学改革项目(kg2015334);2015年度浙江省高校实验室工作研究项目(Y13201548);2014年浙江省新兴特色专业(生物工程专业)子项目(浙教高教〔2014〕110号);浙江万里学院校级“基础化学实验”课程建设2015年度立项课题
张凯龙(1984-),男,甘肃平凉人,硕士,讲师,主要研究方向为分析化学。
Tel.:0574-88225850; E-mail:chemnb@163.com
O 657.32
A
1006-7167(2017)05-0032-04
