夜景照明对5种蔷薇科植物叶绿素荧光参数影响的差异研究
2017-06-19张辉
张 辉
(陕西省灾害监测与机理模拟重点实验室/宝鸡文理学院,陕西 宝鸡 721013)
夜景照明对5种蔷薇科植物叶绿素荧光参数影响的差异研究
张 辉
(陕西省灾害监测与机理模拟重点实验室/宝鸡文理学院,陕西 宝鸡 721013)
为了分析夜景照明对景观植物生长发育的影响及合理种植景观植物,以5种常见蔷薇科校园绿化植物为材料,测定比较了5种植物之间荧光参数的差异,分析了叶片快速光响应曲线和快速荧光诱导动力学曲线。结果表明:5种测试植物叶片叶绿素荧光参数Fo、Fm、NPQ的种间差异达到了显著水平(P<0.05),Fv/Fm、Fv/ Fo、Fm/Fo、QY的种间差异达到了极显著水平(P<0.01),红叶李和樱桃的荧光参数值较高,酸梅的则较低;快速光响应曲线(LC)中红叶李和樱桃在20 μmol/(m2·s)时有一个拐点,说明红叶李和樱桃的光补偿点(LCP)在20 μmol/(m2·s)左右,其它植物的LCP都低于10 μmol/(m2·s);快速荧光动力学曲线(OJIP)表明各品种O点荧光差异不明显,随着时间的推移,J点开始出现差异,到P点差异达到最大,以红叶李的荧光值最高。综合分析以上结果,红叶李最适合该区域夜景照明下的环境。
照明;景观植物;叶绿素荧光;蔷薇科
0 引言
光合作用是绿色植物及其它生物赖以生存的基础[1]。细胞内的叶绿素分子直接吸收光量子或间接通过捕光色素吸收光量子得到能量,从基态(低能态)跃迁到激发态(高能态)[2]。吸收红光后电子跃迁到最低激发态;吸收蓝光后跃迁到较高激发态[3]。处在最低激发态的叶绿素分子可以通过不同的途径释放能量回到基态,其中第1种途径是放出一个光子而回到基态的过程就会产生荧光;第2种途径不放出光子,直接以热的形式散失掉;第3种途径是进行能量传递的光化学反应。这3种途径相互竞争,当植物处在胁迫状态时光化学反应减少,荧光效应增强[4-5]。叶绿素荧光作为光合作用研究的有效探针,对光合作用的机理研究起到很大的推动作用[6]。植物叶片经暗适应以后,使卡尔文循环(Calvin)的一些酶失去了活性,重新照光后需要一定的时间(光合诱导期)才能正常运行,在光合诱导期内,激发能不再参与叶绿素光化学反应,而转为叶绿素荧光的释放[7-8]。荧光随时间而发生变化的曲线称为叶绿素荧光诱导动力学曲线(OJIP曲线)[9-10],从该过程中可以得到Fo(固定荧光)、Fm(最大荧光)、Fv/Fm(PSⅡ最大光化学量子产量)、QY(量子产额)等光合作用参数,这些参数可以反映出植物光合作用的光反应及暗反应过程,是反映植物生长及生理状态的重要指标[11-12]。
光照作为一种触发信号,影响着植物的光形态建成,最终影响植物的生长发育过程[13-14]。目前,有关城市夜景照明的研究主要集中在规划、设计、照明方式、亮度标准及在建筑或景观观赏中的应用等问题上,殷秀梅对5种常绿阔叶林幼苗叶绿素荧光特征作了研究[15];路兴慧等对新疆7种园林植物的荧光特性作了分析[16],而夜景照明对景观植物生长发育影响的研究并不多。本文就5种校园常见蔷薇科景观植物做了调查研究,分析其在路灯照射下荧光参数变化的差异,以期为景观规划植物选择提供理论依据。
1 材料与方法
1.1 试验材料
本文所用试验材料为夜晚灯光照射下生长的3年生植株,所选植物种类为宝鸡文理学院校园常见蔷薇科景观植物:石楠(PhotiniaserrulataLindl.)、榆叶梅(Amygdalustriloba)、红叶李[PrunuscerasiferaEhrhar f.atropurpurea(Jacq.)]、樱桃(Cerasuspseudocerasus)和酸梅(ArmeniacamumeSieb.)。
1.2 叶绿素荧光参数、光响应曲线及荧光动力学曲线测定
每个植株选取灯光照射范围内的3片完全展开的叶片于2016年6月10日上午9:00开始测定。采用德国Walz公司生产的Mini-Imaging-PAM叶绿素荧光仪进行叶绿素荧光参数、快速光响应曲线及荧光诱导动力学曲线的测定。测定叶绿素荧光参数时,先用弱光照射后得出初始荧光(Fo),随后进行饱和脉冲光3000 μmol/(m2·s)处理,1个脉冲后关闭,得到最大荧光值(Fm)。暗适应20 min后,得到PSⅡ的最大光化学效率(Fv/Fm)、实际光量子产额(QY)、非光化学淬灭系数(NPQ)、可变荧光(Fv)、通过PSⅡ的电子情况(Fm/Fo)、PSⅡ的潜在活性(Fv/Fo)等参数均由所选程序自动计算生成。
利用仪器测定样品的快速光响应曲线,连续光量子能量密度梯度为0、20、50、100、300、500、1000 μmol/(m2·s),测定不同光强下的量子产额,绘制光响应曲线(LC)。利用自带程序测定叶片快速叶绿素荧光诱导动力学曲线,将获得的OJIP荧光诱导曲线进行差异分析[17-18]。
1.3 数据分析
本研究利用Excel 2010进行基础数据计算和作图,用SPSS 19.0进行one way-ANOVA分析[19]。
2 结果与分析
2.1 不同景观植物叶绿素荧光参数差异分析
把5种景观植物的叶绿素荧光参数作图于图1。其中,Fo反映了PSⅡ反应中心完全开放时原初电子受体QA全部被氧化时荧光的大小,与叶绿素含量大小有关[20],由图1A看出,Fo以榆叶梅最高。Fm代表PSⅡ反应中心完全关闭时的荧光值,该值的大小反映了PSⅡ电子传递链的优劣状况[21],Fm以樱桃最高(图1A)。
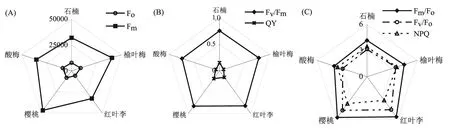
图1 5种景观植物叶绿素荧光参数平均值差异
Fv/Fm代表PSⅡ的最大光化学效率,Fv/Fm以红叶李和樱桃较高(图1B)。QY是PSⅡ的实际光化学效率,它反映了叶片光合电子传递链的能量占所吸收光能的比例[22],较高的QY值有利于提高光能转化效率,为暗反应积累能量,促进碳同化作用,最终促进光合作用[23],量子产额(QY)以樱桃和红叶李较高(图1B)。Fm/Fo表示通过PSⅡ的电子情况,以樱桃和红叶李较高(图1C)。Fv/Fo反映了PSⅡ的潜在活性,与PSⅡ反应中心的数量呈正比关系,Fv/Fo以樱桃和红叶李较高(图1C)。NPQ代表了非光化学淬灭系数,该系数反映了天线色素PSⅡ吸收的光能不能用于光合电子传递而以热能形式散失的那部分能量,热耗散能量的高低与植物对光抑制的自我保护机制有关[24],NPQ以红叶李最低,樱桃最高(图1C)。
为了进一步分析5种景观植物不同荧光参数的差异,进行方差分析,结果列于表1。由表1看出,不同蔷薇科植物各荧光参数之间达到显著或极显著差异。不同景观植物以QY差异最大(F=44.44**),Fv/Fo、Fm/Fo和Fv/Fm次之。樱桃和红叶李的荧光参数Fv/Fm、Fm、Fv/Fo、Fm/Fo、NPQ和QY都较高。酸梅的荧光参数Fv/Fm、Fm、Fv/Fo、Fm/Fo、NPQ和QY值均较低。

表1 5种景观植物叶绿素荧光参数差异分析
注:同列数字后不同字母表示在0.05水平差异显著。
2.2 不同景观植物快速光响应曲线差异分析
图2为5种景观植物的快速光响应曲线,由图2看出,随着光强的增强,各景观植物的量子产额整体呈下降趋势,每种景观植物的下降幅度有所不同。其中,红叶李和樱桃在20 μmol/(m2·s)时QY升高,在50 μmol/(m2·s)时QY开始下降,说明红叶李和樱桃叶片的光补偿点(LCP)在20 μmol/(m2·s)附近。其它3种景观植物的LCP都低于10 μmol/(m2·s)。在20 μmol/(m2·s)光强下的量子产额大小为:红叶李>石楠>樱桃>酸梅>榆叶梅。综合分析,5种景观植物在不同光照强度下的响应曲线得出,红叶李和樱桃应对光强的能力较强,榆叶梅和酸梅较弱。
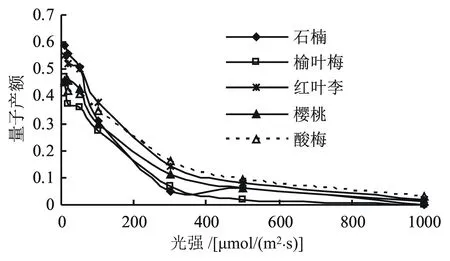
图2 5种景观植物的光响应曲线
2.3 不同景观植物快速叶绿素荧光诱导动力学曲线(OJIP)差异分析
图3为5种景观植物的快速叶绿素荧光诱导动力学曲线(OJIP),可以反映出大量关于PSⅡ反应中心原初光化学反应的信息。由图3看出,不同景观植物OJIP曲线变化趋势基本相同。其中,O点的差异不太明显(20 μs);J点处(2 ms)不同植物间开始有所差异,其中以红叶李最高,达到23277;I点处(30 ms)差异明显,以红叶李最高,为31795;P点时为稳定荧光值,P点差异进一步增大,大小为红叶李>樱桃>石楠>酸梅>榆叶梅。
3 结论与讨论
植物叶片对光能的吸收、传递和转化不仅取决于物种而且还取决于外界环境的变化。叶绿素荧光参数作为一种光合作用的内在性特征,反映了植物的生长状况。叶绿素荧光参数有很多个,这些参数中有些代表的意义相近,但在分析时又有所差别。其中,Fv为Fm与Fo之差,光胁迫下Fv的降低主要来自Fm的降低,而不是Fo的增加[25]。Fo的降低可由非光化学能量耗散引起,植物叶片光合机构的破坏则可引起Fo的升高,因此,Fo、Fm、Fv、Fv/Fm的变化趋势可以反映引起这种变化的内在机制[26]。本试验中,不同植物间叶绿素荧光参数差异显著,以红叶李和樱桃的Fv/Fm和Fv/Fo较高(图1和表1)。NPQ为非光化学淬灭系数,当PSⅡ反应中心天线色素吸收过量的光能时,如不及时以热的形式进行耗散,则将对光合机构造成破坏,所以非光化学淬灭作用是植物的一种自我保护机制[27]。本试验中,各植株的NPQ差异显著,说明应对光胁迫的热耗散有所差异,以樱桃最高,红叶李较高,说明红叶李和樱桃的自我保护机制较强,适应光照的能力较强。一些研究显示:在相同生长条件下具有较高荧光参数值的植物能更好地适应该区的环境[28-29]。本文有相似的结论,红叶李的各荧光参数值较高,最能适应该区夜景照明下的环境。
光照强度可显著改变植物叶片的叶绿素荧光参数[30]。本文结果显示,红叶李和樱桃的光补偿点(LCP)在20 μmol/(m2·s)附近(图2),当光照强度低于LCP时,与光化学能量转化相关的参数量子产额(QY)随着光照强度的增加而增大;而与非光化学能量耗散有关的参数(NPQ)则呈下降趋势,说明LCP处存在光化学转化的“阻力”,需要达到一定的光照强度才能实现光化学转化的最大效率[31]。目前,对于弱光条件下叶片产生“阻力”的机制还不太清楚,可能与PSⅡ反应中心的自我调节有关,与暗反应的反馈抑制及电子传递链的传递关系不大。
典型的叶绿素快速诱导荧光动力学曲线在荧光上升阶段有O、J、I、P四相, 对应不同的光化学反应阶段,外界光照强度和光照时间对OJIP曲线的改变主要反映的是对初级醌受体(QA)的影响。曲线在O点时PSⅡ的电子受体完全失去电子而被氧化,此时PSⅡ受体侧接受电子的能力最强,荧光值最小;曲线J点处的荧光强度升高反映了PSⅡ反应中心受体侧QA瞬时的大量积累;J~I段反映了电子传递过程中快还原型质体醌(PQ)库被先完全还原的过程;P点反映了QA完全进入还原状态,PSⅡ反应中心关闭,荧光产量最大[1,3,9]。本试验所用景观植物表现出典型的快速诱导曲线模式,其中,O点荧光值大小差异不明显;J点时有所差异,以红叶李的荧光值最高,说明红叶李QA瞬时积累力最强;I点时差异明显,还是以红叶李的荧光值最高;P点时达到稳定状态,以红叶李的荧光值最高,各植物间差异性显著增强(图3)。
本文对校园夜景照明下常种5种蔷薇科植物的叶绿素荧光参数、快速光响应曲线及荧光诱导动力学曲线作了分析,结果显示5种植物以红叶李最适合该区夜景照明的环境。在以后园林规划的植物选择中,可以考虑选择蔷薇科植物红叶李在该区进行种植。
[1] 邱晓晗,张玉钧,殷高方,等.基于叶绿素荧光诱导动力学曲线的光合作用参数反演算法研究[J].光谱学与光谱分析,2015,35(8):2194-2197.
[2] 韩志国.20种湿地植物的叶绿素荧光特性[D].广州:暨南大学,2006:18-20.
[3] 李鹏民,高辉远,Strasser R J.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J].植物生理学与分子生物学学报,2005,31(6):559-566.
[4] 刘露,丁柳丽,陈伟洲,等.不同温度下CO2浓度增高对坛紫菜生长和叶绿素荧光特性的研究[J].生态学报,2013,33(13):3916-3924.
[5] 胡文海,闫小红,袁丽芳,等.光强在低温弱光胁迫后番茄叶片光合作用恢复中的作用[J].植物研究,2011,32(2):164-168.
[6] 周蕴薇,刘艳萍,戴思兰.用叶绿素荧光分析技术鉴定植物抗寒性的剖析[J].植物生理学通讯,2006,42(5):945-950.
[7] 高平磊,郭水良,娄玉霞.基于叶绿素荧光参数分析铜锤草(O.xaliscorymbosa)和紫叶酢浆草(O.triangularis)对光照因子的适应特点[J].上海师范大学学报:自然科学版,2011, 40(5):528-532.
[8] Liu L Y, Guan L L, Peng D L, et aL. Detection of the photosynthesis protective mechanisms of C3 and C4 Crops from hyper spectral data[J]. Journal of Remote Sensing, 2012, 16(4): 783-789.
[9] 高玉,高志奎,张晓慧,等.通过快速荧光动力学曲线探测白黄瓜光系统Ⅱ的热激胁迫效应[J].生态学报,2009,29(6):3335-3341.
[10] 贾浩,郝建博,曹洪波,等.遮荫对‘保佳红’桃树叶片快速叶绿素荧光诱导动力学曲线的影响[J].西北植物学报,2015,35(9):1861-1867.
[11] 邱晓晗,张玉钧,殷高方,等.基于叶绿素荧光诱导动力学曲线的光合作用参数反演算法研究[J].光谱学与光谱分析,2015,35(8):2914-2917.
[12] 温国胜,田海涛,张明如,等.叶绿素荧光分析技术在林木培育中的应用[J].应用生态学报,2006,17(10):1973-1977.
[13] Worrall K L, Carter C G. The effects of continuous photoperiod on growth ofJuvenilebarramundi(Lates calcarifer)[J]. Aquaculture International, 2011, 19(6): 1075-1082.
[14] Mishra S. Effect of temperature, photoperiod and pH on in vitro shoot multiplication of sugar cane[J]. Vegetos, 2011, 24(1): 50-53.
[15] 殷秀敏.酸雨、UV-B和光胁迫对5种常绿阔叶树幼苗叶绿素荧光和生长特性的比较研究[D].临安:浙江农林大学,2012:1-10.
[16] 路兴慧,潘存德.新疆7种城市园林绿化树种叶绿素荧光特征比较[J].新疆农业大学学报,2008,31(5):1-6.
[17] Srivastava A, Strasser R J. Stress and stress management of land plants during a regular day[J]. Journal of Plant Physiology, 1996, 148: 445-455.
[18] 朱新广,张其德.NaCl对光合作用影响的研究进展[J].植物学通报,1999,16(4):332-338.
[19] William M, Terry S. 统计学[M].北京:机械工业出版社,2009:43-76.
[20] 李林光,李芳东,王颖,等.苹果四倍体品种叶绿素荧光参数的日变化[J].果树学报,2011,28(1):129-133.
[21] 张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
[22] 贺立红,贺立静,梁红.银杏不同品种叶绿素荧光参数的比较[J].华南农业大学学报,2006,27(4):43-46.
[23] 涂志华,潘瑞,洪雪沿,等.滨海沙地簕竹属10个竹种叶绿素荧光特性研究[J].竹子研究汇刊,2012,31(1):52-56.
[24] 陈四龙,孙宏勇,陈素英,等.不同冬小麦品种(系)叶绿素荧光差异分析[J].麦类作物学报,2005,25(3):57-62.
[25] Krause G H. Photoinhibition of photosynthesis: an evaluation of damaging and protective mechanisms[J]. Plant Physiology, 1988, 74: 566-574.
[26] Maxwell K, Johnson G N. Chlorophyll fluorescence: a practical guide[J]. Journal of Experimental Botany, 2000, 51: 659-668.
[27] Van Heerden P D R, Strasser R J, Krüger G H J. Reduction of dark chilling stress in N2-fixing soybean by nitrate as indicated by chlorophyll a fluorescence kinetics[J]. Plant Physiology, 2004, 121: 239-249.
[28] Baker N R. A possible role for photo system I in environmental perturbations of photosynthesis[J]. Plant Physiology, 1991, 81: 563.
[29] 郑淑霞,上官周平.8种阔叶树种叶片气体交换特征和叶绿素荧光特性比较[J].生态学报,2006,26(4):1080-1087.
[30] 康琅,汪良驹.ALA对西瓜叶片叶绿素荧光光响应曲线的影响[J].南京农业大学学报, 2008,31(1):31-36.
[31] Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1991, 42: 313-319.
(责任编辑:许晶晶)
Effects of Night Illumination on Chlorophyll Fluorescence Parameters of 5 Species of Plants in Rosaceae
ZHANG Hui
(Key Laboratory of Disaster Monitoring and Mechanism Simulation of Shaanxi Province /Baoji University of Arts and Sciences, Baoji 721013, China)
In order to analyze the effect of night illumination on the growth and development of landscape plants and to reasonably plant landscape plants, the author compared the differences in leaf chlorophyll fluorescence parameters among 5 species of common green plants in Rosaceae, and analyzed the rapid light response curve and rapid chlorophyll fluorescence induction kinetic curve of leaves. The results showed that: among these 5 species of plants, there were significant differences in leaf chlorophyll fluorescence parameters Fo, Fmand NPQ (P<0.05), and extremely significant differences in Fv/Fm, Fv/ Fo, Fm/Foand QY (P<0.01). The leaf chlorophyll fluorescence parameters ofPrunuscerasiferaand cherry were higher, while those of dark plum were lower. In the rapid light response curves ofP.cerasiferaand cherry, there was an inflection point at 20 μmol/(m2·s), suggesting the light compensation point (LCP) of these 2 species of plants was about 20 μmol/(m2·s). The LCPs of the other plants were all less than 10 μmol/(m2·s). In the rapid chlorophyll fluorescence kinetic curves, the difference in O-point fluorescence value was not obvious among 5 species of plants, but the difference in J-point fluorescence value started to appear as the time went on, and the difference in P-point fluorescence value reached the maximum;P.cerasiferahad the highest rapid chlorophyll fluorescence value at P point. The above results indicate thatP.cerasiferais most suitable for the night illumination environment in this region.
Illumination; Landscape plant; Chlorophyll fluorescence; Rosaceae
2017-02-05
国家自然科学基金项目(41601016);宝鸡市科技计划项目(16RKX1-14);宝鸡文理学院2016年2014级大学生创新项目 (201610721064);宝鸡文理学院项目(ZK2017070)。
张辉(1981─),男,河南沈丘人,工程师,硕士,主要从事生态地理学研究。
S685.12
A
1001-8581(2017)06-0035-05
