毛竹PheMADS15基因的克隆及功能分析
2017-06-19程占超马艳军
程占超,马艳军,侯 丹,刘 俊,高 健
(国际竹藤中心 国家林业局竹藤科学与技术重点开放实验,北京100102)
毛竹PheMADS15基因的克隆及功能分析
程占超,马艳军,侯 丹,刘 俊,高 健
(国际竹藤中心 国家林业局竹藤科学与技术重点开放实验,北京100102)
以毛竹Phyllostachys edulis花为材料,通过聚合酶链式反应(PCR)克隆技术从毛竹中分离得到1个含完整编码区的cDNA,长603 bp,编码200个氨基酸。命名为PheMADS15(GenBank登记号:KU721916)。对PheMADS15进行分析表明,该基因具有典型的MADS-box基因结构域,与拟南芥Arabidopsis thaliana的A类基因AP1编码蛋白的同源性为58.65%。通过实时荧光定量聚合酶链式反应(qRT-PCR)克隆技术检测了PheMADS15在毛竹花芽、苞片、颖片、稃片、浆片、雄蕊、雌蕊和幼胚中的相对表达量。分析表明:PheMADS15基因在毛竹花发育的初期表达量最高,主要在花芽中表达,可能参与毛竹成花转变过程。图4参20
林木育种学;毛竹;PheMADS15;MADS-box
毛竹Phyllostachys edulis作为经济竹种,经济价值高,生产潜力大,在中国工农业生产和国民经济中占有重要的地位。毛竹营养生长周期长,开花时期不确定,并且开花后集体死亡,导致竹林面积减少,对经济发展和生态环境造成重大损失和破坏。近几年竹子频繁的开花,科研人员不断尝试各种试验手段来探究竹子开花的机制,竹子开花生物学和生殖生物学研究又成为人们关注的重点。近年来,花器官发育研究的快速发展为竹类的花发育研究提供了借鉴和基础,尤其是模式植物拟南芥Arabidopsis thaliana,金鱼草Antirrhinum majus,矮牵牛Petunia hybrida等开花调控基因及其功能的研究。通过对拟南芥和金鱼草中同源异型突变体进行系统的遗传学分析[2-4],提出了花器官ABC模型的假说。在植物中,A类基因能够控制花萼形成,A类和B类基因能够共同控制花瓣的形成,B类和C类基因共同决定雄蕊的发生和发育,而C类基因则控制植物心皮的行成。反向遗传学研究显示,D类基因和E类基因的同源基因同样在调控花形态建成方面起重要作用,D类基因调控胚珠的形成和发育[5-7],而E类基因在所有花器官的形成中起着调控作用[8-10]。在花发育调控中大部分基因属于MADS-box基因家族,该家族基因拥有典型的MADS-box保守结构域,是一类重要的转录因子,主要在植物花器官的发育及开花时间的调控上起作用。目前,从麻竹Dendrocalamus latiflorus和绿竹Bambusa oldhamii中已经分离了与竹子花发育密切相关的MADS-box基因,并对其功能进行初步了分析[11-12],但是对于毛竹MADS-box基因的相关报道比较少,研究人员曾对毛竹的E类基因PeMADS1进行了初步的鉴定与分析[13]。本研究以毛竹花样品为研究材料,首次克隆了1个A类的MADS-box基因PheMADS15,并对该基因与麻竹、拟南芥和水稻Oryza sativa等不同物种同源基因亲缘关系进行了分析,采用实时荧光定量聚合酶链式反应(qRT-PCR)研究它在毛竹不同组织上的表达差异,初步鉴定了PheMADS15的功能,为竹子开花和育种奠定了基础。
1 材料与方法
1.1 植物材料和主要试剂
PheMADS15基因克隆的材料为毛竹的花穗,毛竹开花实验地位于广西壮族自治区桂林市,位于南岭山系的西南部。该毛竹林属于自然生长状态。以毛竹花器官分离出的花芽、苞片、颖片、稃片、浆片、雄蕊、雌蕊和幼胚为模板,共计8个样品,用于克隆和组织特异性表达分析。
TA克隆T-esay Vector,Taq酶购自TaKaRa公司,柱式DNA胶回收试剂盒购自QIAGEN公司。转化用的感受态来自天根公司DH5α大肠埃希菌Escherichia coli。Trizol试剂购自Life公司,反转录试剂盒购自Promega公司。SYBR Green I Master试剂盒购自Roche公司。根据毛竹的TIP41作为内参,用于qRT-PCR分析。聚合酶链式反应(PCR)引物均由金唯智生物科技有限公司合成。
1.2 方法
1.2.1 Trizol试剂盒提取毛竹花的总核糖核酸(RNA) 选取生长良好的毛竹花穗,通过Trizol法提取花样品的总RNA,用于PheMADS15基因的克隆。
1.2.2 PCR扩增PheMADS15的全长序列 根据毛竹基因组数据库的PheMADS15 cDNA序列设计PCR引物,PheMADS15-F:5′-AGTTGAACTGAAGAGGATTGAG-3′;PheMADS15-R:5′-CTAAAGAACCCAACCAAGCATG-3′,引物由金唯智生物科技有限公司合成。以毛竹花cDNA为模板,进行PCR。反应体系50.0 μL:5.0 μL 10.0×长和精确聚合酶链式反应(LA PCR)缓冲液(加镁离子优化),8.0 μL三磷酸碱基脱氧核苷酸(dNTPs)(2.5 mmol·L-1),5.0 μL PheMADS15-F(5.0 mmol·L-1),5.0 μL PheMADS15-R(5.0 mmol·L-1),2.0 μL模板,24.5 μL双蒸水和0.5 μL长和精确脱氧核糖核酸(LA DNA)聚合酶。反应程序为94℃预变性5 min;然后按下列循环参数进行扩增反应:94℃30 s,58℃30 s,72℃90 s,经过30个循环后,72℃10 min,16℃保温。PCR扩增产物进行电泳检验,回收目的DNA片段,与T-easy克隆载体连接,将PCR连接产物热激转化到DH5α感受态细胞,最后涂含Amp的Luria-Bertani(LB)培养基平板,过夜37℃培养,然后挑取单克隆进行菌落PCR反应。取1.0 μL菌液,通过引物PheMADS15-F和PheMADS15-R验证,PCR反应程序同上。将检测正确的阳性克隆菌液测序并保菌。
1.2.3 实时定量PCR分析 根据Trizol试剂提取毛竹花样品的总RNA。通过NanoDrop Spectrophotometer ND-100测定提取的总核糖核酸(RNA)的浓度,然后进行电泳检测。根据Promega胶回收试剂盒说明书,取1.0 μg RNA于0.2 mL离心管(EP)中,70℃孵育10 min,短暂离心后,置于冰上;准备一个20.0 μL的反应体系:4.0 μL 25 mmol·L-1氯化镁,2.0 μL 10×反转录缓冲液,2.0 μL脱氧核糖核苷三磷酸混合液,0.5 μL RNA酶抑制剂,15.0×16.67 nkat鸟类成髓细胞性白细胞病毒(avian myeloblastosis virus,AMV)反转录酶,0.5 μg多聚胸腺嘧啶T重复寡核苷酸[Oligo(dT)]15引物,1.0 μg RNA,最后添加不含核酸酶的水到20.0 μL。混匀后进行反转录反应。使用Oligo(dT)15引物时,42℃孵育15 min,95℃,5 min,然后转入0~5℃放置5 min。得到的cDNA用于下一步的qRT-PCR反应的模板。其反应体系为20.0 μL体系,包括2.0 μL的反转录的cDNA,10.0 μL的2×SYBR Green I Mastermix,各0.4 μL的上下游引物,加双蒸水至反应总体积为20.0 μL,重复3次·处理-1。反应条件:95℃预变性30 s,95℃5 s,60℃30 s,72℃30 s,共40个循环。qRT-PCR使用仪器的是Roche LightCyclerR480。
1.2.4 PheMADS15基因全长序列分析 PheMADS15基因的开放读码框(ORF)由美国生物技术信息中心(NCBI)ORF-finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)来鉴定;通过DNAMAN和MAGE 6.0软件来分析该基因的同源性;用ExPASY(http://web.expasy.org/compute_pi/)分析氨基酸的相对分子质量和等电点等理化性质。
2 结果
2.1 毛竹花总RNA的提取
用Trizol试剂提取毛竹总核糖核酸(RNA),测得RNA样品的光密度为1 103.0 ng·L-1。将提取到的RNA作为模板,于-20℃冰箱保存,用于后续PCR扩增。
2.2 PheMADS15基因全长的克隆
以毛竹花 cDNA为模板,以 PheMADS15-F和 Phe-MADS15-R为引物,PCR扩增PheMADS15的全长,PCR产物经过电泳检测,在603 bp处有一条明亮的条带(图1),与基因组数据的片段大小保持一致,初步判定为目的基因片段。测序的结果表明,该目的基因与毛竹基因组数据库中的cDNA序列完全一致。命名为PheMADS15(GenBank登记号:KU721916)。
2.3 PheMADS15基因和编码蛋白序列分析
用DNAMAN软件和NCBI的Blast在线软件分析测序结果,该基因开放阅读框(ORF)的核酸序列及推导出的氨基酸序列(图2)。结果表明:毛竹PheMADS15基因序列含有1个603 bp的开放阅读框,编码200个氨基酸。用ExPASY(http://web.expasy.org/compute_pi/)分析该基因序列编码的蛋白。该蛋白氨基酸的相对分子量为23.48 kD,理论等电点为8.98。
2.4 进化树分析
通过MAGE 6.0运用Neighboro-Joining方法构建毛竹与其他物种间的系统进化树。对PheMADS15基因编码的蛋白质进行系统进化分析(图3),对比麻竹(AAR32118.1),水稻(AAF19047.1),二穗短柄草Brachypodiumdistachyon(NP_001288319.1),玉米Zea mays(ACG35179.1),小米Setaria italica(XP_004981740.1),高粱Sorghumbicolor(AAB50181.1),小麦Triticumaestivum(ABF57926.1),大麦Hordeum vulgare(AAW82994.1)和拟南芥(AT1G69120),毛竹与麻竹中的DlMADS1和水稻中OsMADS14比较近。这些MADS-box基因都与拟南芥的AP1同源。
2.5 PheMADS15组织特异性表达
提取的总RNA电泳检测结果表明,提取的毛竹花的总RNA结构完整,光密度为1 103.0 ng·L-1,可以用于定量PCR分析。用反转录的毛竹花组织cDNA模板进行qRT-PCR,以TIP41作为内参,Phe-MADS15在毛竹8个样品中进行表达量检测(图4)。结果显示:PheMADS15的表达量在花蕾中最高,其次是苞片,接着是颖片,而表达量最低是雌蕊,其次是浆片,接着是幼胚。在毛竹花发育的过程中,PheMADS15主要在花初期表达量高,随着毛竹花的不断发育,表达量逐渐减少。
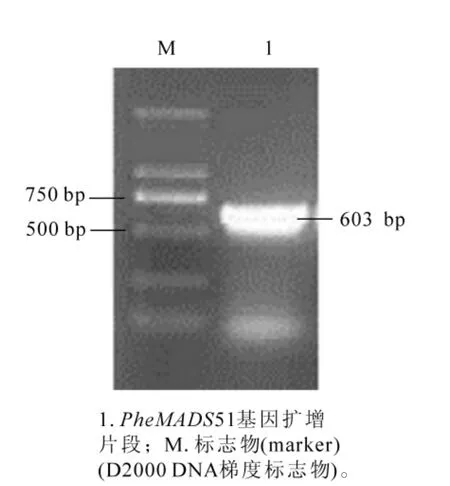
图1 毛竹PheMADS15基因片段电泳图Figure 1 Electrophoresis of the amplification fragment of PheMADS15 gene of Phyllostachys edulis

图2 PheMADS15编码区核酸序列及其氨基酸序列Figure 2 Nucleotide and predicted amino acid sequence of PheMADS15
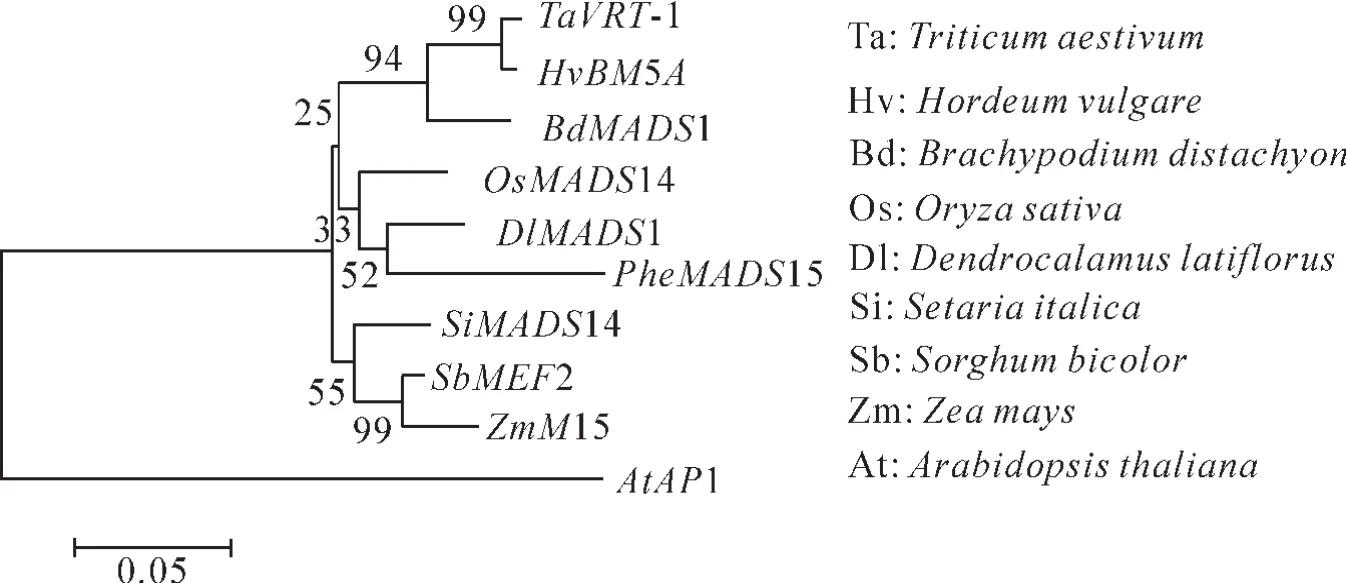
图3 PheMADS15系统进化树分析Figure 3 Phylogenetic tree analysis of PheMADS15
3 讨论
毛竹是中国重要的经济竹种,具有非常独特的性质,在中国具有广泛的栽植面积和非常高的经济价值。目前,竹子造林主要以无性繁殖为主,开花无规律,花粉活性极低,杂交育种进展缓慢,严重阻碍了毛竹新品种培育。现代分子生物学理论和实验技术的快速发展,为阐明竹子开花分子机制奠定了基础,有望突破常规育种的局限性,并加速育种进程。本研究对PheMADS15基因与其他物种的同源基因构建的进化树进行分析,结果表明:毛竹与麻竹的亲缘关系极为相近,其次和水稻的OsMADS14相近,而与玉米的亲缘关系较远,这与之前的报道大体一致。稻亚科Ehrhartoideae和竹亚科Bambusoideae有着比较近的基因序列结构和亲缘关系,在早期,水稻与竹类植物都同属竹亚科[14-15]。
毛竹PheMADS15基因编码的蛋白质与其他物种的MADS-box有着较高的同源性,尤其是与来自麻竹的DlMADS1[16]同源性更高,表明毛竹与麻竹在进化中可能处于比较相近的位置,进而也证明毛竹的MADS-box基因在进化上是相当保守的。Phe-MADS15基因编码蛋白序列与水稻和拟南芥A类基因同处于一个进化树分支中,推测该基因为A类的功能基因。
A类功能基因在花发育过程中起着重要的调节作用。在拟南芥中,AP1主要在花分生组织的初期高量表达,过表达能提前使植物开花[17-19],在开花诱导中起着重要的作用。在水稻中,OsMADS14过表达导致水稻提前开花[20]。毛竹的PheMADS15与拟南芥的AP1以及水稻的OsMADS14在一个进化枝上。PheMADS15在毛竹花的初期表达量比较高,尤其是在花芽中。推测PheMADS15在毛竹开花诱导方面可能起着重要的作用,但PheMADS15在竹子中调控开花的机制仍是未知的。以上结果为竹子开花提供了有用的信息。
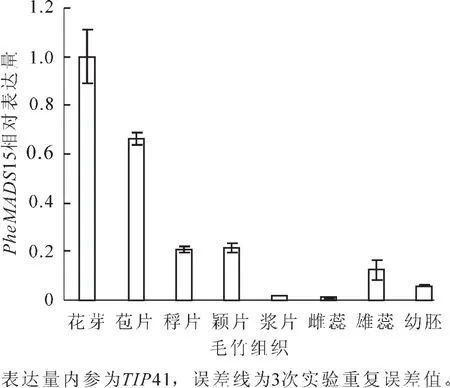
图4 PheMADS15在毛竹不同组织中特异性表达Figure 4 Relative expression of PheMADS15 in different tissues of Phyllostachys edulis
[1] 袁金玲,傅懋毅,庄金坤,等.几个丛生竹开花授粉特性及麻竹苗期初步选择[J].竹子研究汇刊,2005,24(3):9-13.
YUAN Jinling,FU Maoyi,ZHUANG Jinkun,et al.The characteristics of flowering and pollinating of several sympodial bamboos and elementary selection of Dendrocalamus latiflorus seedling[J].J Bamboo Res,2005,24(3):9-13.
[2] CARPENTER R,COEN E S.Floral homeotic mutations produced by transposon-mutagenesis in Antirrhinum majus[J].Genes Dev,1990,4(9):1483-1493.
[3] SOMMER H,BELTRAN J P,HUIJSER P,et al.Deficiens,a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus:the protein shows homology to transcription factors[J].Embo J,1990,9(3):605-613.
[4] BOWMAN J L,DREWS G N,MEYEROWITZ E M.Expression of the Arabidopsis floral homeotic gene AGAMOUS is restricted to specific cell types late in flower development[J].Plant Cell,1991,3(8):749-758.
[5] COLOMBO A,HALL P,NAKAMURA S,et al.Intracoronary stenting without anticoagulation accomplished with intravascular ultrasound guidance[J].Circulation,1995,91(6):1676-1688.
[6] FAVARO R,PINYOPICH A,BATTAGLIA R,et al.MADS-box protein complexes control carpel and ovule development in Arabidopsis[J].Plant Cell,2003,15(11):2603-2611.
[7] PINYOPICH A,DITTA G S,SAVIDGE B,et al.Assessing the redundancy of MADS-box genes during carpel and ovule development[J].Nature,2003,424(6944):85-88.
[8] PELAZ S,DITTA G S,BAUMANN E,et al.B and C floral organ identity functions require SEPALLATA MADS-box genes[J].Nature,2000,405(6783):200-203.
[9] HONMA T,GOTO K.Complexes of MADS-box proteins are sufficient to convert leaves into floral organs[J].Nature, 2001,409(6819):525-529.
[10] DITTA G,PINYOPICH A,ROBLES P,et al.The SEP4 gene of Arabidopsis thaliana functions in floral organ and meristem identity[J].Current Biol,2004,14(21):1935-1940.
[11] 田波.竹类植物开花时间相关基因的克隆与功能分析[D].昆明:中国科学院昆明植物研究所,2005.
TIAN Bo.Isolation and Characterization of Bamboo Flowering Time Genes[D].Kunming:Chinese Academy of Sciences.Kunming Institute of Botany,2005.
[12] 高志民,刘颖丽,李雪平,等.一个绿竹MADS-box基因的克隆与序列分析[J].分子植物育种,2007,5(6):866-870.
GAO Zhimin,LIU Yingli,LI Xueping,et al.Cloning and sequencing analysis of a flowering-related mads-box gene in Bambusa oldhamii L.[J].Mol Plant Breed,2007,5(6):866-870.
[13] 高志民,郑波,彭镇华.毛竹PeMADS1基因的克隆及转化拟南芥初步研究[J].林业科学,2010,46(10):37 -41.
GAO Zhimin,ZHENG Bo,PENG Zhenhua.Isolation of PeMADS1 gene from Phyllostachys edulis and its transformation in Arabidopsis thaliana[J].Sci Silv Sin,2010,46(10):37-41.
[14] 樊龙江,郭兴益,马乃训.竹类植物与水稻等其它禾本科作物的系统进化关系及基因序列组成的比较[J].林业科学研究,2006,19(2):165-169.
FAN Longjiang,GUO Xingyi,MA Naixun.Comparative study on phylogenetics and sequences composition of bamboos and cereals[J].For Res,2006,19(2):165-169.
[15] 王海莲,管延安,张华文,等.高粱基因组学研究进展[J].基因组学与应用生物学,2009,28(3):549-556.
WANG Hailian,GUAN Yan’an,ZHANG Huawen,et al.Advances in the study on sorghum genomics[J].Gen Appl Biol,2009,28(3):549-556.
[16] LIN Erpei,PENG Huazheng,JIN Qunying,et al.Identification and characterization of two bamboo(Phyllostachys praecox)AP1/SQUA-like MADS-box genes during floral transition[J].Planta,2009,231(1):109-120.
[17] FERRÁNDIZ C,GU Q,MARTIENSSEN R,et al.Redundant regulation of meristem identity and plant architecture by FRUITFULL,APETALA1 and CAULIFLOWER[J].Development,2000,127(4):725-734.
[18] SHANNON S,MEEKS-WAGNER D R.A mutation in the Arabidopsis TFL1 gene affects inflorescence meristem development[J].Plant Cell,1991,3(9):877-892.
[19] WEIGEL D,ALVAREZ J,SMYTH D R,et al.LEAFY controls floral meristem identity in Arabidopsis[J].Cell, 1992,69(5):843-859.
[20] KIM S L,LEE S,KIM H J,et al.OsMADS51 is a short-day flowering promoter that functions upstream of Ehd1,Os-MADS14,and Hd3a[J].Plant Physiol,2007,145(4):1484-1494.
Isolation and functional analysis of the PheMADS15 gene in Phyllostachys edulis
CHENG Zhanchao,MA Yanjun,HOU Dan,LIU Jun,GAO Jian
(Key Laboratory of Bamboo and Rattan Science and Technology,International Center for Bamboo and Rattan,State Forestry Administration,Beijing 100102,China)
As a kind of transcription factors,MADS-box genes play significant roles during floral development, but their identification and functions in Phyllostachys edulis remain unclear.Here,we performed functional analysis of the PheMADS15 gene in Ph.edulis.PheMADS15 cDNA was isolated from Phyllostachys edulis by polymerase chain reaction (PCR) (GenBank accession No.KU721916).This study also used a quantitative real-time,polymerase chain reaction (qRT-PCR)and a homology analysis.Results showed that the gene was 603 bp and encoded a protein of 200 aa,which had a typical MADS-box motif.The homology analysis showed that PheMADS15 shared 58.7%similarity with the floral meristem identity gene AP1 indicating that it belonged to A function genes.The qRT-PCR detected expression of PheMADS15 in the floral bud,glume,lemma,palea, lodicule,stamen,pistil,and young embryo.Additionally,PheMADS15 had the highest expression level in the initial-phase of flower development,especially in the floral bud formation stage.These results suggest that Phe-MADS15 might participate in regulating flower development of Ph.edulis.[Ch,4 fig.20 ref.]
forest tree breeding;Phyllostachys edulis;PheMADS15;MADS-box
S722.3
A
2095-0756(2017)03-0421-06
浙 江 农 林 大 学 学 报,2017,34(3):421-426
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2017.03.006
2016-06-14;
2016-07-31
国家高技术研究发展计划(“863”计划)项目(2013AA102607-4);国家自然科学基金资助项目(31570673)
程占超,博士,从事林木遗传育种研究。E-mail:chengzhan_chao@126.com。通信作者:高健,研究员,博士,博士生导师,从事林木遗传育种研究。E-mail:gaojian@icbr.ac.cn
