子宫颈癌患者肿瘤标志物联合MRI影像诊断的临床价值*
2017-06-15新疆喀什地区第二人民医院新疆844000
新疆喀什地区第二人民医院(新疆 844000)
姚春慧 李 波 谭 娟张 沁 买买提明 程凡芝
子宫颈癌患者肿瘤标志物联合MRI影像诊断的临床价值*
新疆喀什地区第二人民医院(新疆 844000)
姚春慧 李 波 谭 娟张 沁 买买提明 程凡芝
目的 探讨肿瘤标志物联合MRI诊断子宫颈癌的临床价值。方法 收集2012年4月-2015年6月我院收治的78例子宫颈癌患者为研究组,选取同期来我院体检的40例健康人作为对照组,入院后均采集空腹静脉血,测定肿瘤标志物鳞状细胞癌抗原(SCCA)、糖类抗原153(CA153)、糖类抗原125(CA125)、细胞角蛋白21-1(CYFRA211)水平,同时所有患者均给予MRI检查,以病理活检结果为金标准,分析肿瘤标志物、MRI及其联合诊断对宫颈癌的临床价值。结果 研究组血清SCCA、CA125、CA153、CYFRA211水平均高于对照组(P<0.05);宫颈癌灶组织ARSI %高于正常组织(P<0.05),两者MRSI %对比差异无统计学意义(P>0.05);MRI诊断宫颈癌阳性率为96.15 %,高于肿瘤标志物各项(P<0.05),肿瘤标志物联合MRI诊断宫颈癌准确率高于MRI,但对比差异无统计学意义(P>0.05)。结论 子宫颈癌患者血清SCCA、CA125、CA153、CYFRA211明显上调,其中CA125敏感度最高,但肿瘤标志物筛查阳性率低于MRI,可将MRI作为宫颈癌筛查的首选手段,将肿瘤标志物作为辅助手段。
MRI;宫颈癌;肿瘤标志物;诊断;联合
宫颈癌为临床常见妇科恶性肿瘤,发病率仅次于乳腺癌,且患者早期症状无特异性,临床误诊、漏诊率较高[1],近年来宫颈癌发病率明显上升[2],早期检出并给予积极的治疗是防治宫颈癌的关键。MRI为宫颈癌常用影像学筛查方案,其可实现多方位成像,直观显示宫颈肿瘤特点,准确测定肿瘤体积及浸润深度等,对宫颈癌有其较高的诊断价值。血清肿瘤标志物则为宫颈癌辅助诊断、复发预测及预后监测的有效手段,近期有研究[3]发现MRI检查辅以血清肿瘤标志物筛查可提高宫颈癌诊断的准确率。基于此,为探讨肿瘤标志物联合MRI影像学诊断宫颈癌的临床价值,我院对收治的78例宫颈癌患者的临床资料展开了回顾性分析,现报道如下。
1 资料与方法
1.1 临床资料收集2012年4月~2015年6月我院收治的78例子宫颈癌患者的临床资料,所有患者均经病理确诊为子宫颈癌,入院后均完成肿瘤标志物检查及MRI检查,且临床资料完整。患者年龄31~70岁,平均(44.9±3.4)岁;临床表现:不规则阴道排液23例,接触性阴道出血51例,左腰疼痛4例。选取同期来我院体检者的40例正常健康女性为对照组,年龄30~71岁,平均(45.1±3.6)岁。
1.2 方法①肿瘤标志物检查。入院次日抽取空腹静脉血3mL,离心后分离血清,采用化学发光法,用罗氏E70型全自动免疫分析仪测定血清CA125、CA153、CYFRA211水平,采用微粒子酶联免疫法,应用雅培i2000SR型全自动免疫分析仪测定血清SCCA水平,参照试剂使用说明进行操作。②MRI检查。采用GE Signa 1.5 T HD echospeed MRI超导性磁共振扫描仪,体部相控阵线圈,均取出节育环,检查前1 h足量饮水,充盈膀胱,平卧位,足先进,自髂骨上缘扫描至双侧股骨颈,先作MR平扫,SE T1WI横断面(TR 400ms,TE 8.0ms,层厚6mm,层距1.0mm,FOV 320×32cm,矩阵32×192,NEX 2)与脂肪抑制快速SE T2WI序列(横断面:TR 4000ms,TE 125.0ms,层厚6mm,层距1.0mm,FOV 32×32cm,矩阵320×192,NEX 4;矢状面:TR 3500ms,TE 110.0ms,层厚5mm,层距0.5mm,FOV 40×40cm,矩阵288×256,NEX 4;冠状面:TR 3500ms,TE 110.0ms,层厚5mm,层距0.5mm,FOV 40×40cm,矩阵288×256,NEX 4)。后作动态增强扫描,经肘静脉高压注射Gd-DTPA,0.1mmol/kg,速率2.5ml/ s,注药16、32、48、64s后均扫描1次,注药300s后行横断面(TR 155 ms,TE 1.4ms,层厚6mm,层距1.0mm,FOV 32×32cm,矩阵320×192,NEX 1)、冠状面(TR 155ms,TE 1.4ms,层厚5mm,层距0.5mm,FOV 40×40cm,矩阵288×256,NEX 1)、矢状面(TR 155ms,TE 1.4ms,层厚5mm,层距0.5mm,FOV 40×40cm,矩阵288×256,NEX 1)快速扰相梯度回波(FSPGR)序列延迟扫描及肝脏容积超快速三维T1WI(LAVA)矢状面(TR 6.1ms,TE 1.1ms,层厚3mm,层距-3.0mm,FOV 40×40cm,矩阵288×256,NEX 1)扫描。
1.3 肿瘤标志物阳性标准SCCA≥1.50ng/mL,CA125≥35.00 IU/mL,CA153≥31.30IU/mL,CYFRA211≥2.08ng/mL。
1.4 图像分析选2名资深影像科医师对所有患者MRI图像作回顾性阅片,观察病灶、大小、形态、浸润情况、TIC曲线类型[4]。计算动态早期信号增强率(ARSI%)与最大相对信号增强率(MRSI%)。
1.5 统计学方法采用SPSS 19.0软件处理数据,计数资料用%表示,χ2检验,计量资料用()表示,t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果78例子宫颈癌患者中,鳞癌70例,腺癌8例;肿瘤分化程度:高分化15例,中分化45例,低分化18例。
2.2 宫颈癌及正常健康人血清肿瘤标志物水平比较研究组血清SCCA、CA125、CA153、CYFRA211水平均高于对照组,对比差异有统计学意义(P<0.05),见表1。
2.3 宫颈癌灶及正常组织ARSI%、MRSI%比较宫颈癌灶组织ARSI%高于正常组织(P<0.05),其MRSI%对比差异无统计学意义(P>0.05),见表2。
2.4 宫颈癌MRI影像学表现78例宫颈癌患者中除3例临床分期为Ⅰa期患者MRI未见阳性征象外,其余75例宫颈癌患者均可见实性肿块,肿块直径0.62~8.86 (5.56±1.74)cm;病灶直径>3cm、≤3cm者分别为32例、43例;肿块非规则46例(图1),规则29例;浸润深度突破基质者55例(图2),未突破者20例;伴宫旁浸润27例(图3),输尿管浸润2例。增强扫描75例病灶均伴强化,67例信号高于周围正常组织(图4-5),8例低于正常组织;延迟扫描60例病灶可见中心低信号,边缘高信号;宫颈癌早期强化均达到峰值(图6-8),强化曲线:Ⅰ型48例,Ⅱ型27例。
表1 宫颈癌及正常健康人血清肿瘤标志物水平比较()
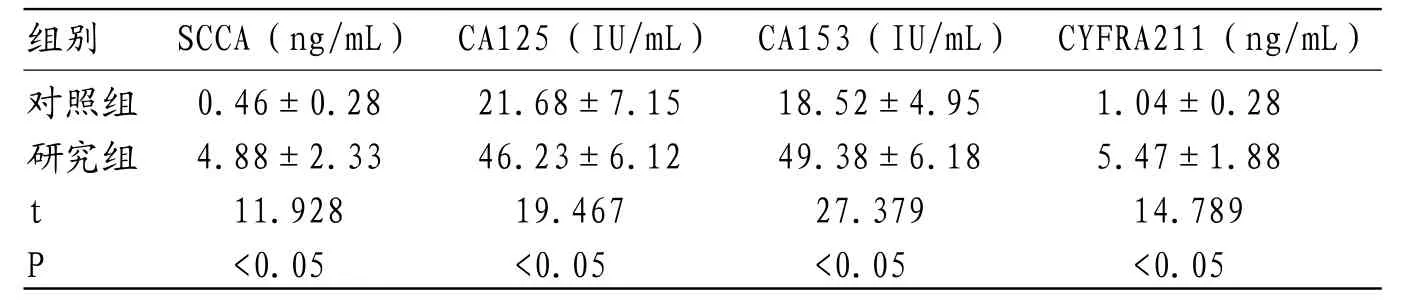
表1 宫颈癌及正常健康人血清肿瘤标志物水平比较()
对照组 0.46±0.28 21.68±7.15 18.52±4.95 1.04±0.28研究组 4.88±2.33 46.23±6.12 49.38±6.18 5.47±1.88 t 11.928 19.467 27.379 14.789 P <0.05 <0.05 <0.05 <0.05
表2 宫颈癌灶及正常组织ARSI%、MRSI%比较(,%)

表2 宫颈癌灶及正常组织ARSI%、MRSI%比较(,%)
组别 ARSI% MRSI%宫颈癌组织 1.98±0.52 1.63±0.64正常组织 1.21±0.51 1.52±0.59 t 9.336 1.116 P <0.05 >0.05

表3 肿瘤标志物、MRI及其联合诊断预测宫颈癌阳性率比较[n(%)]
2.5 肿瘤标志物、MRI及其联合诊断预测宫颈癌阳性率比较肿瘤标志物CA125诊断宫颈癌阳性率略高于SCCA、CA153、CYFRA211,但对比差异无统计学意义(P>0.05),MRI诊断宫颈癌阳性率为96.15%,高于肿瘤标志物各项(P<0.05),肿瘤标志物联合MRI诊断宫颈癌准确率高于MRI,但对比差异无统计学意义(P>0.05),见表3。
3 讨 论
宫颈癌为妇科常见恶性肿瘤,是全球范围内女性癌症第二大死亡原因,据统计显示,我国宫颈癌发病率及病死率约占全球范围的33%,且近年来呈年轻化发展趋势[5]。目前用于宫颈癌临床诊断的方法包括阴道镜、宫颈细胞涂片检查、液基细胞学检查及影像学筛查手段等,宫颈细胞涂片、液基细胞学检查均为有创检查,且部分情况下宫颈活检难以明确肿瘤浸润状况。而MRI则为宫颈癌筛查的首选影像学方式,其软组织分辨率高,与腹部、胸部筛查比较,患者盆腔组织受肠蠕动、呼吸等伪影影响少,对盆腔病理结构显示清晰,对早期宫颈癌判定有较好的指导价值。且MRI可实现多序列、多方位成像,可为宫颈癌分期及治疗提供依据,同时可为准确判定盆腔脏器侵犯情况、淋巴结转移情况奠定影像学基础。
肿瘤标志物则为早期预测癌症发生、治疗效果及预后的有效手段。其中SCCA、CA125、CA153均为宫颈癌常用血清肿瘤标志物。其中SCCA主要存在于宫颈鳞癌中的癌细胞抗原,但人体正常鳞状上皮组织少见SCCA表达。苏晶等[6]发现,SCCA为特异性较高的鳞状细胞癌血清肿瘤标志物,其表示SCCA对起源于鳞状细胞的肿瘤,诸如食管癌、宫颈癌等均有其较好的预测价值,且临床分期越高,SCCA上升幅度越高。CA125蛋白则为卵巢癌重要抗原,早期多用于卵巢癌预后的判断,但刘馨等[7]表示,其在卵巢癌早期诊断中特异性较低,而在宫颈癌患者中有较高的阳性率。CA153则为糖链抗原类肿瘤标志物,在宫颈癌患者表达中较高。CYFRA211则为角蛋白家族成员,分布于正常组织表层,机体出现恶性病变时,蛋白酶激活,加速细胞降解,促使大量角蛋白片段进入血液,上调CYFRA211表达[8]。本研究发现,较正常健康人,宫颈癌患者SCCA、CA125、CA153、CYFRA211等肿瘤标志物水平均明显升高(P<0.05),且在宫颈癌患者四种肿瘤标志物中,以CA125阳性率最高,与上述报道相符。但目前临床多将肿瘤标志物水平的变化作为肿瘤恶性程度及患者治疗及预后的辅助手段。
张秋芳等[9]认为,将肿瘤标志物用于MRI辅助筛查,可提高宫颈癌检出率。本研究发现,MRI对Ⅰb期以上肿瘤有其较好的检出率,可清晰观察癌灶浸润情况,明确显示宫颈内部结构层次,宫旁组织结构及盆腔、阴道情况,同时对宫颈与阴道、直肠与膀胱结构关系显示较好。但对Ⅰa期宫颈癌漏诊率较高,本研究中78例宫颈癌患者,Ⅰa期3例,MRI均漏诊,但对Ⅰb期以上宫颈癌均检出阳性征象,对直径≥3cm及<3cm病灶均可检出,且配合增强扫描可明确病灶强化特点及信号特征,整体诊断准确率高达96.15%。而四项肿瘤标志物诊断宫颈癌准确率均低于MRI(P<0.05),与梁海霞等[10]报道相符。联合诊断发现,肿瘤标志物联合MRI诊断宫颈癌准确率为98.72%,高于肿瘤标志物单项诊断(P<0.05),略高于MRI检查,但对比差异无统计学意义(P>0.05),可能与纳入研究样本量较少有关。
综上所述,子宫颈癌患者血清SCCA、CA125、CA153、CYFRA211等肿瘤标志物较正常健康人上升明显,其中CA125对宫颈癌诊断阳性率较高,但其准确率均低于MRI筛查。可将MRI作为子宫颈癌筛查的首选手段,但对MRI无法明确诊断的Ⅰa期宫颈癌患者,可辅以肿瘤标志物检查,以提高宫颈癌诊断准确率。
[1]吴银花.血清肿瘤标志物与TCT联合对宫颈癌早期筛查的应用及预测意义[J].中国妇幼保健,2013,28(23):3852-3854.
[2]刘晓蓓,肖虎,刘文亚,等.MRI对宫颈癌的诊断及分期评价[J].实用放射学杂志,2012,28(9):1415-1419.
[3]覃飞,车锦连,薛元领,等.MRI在宫颈癌诊断及分期中的应用[J].广西医科大学学报,2013,30(2):258-260.
[4]程祝忠,任静,王闽,等.MRI动态增强成像对宫颈癌的诊断和分期价值[J].西部医学,2011,23(4):713-715.
[5]闫慧,薛冰.血清肿瘤标志物CA125、CEA联合检测在宫颈癌诊断中的临床价值[J].国际检验医学杂志,2016,37(1):134-135.
[6]苏晶,苏广龙.多种肿瘤标志物的联合检测对宫颈癌诊断及预后判断的临床价值[J].实用癌症杂志,2014,29(9):1089-1090,1104.
[7]刘馨,白艳香.肿瘤标志物联合检测与宫颈癌早期诊断的相关性[J].中国老年学杂志,2013,33(13):3155-3156.
[8]童红莉,李娟,温新宇,等.肿瘤标志物联合检测在宫颈癌诊断中的应用价值[J].标记免疫分析与临床,2011,18(3):160-162.
[9]张秋芳,连鹏.浸润性宫颈癌术前CT及MRI诊断的临床价值研究[J].中国CT和MRI杂志,2016,14(4):104-106,113.
[1 0]梁海霞,陈必良.磁共振成像技术在宫颈癌分期及治疗中的应用价值研究[J].中国全科医学,2011,14(21):2362-2366.
(本文编辑: 汪兵)
Clinical Value of Tumor Markers Combined with MRI in the Diagnosis of Cervical Cancer*
YAO Chun-hui, LI Bo, TAN Juan, et al., The Second People's Hospital of Kashi Region, Xinjiang 844000, China
Objective To investigate the clinical value of tumor markers combined with MRI in the diagnosis of cervical cancer. Methods Seventy-eight cases of patients with cervical cancer who were admitted to our hospital between April 2012 and June 2015 were enrolled in the study group, and 40 healthy persons were selected as control group at the same time. After admission, the fasting venous blood was collected. The levels of tumor markers squamous cell carcinoma antigen (SCCA), carbohydrate antigen 153 (CA153), carbohydrate antigen 125 (CA125), cytokeratin 21-1 (CYFRA211)] were determined. Meanwhile, all patients underwent MRI examination. With the results of pathological biopsy results as the golden standard, the clinical value of tumor markers, MRI and their combined diagnosis of cervical cancer was analyzed. Results The levels of serum SCCA, CA125, CA153 and CYFRA211 in the study group were higher than those in the control group (P<0.05). ARSI% of cervical cancer was higher than that of normal tissues (P<0.05), and there was no significant difference between the two groups in MRSI% (P>0.05). The positive rate of cervical cancer diagnosed by MRI (96.15%) was higher than that by tumor markers (P<0.05). The accuracy of tumor markers combined with MRI in the diagnosis of cervical cancer was higher than that of MRI, but there was no significant difference (P>0.05). Conclusion The levels of serum SCCA, CA125, CA153 and CYFRA21-1 in patients with cervical cancer are significantly higher, and CA125 is the most sensitive, but screening positive rate of tumor markers is lower than MRI. MRI can be used as an preferred means of screening for cervical cancer, and tumor markers can be taken as an adjuvant means.
MRI; Cervical Cancer; Tumor Marker; Diagnosis; Combined
R445.2;R737.33
A
国家自然科学基金项目(30860302;30660193)
10.3969/j.issn.1672-5131.2017.06.032
姚春慧
2017-04-26