外源Cd在不同品种水稻组织中的细胞分布和化学形态特征研究*
2017-06-12付铄岚王昌全张敬昇何玉亭曾杰熙
付铄岚,王昌全,李 冰,徐 强,张敬昇,李 萌,唐 杰,何玉亭,沈 杰,曾杰熙,严 勋
(四川农业大学资源学院 成都 611130)
外源Cd在不同品种水稻组织中的细胞分布和化学形态特征研究*
付铄岚,王昌全**,李 冰,徐 强,张敬昇,李 萌,唐 杰,何玉亭,沈 杰,曾杰熙,严 勋
(四川农业大学资源学院 成都 611130)
采用水培试验,以低镉(Cd)积累水稻品种‘D83A/R527’和高Cd积累水稻品种‘辐优838’为供试材料,设置3个Cd浓度(5 μmol·L-1、10 μmol·L-1、25 μmol·L-1)处理,从Cd亚细胞及化学形态分布角度研究了不同基因型水稻品种的Cd积累特性,为探讨水稻对Cd的吸收积累生理机制提供科学依据。结果表明:(1)水稻‘D83A/R527’的根系和茎叶Cd含量及根系-茎叶转移系数均显著低于‘辐优838’(P<0.05)。(2)两水稻根系各亚细胞组分中Cd含量表现为可溶部分(F3)>细胞壁(F1)>细胞器(F2),茎叶表现为细胞壁(F1)>可溶部分(F3)>细胞器(F2);‘D83A/R527’根系和茎叶细胞壁Cd的质量分数(36.76%~51.75%)高于‘辐优838’(31.29%~49.07%)。(3)两水稻品种 Cd化学形态含量均表现为氯化钠提取态(FNaCl-Cd)>醋酸提取态(FHAc-Cd)>去离子水提取态(FW-Cd)>乙醇提取态(FE-Cd)>盐酸提取态(FHCl-Cd);随 Cd处理浓度的增加,‘D83A/R527’根系 FE-Cd和FW-Cd(活性态Cd)质量分数逐渐下降(24.75%~18.34%),‘辐优838’活性态Cd逐渐上升(27.18%~28.68%),茎叶FHAc-Cd和 FHCl-Cd(惰性态 Cd)质量分数(32.41%~38.98%)逐渐上升且高于‘辐优 838’(28.44%~31.22%),‘D83A/R527’根系和茎叶 FNaCl-Cd质量分数(32.71%~51.17%)均高于‘辐优 838’(32.14%~47.63%)。综上,‘D83A/R527’水稻幼苗Cd积累量低;与‘辐优838’相比,‘D83A/R527’水稻幼苗根系和茎叶细胞壁质量分数较高,“活性态”Cd质量分数较低,“惰性态”Cd则更高,表明‘D83A/R527’水稻对Cd有更强的固持能力。
外源镉;水稻;亚细胞组分;化学形态;活性态镉;惰性态镉
水稻(Oryza sativa)是人类的主要粮食作物[1],保障稻米安全是我国目前粮食安全的重要课题[2]。镉(Cd)是“五毒”元素之一,迁移能力较强,易通过植物富集从而污染食物链[3]。水稻对Cd具有较强的富集能力,容易造成稻米含量超标从而危害人体健康[4]。近年来我国Cd污染农耕地已达1.3×104hm2,每年Cd污染农产品数量超过1.5×105t,涉及11个省市的25个地区[5]。大范围的农田Cd污染已经严重威胁到中国的粮食安全。因此降低水稻Cd吸收积累对保障我国粮食安全、提高人民生活品质具有重要的现实意义[6]。
水稻体内Cd积累受到根系的活化和吸收、细胞液泡区室化和滞留、木质部的装载和运输,以及茎叶之间的分配、韧皮部向籽粒中进一步迁移等多个生理过程影响[7]。研究表明,植物细胞壁上的纤维素、半纤维素和果胶等大分子物质能结合重金属进而将其固定[8],当植物细胞壁上的重金属结合位点饱和时,原生质中的重金属会被转运至液泡,与大量的有机配位体结合形成稳定态的螯合物并被储藏,降低细胞质中自由重金属离子的浓度[9];细胞液泡区室化过程与Cd化学形态密切相关[10],不同化学形态的Cd的迁移、活性又存在显著差异[11-12]。Howden等[13]研究发现,硫醇类结合态Cd与液泡区隔化有密切联系。目前对Cd亚细胞分布和化学形态的研究较多,但对比研究两者间相互影响效应的文献鲜有报道。因此,本文以前期试验中筛选出的Cd高积累水稻品种‘辐优838’和低积累水稻品种‘D83A/R527’为供试材料,设置3个不同Cd浓度(5 μmol·L-1、10 μmol·L-1、25 μmol·L-1)处理,通过水培试验,研究水稻幼苗Cd亚细胞分布和化学形态变化及其相互影响关系,为探讨水稻对Cd的吸收积累生理机制提供科学依据。
1 材料与方法
1.1 供试材料
试验于2015年5—7月在四川农业大学网室内进行。供试材料选取本课题组筛选籽粒Cd质量分数差异较大的2个常规水稻品种‘辐优838’(高Cd积累品种)和‘D83A/R527’(低Cd积累品种)为研究材料(四川农业大学水稻研究所提供)。
1.2 试验设计与处理
将精选的两水稻品种种子经30%H2O2消毒、洗净后育苗,10 d后将长势一致的幼苗移植于容积为15 L的黑色塑料桶中。塑料桶被木板分隔成4个区域,在每个区域分别套1个塑料袋,再放置1个底部由尼龙网包裹的直径约6 cm、高约5 cm去除底部的塑料杯,将其固定在适宜培养水稻的位置,每杯5株生长一致的株苗。将水稻培养于完全营养液中,营养液采用国际水稻研究所(IRRI)推荐的配方配制。营养液的起始pH为5.5~6.0。幼苗先在1/2浓度的营养液中培养7 d,然后进行全营养液培养和不同浓度的Cd处理。设置3个Cd处理水平:5 μmol·L-1、10 μmol·L-1和25 μmol·L-1,每个处理重复3次。营养液中Cd以CdCl2·2.5H2O形式加入。培养液每4 d更换一次,每天用0.1 mol·L-1NaOH或0.1 mol·L-1HCl调节pH至5.5~6.0。培养20 d收获。水稻根系先用自来水冲洗,再用去离子水冲洗几遍,再在 20 mmol·L-1Na2-EDTA中浸泡15 min,用以去除根系表面吸附的二价Cd离子,最后用纱布吸干表面水分。将根、叶分开后保存在-20℃冰箱中备用。
1.3 水稻幼苗亚细胞Cd含量的测定
亚细胞Cd含量的测定参考文献[14],并进行改进:分别称取水稻根、叶鲜样1.0 g左右,加入10 mL亚细胞提取液——Tris-HCl缓冲液(0.154 g·L-1DTT, 0.25 mol·L-1蔗糖溶液,pH 7.4,料液比1∶10),在冰浴上迅速研磨成匀浆,用漏斗、尼龙布过滤到离心管中,尼龙布上的残渣(即细胞壁部分,F1)装入三角瓶中;滤液装入离心管,在15 000 r×min-1下离心40 min,将上清液和沉淀分别倒入三角瓶中,则分别为可溶性部分(F3)、膜和细胞器部分(F2)。最后,分别向所用三角瓶中加4∶1的硝酸和高氯酸的混合酸10 mL(F2、F3)和20 mL(F1),待充分消化,消煮至澄清,蒸馏水定容,用MKii M6型石墨炉原子吸收光谱仪(美国Thermo Elemental公司生产)测定Cd含量。
1.4 水稻幼苗Cd的化学形态分析
化学形态的测定参考Wu等[14]的方法并进行改进。准确称取0.4 g根、茎叶干燥样品于100 mL的塑料离心管中,加入提取剂,样品与提取剂的比例为1∶100,在25℃恒温下浸泡22 h后,25℃恒温振荡机震荡1 h,5 000 r×min-1离心10 min,倒出上清液后,再加入10 mL的提取剂,振荡机振荡1 h,5 000 r×min-1离心10 min,倒出上清液。合并两次上清液于150 mL的三角瓶中,电炉上蒸发至近干,加入硝酸和高氯酸的混合液(4∶1)10 mL,待充分消解后,消煮至澄清,10%硝酸定容,用美国Thermo Elemental公司生产的MKii M6型石墨炉原子吸收光谱仪测定Cd的含量。采用下列5种提取剂逐步提取:(a)80%乙醇提取硝酸盐、氯化物为主的无机盐及氨基酸盐等,乙醇提取态Cd(FE-Cd);(b)去离子水提取水溶性有机酸盐、重金属的一代磷酸盐等,水溶性Cd(FW-Cd);(c)1 mol·L–1氯化钠提取果胶酸盐、与蛋白质结合态或呈吸附态的重金属等,氯化钠提取态(FNaCl-Cd);(d)2%醋酸提取难溶于水的重金属磷酸盐,包括二代磷酸盐、正磷酸盐,难溶性磷酸盐结合态Cd(FHAC-Cd);(e)0.6mol·L-1盐酸提取草酸盐,草酸结合态Cd(FHCl-Cd)等。
1.5 数据分析
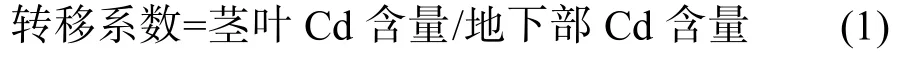
所有数据采用Microsoft Excel 2010进行数据汇总和统计,采用SPSS 19.0进行各个处理间差异显著性分析。
2 结果与分析
2.1 不同杂交水稻幼苗中的Cd含量及转移系数
图1显示,‘D83A/R527’根系和茎叶的Cd含量显著低于‘辐优838’(P<0.05)。各Cd浓度处理下,‘辐优838’茎叶Cd含量分别是‘D83A/R527’的1.42倍、1.93倍和1.79倍,根系Cd含量是‘D83A/R527’的1.32倍、1.60倍和1.49倍。两水稻品种Cd吸收累积特性差异在茎叶体现更明显。
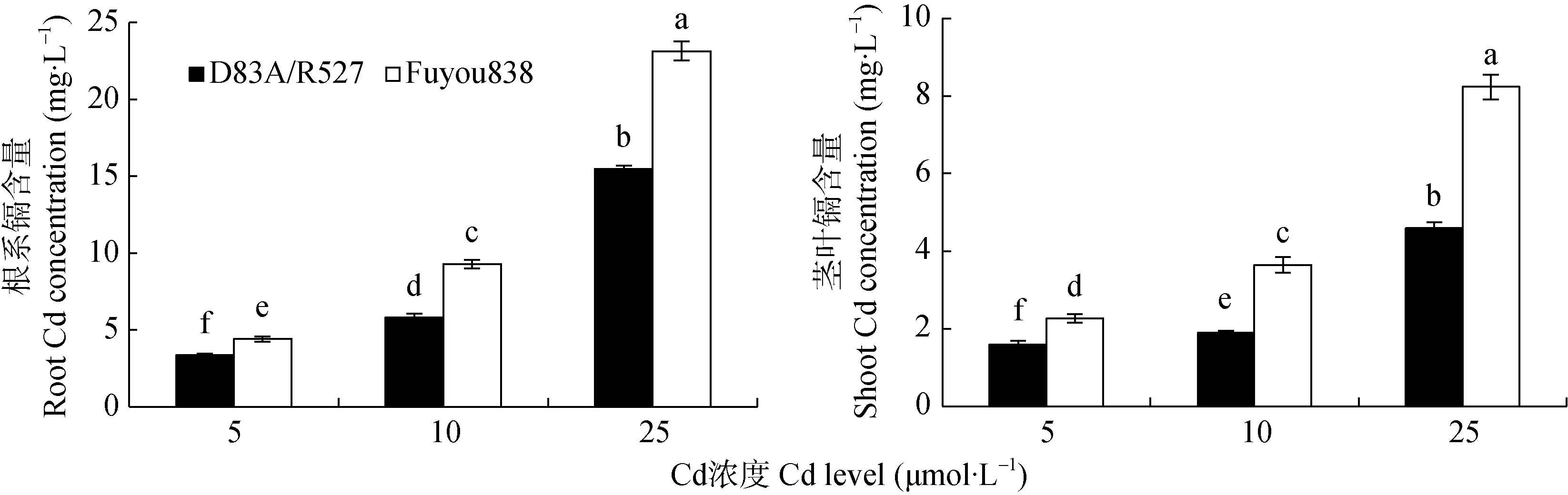
图1 不同Cd浓度处理对水稻品种‘D83A/R527’和‘辐优838’幼苗根系和茎叶Cd积累的影响Fig.1 Cadmium concentrations in roots and shoots of rice varieties‘D83A/R527’and‘Fuyou838’in different Cd levels
从图2可以看出,两个水稻品种的转移系数位于0.30~0.52,不同Cd浓度处理下,‘D83A/R527’转移系数均显著低于‘辐优 838’(P<0.05),表明‘D83A/R527’对Cd的转运能力较差,能减少Cd从根系到茎叶的运输。25 μmol·L-1处理时,两水稻转移系数最低,表明在高Cd浓度处理下根系对Cd的固持能力更强。
2.2 不同Cd浓度下水稻幼苗中Cd的亚细胞分布
如表1所示,不同浓度Cd胁迫下,两水稻品种根系亚细胞Cd含量分布均表现为可溶部分(F3)最多,细胞壁(F1)次之,细胞器(F2)最少。两水稻品种对比来看,‘辐优838’的F3 Cd含量均最高;5 μmol·L-1Cd处理下,‘D83A/R527’的F3 Cd含量显著高于‘辐优838’中F1的Cd含量,在10 μmol·L-1、25 μmol·L-1Cd浓度处理下则相反。不同Cd浓度下,‘D83A/R527’根系F1和F3中Cd质量分数高于‘辐优838’(图3),细胞器Cd质量分数低于‘辐优838’,表明Cd对‘D83A/R527’根细胞的生命活动影响较小。随着Cd处理浓度的增加,‘辐优838’根系细胞壁Cd质量分数逐渐下降(32.55%~31.29%),‘D83A/R527’细胞壁Cd质 量 分 数 逐 渐 上 升 (36.76%~38.55%),表 明‘D83A/R527’根系将Cd固定在细胞壁的能力强于‘辐优838’。
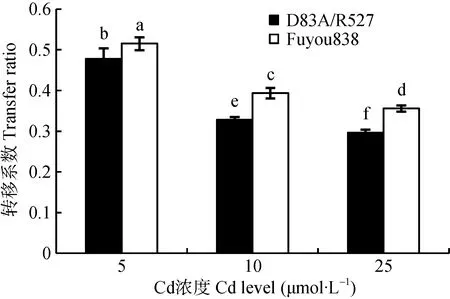
图2 不同Cd浓度处理对水稻品种‘D83A/R527’和‘辐优838’幼苗根系-茎叶的Cd转移系数的影响Fig.2 Cadmium transfer ratios of rice varieties‘D83A/R527’and‘Fuyou838’in different Cd levels treatments
表1 不同Cd浓度处理下水稻品种‘D83A/R527’和‘辐优838’幼苗中Cd的亚细胞分布Table 1 Subcellular distribution of cadmium in seedlings rice varieties‘D83A/R527’and‘Fuyou838’in different Cd levels
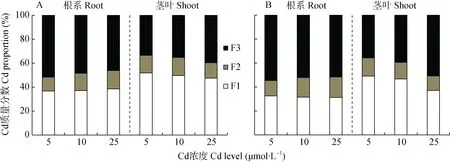
图3 不同Cd浓度处理下水稻品种‘D83A/R527’(A)和‘辐优838’(B)幼苗根系和茎叶中Cd的亚细胞质量分数Fig.3 Proportions of cadmium in subcellular fractions of roots and shoots of rice varieties‘D83A/R527’(A)and‘Fuyou838’(B)in different Cd levels treatments
水稻幼苗茎叶Cd亚细胞分布与根系有较大差异。5 μmol·L-1、10 μmol·L–1Cd浓度处理下,‘辐优838’F1的Cd含量最高,F3的Cd含量次之;25 μmol·L–1Cd处理时,‘辐优838’中F3的Cd含量最高,F1次之。不同Cd浓度下,‘D83A/R527’中Cd含量F1>F3>F2。随着Cd处理浓度的增加,‘D83A/R527’根系和茎叶Cd亚细胞含量上升幅度小于‘辐优838’,表现低Cd积累特征。各Cd浓度处理下,两水稻品种的茎叶表现为细胞壁Cd质量分数最高,且‘D83A/R527’细胞壁质量分数(51.75%~47.52%)高于‘辐优838’(49.07%~37.05%),表明‘D83A/R527’能将大部分的Cd积累在细胞壁中。
2.3 不同Cd浓度下水稻幼苗中Cd的化学形态分布
不同Cd浓度胁迫下,水稻幼苗中不同Cd化学形态含量分布如表2所示。随Cd浓度增加,不同Cd化学形态含量均上升,‘辐优838’各Cd化学形态含量均高于‘D83A/R527’。同一Cd浓度同一品种根系各Cd化学形态含量差异显著,具体表现为氯化钠提取态(FNaCl-Cd)>醋酸提取态(FHAc-Cd)>去离子水提取态(FW-Cd)>乙醇提取态(FE-Cd)>盐酸提取态(FHCl-Cd)。茎叶部分各Cd化学形态与根系略有不同,5 μmol·L-1Cd浓度处理下,‘辐优838’中FE-Cd、FW-Cd差异不显著, FNaCl-Cd最高,FHAc-Cd次之,FHCl-Cd最低;25 μmol·L-1Cd浓度处理下,FNaCl-Cd、FHAc-Cd最高,其余各Cd化学形态含量差异显著,具体表现为 FW-Cd> FE-Cd>FHCl-Cd。总的来说不同Cd浓度处理下,两水稻品种根系和茎叶Cd均以FNaCl-Cd、FHAc-Cd、FW-Cd占主导地位,不同Cd浓度下两个品种3种形态的Cd含量平均值在根系中分别占47.73%、23.35%、15.74%,在茎叶中分别占34.63%、29.49%和18.83%。相反, FE-Cd以及FHCl-Cd含量相对较低,在不同浓度处理下两品种根系Cd含量平均值分别占9.37%、3.80%,茎叶分别占14.16%、2.89%。
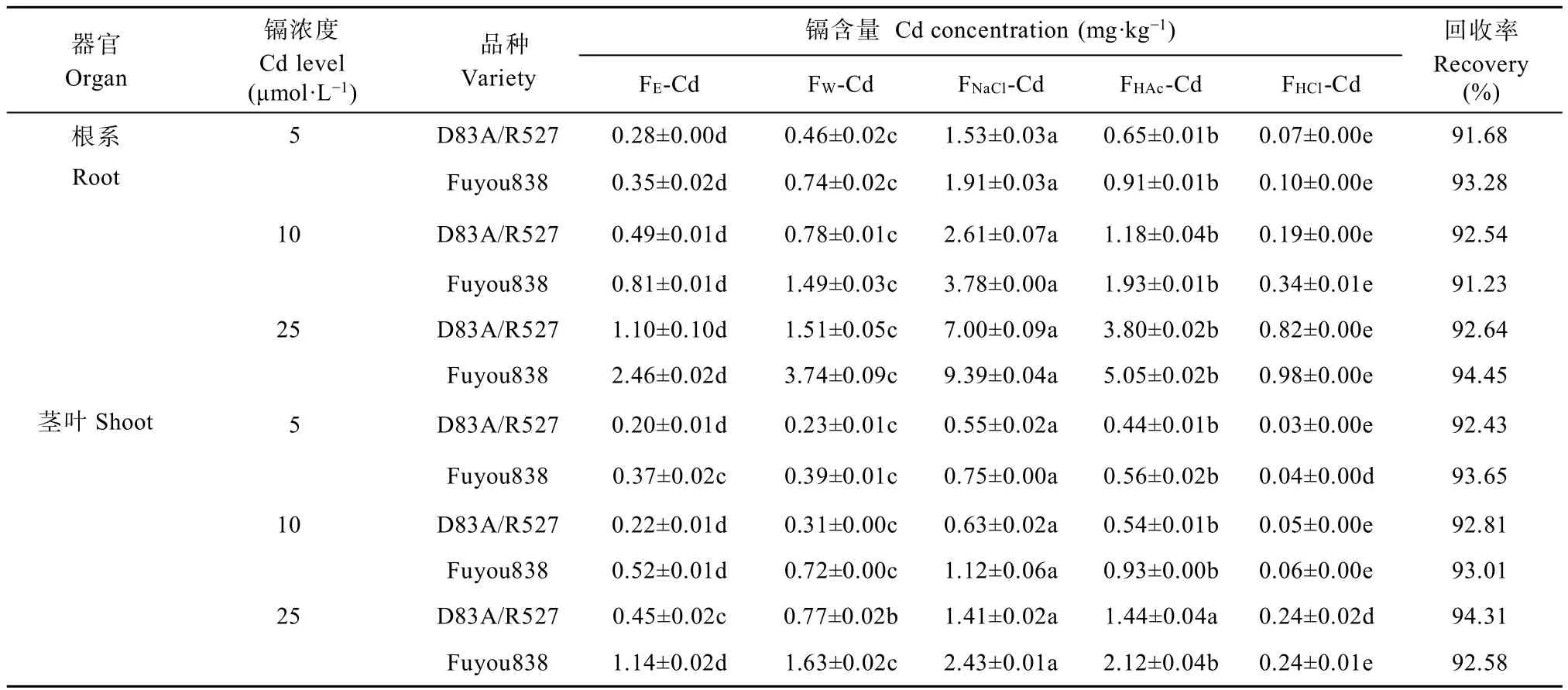
表2 不同Cd浓度处理下水稻幼苗中Cd的化学形态分布Table 2 Cd contents in different extraction forms of rice seedlings of different varieties in different Cd levels treatments
如图4所示,随着Cd浓度上升,‘D83A/R527’根系FE-Cd和 FW-Cd分配比例总体呈下降趋势(24.75%~18.34%),‘辐 优 838’则 呈 上 升 趋 势(27.18%~28.68%)。5 μmol·L-1、10 μmol·L-1Cd浓度下,‘D83A/R527’中 FHAc-Cd和 FHCl-Cd总体分配比例(24.08%、26.10%)低于‘辐优838’(25.19%、27.19%),在25 μmol·L-1浓度处理下‘D83A/R527’中FHAc-Cd和FHCl-Cd分配比例之和(32.47%)高于‘辐优838’(27.89%),表明随Cd浓度增加,相对‘辐优838’来说‘D83A/R527’根系被固定的 Cd逐渐增加。不同浓度处理下,‘D83A/R527’茎叶中FHAc-Cd和FHCl-Cd总体分配比例(32.41%~38.98%)逐渐增加,且均高于‘辐优838’(28.44%~31.22%);FW-Cd和FE-Cd总体分配比例(30.29%~28.31%)低于‘辐优838’(37.01%~36.02%),表明‘D83A/R527’茎叶中Cd逐渐向移动性较弱形态的转化能力强于‘辐优838’,降低Cd对水稻幼苗生理生化过程的干扰。两水稻幼苗中,FNaCl-Cd所占比例最高,且随着浓度增加均呈下降趋势,表明不同Cd处理浓度下FNaCl-Cd可能在水稻Cd积累和解毒过程中起重要作用, FNaCl-Cd在根系的分布影响水稻幼苗Cd的积累。
3 讨论
3.1 不同杂交水稻品种幼苗Cd吸收转运差异分析
Cd因其剧烈的生物毒性,对作物生理性能、产量和品质等影响极大[15]。本研究表明,水稻低镉积累品种‘D83A/R527’Cd含量显著低于高镉积累品种‘辐优838’,表明其受到Cd毒害较小。转移系数反映植物将重金属从根系转运到茎叶能力的强弱,转移系数越大,表明其转运重金属的能力越强[16-17]。本研究结果表明‘D83A/R527’将Cd从地下部转移到茎叶的能力显著低于‘辐优838’,表明根系对Cd的截留能力更强,降低了Cd通过可食部位进入食物链的风险。这可能是因为不同基因型水稻幼苗化学形态以及亚细胞分布的不同,从而导致其对Cd吸收转移能力的差异。
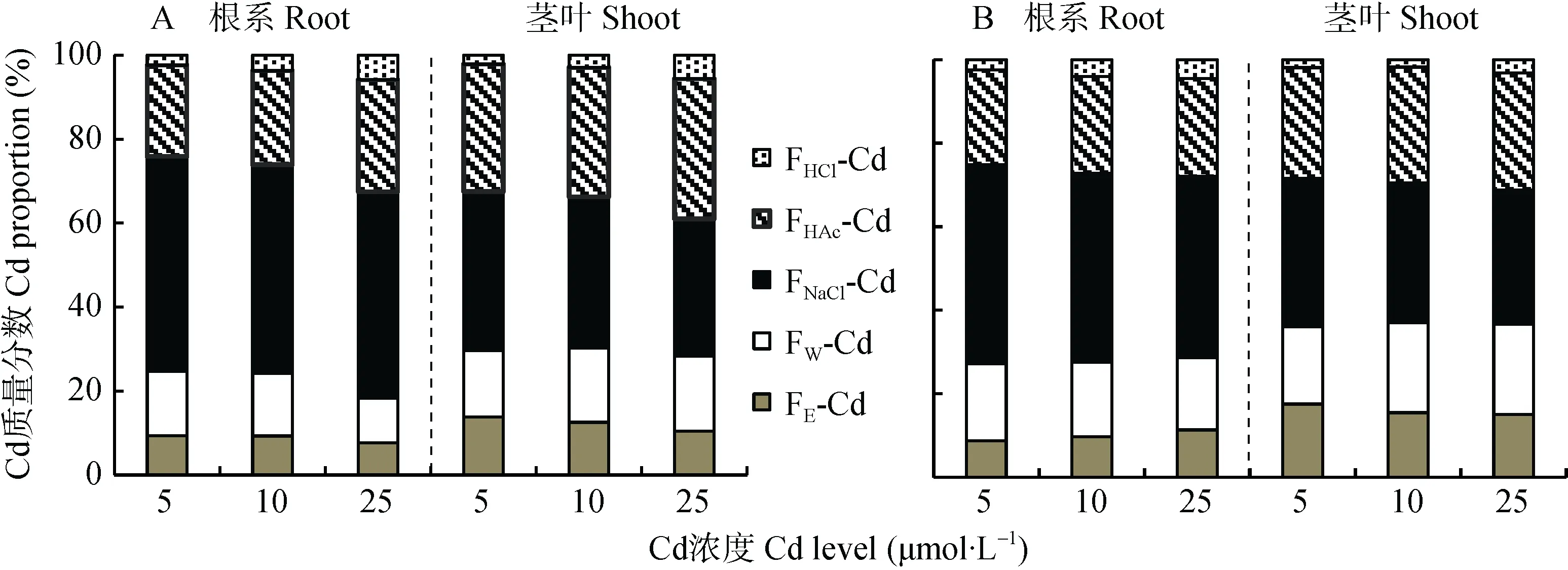
图4 不同Cd处理浓度下水稻品种‘D83A/R527’(A)和‘辐优838’(B)幼苗根系和茎叶中Cd的化学形态分布Fig.4 Proportions of Cd in different chemical forms of roots and shoots of rice varieties‘D83A/R527’(A)and‘Fuyou838’(B)in different Cd levels treatments
3.2 不同杂交水稻幼苗中Cd的亚细胞分布
根是植物抵制重金属毒害的第一道屏障[18],而细胞壁作为原生质体的第一道保护膜[19],是保护原生质体不受重金属毒害的第一道屏障[20]。Cd被植物根系吸收后,带正电的Cd离子被细胞壁中带负电的亲Cd物质所吸附固定[10],可以有效地减少细胞内游离的Cd离子[21]。本研究中,‘D83A/R527’根系细胞壁所占比例显著高于‘辐优838’,表明‘D83A/R527’根系细胞壁对Cd具有更强的固持能力,这是根部一个重要的亚细胞机制,导致不同基因型水稻品种茎叶Cd的积累差异,相似的结果在蚕豆(Nasturtium officinaleL.R.Br.)[22]、小白菜(Brassica chinensisL.)[19]中均有报道。细胞壁的固定作用是应对Cd胁迫程度增大时的首要应对机制,张雯等[23]研究显示, Cd在不同处理条件下,细胞壁组分百分含量均表现为高Cd浓度>低Cd浓度。研究表明,植物吸收Cd后,将其大部分储存于根系可溶部分,其次是细胞壁,如小麦根系可溶部分Cd含量占58.5%~63.4%[24],辣椒(Capsicum annuumL.)根系可溶部分Cd含量占77%~87%[25]。本试验也有类似结果,根系可溶部分Cd含量最高为46.12%~52.13%,其次为细胞壁(31.29%~38.55%)。‘D83A/R527’根系可溶部分Cd百分含量低于‘辐优838’,这是引起‘D83A/R527’的转移系数比‘辐优838’低的原因,与Yu等[26]报道低镉基因型水稻转移系数低于高镉基因型水稻类似。细胞壁因没有足够多的功能性多糖(如纤维素、半纤维素,果胶等),其固定Cd的能力有限[27],当Cd胁迫浓度增强时,细胞壁的Cd固定能力不足以阻止Cd进入原生质[22],原生质的Cd大部分又被转移到液泡。Sylwia等[28]研究结果显示,野生烟草(Nicotiana tabacumL.)植物液泡中的Cd占原生质中Cd的92%。由此可看出,细胞壁和液泡是植物Cd积累的主要部位。本试验结果显示Cd大部分结合在细胞壁和可溶部分,与前人结果一致。随着Cd胁迫浓度增加,各亚细胞组分Cd总量也增加。‘辐优838’各亚细胞组分在3个浓度下增加幅度大部分均高于‘D83A/R527’,表现出高Cd积累特性。
3.3 Cd在不同杂交水稻幼苗中的化学形态分布
植物体内的重金属活性、毒性和迁移能力与重金属在植物体内的化学形态有关[15]。不同化学提取剂提取不同化学形态Cd,无机态Cd(FE-Cd,用80%乙醇提取)和水溶性Cd(FW-Cd,用去离子水提取)有较高迁移能力,对植物细胞毒性较大,通常称为“活性态”;难溶性磷酸盐结合态Cd(FHAC-Cd,用2%冰醋酸提取)和草酸结合态Cd(FHCl-Cd,0.6 mol·L-1HCl提取)较难移动,通常活性相对较低,毒性小,称为“惰性态”[15,21]。本试验结果显示,在高Cd浓度下,‘D83A/R527’根系“活性态”Cd含量以及百分含量低于‘辐优838’,“惰性态”Cd百分比例高于‘辐优838’,表明‘D83A/R527’根系吸收积累的Cd相对‘辐优838’难以移动。两种水稻中,醋酸提取态和盐酸提取态总体分配比例随着Cd胁迫的增大而增加,表明这两种化学形态与Cd解毒作用有关。“活性态”Cd比其他形态的Cd更易从根系向茎叶运输,这也可以解释为什么‘辐优838’转移系数高于‘D83A/R527’,相似结果在小白菜中也有相关报道[21]。
Cd与果胶/蛋白质结合(即果胶/蛋白结合态,也称为氯化钠提取态,由1 mol·L-1NaCl溶液提取)可能是耐Cd植物低镉积累的重要过程[21]。Wu和Clemens等报道[14,29],植物螯合肽(PCs)是一种谷胱甘肽,与植物Cd的吸收、转运、解毒有关。与Qiu等[21]研究结果类似,本试验所有Cd化学形态中,氯化钠提取态Cd的百分比例最高,表明其与水稻幼苗Cd吸收、转运、解毒有关。
已有研究报道,Cd的亚细胞分布与Cd在植物体内的化学形态存在必然联系。Jiang等[30]研究表明,难溶性磷酸盐结合态Cd位于细胞壁上,果胶/蛋白质结合态Cd主要位于液泡[21]。本试验结果与该结论吻合,两水稻幼苗根系可溶部分Cd含量百分比与氯化钠提取态Cd含量百分比均最高,细胞壁、难溶性磷酸盐结合态Cd均仅次之,类似结果报道也见于蚕豆的研究中[22]。PCs在植物镉耐性中起关键作用[29]。Cd进入原生质后,低分子量的PC-Cd配合物可进入液泡,然后在液泡中与S2-合成高分子PC-Cd螯合物,最终形成细胞内Cd的区隔化,因此,低Cd积累品种中果胶/蛋白质结合态Cd的百分含量高于高Cd积累品种[21]。这可能与低Cd积累品种中Cd流动性低有关。
4 结论
与‘辐优838’相比,‘D83A/R527’水稻Cd积累量低,且具有较低的Cd转移特性。亚细胞分析表明,‘D83A/R527’各亚细胞Cd含量均低于‘辐优838’,其根系细胞壁质量分数高于‘辐优838’,可溶部分和细胞器质量分数低于‘辐优838’,茎叶可溶部分Cd质量分数低于‘辐优838’,表明‘D83A/R527’根系截留Cd的能力更强,向地上部转移的Cd更低。化学形态结果显示‘D83A/R527’幼苗“惰性态”Cd质量分数高于‘辐优838’,“活性态”Cd质量分数低于‘辐优838’,表明‘D83A/R527’体内Cd较‘辐优838’更难迁移。
氯化钠提取态(果胶/蛋白质结合态)在两水稻品种中所占质量分数最高,是水稻体内重要的Cd解毒形态。‘D83A/R527’水稻Cd积累量低,根系细胞壁对Cd截留能力强;其根系“活性态”Cd质量分数低于‘辐优838’,茎叶“活性态”Cd质量分数低于‘辐优838’且“惰性态”Cd分配比例更高,从而‘D83A/R527’水稻对Cd的固持能力强于‘辐优838’。
References
[1]沙之敏,袁婧,赵峥,等.水稻种植模式对水稻籽粒离子组的影响[J].中国生态农业学报,2016,24(5):600–607 Sha Z M,Yuan J,Zhao Z,et al.Ionome of rice seed response to rice cultivation patterns[J].Chinese JournalofEco-Agriculture,2016,24(5):600–607
[2]李虹颖,唐杉,王允青,等.硒对水稻镉含量及其在亚细胞中的分布的影响[J].生态环境学报,2016,25(2): 320–326 Li H Y,Tang S,Wang Y Q,et al.Mechanism of Se on Cd contentand subcelldistribution in rice[J].Ecology and Environmental Sciences,2016,25(2):320–326
[3]吴朝波,王蕾,郭建春,等.镉在海雀稗体内的分布及化学形态特征[J].环境化学,2016,35(2):330–336 Wu C B,Wang L,Guo J C,et al.Distribution and chemical forms of Cd inPaspalum vaginatumSW.[J].Environmental Chemistry,2016,35(2):330–336
[4]尹洁,赵艳玲,徐莜,等.锌对粳稻幼苗镉吸收转运特性的影响[J].农业环境科学学报,2016,35(5):834–841 Yin J,Zhao Y L,Xu Y,et al.Effects of zinc supply on absorption and translocation of cadmium in rice seedlings[J]. Journal of Agro-Environment Science,2016,35(5):834–841
[5]徐良将,张明礼,杨浩.土壤重金属镉污染的生物修复技术研究进展[J].南京师大学报:自然科学版,2011,34(1): 102–106 XuL J,ZhangM L,YangH.Research progressof bioremediation technology ofcadmium polluted soil[J]. JournalofNanjing NormalUniversity:NaturalScience Edition,2011,34(1):102–106
[6]李冰,王昌全,李枝,等.Cd胁迫下杂交水稻对Cd的吸收及其动态变化[J].生态环境学报,2014,23(2):312–316 Li B,Wang C Q,Li Z,et al.Absorption of Cd by hybrid rice under the Cd stress and its dynamic change[J].Ecology and Environmental Sciences,2014,23(2):312–316
[7]李鹏,葛滢,吴龙华,等.两种籽粒镉含量不同水稻的镉吸收转运及其生理效应差异初探[J].中国水稻科学,2011, 25(3):291–296 Li P,Ge Y,Wu L H,et al.Uptake and translocation of cadmium and its physiological effects in two rice cultivars differed in grain cadmium concentration[J].Chinese Journal of Rice Science,2011,25(3):291–296
[8]Francine M K,Louise W A,Pythagore F S,et al.Antioxidant properties of cell wall polysaccharides ofStevia rebaudianaleaves[J].Journal of Coastal Life Medicine,2014,2(12): 962–969
[9]Brunetti P,Zanella L,De Paolis A,et al.Cadmium-inducible expression of the ABC-type transporterAtABCC3increases phytochelatin-mediated cadmium tolerance inArabidopsis[J]. Journal of Experimental Botany,2015,66(13):3815–3829
[10]黄白飞,辛俊亮.植物积累重金属的机理研究进展[J].草业学报,2013,22(1):300–307 Huang B F,Xin J L.Mechanisms ofheavy metal accumulation in plants:A review[J].Acta Prataculturae Sinica,2013,22(1):300–307
[11]Devriese M,Tsakaloudi V,Garbayo L,et al.Effect of heavy metals on nitrate assimilation in the eukaryotic microalgaChlamydomonasreinhardtii[J]. Plant Physiology and Biochemistry,2001,39(5):443–448
[12]Hart J J,Welch R M,Norvell W A,et al.Characterization of cadmium binding, uptake, and translocation in intact seedlings ofbread and durum wheatcultivars[J].Plant Physiology,1998,116(4):1413–1420
[13]Howden R,Goldsbrough P B,Andersen C R,etal. Cadmium-sensitive,cad1mutants ofArabidopsis thalianaare phytochelatin deficient[J].Plant Physiology,1995,107(4): 1059–1066
[14]Wu F B,Dong J,Qian Q Q,et al.Subcellular distribution and chemical form of Cd and Cd-Zn interaction in different barley genotypes[J].Chemosphere,2005,60(10):1437–1446
[15]白雪,陈亚慧,耿凯,等.镉在三色堇中的积累及亚细胞与化学形态分布[J].环境科学学报,2014,34(6):1600–1605 Bai X,Chen Y H,Geng K,et al.Accumulation,subcellular distribution and chemicalformsofcadmium inViola tricolorL.[J].Acta Scientiae Circumstantiae,2014,34(6): 1600–1605
[16]李云,张世熔,张少卿,等.野茼蒿对镉的富集及其镉耐性[J].农业环境科学学报,2012,31(7):1296–1302 Li Y,Zhang S R,Zhang S Q,et al.Cadmium tolerance and accumulation characteristics ofCrassocephalum crepidioides[J].Journal of Agro-Environment Science,2012, 31(7):1296–1302
[17]陆仲烟,刘仲齐,宋正国,等.大麦中镉的亚细胞分布和化学形态及PCs合成的基因型差异[J].农业环境科学学报, 2013,32(11):2125–2131 Lu Z Y,Liu Z Q,Song Z G,et al.Subcellular distribution and chemical forms of Cd and the synthesis of Phytochelatins (PCs) in different barley genotypes[J]. Journal of Agro-Environment Science,2013,32(11):2125–2131
[18]曲荣辉,张曦,李合莲,等.不同锌水平对低剂量镉在水稻中迁移能力的影响[J].中国生态农业学报,2016,24(4): 517–523 Qu R H,Zhang X,Li H L,et al.Effects of zinc level on low dose cadmium transport in rice plant[J].Chinese Journal of Eco-Agriculture,2016,24(4):517–523
[19]Xue M,Zhou Y H,Yang Z Y,et al.Comparisons in subcellular and biochemical behaviors of cadmium between low-Cd and high-Cd accumulation cultivarsofpakchoi (BrassicachinensisL.)[J]. Frontiers of Environmental Science&Engineering,2014,8(2):226–238
[20]Fan J L,Wei X Z,Wan L C,et al.Disarrangement of actin filaments and Ca2+gradient by CdCl2alters cell wall construction inArabidopsis thalianaroot hairs by inhibiting vesicular trafficking[J].Journal of Plant Physiology,2011, 168(11):1157–1167
[21]Qiu Q,Wang Y T,Yang Z Y,et al.Effects of phosphorus supplied in soil on subcellular distribution and chemical formsofcadmium in two Chinese flowering cabbage (Brassica parachinensisL.)cultivars differing in cadmium accumulation[J].Food and Chemical Toxicology,2011,49(9): 2260–2267
[22]Wang J B,Su L Y,Yang J Z,et al.Comparisons of cadmium subcellular distribution and chemical forms between low-Cd and high-Cd accumulation genotypes of watercress (Nasturtium officinaleL.R.Br.)[J].Plant and Soil,2015, 396(1/2):325–337
[23]张雯,林匡飞,周健.不同硫浓度下叶面施硒对水稻幼苗镉的亚细胞分布及化学形态的影响[J].农业环境科学学报, 2014,33(5):844–852 Zhang W,Lin K F,Zhou J.Effects of selenium foliar spray on subcellular distribution and chemical forms of cadmium in rice seedlings in differentsulfurconcentrations[J]. Journal of Agro-Environment Science, 2014, 33(5): 844–852
[24]万敏,周卫,林葆.镉积累不同类型的小麦细胞镉的亚细胞和分子分布[J].中国农业科学,2003,36(6):671–675 Wan M,Zhou W,Lin B.Subcelluarand molecular distribution of cadmium in two wheat genotypes differing in shoot/root Cd partitioning[J].Scientia Agricultura Sinica, 2003,36(6):671–675
[25]Xin J L,Huang B F.Subcellular distribution and chemical forms of cadmium in two hot pepper cultivars differing in cadmium accumulation[J].Journal of Agricultural and Food Chemistry,2014,62(2):508–515
[26]Yu H,Xiang Z X,Zhu Y,et al.Subcellular and molecular distribution of cadmium in two rice genotypes with different levels of cadmium accumulation[J].Journal of Plant Nutrition, 2012,35(1):71–84
[27]Fu X P,Dou C M,Chen Y X,et al.Subcellular distribution and chemical forms of cadmium inPhytolacca americanaL.[J].Journal of Hazardous Materials,2011,186(1):103–107
[28]Sylwia W,Anna R,Ewa B,et al.The role of subcellular distribution of cadmium and phytochelatins in the generation of distinct phenotypes of AtPCS1-and CePCS3-expressing tobacco[J].JournalofPlantPhysiology,2010,167(12): 981–988
[29]Clemens S.Toxic metal accumulation,responses to exposure and mechanisms of tolerance in plants[J].Biochimie,2006, 88(11):1707–1719
[30]Jiang H M,Yang J C,Zhang J F.Effects of external phosphorus on the cell ultrastructure and the chlorophyll content of maize under cadmium and zinc stress[J]. Environmental Pollution,2007,147(3):750–756
Histocyte distribution and cadmium forms in different rice cultivar seedlings with exogenous cadmium supply*
FU Shuolan,WANG Changquan**,LI Bing,XU Qiang,ZHANG Jingsheng,LI Meng,TANG Jie, HE Yuting,SHEN Jie,ZENG Jiexi,YAN Xun
(College of Resources,Sichuan Agricultural University,Chengdu 611130,China)
A hydroponic experiment was conducted to study cadmium(Cd)accumulation characteristics in different rice genotypes—lowCd accumulation(‘D83A/R527’)and high Cd accumulation(‘Fuyou838’).The subcellular distribution and chemical forms of Cd in the root and shoot of different rice genotypes were investigated after exposure to Cd concentrations of 5 μmol·L-1,10 μmol·L-1and 25 μmol·L-1.The aim of the study was to explore subcellular distribution and chemical forms change of Cd in rice to provide reference for research on Cd absorption mechanisms of rice.The results showed that:1)the concentrations of Cd in roots and shoots and the transfer rate in‘D83A/R527’were significantly lower than those in‘Fuyou838’(P<0.05).2)The contents of Cd in subcellular fractions of two rice cultivars were in the orders of soluble fraction(F3)>cell wall(F1)>organelle(F2)in roots,but cell wall(F1)>soluble fraction(F3)>organelle(F2)in shoots.The proportions of Cd in cell walls(36.76%-51.75%)in both roots and shoots of‘D83A/R527’were higher than those in‘Fuyou838’(31.29%-49.07%).3)The order of contents of Cd chemical forms revealed by different processing methods was sodium chloride extraction state(FNaCl-Cd)>acetic acid extractable state(FHAc-Cd)> deionized water extraction(FW-Cd)>ethanol extracted state(FE-Cd)>HCl extractable state(FHCl-Cd)in both cultivars.When Cd concentration increased,the proportions of FE-Cd and FW-Cd(active forms)from root of‘D83A/R527’declined gradually (24.75%-18.34%),but increased gradually in‘Fuyou838’(27.18%-28.68%).The percentages of FHAC-Cd and FHCl-Cd(inertia forms) in shoot of‘D83A/R527’(32.41%-38.98%)were higher than those in‘Fuyou838’(28.44%-31.22%).The proportions of FNaCl-Cd in both root and shoot of‘D83A/R527’(32.71%-51.17%)were higher than those in‘Fuyou838’(32.14%-47.63%).In short,Cd accumulation in‘D83A/R527’was lower than that in‘Fuyou838’.Then cell wall mass fractions of both root and shoot systems were higher in‘D83A/R527’than that in‘Fuyou838’.Also there was lower accumulation of active forms of Cd and higher accumulation of inertia forms of Cd in‘D83A/R527’than that in‘Fuyou838’.Therefore,rice cultivar‘D83A/R527’had a better Cd fixation capacity than‘Fuyou838’.
Exogenous cadmium;Rice;Subcellular distribution;Chemical form;Active form of cadmium;Inertia form of cadmium
Nov.19,2016;accepted Dec.20,2016
X171.5
A
1671-3990(2017)06-0903-08
10.13930/j.cnki.cjea.161041
付铄岚,王昌全,李冰,徐强,张敬昇,李萌,唐杰,何玉亭,沈杰,曾杰熙,严勋.外源Cd在不同品种水稻组织中的细胞分布和化学形态特征研究[J].中国生态农业学报,2017,25(6):903-910
Fu S L,Wang C Q,Li B,Xu Q,Zhang J S,Li M,Tang J,He Y T,Shen J,Zeng J X,Yan X.Histocyte distribution and cadmium forms in different rice cultivar seedlings with exogenous cadmium supply[J].Chinese Journal of Eco-Agriculture, 2017,25(6):903-910
* 国家科技支撑计划项目(2012BAD14B18)和四川省科技支撑计划(2013NZ0028)资助
**通讯作者:王昌全,主要从事土壤与环境可持续的研究。E-mail:w.changquan@163.com
付铄岚,主要从事土壤质量与农产品安全的研究。E-mail:roxannyfu@163.com
2016-11-19 接受日期:2016-12-20
* This study was supported by the National Key Technologies R&D Program of China(2012BAD14B18)and the Key Technologies R&D Program of Sichuan Province(2013NZ0028).
**Corresponding author,E-mail:w.changquan@163.com
