趋化因子CXCL14在SLE患者外周血单个核细胞中的表达及启动子甲基化分析*
2017-06-12王金丹黄茜茜叶璐璐范超凡郭刚强徐玲娟薛向阳盛秀胜
王金丹, 黄茜茜, 叶璐璐, 范超凡, 郭刚强, 徐玲娟, 薛向阳, 盛秀胜
(1. 温州医科大学检验医学院、生命科学院, 2. 温州医科大学第二临床医学院,3. 温州医科大学微生物学和免疫学教研室,分子病毒与疫苗研究所,热带医学研究所, 浙江 温州 325035;4. 金华市中医医院检验科, 5. 金华职业技术学院医学院, 浙江 金华 321017)
趋化因子CXCL14在SLE患者外周血单个核细胞中的表达及启动子甲基化分析*
王金丹1, 黄茜茜2, 叶璐璐3, 范超凡2, 郭刚强3, 徐玲娟4, 薛向阳3, 盛秀胜5△
(1. 温州医科大学检验医学院、生命科学院, 2. 温州医科大学第二临床医学院,3. 温州医科大学微生物学和免疫学教研室,分子病毒与疫苗研究所,热带医学研究所, 浙江 温州 325035;4. 金华市中医医院检验科, 5. 金华职业技术学院医学院, 浙江 金华 321017)
目的:分析趋化因子CXCL14在系统性红斑狼疮(SLE)患者外周血单个核细胞(PBMC)中的表达及其启动子甲基化特征。方法:收集28例SLE患者和20名健康人外周血单个核细胞(PBMC)标本,抽提细胞中RNA,逆转录后,以GAPDH为内参,通过定量PCR检测PBMC中CXCL14的表达,统计分析CXCL14表达水平与SLE各种临床资料的相关性,探讨PBMC中CXCL14表达与SLE的关系,通过重亚硫酸盐修饰的全基因组DNA用以BSP测序来明确不同标本中CXCL14启动子中甲基化位点的甲基化率。结果:CXCL14在SLE患者和正常人PBMC中的表达量存在显著差异(P<0.05)。与健康人PBMC中CXCL14的含量相比较,CXCL14在SLE患者PBMC中表达量显著降低。与进一步CXCL14表达水平与SLE各种临床资料的相关性分析显示,CXCL14表达水平与SSB抗体(干燥综合征B抗体)、蛋白尿及血小板计数相关。与SSB抗体阴性SLE患者比较,SSB抗体阳性患者CXCL14表达水平更低(P<0.05);与蛋白尿阴性SLE患者相比,蛋白尿阳性患者CXCL14表达水平更低(P<0.05);而血小板升高患者的CXCL14表达水平更高(P<0.05)。CXCL14表达水平与SLE活动、肾损害指标、抗ds-DNA、C反应蛋白(CRP)、补体C3水平等指标未见显著相关性。CXCL14启动子区甲基化分析显示,SLE患者CpG岛甲基化明显高于正常对照。结论:PBMC中低表达的CXCL14与SLE发生发展相关,其启动子区CpG岛过度甲基化是SLE患者CXCL14低表达的重要机制。
系统性红斑狼疮;趋化因子;CXCL14;甲基化
系统性红斑狼疮(systemic lupus erythematosus, SLE) 是一种以多系统损害伴多种自身抗体形成为特征的自身免疫性疾病,其共同病理特征为炎症细胞(特别是单核细胞和淋巴细胞) 在受累组织或器官的浸润。研究表明,趋化因子(chemokine)对特异白细胞的趋化和功能活化是启动与自身免疫反应有关病变的关键步骤之一。CXC趋化因子配体14(chemokine CXC ligand 14,CXCL14)是CXC趋化因子家族的一员。作为ELR((Glu-Leu-Argmotifimmediately prior) )趋化因子家族中的一员,CXCL14具有抗血管生成,趋化自然杀伤细胞、B细胞、巨噬细胞、单核细胞核和不成熟的树突状细胞等多种功能[1-5]。关于CXCL14表达与SLE关系迄今尚未有文献报道。为此,本研究分析SLE患者外周血单个核细胞(PBMC)中CXCL14表达水平及其意义。
1 材料与方法
1.1 临床资料
本研究共计收集自2011年3月至2012年5月在温州医科大学附属第一医院确认收治确诊的SLE患者28例,男4例,女24例,年龄18~45岁,平均(34.46±12.15)岁。其中所有SLE患者均进行了常见临床症状调查、常见检测指标的测定,并根据国际通用的SLE疾病活动指数(systemic lupus erythematosus disease activity index,SLEDAI)进行评分[6]。另选取同一时期健康体检者(均排除SLE及其他自身免疫性疾病)抗凝外周静脉血标本20例,男4例,女16例,年龄20~43岁,平均(33.16±11.22)岁。
1.2 实验试剂
淋巴细胞分离液(达科为公司),Trizol试剂(Invitrogen公司);抗核抗体谱印迹法检测试剂盒(北京欧蒙公司);逆转录酶、SYBR Green试剂(Toyobo公司);DnaseⅠ、热启动Hot start Taq酶及pMD19-T 载体(Takara公司);TIANamp Genomic DNA Kit (上海天根);DNA Methylation-Gold试剂盒(ZYMO公司);引物、测序(上海生工公司)。
1.3 外周血单个核细胞分离
取新鲜静脉采血的EDTA抗凝血(4 ml),加等体积的生理盐水,按淋巴细胞分离液说明书操作步
骤分离PBMC,PBS洗涤2次后,分成等量的2部分,一部分细胞加Trizol试剂用于RNA抽提,另一半的细胞-80℃冻存用于DNA抽提。
1.4 RNA及DNA的分离纯化
总RNA的提取参照Trizol试剂说明书进行。为去除残留的DNA污染,抽提的总RNA以DnaseⅠ消化,再以氯仿-异丙醇提取,得到的RNA以DEPC水溶解。基因组DNA的抽提采用天根公司DNA抽提试剂盒进行。用紫外分光光度计检测RNA和DNA浓度后,-80℃储存备用。
1.5 抗SSB抗体检测
取新鲜静脉血3 ml,取血清-80℃保存,用于自身抗体检测。用免疫印迹法检测抗SSB抗体,严格按照产品说明书操作。
1.6 CXCL14表达的检测
参照ReverTra Ace逆转录试剂盒说明书,取1 μl提取的RNA以OligodT进行逆转录。反应条件为:42℃ 60 min,75℃ 15 min,反应结束后-20℃保存。以15 μl反应体系进行real-time PCR。CXCL14特异前向引物为5'-CAGGGCTGCTTTTAACTCTGGTAA-3',特异反向引物为5'-GGGTGGAATCATATTGGAACATGT-3'。内参GAPDH特异前向引物为5'-CAGGGCTGCTTTTAACTCTGGTAA-3',特异反向引物为5'-GGGTGGAATCATATTGGAACATGT-3'。反应体系包括:1 μl逆转录产物,1×SYBR Green I MasterMix,0.5 μmol/L特异前向引物,0.5 μmol/L特异反向引物。反应条件为:95℃ 2 min后,95℃ 15 s,60℃ 1 min,40个循环。使用Bio-Rod CFX96仪器进行。所有样品做3复孔。根据待测标本的Ct值,以GAPDH为内参照,采用相对定量法,以2-△Ct表示标本中CXCL14相对表达量。
1.7 CXCL-14启动子区甲基化分析
[7, 8]分析CxCL-14启动子区DNA甲基化,0.5 μg DNA通过EZ DNA Methylation-Gold Kit试剂盒进行亚硫酸盐修饰后,以5'- GTTGTGGTATGGGTGTGTAAG-3'和5'-CRCCAAAAACCTCATACTAACC-3'为前向和反向引物,扩增CxCL-14启动子区。50 μl反应体系包括:0.5 μg DNA为模板,特异前向和反向引物各0.5 μmol/L,其他参考Hot start Taq酶说明书。反应条件:94℃ 5 min后,94℃ 30 s,60℃ 1 min, 72℃ 1 min,35循环;最后72℃ 5 min。PCR产物连接pMD19-T 载体,每份标本挑5个克隆,进行测序。
1.8 统计学处理
采用SPSS 21统计软件分析。2组独立样本间比较采用Mann-Whitney U检验,3组及以上独立样本间比较采用Kruskal-Wallis H检验,相关性分析用Pearson 法。
2 结果
2.1 CXCL14在SLE患者和正常人外周血单个核细胞中的表达水平的检测
SLE 患者单个核细胞中CXCL14 逆转录为cDNA后,采用real-time PCR检测其表达水平。结果如图1A显示:CXCL14及内参GAPDH的定量PCR的溶解曲线为单峰,提示建立的荧光定量PCR方法可有效检测标本中CXCL14和GAPDH。据前述建立的方法,以GAPDH为内参,检测28例SLE患者、20例正常健康人PBMC中CXCL14表达水平。如图1B所示,CXCL14在SLE患者和正常人的PBMC中的相对表达量并存在显著差异(P=0.039)。在SLE患者的PBMC中,其CXCL14表达水平明显下调。
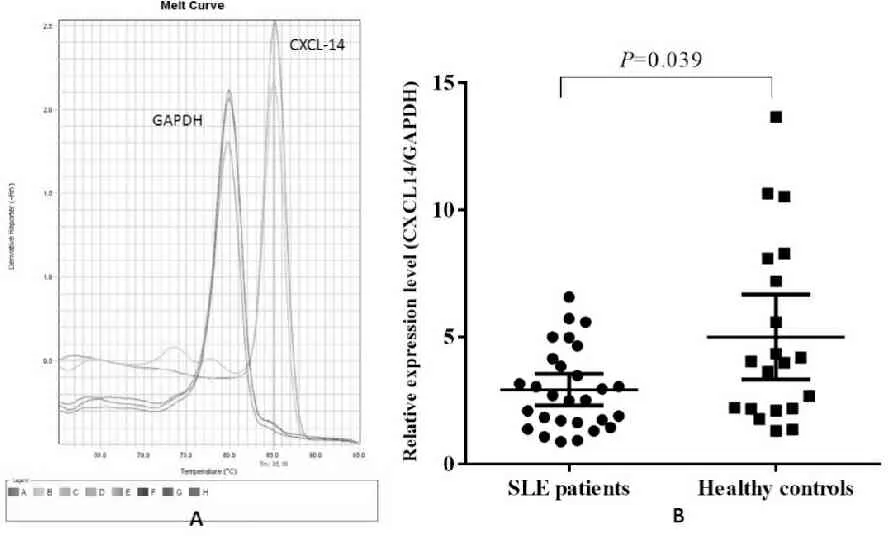
Fig. 1 Down-regulation of CXCL14 in PBMCs from SLE patients A: Melt curve of CXCL14 and GAPDH detected by real-time quantitative PCR; B: Relative CXCL14 expression in PBMCs isolated from SLE patients and healthy controls
2.2 CXCL14表达水平与在SLE患者临床特征相关性分析
如表1所示,分析PBMC中CXCL14的表达水平与SLE相关性抗体间关系发现,与抗SSB抗体阴性的SLE患者相比,抗SSB抗体阳性的SLE患者其PBMC中CXCL14的表达水平显著降低(P<0.05);在对肾功能指标进行分析时,与蛋白尿阴性的SLE患者相比,蛋白尿阳性的患者体内CXCL14的表达量明显降低(P<0.05)。人PBMC中CXCL14 的表达水平(2-△C t值)与患者的性别、抗ds-DNA、C 反应蛋白(CRP)、补体C3 水平等未见显著差异。
2.3 CXCL14启动子区域甲基化分析
CXCL14启动子区域存在51个CpG岛[7]。亚硫酸氢盐处理后测序结果显示(图2),SLE患者的PBMC检测到所有CpG岛(100%)均可检测到甲基化现象,CXCL14启动子区域CpG岛甲基化平均覆盖率达32.91%[470/(28×51)],而正常对照PBMC检测到39个CpG岛(86.27%)存在甲基,甲基化平均覆盖率为19.41%[198/(20×51)],两者差异有统计学意义(P<0.01)。进一步分析各CpG岛甲基化发现,第2、4、6、8、9、21及23号CpG岛的甲基化仅存在于SLE患者中,第3、7、12、15、16、24、26、27、30、31、32、41、42及43号CpG岛的甲基化概率在SLE患者中也明显增高(P<0.01)。
Tab. 1 Relationship between clinical indicators of SLE patients and CXCL14 expression in their PBMCs
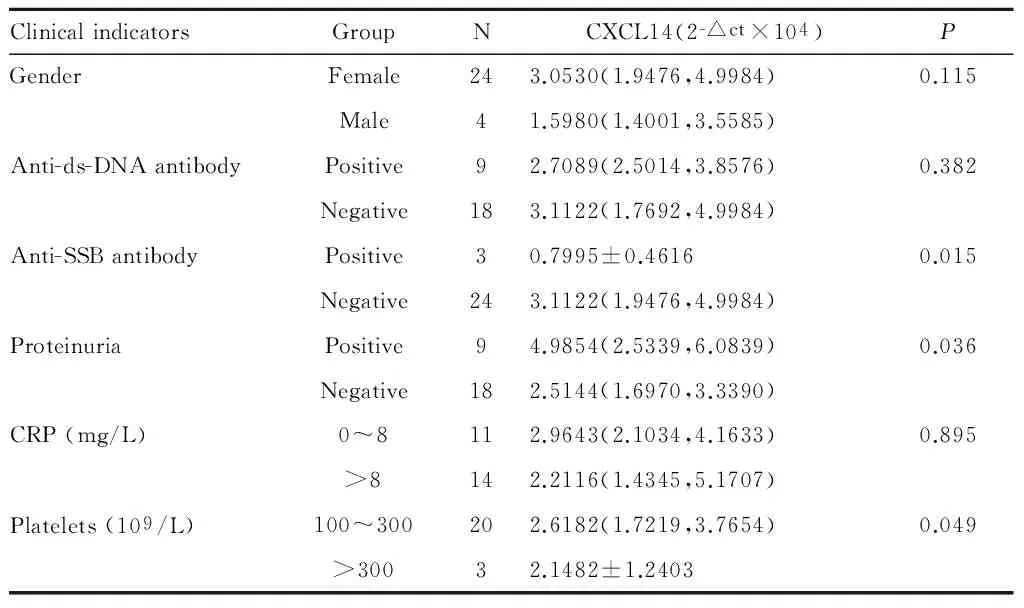
ClinicalindicatorsGroupNCXCL14(2-△ct×104)PGenderFemale243.0530(1.9476,4.9984)0.115Male41.5980(1.4001,3.5585)Anti-ds-DNAantibodyPositive92.7089(2.5014,3.8576)0.382Negative183.1122(1.7692,4.9984)Anti-SSBantibodyPositive30.7995±0.46160.015Negative243.1122(1.9476,4.9984)ProteinuriaPositive94.9854(2.5339,6.0839)0.036Negative182.5144(1.6970,3.3390)CRP(mg/L)0~8112.9643(2.1034,4.1633)0.895>8142.2116(1.4345,5.1707)Platelets(109/L)100~300202.6182(1.7219,3.7654)0.049>30032.1482±1.2403
#CXCL14 expressions were presented as median (25th-75th percentile)
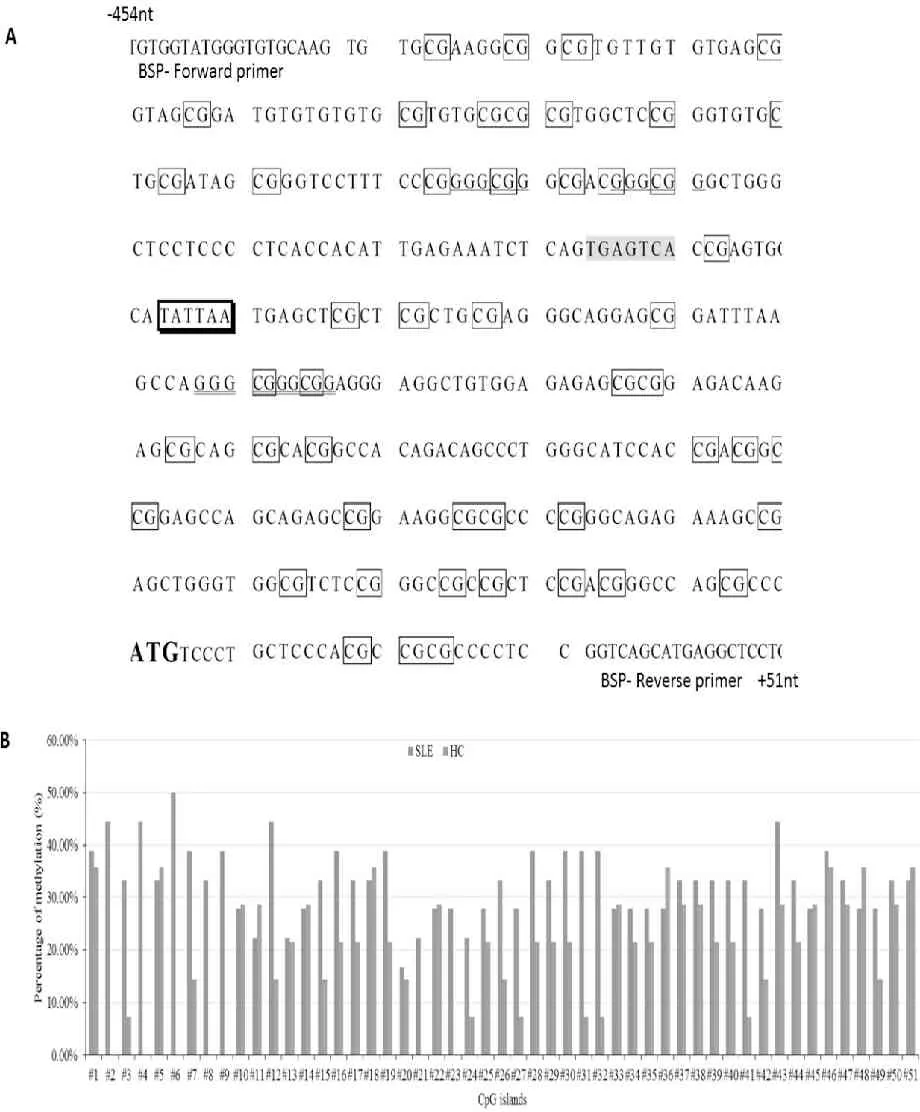
Fig. 2 Methylation level of 51 CpG islands in PBMCs from SLE patients and healthy controls A: Features of CXCL14 promoter region. : TATA-like sequence; : AP-1 binding sequence;□: CpG island. B: Methylation level of 51 CpG islands in PBMCs from SLE patients and healthy controls
3 讨论
趋化因子根据多肽链一级结构中N末端CYS(C)残基和其他氨基酸(X)的排列位置趋化因子超家族可以分为4个亚类, 即CXC类、CC类、C类、CX3C类。它们能够精确的调节和控制白细胞向炎症组织的迁移,还可诱导细胞分化, 以维持组织细胞正常免疫功能的平衡。趋化因子高水平的持续不适当的表达, 会使募集的白细胞大量增加形成破坏性的损伤。越来越多研究证实趋化因子及其受体参与SLE在内的多种疾病的发生和发展。研究表明,趋化因子CCL2、CCL5、CXCL12是发病机制过程中重要的炎性介质,它们分别通过与其相应趋化因子受体CCR2、CCR5及CXCR4结合发挥作用[9,10]。在狼疮肾炎病人的肾小球中浸润的细胞主要是巨噬细胞, T 淋巴细胞很少, 而在组织间隙主要是T 淋巴细胞, 其次是巨噬细胞。Yamada M等[11]和Murata H 等[12]报道狼疮性肾炎病人肾组织中主要以CD4+T 细胞和单核巨噬细胞为主, 并且这种CD4+T 细胞表达高水平的CCR4。王倩[13]的研究中证实了CXCL9,CXCL10,CXCL11与SLE具有相关性。
CXCL14(也称为BRAK,Mip-2c,BMAC),是一种CXC类趋化因子。它的基因位于5p31.1染色体上,并由77个氨基酸构成。在生理方面,CXCL14扮演着自我平衡的作用,它能在表达于大脑、小肠、肾脏和上皮细胞,但是不在淋巴组织中表达。在炎症中,CXCL14倾向于减少。然而,在炎细胞浸润的肿瘤中它的表达反而增多。此外,CXCL14还具有抗血管生成,对自然杀伤细胞、B细胞、肥大细胞、巨噬细胞、未成熟树突细胞、单核细胞等白细胞有强烈趋化作用并能增强各类细胞的生理功能,以致与很多疾病也存在相关性,如肝损、脂肪肝、免疫系统疾病、脱髓鞘疾病、黄斑退化症、动脉瘤等。研究发现,CXCL14在自身免疫性关节炎的关节液中过表达[14],进一步利用转基因小鼠发现CXCL14过表达可促进自身免疫性关节炎进程,提示CXCL14可参与自身免疫性疾病进程[15]。但CXCL14在SLE患者中的表达及意义目前尚未见相关研究报道。
SLE是一种全身性免疫系统紊乱的自身免疫性疾病,其外周血单个核细胞功能的变化是其免疫失调的重要特征。本研究发现CXCL14在SLE的PBMC中表达水平明显低于健康成人,首次证实CXCL14表达与SLE相关。另外。本研究还发现,CXCL14表达水平与SLE患者的SSB抗体及蛋白尿相关,SSB抗体及蛋白尿阳性SLE患者,CXCL14表达更低,但与其他多数SLE指标未见显著相关性。既往的研究普遍认为,CXCL14在维持自我稳定中发挥作用。其在SLE患者PBMC中的失调表达,也提示在CXCL14维持外周血免疫细胞间的平衡及功能中发挥重要作用,其产生的相关细胞有待于进一步确定。
研究证实,多种免疫相关基因的DNA异常甲基化是SLE重要特征。CXCL14基因启动子区含一个非典型的TATA样序列(TATTAA)、一个AP-1转录因子结合序列、4个 GC盒及 51个CpG岛。在头颈鳞癌、胃癌、结肠癌、前列腺癌等多种肿瘤中已报道CXCL14启动子区甲基化是其表达的重要调控机制[7, 8, 16, 17]。我们的研究显示, SLE患者CXCL14基因启动子区CpG岛甲基化明显高于正常对照,提示其启动子区CpG岛过度甲基化是SLE患者PBMC中CXCL14低表达的重要机制。
综上,目前对CXCL14与SLE 关系尚不明确,但本试验结果提示CXCL14在SLE 的发病过程中可能发挥重要作用,探讨CXCL14与SLE的关系,将有助于进一步阐明SLE的发病机制。
【参考文献】
[1] Shellenberger TD, Wang M, Gujrati M,etal. BRAK/CXCL14 is a potent inhibitor of angiogenesis and a chemotactic factor for immature dendritic cells[J].CancerRes, 2004, 64(22): 8262-8270.
[2] Fragoso-Loyo H, Richaud-Patin Y, Orozco-Narvaez A,etal. Interleukin-6 and chemokines in the neuropsychiatric manifestations of systemic lupus erythematosus[J].ArthritisRheum, 2007, 56(4): 1242-1250.
[3] Kurth I, Willimann K, Schaerli P,etal. Monocyte selectivity and tissue localization suggests a role for breast and kidney-expressed chemokine (BRAK) in macrophage development[J].JExpMed, 2001, 194(6): 855-861.
[4] Starnes T, Rasila KK, Robertson MJ,etal. The chemokine CXCL14 (BRAK) stimulates activated NK cell migration: implications for the downregulation of CXCL14 in malignancy[J].ExpHematol, 2006, 34(8): 1101-1105.
[5] Juremalm M, Nilsson G. Chemokine receptor expression by mast cells[J].ChemImmunolAllergy, 2005, 87: 130-144.
[6] Bombardier C, Gladman DD, Urowitz MB,etal. Derivation of the SLEDAI. A disease activity index for lupus patients. The Committee on Prognosis Studies in SLE[J].ArthritisRheum, 1992, 35(6): 630-640.
[7] Komori R, Ozawa S, Kato Y,etal. Functional characterization of proximal promoter of gene for human BRAK/CXCL14, a tumor-suppressing chemokine[J].BiomedRes, 2010, 31(2): 123-131.
[8] Hu C, Lin F, Zhu G,etal. Abnormal hypermethylation of promoter region downregulates chemokine CXC ligand 14 expression in gastric cancer[J].IntJOncol, 2013, 43(5): 1487-1494.
[9] 徐春阳, 李 爽, 邵 坤, 等. 单核细胞趋化蛋白1及其受体CCR2 mRNA在急性酒精中毒大鼠脑组织的表达[J]. 中国应用生理学杂志, 2011, 27(3): 274-275,283,379.
[10]杜瑞雪, 叶 平, 颜光涛, 等. 瑞舒伐他汀对颈动脉粥样硬化患者单个核细胞CCR2表达的影响及机制[J]. 中国应用生理学杂志, 2016, 32(3): 202-206.
[11]Yamada M, Yagita H, Inoue H,etal. Selective accumulation of CCR4+ T lymphocytes into renal tissue of patients with lupus nephritis[J].ArthritisRheum, 2002, 46(3): 735-740.
[12]Murata H, Matsumura R, Koyama A,etal. T cell receptor repertoire of T cells in the kidneys of patients with lupus nephritis[J].ArthritisRheum, 2002, 46(8): 2141-2147.
[13]王 倩, 刘 伟, 卢 葳, 等. 系统性红斑狼疮患者血清中趋化因子CXCL9,CXCL10及CXCL11的检测[J]. 中国皮肤性病学杂志, 2015, 27(2): 125-128.
[14]Booth G, Newham P, Barlow R,etal. Gene expression profiles at different stages of collagen-induced arthritis[J].Autoimmunity, 2008, 41(7): 512-521.
[15]Chen L, Guo L, Tian J,etal. Overexpression of CXC chemokine ligand 14 exacerbates collagen-induced arthritis[J].JImmunol, 2010, 184(8): 4455-4459.
[16]Song EY, Shurin MR, Tourkova IL,etal. Epigenetic mechanisms of promigratory chemokine CXCL14 regulation in human prostate cancer cells[J].CancerRes, 2010, 70(11): 4394-4401.
[17]Cao B, Yang Y, Pan Y,etal. Epigenetic silencing of CXCL14 induced colorectal cancer migration and invasion[J].DiscovMed, 2013, 16(88): 137-147.
Expression and its promoter methylation of chemokine CXC ligand 14 in peripheral blood mononuclear cells from patients with lupus
WANG Jin-dan1, HUANG Qian-qian2, YE Lu-lu3, FAN Chao-fan2, GUO Gang-qiang3,XU Ling-juan4, XUE Xiang-yang3, SHENG Xiu-sheng5△
(1. School of Laboratory Medicine and Life Science, Wenzhou Medical University, Wenzhou 325035; 2. The Second Clinical College,Wenzhou Medical University, Wenzhou 325035; 3. Department of Microbiology and Immunology, Institute of Molecular Virology and Immunology,Institute of Tropical Medicine, Wenzhou Medical University, Wenzhou 325035; 4. Department of Laboratory, Jinhua Hospital of Traditional Chinese Medicine, 5. Medical School, Jinhua Polytechnic College, Jinhua 321000, China)
Objective: To analyze the expression and its promoter methylation of chemokine CXC ligand 14 (CXCL14) in peripheral blood mononuclear cells (PBMCs) from patients with systemic lupus erythematosus (SLE). Methods: The RNAs of PBMCs from 28 SLE patients and 20 healthy controls were isolated and reversely transcribed into cDNAs. Using GAPDH as the internal reference, the levels of CXCL14 expression were detected by real-time polymerase chain reaction (PCR). The correlation between CXCL14 expression and the clinic pathological features of SLE were further analyzed. DNA methylation was analyzed by bisulfite sequencing PCR (BSP). Results: Our data indicated that the level of CXCL14 in the PBMC of SLE patients was statistically lower than that in healthy controls (P<0.05). Further analysis showed that CXCL14 expression was negatively correlated with anti-Sj gren syndrome B antibody(anti-SSB antibody,P<0.01)and albuminuria(P<0.05). However, CXCL14 expression was not significantly correlated with the indexes of SLE activity, renal damage, the level of anti-ds-DNA antibodies, complement C3 and C-reactive protein. In addition, we further demonstrated that the CXCL14 promoter hypermethylation expression was significant higher than healthy controls. Conclusion: Down-regulated of CXCL14 expression in PBMC maybe involved in the occurrence or development of SLE disease. The loss of CXCL14 expression was regulated by promoter hypermethylation.
systemic lupus erythematosus(SLE); chemokine; CXCL14; methylation
浙江省科技厅科研基金资助项目(2012C33126);浙江省大学生新苗计划(2014R413058,2015R413027,2015R413069);金华市科技局科研基金资助项目(2013-3-014)
2016-01-15
2016-11-29
R392.6
A
1000-6834(2017)03-197-05
10.12047/j.cjap.5415.2017.049
△【通讯作者】Tel: 0579-82232886; E-mail: shengsheng117@sina.com
