ZnFe2O4及ZnO/ZnFe2O4复合材料的光催化性能的研究
2017-06-10亓淑艳赵博超吴超胥焕岩
亓淑艳+赵博超+吴超+胥焕岩

摘要:采用沉淀法制备出了ZnFe2O4及ZnO/ZnFe2O4复合材料。利用X衍射仪(XRD)及扫描电镜(SEM)对其结构和形貌进行表征。实验结果表明, 通过XRD可知制备出ZnFe2O4及ZnO/ZnFe2O4样品;通过SEM可知ZnFe2O4为不规则的颗粒状,ZnO/ZnFe2O4为球型且附着有细小颗粒。在模拟太阳光(氙灯)下用02 gZnO/ZnFe2O4对100 mL模拟有机废水(20 mg/L的亚甲基蓝)进行实验,降解效率可达892%。
关键词:ZnO/ZnFe2O4;模拟太阳光;催化氧化;亚甲基蓝
DOI:1015938/jjhust201702002
中图分类号: TQ 1324文献标志码: A文章编号: 1007-2683(2017)02-0007-05Investigation on the Preparation and Photocatalytic
Properties Study of ZnO/ZnFe2O4
Abstract:In this paper, ZnFe2O4 and ZnO/ZnFe2O4 were synthesized by precipitation method The structure and appearance of the synthesized nanoparticles were characterized by XRD and SEM The results show that ZnFe2O4 and ZnO/ZnFe2O4 can be successfully prepared by XRD; we can find that the ZnFe2O4 is irregular, and the ZnO/ZnFe2O4 is the ball type and the small particles are attachedA study on the photocatalytic performance of the simulated wastewater (Methylene blue) with ZnO/ZnFe2O4 under the simulated sunlight showed that the highest degradation rate could reach to 892%
Keywords:ZnO/ZnFe2O4; simulated solar; irradiation photocatalysis; methylene blue
0引言
随着工业时代的到来,各种类型的工厂大量产生,工厂的产生自然带来大量经济效益,但是带来经济效益的同时环境也随之被破坏了。其中废水的污染最为严重,因为废水还会污染土地、河流、海洋,而且让人们使用受污染的水的时候人们的健康就受到了危险。因此污染的治理尤为重要,为了治理环境污染:氧化处理法、物理吸附法、凝聚法、膜分离法等方法随之诞生,但是它们都存在着成本高、处理效率低、无法将污染物彻底氧化等不足,所以光催化氧化法因为操作简单、适用范围广、成本低廉、高效等优点而受到人们的广泛关注。其中高效的催化剂ZnO[1-4] ,TiO2[5],MgO[6-7]等。
ZnO作为半导体n型半导体材料,具有优良的性能,如它的禁带宽度为337eV,具有良好的激子束缚能(60meV)[8-9],这有利于在室温的条件下降低ZnO的阈值,而且还有阻碍电子和空穴复合的作用。这些优良的性质都决定了它能在紫外光下被激发。而太阳光中有包含有紫外光波段,所以作为半导体材料ZnO在光催化领域就有了发展前景。但是它的回收一直成为一个难题。近些年来具有n型半导体结构的磁性材料ZnFe2O4[10-11]广受人们关注。虽然ZnFe2O4它的禁带宽度(19eV)比ZnO、TiO2等材料的禁带宽度窄,但是它有着自己独特的属性——磁性。磁性可以帮助它更好的回收,这样就可以多次利用,提高利用率。
ZnO/ ZnFe2O4[12-14]与纯ZnO相比虽然没有更高的光催化性能,但是在回收方面具有很大的優势,因此在光催化领域具有比纯ZnO更为广阔的应用前景。目前,关于ZnO复合物的制备方法有很多。主要包括模板法、电纺丝法、离子体增强化学气相沉积法、ECV功法、水热法、溶剂热法等[15-19]。但是这些制备方法都存在着不足,例如火焰喷雾热解法等的制备工艺复杂操作起来比较困难,水热法制备的ZnO复合物具有较高的结晶度,但是反应过程中需要高温高压的苛刻条件,电纺丝法操作虽然简便,但需要与高分子有机物复合,而且产品纯度低。本文采用沉淀法制备ZnO。沉淀法具有效率高、沉淀颗粒大小在1μm左右且粒度均匀等优点。但是原材料硝酸锌浓度高时产物易出现团聚现象。而且产量可随浓度的增加而增加。操作简单、成本低廉、便于大量生产,对现代环境治理有着重要的意义。本文采用沉淀法制备出了ZnFe2O4及ZnO/ ZnFe2O4样品,通过XRD和SEM手段对其结构和形貌进行了表征,进行了初步的研究。
1实验
11实验药品
本实验主要化学试剂:Zn(NO3)2·6H2O、Fe(NO3)3·9H2O、CO(CH2CH2O)nH、NH3·H2O、C16H18ClH35·3H2O均为分析纯
12ZnFe2O4的制备
按照比例称量609g Zn(NO3)2·6H2O和83gFe(NO3)3·9H2O放入烧杯中,加入750mL水,将混合盐溶液放在70℃的水浴锅中保温并且搅拌。硝酸锌与氨水的物质的量比为8∶1来配制硝酸锌溶液。配制聚乙二醇(PEG)氨水的混合溶液130mL,缓慢滴加到Zn(NO3)2·6H2O、Fe(NO3)3·9H2O的混合溶液中为使其充分反应8h。待反应结束,静置使溶液温度冷却到室温。然后在砂芯漏斗中加入滤膜再抽滤,分别用蒸馏水和酒精清洗数次。将滤饼取出,并放入恒温烘箱中,温度设置为60℃烘干6h,得到ZnFe2O4复合粉体。
13ZnO/ ZnFe2O4的制备
配制硝酸锌溶液,按照目标产物的化学式中各元素化学计量比计算硝酸锌的用量。硝酸锌与氨水的物质的量比为8∶1来配制硝酸锌溶液。计算出六水合硝酸锌的用量为609g。用天平称取定量的药品,放入烧杯中与750mL水混合配制成溶液,将盐溶液放在70℃的水浴锅中保温并且搅拌,在溶液中加入一定量已制备好的ZnFe2O4。配制PEG和氨水的混合溶液,然后向烧杯中缓慢滴加氨水和PEG的混合溶液为使其充分反应8h。将烧杯从水浴锅中取出,静置使溶液温度冷却到室温。然后在砂芯漏斗中加入滤膜再抽滤,分别用蒸馏水和酒精清洗数次。将滤饼取出,并放入恒温烘箱中,温度设置为60℃烘干6h,得到ZnO/ZnFe2O4复合粉体。
14表征手段
使用日本理学公司生产的,型号为D/MAX3B型X射线衍射仪(XRD)分析样品结构,扫描范围10°~80°。使用英国Camscan生产的扫描电镜(SEM)分析其形貌。模拟光源是用北京纽比特科技公司生产的氙灯。分析浓度的变化是用上海生产的722型分光光度计测量样品的吸光度,然后通过计算反应其浓度变化。
15光催化实验步骤
1)配制20mg/L的亚甲基蓝溶液作为实验室模拟废水,取35mL溶液用722分光光度仪测其吸光度,记为溶液初始吸光度;
2)将100mL浓度为20mg/L的亚甲基蓝溶液倒入250mL烧杯中,称量02g样品放入烧杯中;
3)将装置置于模拟太阳光灯下,用磁力搅拌。每隔30min取上层液5mL上层液用离心管,然后在离心机中离心,取上层清液让入比色皿中后测其吸光度并记录;
4)计算亚甲基蓝的溶液脱色率,并绘制脱色率与时间的变化曲线。
实验采用分光光度计来定性测量亚甲基蓝溶液浓度的变化。分光光度计采用一个可以产生多个波长的光源,通过系列分光装置,从而产生特定波长的光源(本实验中测量亚甲基蓝的吸光度在664nm下进行)。光源透过测试的样品后,部分光源被吸收,计算样品的吸光值,从而转化成样品的浓度,样品的吸光值与样品的浓度在一定范围内成正比。根据浓度的大小就可以判断出哪种温度下制备的ZnO及其复合物的降解亚甲基蓝的能力更强。
16光催化实验回收步骤
1)配制20mg/L的亚甲基蓝溶液作为实验室模拟废水,取35mL溶液用722分光光度仪测其吸光度,记为溶液初始吸光度;
2)将100mL浓度为20mg/L的亚甲基蓝溶液倒入250mL烧杯1中,称量02g样品放入烧杯中;
3)将装置置于模拟太阳光灯下,用磁力搅拌。每隔30min取上层液5mL上层液用离心管,然后在离心机中离心,取上层清液让入比色皿中后测其吸光度并记录,离心管的下层悬浊液收集在烧杯2中;
4)待反应结束后,将烧杯1中的悬浊液用离心管洗涤,洗涤干净过放入烧杯2中,放入干燥箱中干燥;
5)计算亚甲基蓝的溶液脱色率,并绘制脱色率与时间的变化曲线。
2表征
21物相分析
图1ZnFe2O4的XRD图图1为所制得的基准样品ZnFe2O4的XRD图。在图中显示了2θ角对应的衍射晶面为(111)、(220)、(311)、(222)、(400)、(422)、(511)、(440)、(620)、(533)和(622),标准ZnFe2O4的PDF号为22-1012。从图中可以看出, XRD图谱中没有杂相峰出现,所有峰出现的位置都与标准图谱PDF 22-1012相一致,证明所制样品为尖晶石型铁氧体且衍射峰强度较高,峰型窄结晶度较好。
图2为不同配比的ZnO/ ZnFe2O4的XRD图,可以看到在2θ=31880,34410,36260, 47520,56700,62800,66800,67900,6900处,分别对应六方晶相ZnO的(100),(002),(101),(102),(110),(l03),(200), (201),(112)晶面。而且在图中显示了衍射峰分别为(111)、(220)、(311)、(222)、(400)、(422)、(511)、(440)、(620)、(533)和(622)的铁酸锌衍射峰。由此可知氧化锌与铁酸锌复合的很好。由这5条曲线还可看出10∶5的衍射峰最宽,证明ZnO晶粒成长的不好。而其它4个衍射峰相对而言比较窄,尤其是10∶1和10∶2的衍射峰最窄,这证明复合量越少越有利于ZnO的结晶长大。
22形貌分析
图3 为ZnFe2O4及ZnO/ZnFe2O4的SEM图。图a)为铁酸锌的SEM图,从图a中可以看出ZnFe2O4的粒径要大于氧化锌的粒径。而从其它复合图片中可以看出大粒径的ZnFe2O4已经没有了,可能是在ZnO形成的过程中两者相互作用使ZnFe2O4的粒径减小。图b)、c)、d)中粒子的形状大多为球形而且粒径大体一样。但也有些略微的变化,能从图中看出氧化锌的形貌在从球型到椭球形过渡。图e)中看出其粒径略微变小。图f)中可以看出粒径明显比其它样品小,而且形状有所变化。证明随铁酸锌量影响氧化锌晶粒的长大。
23降解亚甲基蓝的脱色率分析
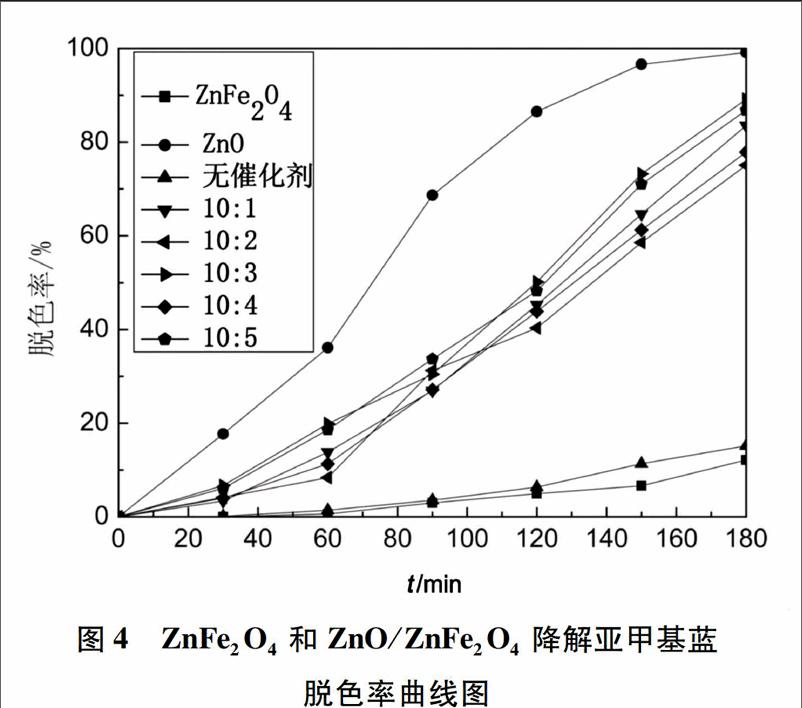
图4为ZnO/ZnFe2O4在模擬太阳光下处理亚甲基蓝模拟废水的脱色率变化图。
从图4中可以看出,单独ZnO的催化效果很好。单独使用ZnFe2O4降解亚甲基蓝的效果非常不好,证明ZnFe2O4在模拟太阳光基本对解亚甲基蓝不产生降解作用。而ZnO与ZnFe2O4复合之后,相对于ZnFe2O4的催化效果明显提高,都为75%以上。这5种复合物降解效率相差不大,降解率都能达到75%以上。但是复合铁酸锌就是为了想回收氧化锌,所以首选ZnFe2O4的量最多的样品。因为ZnFe2O4具有很好的磁性,它的含量越高磁性就越大,在脱色率相差不大的情况下, ZnO∶ZnFe2O4=10∶5的复合物为最优的选择。
产生这样结果,原因可能是:ZnFe2O4与ZnO相比导带的电位更显负电性,而ZnO与ZnFe2O4相比价带的点位更显正电性,所以光生电子能从ZnFe2O4的导带迁移到ZnO导带,而空穴却停留在ZnFe2O4的价带,从而减小了电子和空穴复合的几率[20]。所以·OH(羟基自由基)会在ZnFe2O4粒子的表面上大量产生,提升其对亚甲基蓝分子的催化氧化降解速度。另一方面,由于ZnO/ ZnFe2O4粒子较小,所以具有很大的比表面积可提供更多的表面活性位,提高了光催化活性。
24多次回收ZnO/ZnFe2O4的光降解分析
图5为ZnO/ZnFe2O4比例为10∶5的样品经过多次回收降解亚甲基蓝图。五次的回收率分别为925%、85%、775%、55%、40%,它们分别降解018mg/L、017mg/L、015mg/L、011mg/L、008mg/L的亚甲基蓝溶液。虽然复合物的降解率不如ZnO的降解率,但是由于铁酸锌有磁性,所以这样对ZnO的回收具有很重要的意义。虽然每次回收后质量都在减少,但是其降解的效率基本不会产生太大的变化。这说明ZnO∶ZnFe2O4=10∶5可以多次的循环使用,而且降解效率不会因为回收次数增多而受到影响。
2结论
本文将已经制备好的ZnOFe2O4加入到ZnO的制备过程中,得到不同配比样品ZnO/ZnOFe2O4的复合材料。通过物相和形貌进行了分析,发现体系当中含有ZnO和ZnOFe2O4两相,形貌均为球形。通过光催化结果显示,ZnO∶ZnOFe2O4=10∶3的降解亚甲基蓝效果最佳,降解率为892%。产生这样的原因可能是由于ZnFe2O4与ZnO相比导带的电位更显负导致电子和空穴复合的几率降低,从而提升了光催化效果。
参 考 文 献:
[1]GHIMPU L, REIMER T, SMAZNA D, et al Photocatalytic Applications of Doped Zinc Oxide Porous Films Grown by Magnetron Sputtering[C]// 3rd International Conference on Nanotechnologies and Biomedical Engineering, 2016, 55:353-356
[2]HU Junjie, YUAN Hai, LI Peng, et al Synthesis and Photocatalytic Activity of ZnOAu25 Nanocomposites [J]. Science China Chemistry, 2015,59(3): 1-5
[3]ARJUNAN Nithya, KANDASAMY, JOTHIVENKATACHALAM Chitosan Assisted Synthesis of ZnO Nanoparticles: An Efficient Solar Light Driven Photocatalyst and Evaluation of Antibacterial Activity [J]. Journal of Materials Science: Materials in Electronics, 2015, 26(12): 10207-10216
[4]贾相华, 黄海亮, 付斯年 不同衬底温度对ZnO薄膜结构和光学性质的影响[J]. 哈尔滨理工大学学报, 2014, (1): 108-111
[5]丁军, 吴泽, 单连伟 银系TiO2光催化无机抗菌材料的制备及抗菌性能测试[J]. 哈尔滨理工大学学报, 2014(4): 75-78
[6]郑威, 崔赛, 张晓娜 染料敏化纳米晶MgO/TiO2薄膜太阳能电池[J]. 哈尔滨理工大学学报, 2015(5): 5-8
[7]张文龙, 徐景文, 吉超 均匀沉淀法制备纳米MgO[J]. 哈尔滨理工大学学报, 2010(6): 112-115
[8]YI Zao, CHEN Jiafu, LUO Jiangshan, et al SurfacePlasmonEnhanced Band Emission and Enhanced Photocatalytic Activity of Au Nanoparticlesdecorated ZnO Nanorods [J]. Plasmonics, 2015, 10: 1373-1380
[9]PAZHANIVELU V, PAUL BLESSINGTON SELVADURAI A, MURUGARAJ R Effect of Ist group elements codoping on structural, optical and magnetic properties of ZnO:Co nanoparticles [J]. Journal of Materials Science: Materials in Electronics, 2015: 1-8
[10]孫墨杰, 胡全, 李健, 等 ZnFe2O4/TiO2纳米管阵列电极的制备及光电催化降解苯酚的研究[J]. 化学学报, 2013, 71: 213-220
[11]陆胜, 刘仲娥 ZnFe2O4纳米微粉低温制备及其电磁特性[J]. 硅酸盐学报, 2005, 33(6): 665-668
[12]徐莉, 唐吉龙, 房丹, 等 ZnFe2O4/ZnO纳米复合纤维的制备及性质研究[J]. 长春理工大学学报, 2014,37(6): 1-8
[13]巩宗霞, 李斌, 张飞跃, 等 ZnFe2O4/ZnO气相法催化合成烷基毗嗓[J]. 精细化工, 2014, 31(4): 524-528
[14]LI Yun, DAI Guozhang, ZHOU Chunjiao, et al ZnO Formation and Optical Properties of ZnO:ZnFe2O4 Superlattice Microwires[J]. Nano Research, 2010, 3(5):326-338
[15]龚良玉, 刘建静 ZnO模板法合成的MnO2纳米棒及其电容特性研究[J]. 化学通报, 2011, 74(2):184-187
[16]袁卉华, 屠红斌, 李碧云, 等 稳定射流电纺丝法制备定向排列的壳聚糖超细纤维[J]. 高分子学报,2014(1):131-140
[17]侯国付, 薛俊明, 袁育杰, 等 高压射频等离子体增强化学气相沉积制备高效率硅薄膜电池的若干关键问题研究[J]. 物理学报, 2012, 61(5):1-4
[18]魏龙福, 余长林, 陈建钗, 等 水热法合成Ag2CO3/ ZnO异质结复合光催化剂及其光催化性能[J]. 有色金属科学与工程, 2014, 5(1):47-53
[19]薛源, 贾冲, 陈翌庆, 等 溶剂热法制备Co,Ni共掺杂ZnO纳米棒及其性能研究[J]. 热加工工艺, 2014, 43(2):21-23
[20]SUN M J,HU Q, LI J, et al Preparation of ZnFe2O4/TiO2 Nanotube Array Electrode and Photoelecatalysis Degradation of Phenol[J].Acta China Sinica, 2013(7): 213-220
(编辑:温泽宇)
