阿格列汀与吡格列酮联合治疗2型糖尿病的疗效及对胰岛β细胞功能改善的影响
2017-06-09虞欣
虞 欣
(北京市丰台医院 高干病房, 北京, 100070)
阿格列汀与吡格列酮联合治疗2型糖尿病的疗效及对胰岛β细胞功能改善的影响
虞 欣
(北京市丰台医院 高干病房, 北京, 100070)
目的 探讨阿格列汀与吡格列酮联合治疗2型糖尿病的疗效及对胰岛β细胞功能改善的影响。方法 选取T2DM患者79例,采用随机数字表法分为安慰剂(PBO)组(n=26)、阿格列汀组(ALO)组(n=26)和阿格列汀/吡格列酮(ALO/PIO)组(n=27)。16周后,对比3组指标变化及临床疗效。结果 3组患者服药16周后, FPG、2 h PG、HbAlc、HOMA-IR、HOMA-β指数比较,差异有统计学意义(P<0.05)。结论 联合应用ALO/PIO治疗可以改善血糖控制,减轻胰岛素抵抗,改善胰岛β细胞功能。
2型糖尿病; 阿格列汀; 吡格列酮; 胰岛β细胞功能
胰岛素抵抗和β细胞功能缺陷是2型糖尿病发病的2个主要环节。既往传统的治疗方法多为“阶梯式疗法”,即生活方式干预失效后,由启动口服降糖药物逐渐过渡到胰岛素皮下注射治疗。但是这种治疗模式往往忽略了T2DM的核心缺陷,对于多数患者,胰岛素抵抗、β细胞功能缺陷等在病程早期并没有显著缓解。目前与胰高血糖素样肽-1(GLP-1)相关的上市药物主要有GLP-1类似物与二肽基肽酶(DPP-4)抑制剂,后者阻止内源性GLP-1裂解,促进胰岛β细胞分泌胰岛素,抑制胰岛α细胞分泌胰高血糖素,参与机体内部血糖的稳定调节,可有效控制血糖且延缓胰岛功能恶化,阻止T2DM病情进展。噻唑烷二酮类(TZD)作为传统降糖药物,为过氧化物酶增殖物激活受体γ(PPARγ)的高选择性及强力的激动剂,可以改善脂肪细胞的胰岛素敏感性,降低胰岛素抵抗。本研究探讨应用传统降糖药物血糖控制不佳的初发T2DM患者联合应用DPP-4抑制剂和TZD后的降糖作用及对胰岛β细胞功能改善的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2014年5月—2016年6月本院内分泌科和高干病房就诊的初发T2DM患者。纳入标准: ① 采用WHO 1999年糖尿病诊断标准,年龄20~70岁; ②初发的T2DM患者(病程≤3年); ③ 入院前经饮食及运动后血糖控制不佳,或者正规、单一使用二甲双胍、磺脲类及格列奈类口服降糖药物至少3月血糖仍未达标者; ④ 主要的入选指标包括: 糖化血红蛋白(HbA1c)6.5%~9.0%, 空腹血糖<13.3 mmol/L,BMI 23~28 kg/m2。排除标准: ① 1型糖尿病或其他类型糖尿病; ② 糖尿病有严重急慢性并发症,如伴发如酮症或酮症酸中毒、高渗性昏迷、严重应激状态; ③ 严重肝、肾功能受损患者和严重心肺功能不全患者; ④ 有明显影响血糖的各种疾病(如甲状腺功能亢进症、皮质醇增多症等); ⑤ 怀孕或哺乳期妇女; ⑥ 接受糖皮质激素治疗或激素替代治疗者。本研究方案获得本院伦理委员会批准,试验遵循了赫尔辛基宣言,所有受试者均自愿参加并签署了试验知情同意书。
1.2 研究方法
筛选入住本院内分泌科和高干病房的初诊T2DM患者,共纳入79例患者,采用随机数字表法分为PBO组(n=26)、ALO组(n=26)和ALO/PIO组(n=27)。ALO组患者给予口服苯磺酸阿格列汀(规格: 25 mg/片; 日本武田; 注册证号: H20130548) 25 mg/次, 1次/d; ALO/PIO组患者给予口服苯磺酸阿格列汀25 mg/次, 1次/d, 盐酸吡格列酮(规格: 15 mg/片; 天津武田药品有限公司; 国药准字: 20090134) 15 mg/次, 1次/d; PBO组患者给予安慰剂治疗。所有患者既往的口服降糖药物均不予改变,在本研究中继续服用。
1.3 观察指标
记录研究对象的性别、年龄、身高(H)、体质量(W)、血压(BP)、腰围(WC),并计算体质量指数(BMI)。于治疗前由内分泌专科医生进行糖尿病教育、给予患者糖尿病标准热卡饮食,相对固定每日体力活动。于空腹8 h以上,清晨抽取空腹静脉血, 100 g标准馒头餐试验,0、30、60、120、180 min取血检测血糖、胰岛素水平,并检测HbA1c水平。服药期间每2周监测肝肾功能、血糖水平与心电图变化情况,若出现持续低血糖症状或血糖值低于3.9 mmol/L者,给予调整药物剂量。16周后,对比3组指标变化及判定临床疗效。
1.4 指标计算
用稳态模型(Homa)计算胰岛β细胞功能(HOMA-β)及胰岛素抵抗指数(HOMA-IR): HOMA-β=20×空腹胰岛素/(空腹血糖-3.5); HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.5 不良反应指标
服药过程中观察并记录患者有无出现药物相关不良反应,其中血糖水平低于3.9 mmol/L定义为低血糖。
1.6 统计学处理
采用SPSS 18.0软件进行统计学分析,正态分布计量资料采用均数±标准差表示,计数资料采用率表示。三组间比较采用单因素方差分析,两两比较采用LSD-t法。计数资料采用卡方检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料分析
79例T2DM患者均完成了本研究,其中男38例,女41例,年龄20~70岁,3组患者在性别、年龄、BMI、SBP、DBP、FPG、2 h PG、HbA1c、病史、既往用药等方面比较,差异无统计学意义(P>0.05), 具有可比性。见表1。
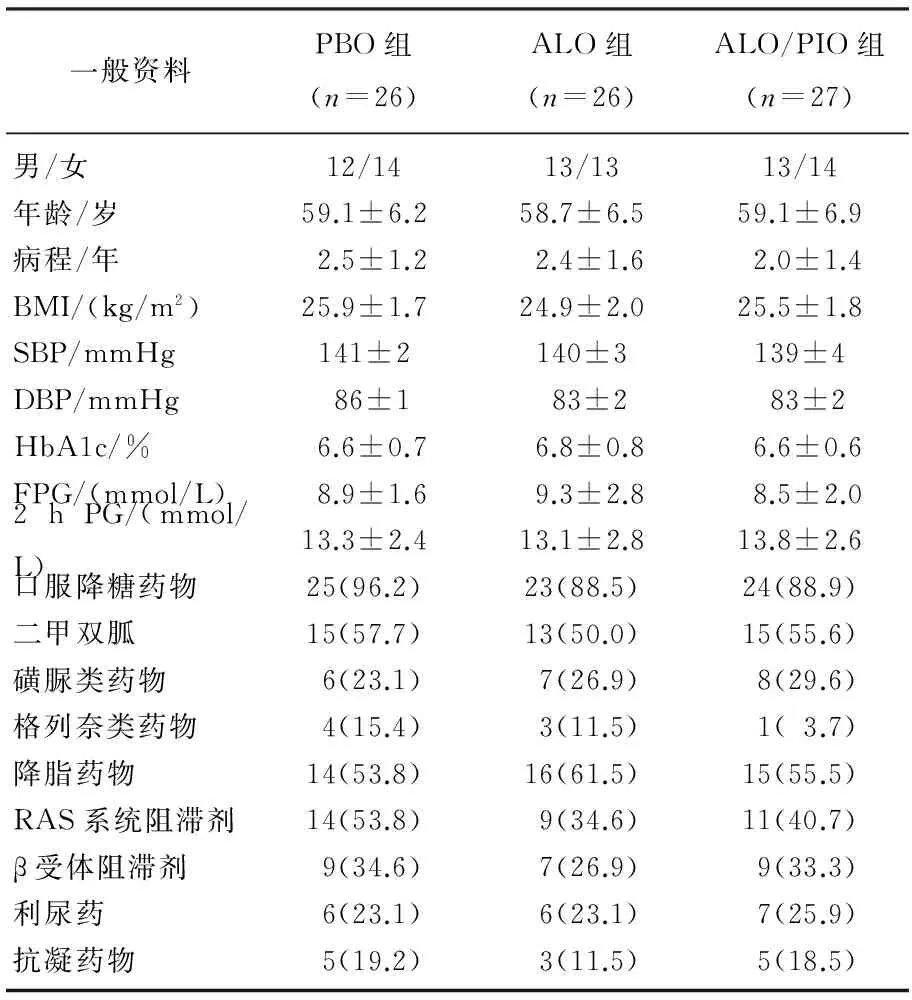
表1 3组患者一般临床资料的比较[n(%)]
2.2 3组患者治疗前后各指标的变化
3组患者服药16周后, ALO组与ALO/PIO组的FPG、2 h PG、HbAlc、HOMA-IR指标均显著下降,与PBO组比较有显著差异(P<0.05); ALO/PIO组与ALO组比较,上述指标下降的幅度更大(P<0.05); PBO组患者在16周后上述指标均较前增加。PBO组与ALO/PIO组的BMI均较基线增加; ALO组患者的BMI较前下降,与ALO/PIO组相比较,差异有统计学意义(P<0.05)。ALO/PIO组的HOMA-β指数较前增加, ALO组较前下降, PBO组无显著变化, ALO/PIO组与ALO组比较,差异有统计学意义(P<0.05)。见表2、3、4。

表2 3组患者治疗前后BMI及HbA1c变化比较
与PBO组比较, *P<0.05; 与ALO组比较, #P<0.05。

表3 3组患者治疗前后FPG及2 h PG变化比较
与PBO组比较, *P<0.05; 与ALO组比较, #P<0.05。

表4 3组患者治疗前后HOMA-β及HOMA-IR变化比较
与PBO组比较, *P<0.05; 与ALO组比较, #P<0.05。
2.3 药物不良反应
3组的不良反应发生率分别为11.5%、42.3%、44.4%。常见的不良反应分别为鼻咽炎、消化道症状、头晕等,考虑与研究药物相关。低血糖在3组中均有发生,但无严重低血糖。3组患者均未出现严重肝肾损害、心功能异常等严重不良反应。见表5。

表5 3组不良反应发生率比较
与PBO组比较, *P<0.05。
3 讨 论
目前对于T2DM尚没有一种有效的药物或手段能完全治愈,通过控制血糖可降低并延缓并发症的发生。既往传统的治疗方法多为“阶梯式疗法”,这种治疗模式往往忽略了T2DM的核心缺陷,对于多数患者,胰岛素抵抗、β细胞功能缺陷等在病程早期并没有得到缓解。传统抗糖尿病药物为目前T2DM 患者的主要临床药物,随着对T2DM发病机制更深入、全面的了解,对于糖尿病的治疗药物研究,也从对传统机制的药物研究过渡到对具有新靶点和新作用机制的药物研究。其中基于这些新靶点设计的糖尿病治疗新药有些已上市,且获得良好的降糖效果,如GLP-1受体激动剂、DPP-4抑制剂及 SGLT-2抑制剂等。
DPP-4抑制剂近年来在临床上推广使用,阿格列汀便是DPP-4抑制剂的代表药物之一。DPP-4抑制剂可通过抑制DPP-4对GLP-1和葡萄糖依赖促胰岛素多肽(GIP)的降解来间接调节胰岛素的分泌,延长GLP-1和GIP的降解时间,间接促进胰岛素的合成与分泌,抑制胰岛细胞凋亡[1]。汤涌等[2]对单一服用二甲双胍、磺脲类药物治疗2型糖尿病效果不佳的患者加服西格列汀24周,结果显示治疗后患者HbAlc、FPG、2 h PG较之治疗前分别下降了0.91%、1.3 mmol/L、3.8 mmol/L。傅军等[3]对西格列汀联合二甲双胍治疗T2DM患者的临床效果进行了Meta分析,认为该药物组合和TZD+二甲双胍组合均是治疗2型糖尿病的有效药物,具有同等降低HbAlc的功效。吡格列酮作为PPARγ高度选择性及强力的激动剂可以改善脂肪细胞的胰岛素敏感性降胰岛素抵抗。研究[4]表明罗格列酮不刺激内源性胰岛素分泌,单一服用较少引起低血糖,与其他降糖药合用时可略微增加低血糖发生频率。但因TZD类药物与体质量增加、水肿、心力衰竭等风险增加有关使该类药物使用受到限制[5]。
既往关于二者的应用多集中在对血糖的控制方面,对T2DM患者的β细胞功能改善的研究较少,且二者的联合应用研究在国内也罕见报道,亟需开展临床研究以积累更多的临床证据。本研究中,作者发现ALO/PIO联合治疗与单一ALO组比较,不仅获得了更好的血糖控制,而且有助于提高胰岛β细胞功能,改善胰岛素抵抗。更重要的是,二者的联合治疗与ALO单药治疗相比较,同样具有良好的安全性与耐受性。ALO/PIO联合治疗从多种角度强调了T2DM的核心发病机制。首先, ALO/PIO联合治疗可以改善β细胞的功能。国外有学者研究[6]发现, ALO/PIO联合治疗后可以提高胰岛β细胞对血糖的敏感性,并且增加了空腹胰岛素分泌率(ISR)。众所周知, DPP-4抑制剂可以增加胰岛β细胞的动态和静态指数,包括促胰岛素生成指数,β细胞血糖敏感性,空腹胰岛素分泌率,高糖钳夹试验中的第一时相、第二时相以及精氨酸诱导的胰岛素分泌作用[7-8]。同样, PIO也具有改善胰岛β细胞功能和阻止T2DM高危人群的病情发展[9-10]。然而,以上这些作用是直接作用于β细胞还是获益于胰岛素敏感性和血糖带来的变化,仍然不得而知。其次, ALO/PIO联合治疗也可以促进α细胞的功能。二者联合治疗可以降低胰高血糖素水平,从而减少肝糖原的输出[11]。DPP4-抑制剂的短期和长期治疗均可以降低餐后胰高血糖素的水平,从而增加GLP1的水平,这已经是不争的事实[7, 12]。已经有研究[6]表明, ALO/PIO联合治疗也可以显著增加血清中GLP1的水平。再次, ALO/PIO联合治疗可以改善胰岛素抵抗指数以及餐后胰岛素敏感性。PIO可通过增强脂肪、肌肉和肝脏等组织对胰岛素的敏感性,降低糖异生,改善机体糖代谢; 同时可通过减少总胆固醇和游离脂肪酸水平而减轻脂质对胰岛细胞的脂毒性作用[13-14]。此外,另一个降糖药物联合治疗的益处是或许可以减少药物的不良反应,因为药物的治疗剂量得到减少。对于PIO来说,因与体质量增加、水肿、心力衰竭、膀胱癌等风险增加有关使该类药物使用受到限制。但是需要注意的是,这些不良反应往往与药物剂量相关,在使用最小有效剂量控制血糖的情况下,此类药物应该受到一定的重视,因为TZD类药物在改善血糖,阻止β细胞功能衰竭方面的作用值得肯定[15-16]。本研究发现ALO组患者的身体质量指数在16周后较前显著下降,与安慰剂组比较有显著性差异。而ALO/PIO联合治疗组患者身体质量指数较前增加,但与安慰剂相比较无显著性差异。因此考虑为ALO能够“中和”PIO的体重增加作用,从而降低TZD 药物的副作用。
值的注意的是,在本研究中,作者发现ALO单一治疗组在HOMA-β指数改善上作用不明显,与安慰剂组相比较, 2组并无显著差异。可能的解释或许为本实验样本量较少,或与患者基线血糖水平并非显著升高有关,因为DPP-4抑制剂的降糖作用模式为葡萄糖依赖性的[17]。正因为如此,与磺脲类药物相比,虽同为增加胰岛素分泌,ALO在体内血糖水平正常或者较低时,发挥作用较弱,不易导致低血糖的发生。在安全性方面,3组患者均未出现严重不良反应。 ALO组与ALO/PIO组比较,不良反应发生率无显著差异(P>0.05), 说明ALO在单药和与PIO联合治疗时均具有良好的安全性与耐受性。ALO/PIO组和ALO组与安慰剂组相对比,不良事件发生率显著上升,常见的不良反应分别为鼻咽炎、消化道症状、头晕等不适,考虑与研究药物相关。
[1] 彭姝彬, 熊国梅, 苏燕, 等. 磺酰脲受体1基因多态性与2型糖尿病的相关性[J]. 现代生物医学进展, 2006, 6(11): 54-59.
[2] 汤涌, 周芬, 张红梅, 等. 西格列汀联合治疗单一口服药治疗效果不佳的2型糖尿病观察[J]. 中国药师, 2012, 15(10): 1465-1466.
[3] 傅军, 徐宏彬, 俞杰, 等. 西格列汀联合二甲双胍治疗2型糖尿病的系统评价[J]. 中南药学, 2012, 10(9): 707-710.
[4] 范小云, 沈革薇, 姚洁, 等. 罗格列酮钠联合二甲双胍、格列美脲治疗2型糖尿病的临床疗效观察[J]. 重庆医学, 2008, 37(24): 2807-2808.
[5] Home P D, Pocock S J, Beck-Nielsen H, et al. Rosiglitazone evaluated for cardiovascular outcomes in oral agent combination therapy for type 2 diabetes (RECORD): a multicentre, randomised, open-label trial[J]. Lancet, 2009, 373(9681): 2125-2135.
[6] Van Raalte D H, van Genugten R E, Eliasson B, et al. The effect of alogliptin and pioglitazone combination therapy on various aspects of β-cell function in patients with recent-onset type 2 diabetes[J]. European Journal of Endocrinology, 2014, 170(4): 565-74.
[7] Genugten R E V, Raalte D H V, Diamant M. Dipeptidyl peptidase-4 inhibitors and preservation of pancreatic islet-cell function: a critical appraisal of the evidence[J]. Diabetes Obesity & Metabolism, 2012, 14(2): 101-111.
[8] Foley J E, Bunck M C, Ller-Goede D L, et al. Beta cell function following 1 year vildagliptin or placebo treatment and after 12 week washout in drug-naive patients with type 2 diabetes and mild hyperglycaemia: a randomised controlled trial[J]. Diabetologia, 2011, 54(8): 1985-91.
[9] Gastaldelli A, Ferrannini E, Miyazaki Y, et al. Thiazolidinediones improve beta-cell function in type 2 diabetic patients[J]. American Journal of Physiology Endocrinology & Metabolism, 2007, 292(3): E871-E883.
[10] Xiang A H, Peters R K, Kjos S L, et al. Effect of pioglitazone on pancreatic beta-cell function and diabetes risk in Hispanic women with prior gestational diabetes[J]. Diabetes, 2006, 55(2): 517-22.
[11] Shah P, Vella A, Basu A, et al. Lack of suppression of glucagon contributes to postprandial hyperglycemia in subjects with type 2 diabetes mellitus[J]. Journal of Clinical Endocrinology & Metabolism, 2000, 85(11): 4053-9.
[12] Nauck M. Incretin therapies: highlighting common features and differences in the modes of action of glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors[J]. Diabetes Obesity & Metabolism, 2016, 18(3): 203-216.
[13] Ian W. Campbell, Segundo Mariz. β-Cell preservation with thiazolidinediones[J]. Diabetes Research & Clinical Practice, 2007, 76(2): 163-76.
[14] Kintscher U, Law R E. PPARγ-mediated insulin sensitization: the importance of fat versus muscle[J]. Ajp Endocrinology & Metabolism, 2005, 288(2): E287-91.
[15] Defronzo R A. Banting Lecture. From the triumvirate to the ominous octet: a new paradigm for the treatment of type 2 diabetes mellitus[J]. Diabetes, 2009, 58(4): 773-95.
[16] Kahn S E, Lachin J M, Zinman B, et al. Effects of rosiglitazone, glyburide, and metformin on β-cell function and insulin sensitivity in ADOPT[J]. Diabetes, 2011, 60(5): 1552-60.
[17] 曲颖, 张纯利, 胡文娟, 等. 西格列汀、罗格列酮分别联合二甲双胍治疗老年2型糖尿病的疗效观察[J]. 现代生物医学进展, 2013, 13(21): 4077-4080.
Efficacy of alogliptin combined with pioglitazone in treatment of patients with type 2 diabetes and its influence on improvement of islet β cell function
YU Xin
(WardforHigh-rankingOfficials,BeijingFengtaiHospital,Beijing, 100070)
Objective To explore the efficacy of alogliptin combined with pioglitazone on treatment of patients with type 2 diabetes and its influence on improvement of islet β cell function. Methods A total of 79 T2DM patients were randomly divided into PBO group (n=26), ALO group (n=26) and ALO/PIO group (n=27). After 16 weeks of treatment, the clinical efficacy and changes of related indexes were compared. Results After 16 weeks of treatment, there were significant differences in FPG, 2 h PG, HbAlc, HOMA-IR and HOMA-β among three groups (P<0.05). Conclusion Combined ALO/PIO therapy can improve glycemic control, reduce insulin resistance and improve islet β cell function.
type 2 diabetes; alogliptin; pioglitazone; islet β cell function
2017-01-20
R 587.1
A
1672-2353(2017)09-064-05
10.7619/jcmp.201709017
