有氧运动对肥胖大鼠海马组织tau蛋白磷酸化水平及PI3K/Akt信号通路的影响
2017-06-09房国梁田野赵杰修李良杨星雅李鹏飞于涛何子红
房国梁 田野 赵杰修 李良 杨星雅 李鹏飞 于涛 何子红
1国家体育总局体育科学研究所(北京 100061)
2国家体育总局反兴奋剂中心
有氧运动对肥胖大鼠海马组织tau蛋白磷酸化水平及PI3K/Akt信号通路的影响
房国梁1田野2赵杰修1李良1杨星雅1李鹏飞1于涛1何子红1
1国家体育总局体育科学研究所(北京 100061)
2国家体育总局反兴奋剂中心
目的:探讨有氧运动对肥胖大鼠海马组织tau蛋白磷酸化水平及其调控通路PI3K/Akt的影响,为揭示运动改善肥胖导致的神经系统功能紊乱提供一定的理论依据。方法:3周龄雄性SD大鼠随机分为高脂饮食组和正常饮食组,分别以高脂饲料和普通饲料饲养12周。随后高脂饮食组大鼠随机分为高脂安静组(HF-Sed组)和高脂运动组(HF-Ex组)。正常饮食组大鼠随机分为正常安静组(ND-Sed组)和正常运动组(ND-Ex组)。HF-Ex组和ND-Ex组大鼠进行为期8周的跑台训练。训练结束后48小时,分离两侧海马组织。通过Western blot检测各组大鼠海马组织中tau、GSK3β、PI3K和Akt蛋白含量及其磷酸化水平。结果:经过12周的饲养后,高脂饮食组大鼠中有55%符合肥胖大鼠建模成功条件。经过8周跑台训练后,HF-Sed组tau蛋白的磷酸化水平显著高于ND-Sed组;而HF-Ex组tau蛋白的磷酸化水平却显著低于HF-Sed组。另外,HF-Sed组GSK3β Ser9位点的磷酸化水平显著低于ND-Sed组,Tyr216位点的磷酸化水平显著高于ND-Sed组,说明HF-Sed组GSK3β激酶活性高于ND-Sed组;而经过8周跑台训练,HF-Ex组GSK3β Ser9位点的磷酸化水平显著高于HF-Sed组,Tyr216位点的磷酸化水平显著低于HFSed组,说明HF-Ex组GSK3β激酶活性受到抑制。此外HF-Sed组PI3K p110、p85亚基蛋白含量和Akt Thr308、Ser473位点的磷酸化水平显著低于ND-Sed组,说明HF-Sed组PI3K/Akt通路活性受到抑制;而HF-Ex组PI3K p110、p85亚基蛋白含量和Akt Thr308、Ser473位点的磷酸化水平显著高于HF-Sed组,说明HF-Ex组该通路活性增强。结论:肥胖能够诱导大鼠海马组织tau蛋白磷酸化水平上升,而有氧运动通过提高肥胖大鼠海马组织PI3K/Akt信号通路活性,抑制GSK3β的激酶活性,从而降低了tau蛋白的磷酸化水平,对于延缓脑内神经纤维缠结的形成,防治肥胖导致的神经系统退行性疾病有积极作用。
有氧运动;肥胖;海马;tau;GSK3β;PI3K;Akt;磷酸化
1 前言
tau蛋白是一种微管相关蛋白,在大脑组织中含量很高,其主要功能是促进微管的形成和维持微管的稳定[1]。tau蛋白与微管的结合能力取决于其丝氨酸(Ser)和苏氨酸(Thr)的磷酸化水平,正常生理状态下,大脑组织中tau蛋白的磷酸化水平很低[2]。而当Ser、Thr高度磷酸化时,tau蛋白从微管上解聚下来,破坏细胞骨架的稳定,导致分子间广泛交叉聚集形成双螺旋纤维(paired helical filament,PHF),最终沉积形成神经纤维缠结(neurofbrillary tangles,NFTs)[3]。而NFTs的形成是阿尔茨海默病(Alzheimer’s disease,AD)的主要病因[4,5]。
tau蛋白的磷酸化水平受多种因子调节,而糖原合酶激酶3β(glycogen synthase kinase 3β,GSK3β)是其中最为重要的一种[6]。GSK3β是一种Ser/Thr蛋白激酶,能够磷酸化tau蛋白的多个位点[7]。而GSK3β的活性受磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein kinase B,PKB/Akt)信号通路调控[8]。PI3K由催化亚基p110和调节亚基p85组成,p110亚基能够催化4,5二磷酸肌醇(phosphatidylinositol-3,4-bisphosphate,PIP2)生成3,4,5三磷酸肌醇(phosphati⁃dylinositol-3,4,5-trisphosphate,PIP3)[9]。生成的PIP3招募磷酸肌醇依赖激酶1(phosphoinositide dependent kinase-1,PDK1)和Akt至细胞膜,促使PDK1磷酸化Akt Thr308位点[10,11]。哺乳动物雷帕霉素靶蛋白复合体 2(mammalian targetofrapamycin complex 2,mTORC2)磷酸化Akt Ser473位点,完全激活Akt[12,13]。活化的Akt能够磷酸化GSK3β Ser9位点,抑制GSK3β的活性[14],而GSK3β Tyr216位点磷酸化则激活其激酶活性[15]。
最新研究发现肥胖能够诱导脑中tau蛋白磷酸化水平上升,导致NFTs的形成,破坏大脑功能,促进阿尔茨海默病等神经系统疾病的发生[16,17]。而有氧运动能够显著改善肥胖导致的诸多不良影响,提高神经系统功能,但其机理尚不清楚。本研究观察8周有氧运动对肥胖大鼠海马组织tau蛋白磷酸化水平及PI3K/Akt信号通路的影响,揭示了有氧运动能够降低肥胖诱导的海马组织tau蛋白高度磷酸化,延缓神经纤维缠结的形成,为阐明有氧运动改善肥胖导致的神经系统功能紊乱提供一定的理论依据。
2 材料与方法
2.1 肥胖大鼠模型的建立
实验选用3周龄健康雄性SD大鼠60只,体重53±5 g,购自维通利华公司。常规分笼饲养,自由进食饮水,光照比12 h/12 h,温度20±2℃;相对湿度40%~60%。在适应性饲养1周后,随机分为正常饮食组(ND,n=20)和高脂饮食组(HF,n=40),分别以普通饲料和高脂饲料饲养12周。其中普通饲料含有脂肪10%、碳水化合物70%、蛋白质20%,而高脂饲料含有脂肪45%、碳水化合物35%、蛋白质20%。每周称量1次大鼠体重及饲料摄取,每2周尾静脉取血1次进行检测。肥胖大鼠建模成功的依据为:①高脂饮食组大鼠的体重大于正常饮食组大鼠平均体重20%;②高脂饮食组大鼠的血清总胆固醇和甘油三酯显著高于正常饮食组[18]。
2.2 训练方案
饲养12周后,高脂饮食组40只大鼠中有22只符合肥胖大鼠建模成功条件,成模率为55%。从中筛选出20只肥胖大鼠,然后随机分为安静组(HF-Sed组,n= 10)和运动组(HF-Ex组,n=10)。正常饮食组大鼠同样随机分为安静组(ND-Sed组,n=10)和运动组(ND-Ex组,n=10)。HF-Ex组和ND-Ex组大鼠先进行1周的适应性跑台训练,速度为10 m/min,每天训练10 min,连续训练5天,随后在8周时间内按表1中的方案进行训练。依据Bedford等的研究,采用中等强度跑台训练,速度从15 m/min增至28 m/min,相当于50%VO2max负荷强度[19]。跑台坡度为0o,每周一至周五训练,休息2天。而HF-Sed组和ND-Sed组大鼠则一直处于安静状态。整个训练过程中HF-Sed组和HF-Ex组大鼠继续喂以高脂饲料,ND-Sed组和ND-Ex组则继续喂以普通饲料。
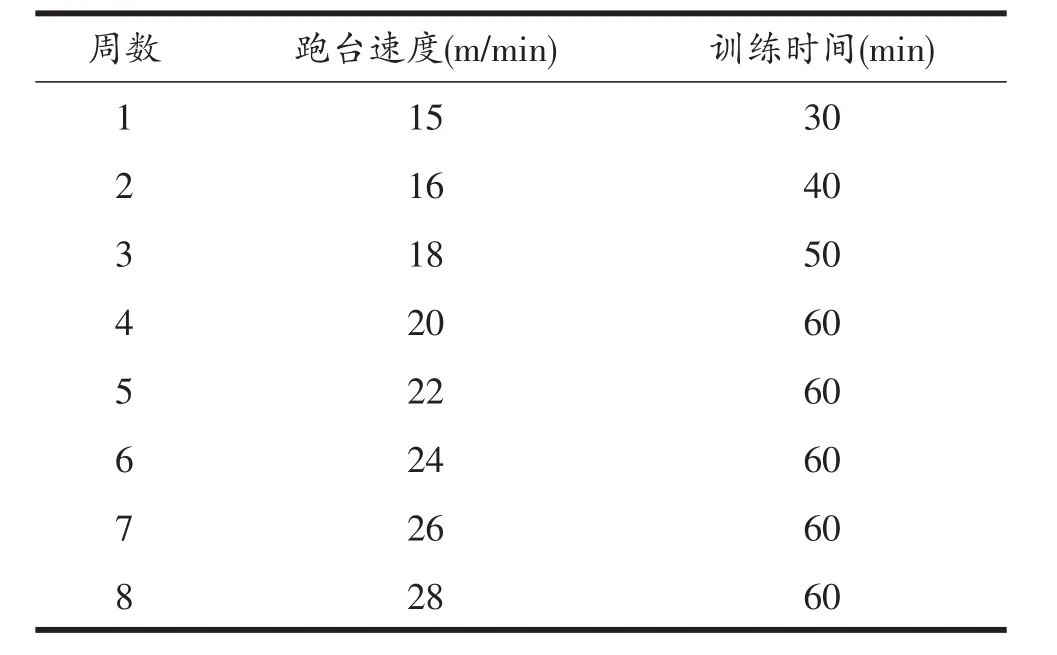
表1 8周跑台训练方案
2.3 样品制备
在最后一次训练结束后48 h,所有大鼠腹腔麻醉,然后断头取脑,在冰上迅速分离两侧海马组织,放入液氮冷冻。然后将样品转入-80℃冰箱中保存待测。
2.4 Western blot实验
取适量各组大鼠海马组织,在液氮中研磨后,迅速加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA蛋白裂解液进行细胞组织的充分裂解。4℃,12000×g离心15 min,取400 μL上清液然后加入100 μL 5×蛋白上样缓冲液,放入100℃水浴锅中进行蛋白变性,持续10 min。然后进行SDS-PAGE电泳,电泳后将蛋白转至硝酸纤维素膜上,用5%脱脂奶粉室温封闭膜1 h,然后将膜与稀释好的一抗4℃孵育过夜(实验中用到的一抗PI3K p110、PI3K p85抗体购自Cell Signaling Technol⁃ogy公司;Akt、Phospho-AktThr308、Phospho-Akt Ser473、GSK3β、Phospho-GSK3β Ser9和β-actin抗体购自Beyotime公司;tau、Phospho-tau Ser202、Phosphotau Thr231、Phospho-tau Ser396和Phospho-GSK3β Tyr216抗体购自Abcam公司)。次日用TBST洗膜3次,每次5 min,洗去残留一抗,然后将膜与稀释好的二抗室温孵育1 h(实验中用到的二抗HRP标记山羊抗兔 IgG和HRP标记山羊抗小鼠 IgG购自Beyotime公司),然后用TBST洗膜4次,每次5 min,以洗去残留的二抗。最后使用ECL化学发光试剂和X线片检测蛋白信号。
2.5 灰度分析及数据统计
使用ImageJ软件进行Western blot条带的灰度分析,应用SPSS 13.0软件进行统计学分析,文中所有统计数据为3次独立实验结果的平均值±标准差.,显著性检验选择双尾t检验。P<0.05示差异有统计学意义。
3 实验结果
3.1 肥胖大鼠模型的建立
ND组大鼠和HF组大鼠分别以普通饲料和高脂饲料饲养12周后,其体重分别为555.9±58.3 g和676.6±26.2 g,HF组大鼠体重大于ND组大鼠平均体重的21.7%(图1A)。此外,如图1所示,HF组大鼠血清总胆固醇(图1B)、甘油三酯(图1C)和血糖(图1D)均显著高于ND组(P<0.05)。高脂饮食组40只大鼠中有22只符合肥胖大鼠建模成功条件,成模率为55%。
3.2 有氧运动降低肥胖诱导的大鼠海马组织ttaauu蛋白高度磷酸化
我们首先通过Western blot方法检测了各组大鼠海马组织中tau总蛋白和多个位点的磷酸化水平。实验发现,各组大鼠海马组织tau总蛋白水平并未发生显著改变[图2A(a),B]。而HF-Sed组tau蛋白多个位点的磷酸化水平却显著高于ND-Sed组[图2A(b-d)]。其中HF-Sed组Ser202、Thr231和Ser396位点的磷酸化水平分别约为ND-Sed组水平的156.8%(图2C,P<0.01)、223.3%(图2D,P<0.01)和128.1%(图2E,P<0.05)。这反映出HF-Sed组大鼠海马组织tau蛋白整体磷酸化程度高于ND-Sed组,说明肥胖能够诱导大鼠海马组织tau蛋白磷酸化水平的提升。
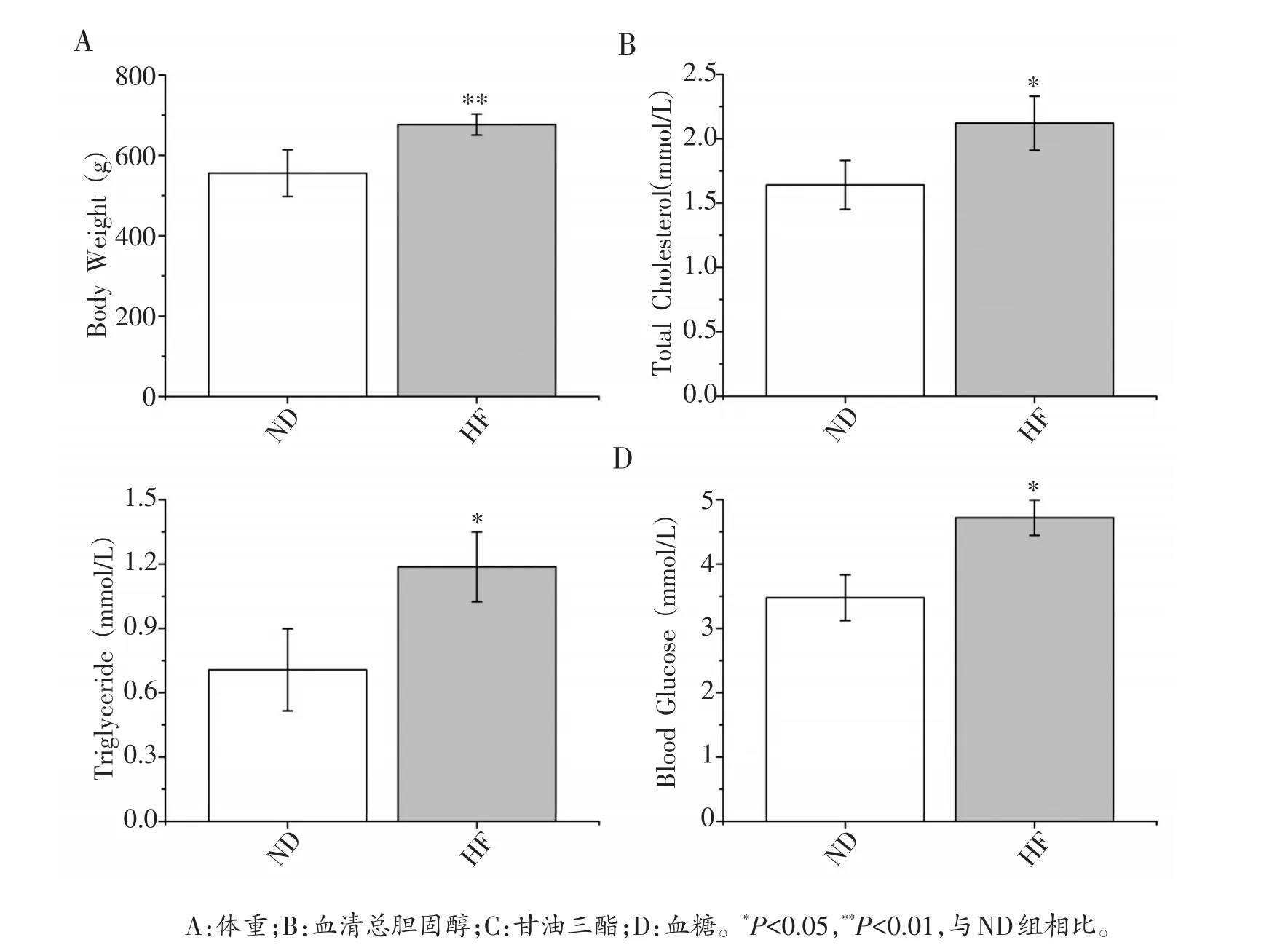
图1 正常饮食和高脂饮食组大鼠生理生化指标比较
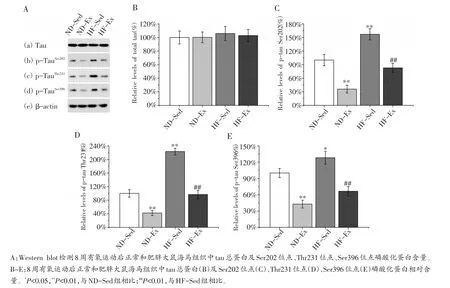
图2 有氧运动对正常和肥胖大鼠海马组织tau蛋白的影响
然而我们发现ND-Ex组Ser202、Thr231和Ser396位点的磷酸化水平显著低于ND-Sed组[图2A(b-d)],分别为ND-Sed组水平的35.8%、42.2%和42.8%(图2C~E,P<0.01)。此外,HF-Ex组Ser202、Thr231和Ser396位点的磷酸化水平也显著低于HF-Sed组[图2A(b-d)],分别约为HF-Sed组水平的52.8%、43.3%和51.9%(图2C~E,P<0.01)。上述结果说明8周有氧运动能够显著降低正常大鼠海马组织tau蛋白磷酸化水平,并能有效降低肥胖诱导的大鼠海马组织tau蛋白高度磷酸化。
3.3 有氧运动抑制肥胖诱导的大鼠海马组织GSK3β活化
tau蛋白的磷酸化水平受GSK3β的调控,而GSK3β的活性取决于其Ser9、Tyr216位点是否磷酸化。Ser9位点磷酸化,抑制GSK3β激酶活性[14],而Tyr216位点磷酸化则激活其激酶活性[15]。因此我们随后检测了各组大鼠海马组织中GSK3β总蛋白及Ser9、Tyr216位点的磷酸化水平,以判断GSK3β活性高低。
由图3可知,8周有氧运动后各组大鼠海马组织GSK3β总蛋白水平并未发生显著改变(图3A(a),B)。而HF-Sed组Ser9位点的磷酸化水平显著低于ND-Sed组[图3A(b)],约为ND-Sed组水平的67.2%(图3C,P<0.05);Tyr216位点的磷酸化水平却显著高于ND-Sed组[图3A(c)],约为ND-Sed组水平的155.2%(图3D,P<0.01)。这反映出HF-Sed组GSK3β的激酶活性高于ND-Sed组,说明肥胖能够诱导大鼠海马组织GSK3β活化。
然而,ND-Ex组Ser9位点的磷酸化水平显著高于ND-Sed组[图3A(b)],约为ND-Sed组水平的202.2%(图3C,P<0.01);Tyr216位点的磷酸化水平却显著低于ND-Sed组[图3A(c)],约为ND-Sed组水平的45.7%(图3D,P<0.01)。另外,我们发现HF-Ex组Ser9位点的磷酸化水平也显著高于HF-Sed组[图3A(b)],约为HF-Sed组水平的249.2%(图3C,P<0.01);Tyr216位点的磷酸化水平显著低于HF-Sed组[图3A(c)],约为HF-Sed组水平的46.9%(图3D,P<0.01)。以上结果说明8周有氧运动能够显著降低正常大鼠海马组织GSK3β的激酶活性,并能有效抑制肥胖诱导的GSK3β活化。
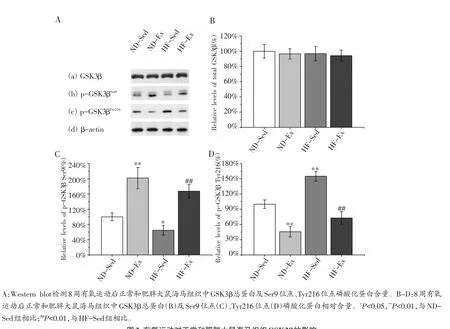
图3 有氧运动对正常和肥胖大鼠海马组织GSK3β的影响
3.4 有氧运动提高肥胖大鼠海马组织PI3K/Akt信号通路活性
GSK3β的活性受上游PI3K/Akt信号通路的调控,因此我们随后检测了有氧运动对各组大鼠海马组织PI3K/Akt通路的影响。
如图4所示,HF-Sed组PI3K p110和p85亚基蛋白含量显著低于ND-Sed组(图4A),分别约为ND-Sed组水平的70.6%和69.1%(图4B,C,P<0.05)。这说明肥胖能够诱导大鼠海马组织PI3K蛋白含量降低从而降低其磷脂酰肌醇激酶活性。
而ND-Ex组PI3K p110和p85亚基蛋白含量却显著高于ND-Sed组(图4A),分别约为ND-Sed组水平的192.6%和153.1%(图4B,C,P<0.01)。另外HF-Ex组PI3K p110和p85亚基蛋白含量也显著高于HF-Sed组(图4A),分别约为HF-Sed组水平的211.1%和172.4%(图4B,C,P<0.01)。上述结果表明8周有氧运动能够显著提高正常和肥胖大鼠海马组织PI3K含量,从而提高其磷脂酰肌醇激酶活性。
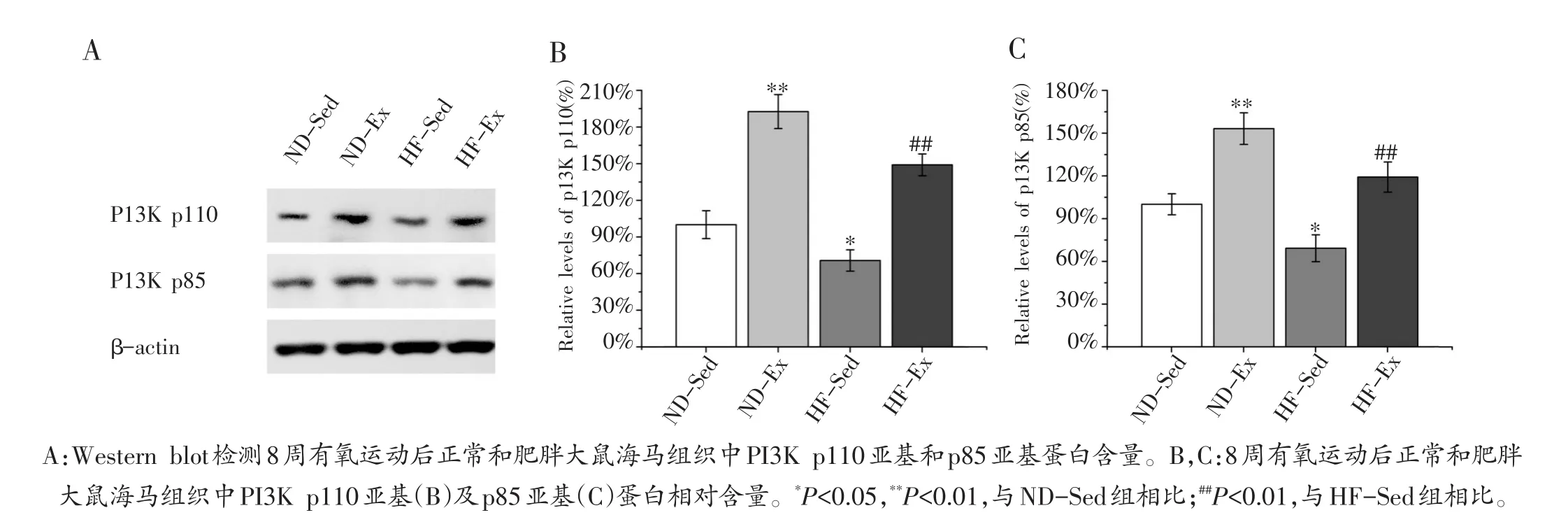
图4 有氧运动对正常和肥胖大鼠海马组织PI3K的影响
另外,实验发现8周有氧运动后各组大鼠海马组织Akt总蛋白水平并未发生显著改变[图5A(a),B]。但是HF-Sed组Thr308和Ser473位点的磷酸化水平显著低于ND-Sed组[图5A(b,c)],分别约为ND-Sed组水平的42.5%和67.4%(图5C,D,P<0.01)。表明肥胖能够诱导大鼠海马组织Akt激酶活性降低。
而ND-Ex组Thr308位点和Ser473位点的磷酸化水平显著高于ND-Sed组[图5A(b,c)],分别约为NDSed组水平的173.8%和354.4%(图5C,D,P<0.01)。另外我们发现HF-Ex组Thr308位点和Ser473位点的磷酸化水平也显著高于HF-Sed组[图5A(b,c)],分别约为HF-Sed组水平的344.9%和410.2%(图5C,D,P<0.01)。上述结果说明8周有氧运动能够显著提高正常和肥胖大鼠海马组织Akt的激酶活性。
4 分析与讨论
肥胖已成为困扰许多现代人的严重问题。肥胖是一种严重的慢性病,能够引发众多疾病,早期研究发现肥胖病人患心脏病、糖尿病以及骨关节疾病的风险大大提高[20]。研究表明,肥胖还能够导致大脑功能紊乱和记忆力衰退,诱发如阿尔茨海默病等神经系统疾病[21,22]。大量研究表明,长期有规律的体育运动能够显著降低体脂含量,防止超重或肥胖,降低心脏病、糖尿病、高血压等疾病的发病率。但体育运动是否能够改善因肥胖而导致的神经系统功能障碍,目前尚无明确报道。
我们在研究过程中发现以高脂饲料和普通饲料饲养12周后,HF组大鼠体重、血清总胆固醇、甘油三酯和血糖含量均显著高于ND组(图1),满足肥胖大鼠模型建立成功标准。有文献报道喂以高脂饲料3个月就会造成大鼠认知功能障碍[23],肥胖大鼠突触可塑性发生改变并且脑源性神经营养因子(BDNF)含量降低[24]。此外肥胖加剧了阿尔茨海默病模型小鼠脑内淀粉样蛋白积聚,大幅提高了tau蛋白磷酸化水平,行为障碍程度更加严重等问题[16,17,25]。我们在实验中发现HF-Sed组大鼠海马组织tau蛋白磷酸化水平和GSK3β激酶活性显著高于ND-Sed组,而PI3K/Akt活性却显著低于ND-Sed组。这些变化可能与高脂饮食影响了胰岛素/ IGF信号通路有关,造成胰岛素/IGF受体或相关信号蛋白数量减少,抑制PI3K/Akt,激活GSK3β,从而造成tau蛋白磷酸化水平的升高[16,21,26]。
在本研究中,我们首先发现了8周有氧运动能够明显改善大鼠海马组织由于肥胖而导致的tau蛋白高度磷酸化。HF-Ex组大鼠海马组织tau蛋白三个磷酸化位点Ser202、Thr231和Ser396的磷酸化水平分别为HF-Sed组的52.8%、43.3%和51.9%(图2C-E)。而正常大鼠在经过8周有氧运动后tau蛋白磷酸化水平改善效果更为显著,ND-Ex组三个位点的磷酸化水平分别为ND-Sed组水平的35.8%、42.2%和42.8%(图2CE)。这可能与正常和肥胖大鼠海马组织GSK3β的激酶活性有关。实验中我们发现,HF-Sed和HF-Ex组GSK3β Ser9位点的磷酸化水平分别低于ND-Sed和ND-Ex组[图3A(b),C],而Tyr216位点的磷酸化水平分别高于ND-Sed和ND-Ex组[图3A(c),D],这反映出肥胖组大鼠GSK3β的激酶活性高于正常组大鼠,因此GSK3β对tau蛋白的磷酸化作用程度更高。
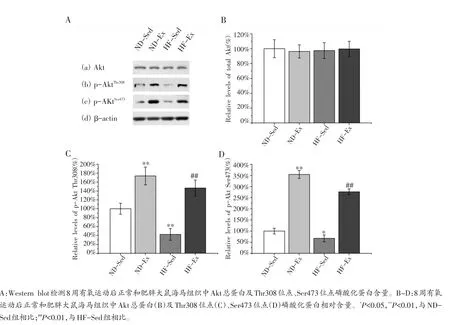
图5 有氧运动对正常和肥胖大鼠海马组织Akt的影响
另外,肥胖组大鼠在经过8周有氧运动后其海马组织PI3K p110和p85亚基蛋白含量提高幅度分别为211.1%和172.4%,高于正常组大鼠的192.6%和153.1%(图4B,C)。同时肥胖组大鼠Akt Thr308位点和Ser473位点磷酸化水平的提高幅度分别为344.9%和410.2%,高于正常组大鼠的173.8%和354.4%(图5C,D)。上述结果说明肥胖大鼠在经过长期有氧运动后其海马组织PI3K磷脂酰肌醇激酶活性和Akt激酶活性的提高幅度均高于正常组大鼠。由此推断,长期有氧运动对于提高肥胖大鼠神经系统功能的效果要显著高于正常大鼠。提示长期有氧运动对于改善因肥胖而导致的大脑功能紊乱和记忆力衰退,提高神经系统功能效果更加明显。
5 结论
肥胖能够诱导大鼠海马组织tau蛋白多个位点磷酸化水平上升,而有氧运动能够通过提高肥胖大鼠海马组织PI3K/Akt信号通路活性,抑制GSK3β的激酶活性,从而降低tau蛋白的磷酸化水平。因此,有氧运动能够显著改善肥胖诱导的大鼠海马组织tau蛋白高度磷酸化,延缓脑内神经纤维缠结的形成,对于防治肥胖导致的神经系统退行性疾病如阿尔茨海默病等有积极作用。
[1] Drubin DG,Kirschner MW.Tau protein function in liv⁃ing cells.J Cell Biol,1986,103(6 Pt 2):2739-2746.
[2] Mietelska-Porowska A,Wasik U,Goras M,et al.Tau pro⁃tein modifications and interactions:their role in function and dysfunction.Int J Mol Sci,2014,15(3):4671-4713.
[3] Wang JZ,Xia YY,Grundke-Iqbal I,et al.Abnormal hy⁃perphosphorylation of tau:sites,regulation,and molecularmechanism of neurofibrillary degeneration.J Alzheimers Dis,2013,33 Suppl 1:S123-139.
[4] Brion JP,Anderton BH,Authelet M,et al.Neurofibrillary tangles and tau phosphorylation.Biochem Soc Symp,2001,67:81-88.
[5] Sergeant N,Bretteville A,Hamdane M,et al.Biochemistry of Tau in Alzheimer's disease and related neurological disorders.Expert Rev Proteomics,2008,5(2):207-224.
[6] Sun W,Qureshi HY,Cafferty PW,et al.Glycogen syn⁃thasekinase-3betaiscomplexed with tau protein in brain microtubules.J Biol Chem,2002,277(14):11933-11940.
[7] Liu F,Liang Z,Shi J,et al.PKA modulates GSK-3betaand cdk5-catalyzed phosphorylation of tau in site-and kinase-specific manners.FEBS Lett,2006,580(26):6269-6274.
[8] Kitagishi Y,Kobayashi M,Kikuta K,et al.Roles of PI3K/ AKT/GSK3/mTOR Pathway in Cell Signaling of Mental Illnesses.Depress Res Treat,2012,2012:752563.
[9] Qiao M,Sheng S,Pardee AB.Metastasis and AKT activa⁃tion.Cell Cycle,2008,7(19):2991-2996.
[10]Franke TF,Kaplan DR,Cantley LC,et al.Direct regula⁃tion of the Akt proto-oncogene product by phosphati⁃dylinositol-3,4-bisphosphate.Science,1997,275(5300):665-668.
[11]Alessi DR,James SR,Downes CP,et al.Characterization of a 3-phosphoinositide-dependent protein kinase which phosphorylates and activates protein kinase Balpha.Curr Biol,1997,7(4):261-269.
[12]Sarbassov DD,Guertin DA,Ali SM,et al.Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex. Science,2005,307(5712):1098-1101.
[13]Alessi DR,Andjelkovic M,Caudwell B,et al.Mechanism of activation of protein kinase B by insulin and IGF-1. EMBO J,1996,15(23):6541-6551.
[14]Cross DA,Alessi DR,Cohen P,et al.Inhibition of glyco⁃gen synthase kinase-3 by insulin mediated by protein ki⁃nase B.Nature,1995,378(6559):785-789.
[15]Goc A,Al-Husein B,Katsanevas K,et al.Targeting Srcmediated Tyr216 phosphorylation and activation of GSK-3 in prostate cancer cells inhibit prostate cancer progres⁃sion in vitro and in vivo.Oncotarget,2014,5(3):775-787.
[16]Bhat NR,Thirumangalakudi L.Increased tau phosphoryla⁃tion and impaired brain insulin/IGF signaling in mice fed a high fat/high cholesterol diet.J Alzheimers Dis,2013,36(4):781-789.
[17]Spolcova A,Mikulaskova B,Krskova K,et al.Deficient hippocampal insulin signaling and augmented Tau phos⁃phorylation is related to obesity-and age-induced periph⁃eral insulin resistance:a study in Zucker rats.BMC Neurosci,2014,15:111.
[18]朱磊,路瑛丽,冯连世,等.不同配方高脂饲料构建SD大鼠肥胖模型的实验研究.中国运动医学杂志,2016,35(7):642-647.
[19]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxy⁃gen consumption of rats and its changes with various ex⁃perimental procedures.J Appl Physiol Respir Environ Ex⁃erc Physiol,1979,47(6):1278-1283.
[20]Ahima RS,Lazar MA.Physiology.The health risk of obe⁃sity--better metrics imperative.Science,2013,341(6148):856-858.
[21]Pasinetti GM,Eberstein JA.Metabolic syndrome and the role of dietary lifestyles in Alzheimer's disease.J Neuro⁃chem,2008,106(4):1503-1514.
[22]Martins IJ,Hone E,Foster JK,et al.Apolipoprotein E,cholesterolmetabolism,diabetes,and the convergence of risk factors for Alzheimer's disease and cardiovascular disease.Mol Psychiatry,2006,11(8):721-736.
[23]Winocur G,Greenwood CE.Studies of the effects of high fat diets on cognitive function in a rat model.Neurobiol Aging,2005,26 Suppl 1:46-49.
[24]Wu A,Ying Z,Gomez-Pinilla F.The interplay between oxidative stress and brain-derived neurotrophic factor modulates the outcome of a saturated fat diet on synap⁃tic plasticity and cognition.Eur J Neurosci,2004,19(7):1699-1707.
[25]Levin-Allerhand JA,Lominska CE,Smith JD.Increased amyloid- levels in APPSWE transgenic mice treated chronically with a physiological high-fat high-cholesterol diet.J Nutr Health Aging,2002,6(5):315-319.
[26]Freude S,Schilbach K,Schubert M.The role of IGF-1 receptor and insulin receptor signaling for the pathogene⁃sis of Alzheimer's disease:from model organisms to hu⁃man disease.Curr Alzheimer Res,2009,6(3):213-223.
The Effects of Aerobic Exercise on Tau Phosphorylation and PI3K/Akt Pathway in the Hippocampus of Obese Rats
Fang Guoliang1,Tian Ye2,Zhao Jiexiu1,He Zihong1,Li Liang1,Yang Xingya1,Li Pengfei1,Yu Tao1,Wen Yuemeng1
1 China Institute of Sport Science,Beijing 100061,China
2 China Anti-Doping Agency,Beijing 100029,China Corresponding Author:Fang Guoliang,Email:fangguoliang@ciss.cn
ObjectiveTo investigate the effects of aerobic exercise on tau phosphorylation and PI3K/ Akt pathway in the hippocampus of obese rats,and provide some theoretical basis for physical activity improving obesity-related neurological disorders.MethodsMale Sprague-Dawley rats aged 3 weeks were randomly assigned to either a high-fat or a normal diet protocol for 12 weeks.Animals submitted to the high-fat diet were further divided into two groups:a sedentary group(HF-Sed)and an exer⁃cise group(HF-Ex).The rats fed the normal diet were also divided into a sedentary group(ND-Sed)and an exercise group(ND-Ex).The rats in the HF-Ex and ND-Ex groups underwent a treadmill training for 8 weeks.Then the hippocampus was isolated at 48h after the last exercise.The protein and phosphorylation levels of tau,glycogen synthase kinase 3β(GSK3β),phosphoinositide 3-kinase(PI3K)and Akt were assayed using Western blotting.ResultsAfter 12 weeks of feeding,55%of rats in the high-fat diet group reached the conditions for the obesity model.After 8 weeks of treadmill ex⁃ercises,in the HF-Sed group the phosphorylation level of tau was significanlty higher than that in the ND-Sed group,while in the HF-Ex group that was significantly lower than the HF-Sed group.More⁃over,in the HF-Sed group the phosphorylation level of GSK3β Ser9 was significantly lower,and the phosphorylation level of GSK3β Tyr216 was significantly higher than the ND-Sed group,indicating the activity of GSK3β was significantly higher than the ND-Sed group.However,after 8 weeks of tread⁃mill exercise,in the HF-Ex group the phosphorylation level of GSK3β Ser9 was signfiicantly higher,and the phosphorylation level of GSK3β Tyr216 was signficanlty lower than the HF-Sed group,indicat⁃ing significantly lower activity of GSK3β than the HF-Sed group.Then,in the HF-Sed group the pro⁃tein levels of PI3K p110 and p85 subunits,and the phosphorylation levels of Akt Thr308 and Ser473 were significantly lower than those in the ND-Sed group,indicating inhibited activity of the PI3K/Akt pathway.However,in the HF-Ex group the protein levels of PI3K p110 and p85 subunits and the phosphorylation levels of Akt Thr308 and Ser473 were significanlty higher than those in the HF-Sed group,showing the activity of PI3K/Akt pathway was enhanced.ConclusionObesity induces tau hyper⁃phosphorylation in the rats hippocampus and long-term aerobic exercises can reduce tau hyperphosphor⁃ylation by increasing PI3K/Akt pathway activity and inhibiting GSK3β activity.It has a positive effect on delaying the formation of neurofibrillary tangles and improving obesity-related neurological disorders.
aerobic exercises,obesity,hippocampus,tau,GSK3β,PI3K,Akt,phosphorylation
2016.10.07
国家体育总局体育科学研究所基本科研业务费资助项目(基本15-10和16-49)
房国梁,Email:fangguoliang@ciss.cn
