武汉机器荡子湖蓝藻水华优势藻种和土嗅味藻源鉴定
2017-06-07许弯弯
万 红,许弯弯
(武昌理工学院生命科学学院,湖北 武汉 430223)
武汉机器荡子湖蓝藻水华优势藻种和土嗅味藻源鉴定
万 红,许弯弯
(武昌理工学院生命科学学院,湖北 武汉 430223)
采用PCR扩增、基因测序技术对湖泊早春季节爆发蓝藻水华的优势藻种和土嗅味藻源进行鉴定研究,实验室条件下分别测定了不同光强和温度对优势藻生物量和土嗅素产量的影响,其中,光强和温度梯度分别为16、26、36 μmol·m-2·s-1和16、26、36 ℃。结果表明,湖泊蓝藻水华的优势藻种为柔细束丝藻(Aphanizomenongracile),富营养化湖泊中的强烈异味可能来源于柔细束丝藻的土嗅素。室内模拟实验显示柔细束丝藻叶绿素含量和土嗅素产量在低温和高光强时较高,实验范围内的低温强光环境有利于其生长;温度对柔细束丝藻生长量和土嗅素产量的影响较光强显著,适宜条件下土嗅素最高产量达6 555 ng·mg-1。
蓝藻水华;基因测序;PCR扩增;土嗅味
湖泊是一种具有复杂结构的生态系统,在调节径流、供应水源、水产养殖、调节生态环境和气候等多方面具有不可替代的功能。当前,湖泊水环境污染以及富营养化问题发展迅速、危害大、处理困难、恢复缓慢,已成为世界范围内最为严重的环境问题之一[1-3]。据报道,我国湖泊爆发的水华多是蓝藻水华,包括微囊藻(Microcystis)水华、鱼腥藻(Anabeana)水华、束丝藻(Aphanizomenon)水华和拟柱胞藻(Cylindrospermopsisraciborskii)水华等[4-5]。蓝藻一般在夏季温度高于20 ℃、水体pH值偏高、光照强且持续时间长时易大量繁殖形成水华[6-7]。蓝藻水华通过产生藻毒素、腐烂时使水体缺氧和破坏正常的水生态平衡系统而影响湖泊功能并危害人体健康。目前,已有较多报道阐释了蓝藻产生藻毒素的机理和危害[8-10]。对于蓝藻产生的异味物质的研究近年来也取得较大进展。蓝藻水华爆发时经常伴随异味产生[11-12]。异味物质是藻类产生的次级代谢产物,其代表物质土霉味和草木味异味物质因很难从水体中根除而成为水体异味的主要来源。其中,土嗅素是淡水中普遍存在的一种土霉味化合物[13],最早从放线菌中被分离出来[14],随后在蓝藻、粘细菌等微生物中被分离出来[15-16]。束丝藻作为蓝藻水华的优势种,由于易产生神经毒素和土嗅素异味物质等问题,目前已成为蓝藻水华研究的热点[17]。
机器荡子湖是武汉市最深的人工湖,平均水深4 m,面积11.7万m2。因污染严重,武汉市水务局于2013年对其实施“抽水、晒底泥、换自来水、种植水生植物”等水体综合治理工程,水质一度得到很大改善。但在2016年早春季节,该湖泊爆发了蓝藻水华并散发出强烈的土腥味。爆发初期,测得湖水中ρ(总氮)、ρ(总磷)、ρ(氨氮)、ρ(硝酸盐)和ρ(叶绿素a)分别为3.485、0.235、0.022、0.083和0.145 mg·L-1,其中,总氮、总磷和叶绿素a含量已超过GB 3838—2002《地表水环境质量标准》的五类水质标准。笔者采用分子生物学技术鉴定此次蓝藻水华的优势藻种和湖泊土嗅味的来源,研究环境因子即光强和温度对优势藻生物量和土嗅素产量的影响,对科学预测湖泊中水华的产生以及采取有效措施防治水华和消除异味物质具有重要的环境和生态学意义[18]。
1 材料与分析
1.1 实验仪器和设备
PCR扩增仪(BIO-RAD T100 Thermal Cycler)、凝胶图像分析仪(GI-1)、电泳仪(DYY-8C)、气相色谱仪(GC-2014C)、分光光度计(UV-2550)、光学显微镜(OLYMPUS BX51、OLYMPUS CKX31)、恒温培养箱(DHP-9052)。
1.2 实验试剂
(1)PCR相关试剂:引物F1(3′-TTGATCCTGGCTCAGGATGA-5′),引物1480(3′-AGTCCTACCTTAGGCATCCCCCTCC-5′),引物GsyF1(5′-ATGCAACCMTTTRAACTGCC-3′),引物GGR1(5′-GCCCTCRAATTCGATTTCTTT-3′),引物GGR3(5′-CCCACAMCCAACTDTCAGTCAT-3′)。
(2)PCR预混液:Es Taq DNA聚合酶、2×Es Taq PCR 缓冲液、3 mmol·L MgCl、400 μmol·L dNTP 混合物以及PCR稳定剂和增强剂组成的预混体系。
(3)凝胶电泳相关试剂
电泳缓冲液:242 g Tris碱、57.1 mL冰乙酸、100 mL 0.5 mol·L-1EDTA,pH值为8.0;DNA凝胶加样缓冲液:w=0.25%酚蓝,w=0.25%二甲苯青FF,w=40%蔗糖;w=1%琼脂糖凝胶:0.2 g琼脂糖,20 mL TAE;DNA 标记(Marker):DM 5 000。
(4)培养基:含氨苄(Amp)的LB(Luria-Bertani)固体培养基(添加100 μL 50 mg·mL-1的Amp,用于筛选成功的克隆子),含Amp的LB液体培养基(添加100 μL 50 mg·mL-1的Amp,用于培养转化成功的克隆子)。
1.3 实验方法
1.3.1 水样采集
2016年3月6日在湖中选取3个取样点,在各样点取水样1 L,将采集水样等体积混合后取1 L水样用φ=1.5%的鲁哥氏液固定以备定量分析使用。定性样品以孔径为64 μm的25号浮游生物网在各样点水面下约0.5 m处作“∞”字形来回拖动多次,取浓缩水样2份,一份立即加入w为4%甲醛溶液,另一份不加甲醛用于24 h内活体镜检和藻类培养。
1.3.2 藻种培养和生长量测定
将纯化后的优势藻接种于LB液体培养基,置于恒温摇床连续通气培养。培养温度为25 ℃,t(光)∶t(暗)=12 h∶12 h,初始pH值为6.8左右,光强为22 μmol·m-2·s-1。每隔8~10 d左右转接1次,使藻细胞能长期处于对数期备用。为了测定光强和温度对藻种和土嗅素产量的影响,实验设置温度梯度为16、26和36 ℃,光强梯度为16、26、36 μmol·m-2·s-1。藻种产量用叶绿素a表示,土嗅味物质的产量用单位质量叶绿素a对应的土嗅素物质的质量表示(ng·mg-1)。
1.3.3 蓝藻水华优势藻种鉴定
(1)PCR扩增反应。光学显微镜下从水样中挑取单根优势藻种藻丝,加入100 μL PCR管中,藻丝样品离心后放在-80 ℃的冰箱(30 min)和60 ℃的水浴锅(6 min)中反复冻融3次破壁,另取2支PCR管制作阳性对照(拟柱孢藻基因)和阴性对照(水);再向样品内加入PCR反应体系(8 μL水、10 μL混合酶、0.5 μL引物F1、0.5 μL引物1480)进行扩增反应。扩增反应条件是94 ℃预变性3 min,94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸50 s,72 ℃反应5 min,共进行34个循环。
(2)琼脂糖凝胶电泳检测。取0.4 g琼脂糖和40 mL电泳缓冲液制成w=1.0%琼脂糖凝胶液,置于中度火力微波炉中加热融化2 min,向冷却至65 ℃左右的琼脂糖凝胶液中加入0.4 μL EB,混匀后灌注胶板制胶,待凝固后向胶板中依次加入3 μL PCR产物和DM 5000(Marker),电泳30 min[19]。
(3)目的DNA提取和纯化。利用凝胶图像分析仪检查目的条带,将出现目标条带的样品再次进行PCR扩增反应,扩增成功的DNA样品通过切胶、水浴加热溶解、离心洗脱杂质等纯化操作得以纯化[20]。
(4)目的DNA克隆测序。0 ℃操作条件下,向100 μL离心管内加入2.5 μL纯化后的优势藻DNA、2.5 μL酶溶液(Solution I)和0.25 μL PMD18-T(载体),轻弹混匀后在16 ℃条件下反应2 h,制取连接产物;取5 μL连接产物和25 μL感受态大肠杆菌Jml09加入1.5 mL离心管内,冰浴30 min,42 ℃水浴加热90 s,冰激5 min,使载体转入大肠埃希氏菌(Ecoli)中[21]。向离心管内加入LB液体培养基200 μL,37 ℃、150 r·min-1振荡培养1 h;取培养藻液50 μL涂布于Amp/LB平板,37 ℃条件下培养10~12 h,直至长出菌落。最后,进行阳性克隆筛选,将阳性克隆菌液送往生物技术公司测序。
1.3.4 水样中土嗅味藻源鉴定
使用气相色谱分析仪初步检测优势藻样品是否产生土腥味[22-23],然后利用表达土嗅素基因的GsyF1作为引物,扩增优势藻种产土嗅味基因,并对扩增产物进行凝胶电泳检测。将扩增成功的PCR产物进行基因测序,检测水样的土嗅味是否来源于优势藻种。土嗅味物质的数量根据土嗅素标准样品的气相色谱标准曲线分析。
1.3.5 优势藻藻液土嗅素基因电泳检测
为了分析土嗅味是否由优势藻种产生,实验进行分子水平的补充鉴定。挑取单根优势藻藻丝在LB液体培养基中培养2周后,分别取1 μL藻液置于12支PCR管中,经冻融破壁操作后,向样品内加入含有引物GGR1的PCR反应体系(由8 μL水、10 μL混合酶、0.5 μL GsyF1、0.5 μL GGR1配成),向对照管内加入含有引物GGR3的PCR反应体系(由 8 μL水、10 μL混合酶、0.5 μL GsyF1、0.5 μL GGR3配成)。目的基因的扩增以能表达土嗅味基因的GsyF1作为前引物,以GGR1和GGR3作为后引物。阳性对照为泥泞颤藻DNA(含有产土嗅味的基因,能扩增出目的条带)。
2 结果与分析
2.1 镜检结果
镜检显示优势藻藻丝直或稍弯曲,藻丝单生。图1(a)所示的单根藻丝含有1个异形胞和2个厚壁孢子,图1(b)所示的单根藻丝含有1个异形胞。优势藻营养细胞呈圆柱形,异形胞近似呈圆球状,厚壁孢子椭圆形,比营养细胞略大。对照藻谱图分析,这些特征与束丝藻属的柔细束丝藻特征相似。显微镜定性分析结果表明样品中只含有单一优势藻种,优势藻细胞密度为8 810 mL-1。
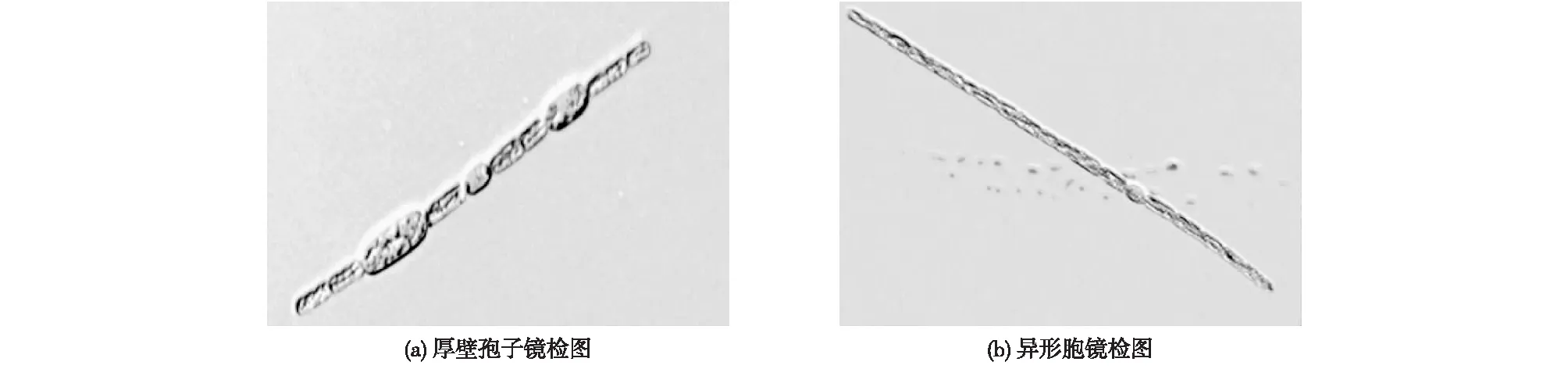
图1 优势藻单根藻丝200倍镜检图Fig.1 Microscopic figure of single filament magnified 200 times
2.2 优势藻PCR扩增产物电泳检测
优势藻PCR扩增产物凝胶电泳图谱如图2所示。
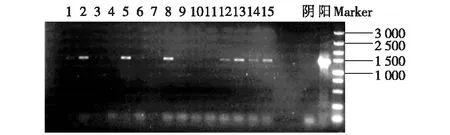
图2 优势藻PCR扩增产物电泳图谱Fig.2 The PCR amplified products electrophoresis of preponderant algae
使用含异形胞和厚壁孢子的蓝藻特异性引物F1和引物1480,扩增出优势藻的目的条带,进一步说明优势藻种中可能含有异形胞和厚壁孢子。将以上出现目的条带的第2、5、8、12、13、15泳道的PCR产物作为模板DNA再次进行PCR扩增,只有第2泳道出现1 500 bp条带,且条带亮度大,可对其进行切胶纯化操作得到目的DNA。
2.3 目的DNA克隆测序结果
将初步鉴定有阳性克隆子的培养液进行PCR扩增和凝胶电泳检测,检测图谱见图3。对比Marker可知泳道1、4、7、11对应的4个样品在1 500 bp出现条带,说明克隆培养转化成功。选择条带清晰明亮的泳道1和4对应的藻液测序,测序结果见图4。
将优势藻株的16S rDNA基因序列在美国国立生物技术信息中心(NCBI)数据库资源上进行同源性比对,结果表明序列与柔细束丝藻(AphanizomenongracileACCS 111)、鱼腥藻(Anabaenasp. 86)、水华束丝藻(Aphanizomenonflosaquae)的相似性都为99%。根据形态特征可知,鱼腥藻营养细胞为圆球形而非圆柱形;水华束丝藻藻丝平行排列,细胞聚集一起形成肉眼可见的叶片状或镰刀形群体,细胞质丝伸展至全细胞,与显微镜观察的优势藻形态不符;柔细束丝藻具有圆球形异形胞和椭圆形厚壁孢子,与显微镜下观察的优势藻株的形态特征一致,由此可确定水体中的优势藻株为柔细束丝藻。
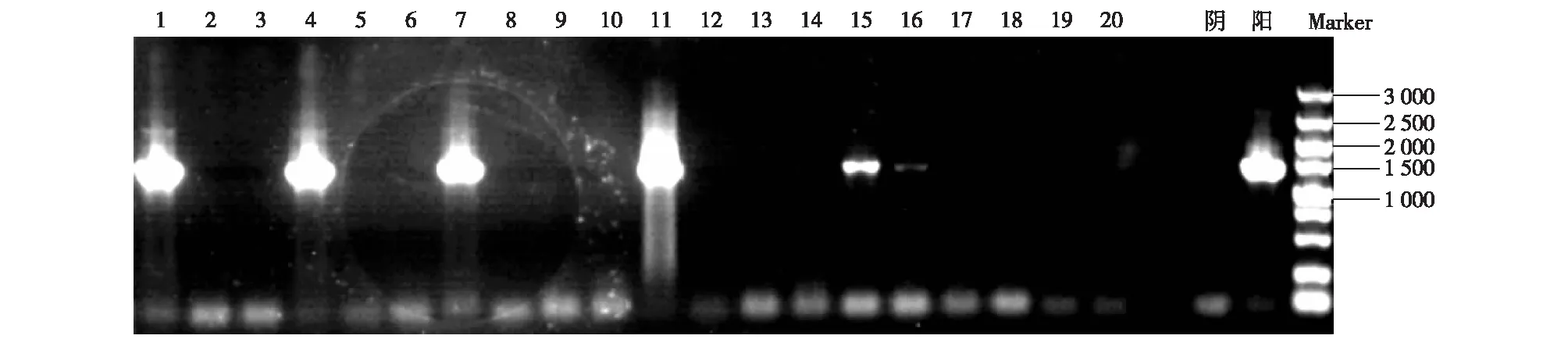
图3 优势藻纯培养藻液PCR扩增产物电泳图谱Fig.3 The PCR amplified products electrophoresis of preponderant algae pure culture

图4 优势藻种16S rDNA序列Fig.4 Gene sequence diagram of preponderant algae 16S rDNA
2.4 水样土嗅味检测结果
配制150 ng·μL-1土嗅素标准样品[24],气相色谱分析见图5。
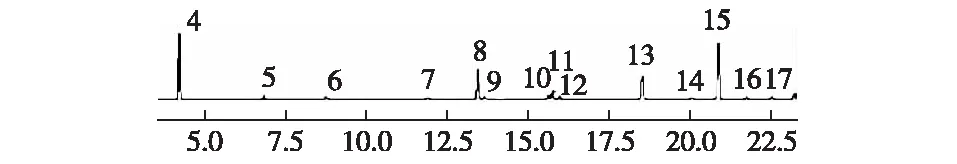
图5 土嗅素标准样品气相色谱分析Fig.5 Gas chromatogram of geosmin standard sample
4号和15号波峰明显,都可能是土嗅素的对应波峰。将标准品设成不同浓度梯度进行气相色谱分析,观察峰面积和标准样品浓度的相关性,发现保留时间为20.887 min的波峰峰面积与标准品浓度呈正相关,相关系数为0.999 4,且保留时间与15号峰对应一致,因此可确定15号峰为土嗅味物质的对应波峰。取10 mL藻液样品进行气相色谱检测,检测结果显示藻液样品在20.825 min时出现波峰,与标准样品15号峰保留时间吻合,可确定藻液样品中产生了土嗅味。
2.5 柔细束丝藻藻液土嗅素基因电泳检测
柔细束丝藻纯培养藻液土嗅素基因的电泳检测图谱如图6所示,泳道1、2、4、5、7、9、10出现目的条带,将泳道1、2对应的PCR产物进行基因测序。将柔细束丝藻纯藻液基因测序结果在NCBI数据库资源上进行同源序列比对,发现与已知柔细束丝藻(WH-1菌株)土嗅素合成酶基因(AphanizomenongracileWH-1 putative geosmin)的相似性为99%。因气相色谱分析表明藻液中产生了土嗅味,定性分析显示样品只含有单一优势藻种,由此推测柔细束丝藻中土嗅素基因得到了表达,水样中土嗅味来源于柔细束丝藻的土嗅素。

图6 柔细束丝藻纯培养藻液土嗅素基因电泳图谱Fig.6 The geosmin gene electrophoresis of the Aphanizomenon gracile pure culture
2.6 温度和光强对优势藻叶绿素a含量和土嗅素产量的影响
设置温度梯度为16、26、36 ℃,光强为22 μmol·m-2·s-1,每隔5 d取样测定叶绿素a浓度和土嗅素产量(图7)。不同温度对优势藻叶绿素a的含量和土嗅素产量均有较大影响。优势藻生长量随温度的升高而降低。特别是过了生长适应期(第16天)以后,16 ℃生长条件下的藻类生长量明显高于其他2组,而在36 ℃培养条件下藻类增长速率比较缓慢。3种温度条件下土嗅素产量先升高后降低,在培养15 d时产量最高。16 ℃生长条件下土嗅素产量明显高于其他2组。
设置光强梯度为16、26、36 μmol·m-2·s-1,温度为20 ℃,每隔5 d取样测定叶绿素a浓度和土嗅素产量(图8)。光强为16 μmol·m-2·s-1时,藻类生长量明显低于其他2组;光强为26和36 μmol·m-2·s-1时,藻种生长量无显著差异。可见,优势藻生长量随光强的增大而增加,显示出喜强光的特征。3种光强条件下土嗅素产量先升高后降低,在培养10 d时产量都达最高,最高产量达6 555 ng·mg-1。在培养前期(5~20 d),低光强条件下土嗅素产量明显低于其他组;30 d后3种光强条件下土嗅素产量无明显差异。对比图7和图8可知,对于柔细束丝藻生长量和土嗅素产量来说,温度的影响比光强要显著一些,可能是因为蓝藻含有气泡,在不利情况下能够调节自身浮力以便能最大程度地获得光照,从而减少不利光强的影响。
综上可知,在低温和高光强条件下柔细束丝藻叶绿素含量较高,其有利生长条件(低温、强光)恰好解释了柔细束丝藻水华在温度较低的早春季节大量暴发的现象。2001年,TSUJIMURA等[25]研究发现水华束丝藻在气温8 ℃的冬季仍可生长良好,而CARMICHAEL等[26]报道水华束丝藻在水温较高的夏季爆发。

图7 温度对优势藻生长量和土嗅素产量的影响Fig.7 Effects of temperature on the growth and geosmin production of preponderant algae
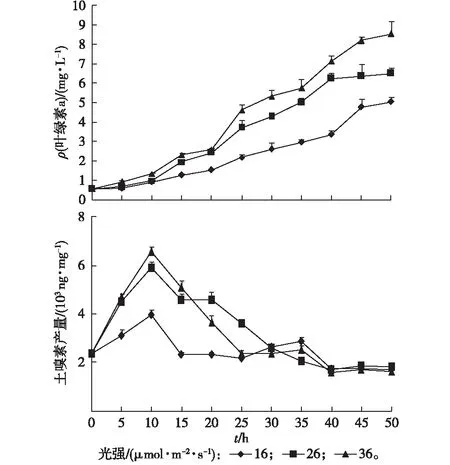
图8 光强对优势藻生长量和土嗅素产量的影响Fig.8 Effects of light intensity on the growth and geosmin production of preponderant algae
该研究结果表明柔细束丝藻在16 ℃时生长量显著高于其他高温条件,这种对温度敏感的差异性可能是由于束丝藻的种类不同导致。同样,低温和高光强条件也有利于土嗅素的产生,即合适条件下土嗅素产量可达最高,室内模拟培养条件下土嗅素产量同柔细束丝藻叶绿素产量表现出一定的正相关性。NAES 等[27]研究发现不同光强下颤藻土嗅素产量和叶绿素a含量呈正相关关系。但是,关于温度和光强对不同种类藻株异味物质的影响也有相反的结论,如BLEVINS等[28]研究发现鱼腥藻叶绿素含量和土嗅素产量呈负相关关系。
3 结论
对湖泊爆发蓝藻水华的优势藻种和土嗅味藻源进行了鉴定研究,优势藻种基因测序结果表明优势藻与柔细束丝藻的基因相似性为99%,结合镜检结果,优势藻珠的藻丝含有圆球形异形胞和椭圆形厚壁孢子,可鉴定出优势藻种为念珠藻科束丝藻属的柔细束丝藻。根据优势藻藻液土嗅素气相色谱分析和优势藻土嗅素基因测序结果,可推测水样中土嗅味可能来源于柔细束丝藻。室内模拟实验条件下,低温和高光强时纯培养柔细束丝藻叶绿素含量和土嗅素产量较高,且温度对柔细束丝藻生长量和土嗅素产量的影响较光强显著。
[1] JØRGENSEN S E.State-of-the-Art of Ecological Modelling With Emphasis on Development of Structural Dynamic Models[J].Ecological Modelling,1999,120(2/3):75-96.
[2] 国家环境保护总局.2007中国环境状况公报[R].北京:国家环境保护总局,2008:6.[State Environmental Protection Administration.The State of Environment in China in 2007[R].Beijing:State Environmental Protection Administration,2008:6.]
[3] 金根东.我国湖泊富营养化研究现状[J].现代农业科技,2008(16):334-336.[JIN Gen-dong.Research Status of Lake Eutrophication in China[J].Modern Agricultural Science and Technology,2008(16):334-336.]
[4] 黄睿,沈烽,罗娟,等.蓝藻水华消亡对湖泊表层沉积物中氨氧化细菌丰度和群落结构的影响[J].生态与农村环境学报,2015,31(3):334-339.[HUANG Rui,SHEN Feng,LUO Juan,etal.Effects of Withering of Cyanobacteria Bloom on Abundance and Community Composition of Ammonia-Oxidizing Bacteria in Surface Lake Sediments[J].Journal of Ecology and Rural Environment,2015,31(3):334-339.]
[5] 钱奎梅,刘霞,段明,等.鄱阳湖蓝藻分布及其影响因素分析[J].中国环境科学,2016,36(1):261-267.[QIAN Kui-mei,LIU Xia,DUAN Ming,etal.Distribution and Its Influencing Factors of Bloom-Forming Cyanobacteria in Poyang Lake[J].China Environmental Science,2016,36(1):261-267.]
[6] 黄炜,商兆堂.蓝藻水华轻度的显著相关环境因素识别模型[J].生态与农村环境学报,2013,29(6):804-810.[HUANG Wei,SHANG Zhao-tang.Model for Identifying Environmental Factors Significantly Associated With Cyanobacterial Bloom Intensity[J].Journal of Ecology and Rural Environment,2013,29(6):804-810.]
[7] 范裕祥,金社军,周培,等.巢湖蓝藻水华分布特征和气象条件分析[J].安徽农业科学,2015,43(4):19l-193,198.[FAN Yu-xiang,JIN She-jun,ZHOU Pei,etal.Analysis on the Distributions and Meteorological Conditions of Cyanobacteria Bloom in Chaohu Lake[J].Journal of Anhui Agricultural Sciences,2015,43(4):19l-193,198.]
[8] NEILAN B A,PEARSON L A,MUENCHHOFF J,etal.Environmental Conditions That Influence Toxin Biosynthesis in Cyanobacteria[J].Environmental Microbiology,2012,15(5):1239-1253.
[9] PAERL H W,HALL N S,CALANDRINO E S.Controlling Harmful Cyanobacterial Blooms in a World Experiencing Anthropogenic and Climatic-Induced Change[J].Science of the Total Environment,2011,409(10):1739-1745.
[10]BALLOT A,FASTNER J,WIEDNER C.Paralytic Shellfish Poisoning Toxin-Producing CyanobacteriumAphanizomenongracileinNortheast Germany[J].Applied and Environmental Microbiology,2010,76(4):1173-1180.
[11]邓绪伟,陶敏,张路,等.洞庭湖水体异味物质及其与藻类和水质的关系[J].环境科学研究,2013,26(1):16-21.[DENG Xu-wei,TAO Min,ZHANG Lu,etal.Relationships Between Odors and Algae and Water Quality in Dongting Lake[J].Research of Environmental Sciences,2013,26(1):16-21.]
[12]PETER A,KÖSTER O,SCHILDKNECHT A,etal.Occurrence of Dissolved and Particle-Bound Taste and Odor Compounds in Swiss Lake Waters[J].Water Research,2009,43(8):2191-2200.
[13]SAADOUN I M K,SCHRADER K K,BLEVINS W,etal.Environmental and Nutritional Factors Affecting Geosmin Synthesis byAnabaenasp.[J].Water Research,2001,35(5):1209-1218.
[14]GERBER N N,LECHEVALIER H A.Geosmin,an Earthy-Smelling Substance Isolated From Actinomycetes[J].Applied Microbiology,1965,13(6):935-938.
[15]LAWTON L A,ROBERTSON P K J,ROBERTSON R F,etal.The Destruction of 2-Methylisobomeol and Geosmin Using Titanium Dioxide Photocatalysis[J].Applied Catalysis B:Environmental,2003,44(1):9-13.
[16]SCHULZ S,FUHLENDORFF J,REICHENBACH H.Identification and Synthesis of Volatiles Released by the MyxobacteriumChondromycescrocatus[J].Tetrahedron,2004,60(17):3863-3872.
[17]施军琼,吴忠兴,马剑敏,等.水华束丝藻对磷的生理响应研究[J].水生生物学报,2011,35(5):857-861.[SHI Jun-qiong,WU Zhong-xing,MA Jian-min,etal.Physiological Response to Phosphorus inAphanizomenonflos-aquae[J].Acta Hydrobiological Sinica,2011,35(5):857-861.]
[18]马健荣,邓建明,秦伯强,等.湖泊蓝藻水华发生机理研究进展[J].生态学报,2011,33(10):3020-3030.[MA Jian-rong,DENG Jian-ming,QIN Bo-qiang,etal.Progress and Prospects on Cyanobacteria Bloom-Forming Mechanism in Lakes[J].Acta Ecologica Sinica,2011,33(10):3020-3030.]
[19]朱英,陶刚,刘作易,等.琼脂糖凝胶电泳操作中值得注意的几个问题[J].贵州农业科学,2004,32(6):27-28.[ZHU Ying,TAO Gang,LIU Zuo-yi,etal.Several Problems Worthy of Being Noticed During Agarose Gel Electrophoresis[J].Guizhou Agricultural Sciences,2004,32(6):27-28.]
[20]彭加平,田锦.基因操作技术[M].北京:化学工出版社,2013:44-47.[PENG Jia-ping,TIAN Jin.Gene Manipulation Technology[M].Beijing:Chemical Industry Press,2013:44-47.]
[21]钟卫鸿.基因工程技术实验指导[M].北京:化学工出版社,2007:45-56.[ZHONG Wei-hong.Experimental Guidance of Genetic Engineering Technology[M].Beijing:Chemical Industry Press,2007:45-56.]
[22]WATSON S B,BROWNLEE B,SATCHWILL T,etal.Quantitative Analysis of Trace Levels of Geosmin and Mib in Source and Drinking Water Using Headspace SPME[J].Water Research,2000,34(10):2818-2828.
[23]LI L,WAN N,GAN N Q,etal.Annual Dynamics and Origins of the Odorous Compounds in the Pilot Experimental Area of Lake Dianchi,China[J].Water Science and Technology,2007,55(5):43-50.
[24]马杰,方赤光,李青,等.气相色谱-质谱联用法测定生活饮用水中的土臭素和2-甲基异莰醇[J].中国卫生检验杂志,2016,26(1):23-25.[MA Jie,FANG Chi-guang,LI Qing,etal.Determination of Geosmin and 2-Methylisoborneol in Drinking Water by Gas Chromatography-Mass Spectrometry[J].Chinese Journal of Health Laboratory Technology,2016,26(1):23-25.]
[25]TSUJIMURA S,ISHIKAWA K,TSUKADA H.Effect of Temperature on Growth of the CyanobacteriumAphanizomenonflosaquaeinLake Biwa and Lake Yogo[J].Phycological Research,2001,49(4):275-280.
[26]CARMICHAEL W W,DRAPEAU C,ANDERSON D M.Harvesting ofAphanizomenonflos-aquaeRalfs Ex Born. and & Flah. var.Flos-aquae(Cyanobacteria) From Klamath Lake for Human Dietary Use[J].Journal of Applied Phycology,2000,12(6):585-595.
[27]NAES H,AARNES H,UTKILEN H,etal.Effect of Photon Fluence Rate and Specific Growth Rate on Geosmin Production of the CyanobacteriumOscillatoriabrevis(Kütz.) Go[J].Applied and Environmental Microbiology,1985,49(6):1538-1540.
[28]BLEVINS W T,SCHRADER K K,SAADOUN I.Comparative Physiology of Geosmin Production byStreptomyceshalstediiandAnabaenasp.[J].Water Science and Technology,1995,31(11):127-133.
(责任编辑:陈 昕)
Identification on Preponderant Algae of Cyanobacteria Bloom and Geosmin Odor Source of Wuhan Jiqidangzi Lake.
WANHong,XUWan-wan
(School of Life Science, Wuchang University of Technology, Wuhan 430223, China)
Research indicates cyanobacteria blooms not only endanger water quality,but also produce neurotoxins and odorous matter. In order to scientifically predict water bloom, and then provide fundamental knowledge on the prevention and control of water bloom and odor, preponderant algae species of cyanobacteria bloom and geosmin odor source multiplied in early spring were identified by means of PCR amplification and gene sequencing technology. The effects of different temperature and light intensity on preponderant algae biomass and geosimin odor yield were also measured respectively under laboratory conditions. The preponderant algae were cultured at three temperatures (16, 26 and 36 ℃) and three light intensities[16, 26, 36 μmol·m-2·s-1]. The preponderant algae of cyanobacteria bloom was identified asAphanizomenongracile, and the strong smell of the eutrophicated lake might come from the geosmin ofAphanizomenongracile. Laboratory simulation study indicate that the content ofAphanizomenongracilechlorophyll-a and the yield of geosmin odor became higher at low temperature and high light intensity, indicating low temperature and strong light environment were favorable growth conditions. It was found that the effect of temperature was more significant than light intensity onAphanizomenongracile, and the highest yield of the geosmin odor was 6 555 ng·mg-1under favorable conditions.
cyanobacteria bloom; gene sequencing; PCR amplification; geosmin odor
2016-07-18
湖北省教育厅科学研究计划(B2015282)
X171
A
1673-4831(2017)06-0539-07
10.11934/j.issn.1673-4831.2017.06.008
万红(1976—),女,湖北随州人,讲师,硕士,从事水污染控制与生态修复方面的研究。E-mail: 19786630@qq.com
