新型Rho激酶抑制剂FSD-C10对A53T细胞突起的作用
2017-06-07张海飞尉杰忠宋丽娟肖保国马存根1
赵 静 张 伟 马 杰 张海飞 尉杰忠△ 柴 智 宋丽娟 肖保国 马存根1,2,△
1)山西医科大学第一临床医学院神经内科 太原 030001 2)山西大同大学脑科学研究所 大同 037009 3)山西中医学院神经生物学研究中心 太原 030024 4)复旦大学华山医院神经病学研究所 上海 200025
·论著·
新型Rho激酶抑制剂FSD-C10对A53T细胞突起的作用
赵 静1,2)张 伟1,2)马 杰1,2)张海飞2)尉杰忠2)△柴 智3)宋丽娟3)肖保国4)马存根1,2,3)△
1)山西医科大学第一临床医学院神经内科 太原 030001 2)山西大同大学脑科学研究所 大同 037009 3)山西中医学院神经生物学研究中心 太原 030024 4)复旦大学华山医院神经病学研究所 上海 200025
目的 探讨新型Rho激酶抑制剂FSD-C10对A53T细胞突起的影响及其促进突起生长的机制。方法 A53T细胞进行常规培养和传代,细胞生长到90%左右后,根据不同实验的需要,分为PBS阴性对照组、Fasudil阳性对照组及FSD-C10干预组。应用Image-Pro Plus v6.0软件测量不同时间各组细胞突起的长度,Western blot检测突起相关蛋白synapsinⅠ、synaptophysin、PSD-95的表达情况。结果 FSD-C10促进A53T细胞突起的生长,synapsinⅠ蛋白表达升高。结论 FSD-C10可能通过诱导synapsinⅠ的表达实现对突起生长的促进作用。
FSD-C10;A53T细胞;突起;synapsinⅠ
Fasudil作为目前临床唯一使用的Rho激酶(ROCK)抑制剂,自1996年在日本用于动脉瘤破裂后迟发性血管痉挛临床治疗以来,目前已被广泛用于多种与血管痉挛相关疾病的治疗。ROCK是近10 a来发现参与细胞诸多活动的主要酶之一。已有研究表明,ROCK可在诸多神经系统疾病中被异常激活,在一些脑卒中、炎性脱髓鞘和炎性变性病等疾病发生发展的病理过程中扮演重要角色。ROCK抑制剂则可有效改善MS[1]及PD[2]动物模型的临床症状。近年来,越来越多的证据表明,Fasudil还可促进神经细胞轴突再生,激发神经干细胞的分化潜能,促进其分化为少突胶质细胞,并在EAE模型中显示其良好的治疗潜能[3-5]。然而,由于Fasudil口服生物利用度差,安全窗相对较小,不宜长期使用,限制了诸多慢性进行性神经元变性疾病的治疗。FSD-C10是基于Fasudil为母板合成的新型Rho激酶抑制剂衍生物。本研究利用A53T细胞探讨FDS-C10对突起生长的影响,并观察对突起相关蛋白synapsinⅠ、synaptophysin、PSD-95的表达。
1 材料与方法
1.1 材料 A53T细胞由复旦大学神经病学研究所肖保国教授惠赠。胎牛血清、DMEM高糖培养液、双抗购自Gibco公司,MTT购自美国Sigma公司,多克隆兔抗突触素Ⅰ抗体、鼠SYP单克隆抗体、兔PSD-95多克隆抗体、HRP-标记山羊抗鼠二抗购自Santa Cruz公司,HRP-标记山羊抗兔二抗购自北京博奥森公司,ECL化学发光试剂盒购自Invitrogen公司。
1.2 方法
1.2.1 细胞的培养和分组:A53T细胞复苏后,接种于10 cm2的培养皿中,在含有10%胎牛血清、1%双抗(100 kU/L青霉素、100 mg/L链霉素)的高糖DMEM培养液中进行常规培养和传代。细胞生长到约90%密度后,根据不同实验的需要,传代接种于新的10 cm2的培养皿中,同时分为PBS阴性对照组、Fasudil阳性对照组、FSD-C10干预组。首先,Fasudil阳性对照组、FSD-C10干预组分别加入Fasudil、FSD-C10,使其培养液含有终浓度为15 μg/mL的Fasudil、FSD-C10;然后将A53T细胞置5% CO2、37 ℃培养箱继续培养,于4 h、72 h分别收集细胞。重复进行3次相同的独立实验。
1.2.2 细胞突起长度的测量:细胞培养至1 h、2 h、4 h、8 h、24 h,显微镜下分别观察各组细胞。采用简单随机抽样的方法,随机挑选3个视野进行拍照,应用Image-Pro Plus v6.0软件测量细胞突起的长度。
1.2.3 Western blot分析:细胞收集后,按100 mg 样品加入0.2 mL预冷裂解液 A (40 mmol/L Tris,1%二硫苏糖醇,蛋白酶抑制剂混合物,内含1 mmol/L苯甲基磺酰氟,1 mmol/L乙二胺四乙酸,0.7 μg/mL 抑肽素,0.5 μg/mL 亮肽素)匀质化,10 000 r/min、10 min、4 ℃离心混合物,将上清转移到干净无菌的离心管中,检测蛋白含量(bicinchoninio acid,BCA)。待调整浓度后,分装置-80 ℃保存。30 μg蛋白经SDS-PAGE 电泳和转膜后,用5%牛奶封闭1 h,加入一抗(突起相关蛋白1∶500,内参 1∶10 000)4 ℃过夜。次日用PBS-T洗涤后,加入HRP-偶联的相应二抗(1∶1 000)室温2 h。再次洗涤后,条带经化学发光试剂(ECL)反应后,采用化学发光检测系统(Bio-Rad公司,Hercules,CA,美国)、图像测量软件(Bio-Rad实验室,Hercules,CA,美国)比较目标蛋白与内参蛋白比值,进行半定量计算。
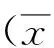
2 结果
2.1 FSD-C10对A53T细胞突起生长的影响 FSD-C10处理后,细胞突起的平均长度在培养1、2、4、8、24 h时明显长于PBS组(P<0.05),1、2、4 h时短于Fasudil组(P<0.01),8、24 h长于Fasudil组,但差异无统计学意义(P>0.05)。见图1、图2。

图1 A53T细胞在Fasudil、FSD-C10作用0、1、2、4、8、24 h的细胞形态
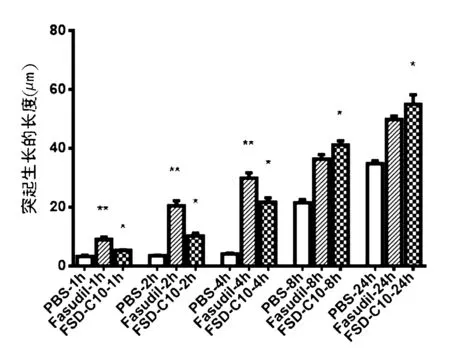
图 2 Fasudil和FSD-C10不同时间对A53T细胞突起长度的影响
2.2 FSD-C10对synapsinⅠ表达的影响 如图3所示,Fasudil及FSD-C10在4 h作用后均不能诱导synapsinⅠ的表达,而72 h时Fasudil诱导synapsinⅠ的上调,但差异无统计学意义(P>0.05),FSD-C10可显著诱导synapsinⅠ的表达(P<0.05),提示FSD-C10诱导synapsinⅠ表达的能力优于Fasudil。
2.3 FSD-C10对synaptophysin表达的影响 如图4所示,Fasudil和FSD-C10无论在4 h或72 h作用后,均不能影响A53T细胞synaptophysin的表达;与对照组相比,synaptophysin的表达无明增加或减少。
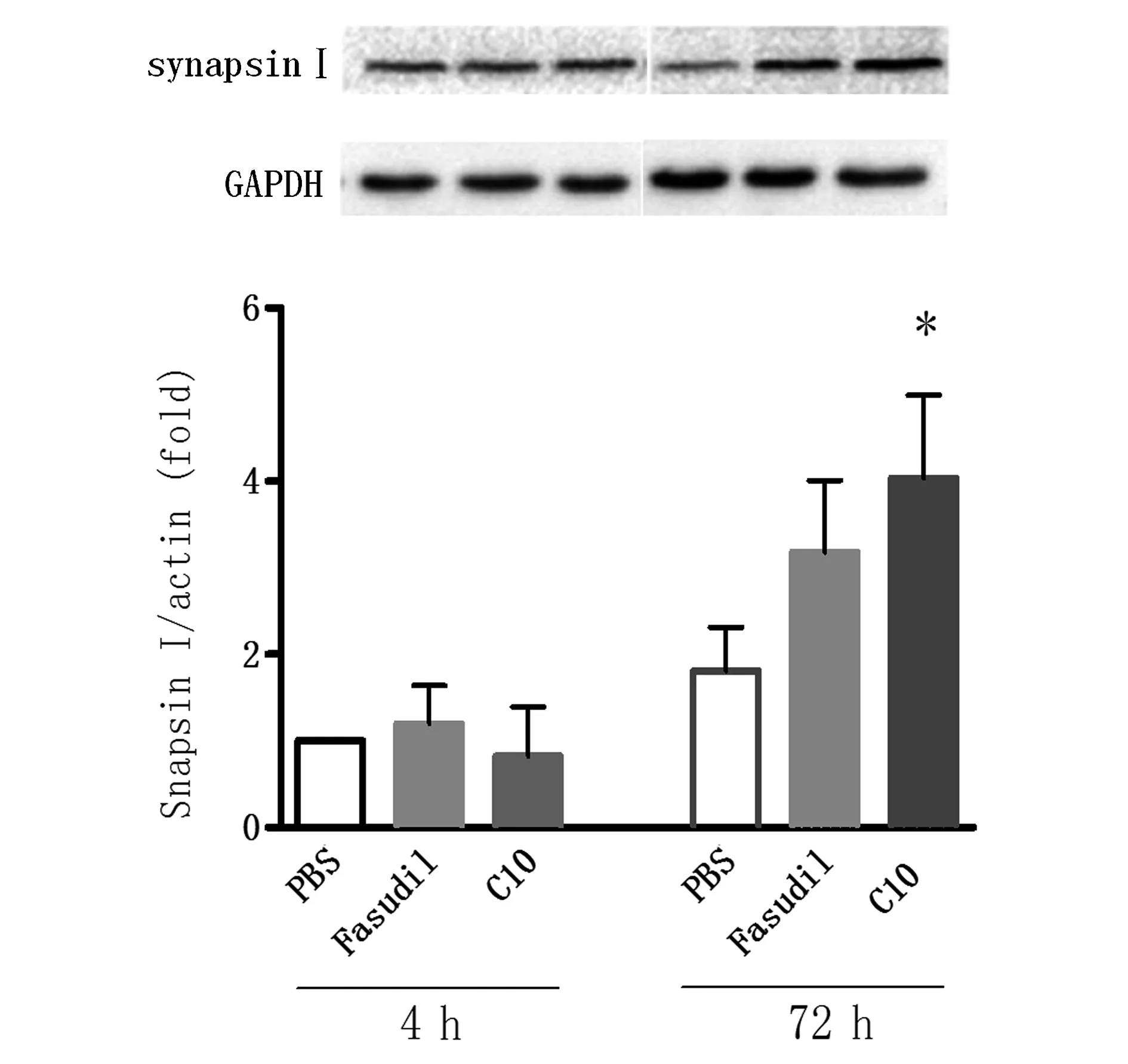
图3 Fasudil和FSD-C10诱导synapsinⅠ的表达
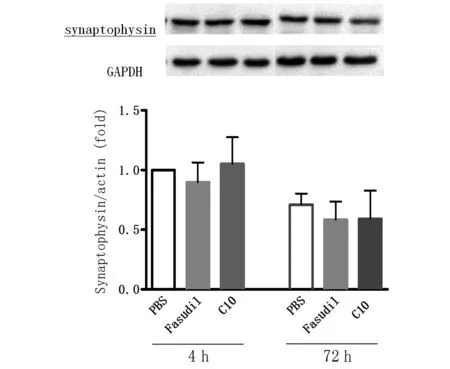
图4 Fasudil和FSD-C10诱导synatophysin的表达
2.4 FSD-C10对PSD-95表达的影响 如图5所示,Fasudil和FSD-C10作用A53T细胞4 h后,均可轻度诱导PSD-95的表达,虽差异尚未达到统计学意义。然而,Fasudil及FSD-C10作用A53T细胞72 h后,均可轻度抑制PSD-95的表达,但差异也未达到统计学意义。提示ROCK抑制剂Fasudil或FSD-C10作用早期可促进PSD-95表达,而在作用晚期则可抑制PSD-95表达。

图5 Fasudil和FSD-C10诱导PSD-95的表达
3 讨论
突触素(synapsin)是一种磷酸蛋白,与突触囊泡相连,是突触小泡特异性的外侧膜蛋白,在神经分化的早期及突起形成的过程中,每种突触素都有其特异性作用,且在大脑各区的每个发育阶段,突触素在脑结构形成的过程中及其结构和功能可塑性都是必不可少的。突触素家族包括突触素Ⅰ、Ⅱ和Ⅲ,其中突触素Ⅰ(synapsinⅠ)是囊泡的外侧膜蛋白。有研究利用基因敲除小鼠发现,在神经发育过程中,突触素发挥了重要作用,参与中枢神经系统(central nervous system,CNS)突触连接的形成和维持。敲除突触素Ⅰ基因后,虽小鼠发育仍正常,且解剖学上无明显异常,但在其脑内结构海马CA3区的突触前结构,神经末端明显缩小,且活性区突触囊泡减少,可见突触形成明显延迟[6-7]。有研究发现,敲除小鼠的突触素Ⅰ基因,小鼠的突触形成受阻[8-9]。本实验将Fasudil及FSD-C10分别添加到A53T细胞的培养液中,观察细胞突起生长情况,经Fasudil及FSD-C10处理的细胞突起的平均长度长于PBS组,说明Fasudil及FSD-C10具有促进A53T细胞突起生长的作用,而Fasudil及FSD-C10对synapsinⅠ的表达呈现诱导作用,且在后期FSD-C10诱导synapsinⅠ表达的能力优于Fasudil,表明Fasudil及FSD-C10通过诱导突触素Ⅰ的表达实现对突起生长的促进作用。而在早期Fasudil作用的细胞突起生长平均长度长于FSD-C10作用的细胞,而后期FSD-C10作用后细胞突起生长平均长度长于Fasudil作用的细胞。因此,FSD-C10在具有Fasudil作用优点的同时,长期作用可能比Fasudil更稳定或有效。
突触体素(synaptophysin)是一种位于突触前膜的囊泡蛋白,与突触的结构可塑性和功能可塑性密切相关[10]。本实验中,在Fasudil及FSD-C10的作用下,与PBS组相比,未见synaptophysin的表达显著增加或减少,结果显示,Fasudil及FSD-C10尽管可促进细胞突起的形成,但似乎可能并不通过突触体素的作用实现。
PSD是一层均质的致密物质,位于突触后膜内侧胞质面,包含多种蛋白质,突触后致密蛋白-95(postsynaptic density protein-95,PSD-95)是其主要蛋白质成分之一,在突触可塑性中起重要作用。突触可塑性是指突触的形态和功能发生较为持久改变的特性或现象,是学习记忆形成的神经生理学基础[11],包括功能可塑性和结构可塑性两大部分[12]。PSD-95为突触后膜的标记蛋白,对维持树突棘的稳定具有重要作用[13]。本实验中,Fasudil及FSD-C10早期略可诱导PSD-95的表达,后期Fasudil及FSD-C10似乎抑制了PSD-95的表达,表明PSD-95在突触结构形成的早期及维持其结构的稳定中起作用。但突触形成后是否降解或转化为其他蛋白有待进一步研究。
综上所述,与Fasudil比较,FSD-C10也可有效促进A53T细胞突触生长,其完整和准确的机制尚未阐明。然而,我们的结果提示,Fasudil和FSD-C10促进细胞突起形成可能与突触素Ⅰ的诱导相关,而与突触体素无关;同时,Fasudil和FSD-C10对PSD-95的作用,早期表现为诱导,晚期则为抑制。此外,本研究还显示,FSD-C10对突触素的作用可能优于Fasudil,因此有必要对FSD-C10化合物进行深入研究,以便为今后临床治疗相关疾病,如脑卒中、炎性脱髓鞘和炎性变性病提供实验依据。
[1] Huang XN,Fu J,Wang WZ.The effects of fasudil on the permeability of the rat blood-brain barrier and blood-spinal cord barrier following experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2011,239(1/2):61-67.
[2] Rodriguez-Perez AI,Dominguez-Meijide A,Lanciego JL,et al.Inhibition of Rho kinase mediates the neuroprotective effects of estrogen in the MPTP model of Parkinson’s disease[J].Neurobiol Dis,2013,58:209-219.
[3] Hou Y,Zhou L,Yang QD,et al.Changes in hippocampal synapses and learning-memory abilities in a streptozotocin-treated rat model and intervention by using fasudil hydrochloride[J].Neuroscience,2012,200:120-129.
[4] Ding J,Yu JZ,Li QY,et a1.Rho kinase inhibitor Fasudil induces neuroprotection and neurogenesis partially through astroeyte-defived GCSF[J].Brain Behav Immun,2009,23(8):1 083-1 088.
[5] Baer AS,Syed YA,Kang SU,et al.Myelin-mediated inhibition of oligodendroeyte precursor differentiation can be overcome by pharmacological modulation of Fyn-RhoA and protein kinase C signaling[J].Brain,2009,132(Pt 2):465-481.
[6] Bloom O,Evergren E,Tomilin N,et al.Colocalization of synapsin and actin during synaptic vesicle recycling[J].J Cell Biol,2003,161(4):737-47.
[7] Iga M,Inui M,Sobue K.Characterization of the interac-tion between synapsinⅠ and calspectin (brain spectrin or fodrin)[J].Biochem Biophys Res Commun,1997, 231(3):852-855.
[8] Ferreira A,Chin LS,Li L,et al.Distinct roles of synapsinⅠ and synapsinⅡ during neuronal development[J].Mol Med,1998,4(1):22-28.
[9] Ferreira A,Han HQ,Greengard P,et al.Suppression of synapsinⅡ inhibits the formation and maintenance of synapses in hippocampal culture[J].Proc Natl Acad Sci USA,1995,92(20):9 225-9 229.
[10] Kwon SE,Chapman ES.Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons[J].Neuron,2011,70(5):847-854.
[11] Richter JD,Klann E.Making synaptic plasticity and memory last:mechanisms of translational regulation[J].Genes Dev,2009,23(1):1-11.
[12] 陈燕.神经元的突触可塑性与学习和记忆[J].生物化学与生物物理,2008,48(6):610-619.
[13] Ehrlich I,Klein M,Rumpel S,et al.PSD-95 is required for activity-driven synapse stabilization[J].Proc Natl Acad Sci USA,2007,104(10):4 176-4 181.
(收稿2017-03-23)
The effect of novel Rho kinase inhibitor FSD-C10 on neurite of A53T cell
Zhao Jing﹡,Zhang Wei,Ma Jie,Zhang Haifei,Yu Jiezhong,Chai Zhi,Song Lijuan,Xiao Baoguo,Ma Cungen
﹡Department of Neurology,the First Clinical Medical College,Shanxi Medical University,Taiyuan 030001,China
Objective To investigate the effect of novel Rho kinase inhibitor FSD-C10 on neurite of A53T cell and its possible mechanism of the neurite outgrowth.Methods A53T cells were routinely cultured and divided into three groups:PBS group,Fasudil group and FSD-C10 group.The neurite length of A53T cells was measured by Image-Pro Plus v6.0 at different time points.The expressions of synapsinⅠ,synaptophysin and PSD-95 protein were examined by Western blot.Results Fasudil and PSD-C10 promoted neurite outgrowth of A53T cells.The expression of synapsinⅠ protein in A53T cells was increased,especially in FSD-C10-treated A53T cells.Both Fasudil and FSD-C10 slightly stimulated the PSD-95 at early state,but inhibited it at late state.Conclusion FSD-C10 can promote neurite outgrowth of A53Tcells possibly by its effect on the expression of synapsinⅠ protein.
FSD-C10;A53T cells;Neurite;SynapsinⅠ
国家自然科学基金2012年面上项目(81272163);山西省回国留学人员重点科研资助项目(2014-重点7);山西中医学院“2011”培育计划项目(2011PY-1)
R-33
A
1673-5110(2017)11-0001-04
△通讯作者:尉杰忠(1977-),在读博士,副教授,硕士生导师;马存根(1960-),博士,教授,博士生导师,E-mail:macungen2001@163.com
