不同季节的显齿蛇葡萄中二氢杨梅素和总黄酮的含量测定
2017-06-07雷华平冯纪南任名新
雷华平, 冯纪南, 任名新, 张 辉
(湘南学院1.药学院;2.化学生物与环境工程学院,湖南 郴州 423000)
不同季节的显齿蛇葡萄中二氢杨梅素和总黄酮的含量测定
雷华平1, 冯纪南2*, 任名新1, 张 辉1
(湘南学院1.药学院;2.化学生物与环境工程学院,湖南 郴州 423000)
目的:测定不同季节和不同干燥方法的显齿蛇葡萄中的二氢杨梅素和总黄酮的含量。方法:采用高效液相色谱法测定二氢杨梅素的含量。用三氯化铝分光光度法测定总黄酮的含量;结果:五月的显齿蛇葡萄中的二氢杨梅素含量最高;四月的显齿蛇葡萄中的总黄酮含量最高。烘干法的样品中总黄酮和二氢杨梅素最高。结论:4~5月为显齿蛇葡萄的最佳采收期,采后烘干较好。研究结果为合理利用显齿蛇葡萄资源提供了可靠依据。
显齿蛇葡萄;二氢杨梅素;总黄酮;含量测定
显齿蛇葡萄(Ampelopsisgrossedentata),又名藤茶,为葡萄科蛇葡萄属的一种野生藤本植物。分布于广西、广东、云南、贵州、湖南、湖北、江西、福建等省(自治区)。显齿蛇葡萄全株药用,味甘、淡,性凉,具有清热解毒、祛风湿、强筋骨等功效,用于治疗感冒发热、咽喉肿痛、黄疸型肝炎等症状[1]。从显齿蛇葡萄茎叶中提取的总黄酮具有抗血栓、降脂、保肝、降血糖、抗炎、镇痛和提高免疫功能的作用[1-2]。二氢杨梅素是其中最重要的黄酮类化合物,具有消炎、止咳、祛痰、镇痛、抑菌、抗高血压、消脂以及乙醇中毒等药理作用[2-4],因而总黄酮和二氢杨梅素的测定是该药材质量评价最为重要的依据。目前关于显齿蛇葡萄总黄酮及其二氢杨梅素的测定已有报道[5-7],但同时测定不同月份显齿蛇葡萄中总黄酮及其二氢杨梅素的含量,还未见报道。
本文通过对不同季节的显齿蛇葡萄中的总黄酮和二氢杨梅素的分析研究,了解其在不同生长期的动态积累规律,为适时采收显齿蛇葡萄,合理开发利用提供依据。
1 仪器与材料
1.1 仪器
高效液相色谱仪(泵L-7100,UV-Vis检测器L-7420,柱温箱L-7300,日本Hitachi公司);色谱柱(Hypersil BDS C18(5 μm,4.6 mm×250 mm),上海依利特分析仪器有限公司);紫外可见分光光度计(L-3010型,日本Hitachi公司);数控超声波清洗器(KQ2200E型,昆山市超声仪器有限公司);电子天平(AUY220,日本岛津公司);三重纯水蒸馏器(SZ-97,上海勇规分析仪器有限公司)。
1.2 材料
乙醇(95%分析纯,安徽安特食品股份有限公司);石油醚(沸程:60~90 ℃,天津市光复科技发展有限公司);甲醇(色谱纯,国药集团化学试剂有限公司);结晶氯化铝(分析纯,天津市北联精细化学品开发有限公司);二氢杨梅素对照品(西安开来生物工程有限公司)。
显齿蛇葡萄于2014年的4月到12月的每个月的中旬采于湖南省郴州市湘南学院后山,经湘南学院彭名勇副教授鉴定为葡萄科蛇葡萄属的显齿蛇葡萄A.grossedentata,因1—3月显齿蛇葡萄几乎没有叶子,故未采集样品。
2 实验方法与结果
2.1 不同季节的显齿蛇葡萄的二氢杨梅素的含量测定
2.1.1 显齿蛇葡萄的前处理
将采集的不同季节的显齿蛇葡萄阴干,干燥后用粉碎机粉碎,放于干燥处。
2.1.2 样品溶液的制备
取显齿蛇葡萄约5 g(粉碎,过20目筛),精密称定,置索氏回流器中,加石油醚适量加热回流2 h,挥干石油醚,得药渣,精密称定。精密称取药渣1 g,精密加入95%乙醇50 mL,称定重量,超声处理(功率300 W,频率40 kHz)30 min,放冷,再称定重量,用95%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.1.3 对照品溶液的制备
精密称取已知含量的二氢杨梅素对照品10 mg于10 mL容量瓶中, 用甲醇定容至刻度 , 充分摇匀备用。
2.1.4 二氢杨梅素标准曲线的测定
精密吸取2.1.3配制的二氢杨梅素对照品溶液0.2,0.4,0.8,1.2,2.0 mL,置于10 mL的容量瓶中,加甲醇定容,应用前经过0.45 μm微孔滤膜过滤。色谱柱: Hypersil BDS 不锈钢柱(4.6 mm ×250 mm),流动相:甲醇-水-磷酸(27∶73∶0.1) ;流速: 1.0 mL/min;进样量:25 μL;柱温:30 ℃;检测波长:294 nm。以浓度为X轴,以峰面积为Y轴,绘制标准曲线。得标准曲线回归方程:Y=338 07X+492 88,线性范围为20~200 μg/mL(R2=0.999 1)。
2.1.5 精密度试验
精密吸取对照品溶液 25 μL,连续进样 6 次,记录峰面积, RSD值为0.8%,结果表明,精密度良好。
2.1.6 重复性试验
精密称取同一样品6份,每份 5.000 g,分别按2.1.2项下操作制备供试品溶液,进样 25 μL,记录峰面积,RSD 值为 1.2%,结果表明本方法重复性良好。
2.1.7 稳定性试验
对同一供试品溶液在12 h内每隔2 h 进样 1 次,记录峰面积,RSD 值为 1.4%。结果表明,供试液在 12 h内稳定。
2.1.8 加样回收率试验
精密称定已知量的样品粗粉6份,每份 5.000 g,定量加入适量的对照品溶液,按供试品液制备法制备供试液,HPLC测定,记录峰面积,计算平均回收率。平均回收率为 97.5%,RSD值为 2.0%。
2.1.9 样品含量测定
精密量取样品溶液1 mL置于10 mL容量瓶中,加甲醇定容至刻度,应用前经过0.45 μm微孔滤膜过滤。色谱条件见2.1.4。记录不同季节显齿蛇葡萄样品溶液的峰面积,结果见表1。
2.2 不同季节的显齿蛇葡萄的总黄酮的含量测定
2.2.1 样品溶液的制备
同2.1.2处理。
2.2.2 对照品溶液的制备
精密称取已知含量的二氢杨梅素对照品10 mg于10 mL容量瓶中, 用95%乙醇定容至刻度 , 充分摇匀备用。
2.2.3 最大波长的确定
精密量取二氢杨梅素对照品母液1 mL,置于10 mL容量瓶中,加入1 mL蒸馏水,加入3 mL 5% AlCl3乙醇溶液,再加95 %已醇定容至刻度,显色40 min,于紫外可见分光光度计扫描波长,确定最大吸收波长为312 nm。这与何桂霞等[7]测定瑶族藤茶总黄酮含量时选择的λmax=314 nm相差不大,故选择312 nm为最大吸收波长。
2.2.4 总黄酮标准曲线的测定
分别吸取对照品溶液0,0.2,0.4,0.6,0.8,1.0 mL于10 mL的容量瓶中,分别向各个容量瓶中加入1 mL蒸馏水和3 mL 5% AlCl3乙醇溶液,用95%乙醇稀释至刻度,于最大波长处测得各吸光度A值。每组做两次平行实验,绘制标准曲线,以浓度为X轴,吸光度为Y轴。得标准曲线回归方程:Y=0.057 4X+0.205 3,线性范围为0~60 μg/mL(R2=0.9943).
2.2.5 总黄酮的含量测定
从样品溶液中量取1 mL样品溶液置于10 mL容量瓶中,用95%乙醇定容到刻度,充分摇匀,再在上述容量瓶中吸取0.5 mL的溶液置于10 mL容量瓶中,加水1 mL,加入5% AlCl3乙醇溶液3 mL,再加95%乙醇定容至刻度,显色40 min,于最大波长处测得吸光度A值。为避免偶然误差,再重复上述操作两次,记录数据。结果见表1。
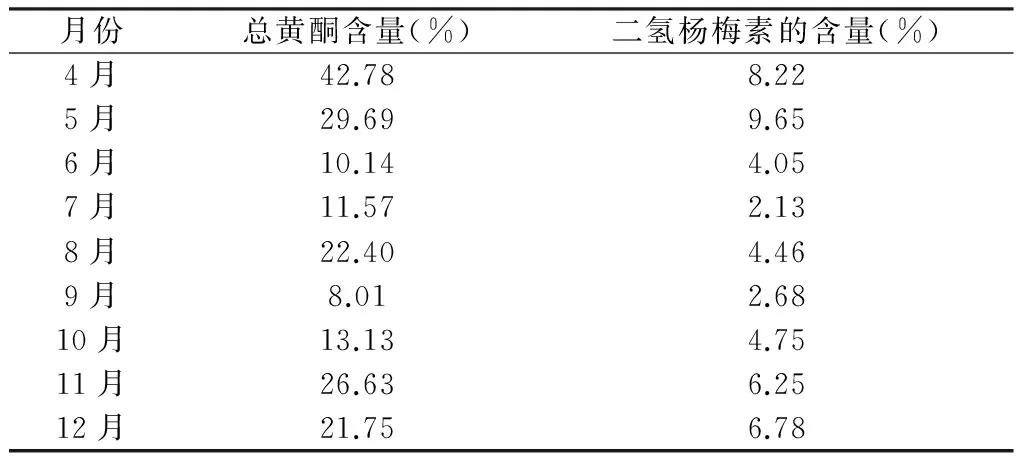
表1 不同季节显齿蛇葡萄总黄酮 和二氢杨梅素的含量(n=3)
由表1可以得出,在4月到12月的显齿蛇葡萄中,不同月份显齿蛇葡萄中总黄酮和二氢杨梅素的含量差异很大,其中四月的显齿蛇葡萄中总黄酮的含量最高,5月的显齿蛇葡萄中二氢杨梅素的含量最高。
2.3 不同干燥工艺的显齿蛇葡萄的二氢杨梅素和总黄酮的含量测定
2.3.1 显齿蛇葡萄的前处理
将4月在湘南学院后山采集的新鲜的显齿蛇葡萄平均分成4份,分别用晒干、阴干以及置于50 ℃的烘箱中烘干6小时以及杀青后晒干的方法进行处理,处理完之后用粉碎机粉碎,放于干燥处保存。
2.3.2 样品溶液的制备
分别取4种干燥工艺干燥的显齿蛇葡萄约5 g(粉碎,过20目筛),精密称定,同2.1.2处理。
2.3.3 二氢杨梅素的含量测定
同2.1.9处理。
2.3.4 总黄酮的含量测定
同2.2.5处理。
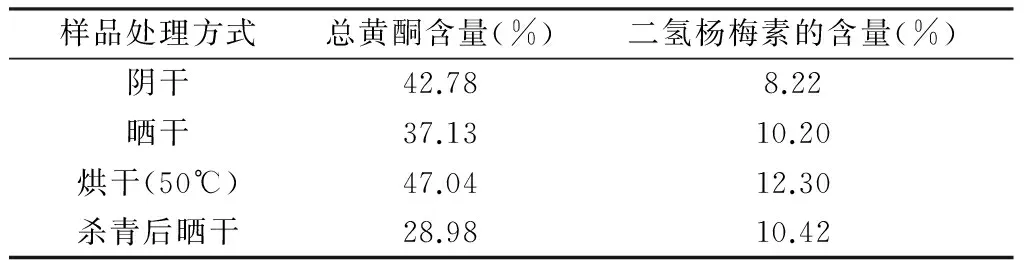
表2 不同干燥工艺显齿蛇葡萄总黄酮 和二氢杨梅素的含量(n=3)
由表2可见,50 ℃烘干处理的显齿蛇葡萄中的总黄酮和二氢杨梅素的含量最高。
3 讨 论
(1) 黄酮类化合物水溶性较差,醇溶性较好,故提取时需用乙醇作溶剂。乙醇作溶剂时,不可避免地将脂溶性色素一起提取出来,这将干扰比色测定,故样品先以石油醚回流脱脂,以剔除其干扰。脱脂后的样品进行超声提取,比熊皓平等[8]的回流提取缩短了提取时间。
(2) 从实验结果可以看出,在不同月份总黄酮的变化趋势与二氢杨梅素的变化趋势基本一致。4~5月的显齿蛇葡萄中总黄酮和二氢杨梅素的含量最高,然后逐渐回落,在8月份有个小高峰,9月之后逐渐回升。因此,显齿蛇葡萄的最佳采收季节是4~5月份,这与民间的采摘日期一致。
(3) 本文讨论不同季节的同一产地的显齿蛇葡萄中总黄酮和二氢杨梅素的含量,以及不同干燥方法对有效成分含量的影响,为合理栽培和采收显齿蛇葡萄提供了科学依据。
[1] 陈晓明,倪峰.藤茶药理作用研究进展[J].海峡药学,2010,22(1):16-17.
[2] 刘建新,周天达. 瑶族藤茶对兔肠平滑肌的影响和解酒实验研究[J].中国民族医药杂志,1998,4(2):43.
[3] 钟正贤, 覃洁萍, 周桂芬,等. 广西瑶族藤茶中双氢杨梅树皮素的药理研究[J].中国民族医药杂志,1998, 4(3):42-44.
[4] 周天达,周雪仙.藤茶中双氢黄酮醇的分离结构鉴定及其药理活性[J].中国药学杂志, 1996,31(8):458-461 .
[5] SHEN YI, LINDEMEYER A K, GONZALEZ C, et al. Dihydromyricetin as a novel anti-alcohol intoxication medication[J] J Neurosci, 2012, 32(1):390-401.
[6] 田森林,张友胜,杨英雄,等.反相高效液相色谱法测定显齿蛇葡萄中二氢杨梅素的含量[J].湖南农业大学学报,2002,28(1):33-34.
[7] 何桂霞,裴刚,周天达,等.显齿蛇葡萄中总黄酮和二氢杨梅素的含量测定[J].中国中药杂志,2000,25(7):424-425.
[7] 何桂霞,何群,裴刚,等.瑶族藤茶中总黄酮类成分的含量测定[J]. 湖南中医药导报,1998,5(12): 30-31.
[9] 熊皓平,杨伟丽,何国庆,等. 分光光度法测定显齿蛇葡萄总黄酮含量[J]. 食品科学,2004,25(2):144-145.
Determination of Dihydromyricetin and Total Flavones inAmpelopisgrossedentatain Different Seasons
Lei Huaping1, Feng Jinan2*, Ren Mingxin1, Zhang Hui1
(1.School of Pharmaceutical Sciences; 2. School of Chemistry, Biology and Environmental Engineering,Xiangnan University, Chenzhou 423000, China)
Objective: To determine the content of the total flavones and dihydromyricetin ofAmpelopisgrossedentatafrom different seasons with different drying methods. Methods: High performance liquid chromatography was employed to determine dihydromyricetin content. And total flavones were determined with AlCl3spetrophotometer method. Results:A.grossedentatain May had the highest content of dihydromyricetin. AndA.grossedentatain April had the highest content of total flavones. The sample with oven drying had the highest content of dihydromyricetin and total flavones. Conclusion: The optimum picking time forA.grossedentatawas between April and May. After picking the sample should be oven dry. The research provided a reliable gist for rational utilization ofA.grossedentata.
Ampelopisgrossedentata; dihydromyricetin; total flavones; content determination
10.3969/j.issn.1006-9690.2017.01.011
2016-04-23
湖南省自然科学基金项目(20015JJ3111);郴州市科技计划项目(2012cj125)。
雷华平(1979—),男,博士,副教授,主要从事中药资源化学研究。E-mail: audenlei@163.com
*通讯作者: 冯纪南,E-mail: czffjjnn@163.com
R284.1
A
1006-9690(2017)01- 0037-03
