耐镉菌株N-17的分离、鉴定及其强化印度芥菜富集土壤镉的潜力
2017-06-06杜东霞尹红梅贺月林
杜东霞,杜 宇,许 隽,尹红梅,贺月林
(湖南省微生物研究院,湖南 长沙 410009)
耐镉菌株N-17的分离、鉴定及其强化印度芥菜富集土壤镉的潜力
杜东霞,杜 宇,许 隽,尹红梅,贺月林*
(湖南省微生物研究院,湖南 长沙 410009)
从镉污染稻田土壤中分离到一株兼具活化碳酸镉、分泌铁载体和固氮能力的耐镉菌株N-17,结合菌体形态、生理生化及16S rDNA分析,初步鉴定其为伯克氏菌属。将其用于强化印度芥菜修复镉污染土壤,盆栽试验结果表明,该菌株能增加污染土壤中可交换态镉的含量,与对照相比,接种该菌后,印度芥菜的生物量提高了9.41%,株高增加了20.2%,地上部和地下部镉含量分别比对照提高了49%和67%。
铁载体;固氮;伯克氏菌属;植物修复
随着我国工业化和城市化进程的加快,环境问题日益突出。根据2014年4月环保部和国土资源部联合发布的《全国土壤污染状况调查公报》显示,全国耕地土壤污染物点位超标率19.4%,污染类型以无机型为主,无机污染物超标点位数占全部超标点位的82.8%,主要无机污染物包括镉(Cd)、汞(Hg)、砷(As)、铜(Cu)、铅(Pb)、铬(Cr)、锌(Zn)、镍(Ni)等重金属,点位超标率分别为7.0%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%。以目前全国粮食播种面积1.35亿hm2推算,有待修复的耕地污染面积约为0.26亿hm2[1-2]。如何修复并提高重金属污染土壤的生产力,已成为事关我国农业可持续发展和环境质量改善的研究热点。
传统的物理、化学修复方法大都存在修复成本高、环境风险大、破坏土壤结构、降低土壤生物活性和土壤肥力等缺点。1983年Chaney最早提出了植物修复的概念[3]。但单一应用植物修复技术会受到植物生物量、生长速度、土壤理化性质及污染物在土壤中的分布和生物利用度等条件的限制,导致其在生产上的推广应用进展缓慢[4]。
微生物,特别是细菌,比表面积大,数量多,代谢活动旺盛,在重金属污染土壤修复方面具有独特的作用,不仅可通过自身吸附累积重金属,还可通过分泌铁载体、功能酶、有机酸及生物表面活性剂等物质活化土壤重金属,促进植物吸收重金属。微生物与超积累植物的联合修复能充分利用其共生关系,发挥各自优势,协同增效,达到高效修复重金属污染土壤的目的[5-8]。Dimkpa等[9]发现链霉菌tendae F4产生的铁载体能显著增强向日葵对镉的吸收能力。吴秉奇等[10]从镉超积累龙葵叶片中筛选到一株内生细菌DE5,结果表明,接种DE5能够强化青葙的镉吸收效果,其作用效果好于浇施螯合剂EDTA。
本研究从重金属污染土壤中分离到1株兼具活化碳酸镉、分泌铁载体和固氮能力的多功能镉耐性菌株N-17,该菌株能够和超累积植物印度芥菜共生,并通过促生长(固氮作用)、活化镉(分泌铁载体和有机酸等)等作用提高印度芥菜的修复效率,以期为植物-微生物联合修复重金属污染土壤的大面积应用提供理论依据和试验材料。
1 材料与方法
1.1 试验材料
供试植物,印度芥菜(Brassicajuncea)。盆栽用土采自岳阳县某镇中轻度镉污染稻田0~20 cm土层,晾干过筛后使用,土壤有机质含量37.2 g·kg-1,镉含量2.33 mg·kg-1,碱解氮、速效磷、速效钾含量分别为180.0、12.9、58.0 mg·kg-1。筛菌用土采自株洲市清水塘工业区某冶炼厂附近0~20 cm土层,保存于无菌纸袋中,带回实验室供菌株分离、筛选,土壤有机质含量30.8 g·kg-1,镉含量12.0 mg·kg-1,碱解氮、速效磷、速效钾含量分别为90.5、21.2、68.9 mg·kg-1。
1.2 仪器与试剂
主要仪器:原子吸收光谱仪,AA-670型,日本岛津制作所生产;紫外分光光度计,751GW,惠普上海分析仪器有限公司生产;pH计,8904型,江苏江环分析仪器有限公司生产。
主要试剂:CdCl2、Pb(NO3)2、ZnSO4、CoCl2、CuSO4、K2Cr2O7、CdCO3,均为分析纯,购自上海生物工程技术服务有限公司。
Ashby无氮培养基参照文献[11]中的配方配制;改进的MSA培养基、CAS检测平板及CAS染液参照文献[12]中的配方配制。
1.3 耐镉菌株筛选及驯化
称取10 g新鲜土壤样品,放入装有90 mL无菌水的三角瓶中,利用常规梯度稀释方法获得各个梯度的土壤稀释液,取适量分别涂布在含Cd的LB固体培养基上,待长出菌落后,参照文献[7]中的方法进行分离纯化。
将筛选到的菌株分别涂布到Cd2+含量为2、4、6、8、10 mmol·L-1的LB固体培养基上,培养后,将长势较好的菌株接种到Cd2+含量比筛选平板高2 mmol·L-1的固体培养基上逐步驯化培养。以相同的方法逐步淘汰镉耐性较差的菌株,记录不同菌株的最高耐受浓度[7]。
1.4 菌株的性能测试
1.4.1 重金属抗性测定
参照文献[7]中的方法,将分离纯化的菌株在LB液体培养基中培养至D600达0.2时,在培养液中分别加入相应浓度(设置浓度梯度)的重金属(Cd2+、Zn2+、Co2+、Pb2+、Cr2+、Cu2+),每个处理设置3个重复,培养24 h后,测定各个含有重金属培养液的D600值。
1.4.2 固氮酶活测定
将纯化后的耐镉菌株转接到固体Ashby无氮培养基,28 ℃培养4 d,挑选生长旺盛、较大、黏稠的菌落保存到斜面备用。用乙炔还原法测定所分离细菌的固氮酶活性[11]。
1.4.3 菌株产铁载体的能力分析
将纯化后的耐镉菌株采用点接方法转接到CAS检测平板上,在30 ℃恒温培养箱中培养1~7 d,每12 h观察一次结果,根据黄色晕圈的有无及大小筛选出产铁载体能力较强的菌株,保存留用。对筛选到的可产铁载体的菌株,采用改进的液体MSA培养基定量测定其产铁载体的能力[12]。
1.5 菌株16S rDNA的PCR扩增和系统发育分析
基因组DNA提取及引物设计参照文献[13]。PCR扩增反应参照文献[14]中的方法,并对其加以改进(PCR 反应缓冲液改用2×GC缓冲液)。PCR产物的纯化和测序由上海生工生物工程技术服务有限公司完成。
通过Blast程序,将待测定的序列与GenBank数据库中已有的16S rDNA序列进行相似性分析[15],利用 DNAstar构建系统进化树。
1.6 菌株对重金属镉的活化作用
将菌株N-17活化后制成菌悬液,以5%的接种量接入加有碳酸镉(100 mg ·L-1)的液体培养基中,30 ℃摇床振荡培养48 h。以加有等量去离子水的液体培养基为对照。每个处理重复3次,10 000 r·min-1离心5 min,收集上清液,测定上清液pH值及其中Cd2+浓度,计算活化率。
将菌株N-17活化后制成菌悬液,接入重金属镉含量为12 mg·kg-1的土壤中(筛菌用土),使菌株的细胞数量达到2×108cfu·g-1,对照加液
体培养基,重复3次,30 ℃恒温培养。每5 d测定1次镉耐性菌株的数量。同时采用改进的Tessie连续浸提法,测定土壤中不同形态镉的含量。
1.7 N-17与印度芥菜联合土壤修复试验
在湖南省微生物研究院网室内开展盆栽试验,土壤类型为紫潮泥土(pH 5.2)。供试土壤经晾干、粉碎、过筛后,装盆,每盆5 kg,按照土壤质量的1%添加N-17,以不添加N-17菌剂的为对照。每个处理重复3次,随机排列。各处理管理措施相同。
1.8 数据处理
用SPSS 17.0软件对数据进行整理及方差分析,采用Duncan法对有显著差异的处理进行多重比较。
2 结果与分析
2.1 菌株N-17的形态特征及生理生化特性
经筛选、驯化,本研究得到1株耐镉菌株,将其命名为N-17。该菌株菌体呈杆状,革兰氏染色呈阴性,无芽孢。菌落为不规则圆形,表面光滑湿润,易挑起,边缘不整齐。主要生理生化特性结果详见表1。
2.2 菌株N-17的重金属抗性
N-17菌株对Cd2+、Zn2+、Co2+、Pb2+、Cr2+、Cu2+表现出不同的程度的抗性(图1),其中,对镉的抗性最高,在LB固体培养基上最高可耐受18 mmol·L-1的镉。
2.3 菌株N-17的固氮能力
表1 菌株N-17的生理生化试验结果
Table 1 Physiological biochemical characteristics of strain N-17

指标Index结果Result指标Index结果Result麦芽糖发酵Maltosefermentation-葡萄糖苷水解酶Grapeglycosidestest+乳糖发酵Lactosefermentation-蛋白水解酶Proteolyticenzymetest+蔗糖发酵Sucrosefermentation-半乳糖苷酶Glucanasetest+甘露糖发酵Mannosefermentation+柠檬酸盐试验Citrateutilizationtest+阿拉伯糖发酵Arabiasugarfermentation+反硝化试验Denitrificationtest+果糖发酵Fructosefermentation+甲基红试验Methylredtest-葡萄糖发酵Glucosefermentation+硫化氢试验hydrogensulfideproductiontest-山梨醇发酵Sorbitolfermentation+明胶液化试验Gelatinliquefactiontests-甘露醇发酵Mannitolfermentation+V⁃P试验V⁃Ptest+脲酶试验Ureasetest+吲哚试验Indoletest+
+表示阳性,-表示阴性。
+indicated positive;-indicated negative.

图1 不同重金属对菌株N-17的最低抑菌浓度Fig.1 Minimum inhibitory concentration of N-17 strain on 6 kinds of heavy metals
菌株N-17在Ashby无氮培养基上培养48 h即可长出肉眼可见、明显的菌落,其固氮酶活性高达216.83 nmol C2H4·mL-1·h-1。
2.4 菌株N-17产铁载体的能力
在CAS检测平板上,N-17菌株菌落周围可产生较大的黄色水解圈(图2)。定量分析结果表明,其铁载体表达量高达83.4%。
2.5 菌株N-17的16S rDNA序列及系统发育分析
菌株N-17的16S rDNA序列扩增长度为1.4 kb。将测序得到的序列进行Blast序列分析和同源性比较,并将其与同源性最高的9株细菌的16S rDNA全序列构建系统发育树(图3)。综合形态学、生理生化试验,以及分子鉴定结果,可初步判定该菌株为伯克氏菌属。
2.6 菌株N-17对镉的活化能力

图2 菌株N-17产铁载体的情况Fig.2 Detection of siderophore produced by strain N-17

图3 菌株N-17的16S rDNA序列系统发育树Fig.3 Phylogenetic tree based on 16S rDNA sequence of strain N-17
从表2可以看出,未接种N-17对照处理的培养液pH为7.25,接种菌株N-17的培养液pH为6.10,降低了1.15个单位。与不接菌对照相比,接种N-17菌株的培养液中有效镉含量增加了13.9倍。
与对照相比,接种菌株N-17后,土壤中可交换态Cd含量增加30.9%,碳酸盐结合态Cd含量增加62.6%,铁锰结合态Cd含量降低21.1%,残渣态Cd含量降低46.0%,有机结合态Cd含量无明显变化(表3)。由此可见,菌株N-17有利于土壤中的铁锰结合态和残渣态Cd向更易被植物吸收的可交换态和碳酸盐结合态转化。
表2 菌株N-17对沉淀态镉的活化作用
Table 2 Activation of Cd by strain N-17 in medium

处理Treatment培养液上清中的镉浓度Cdconcentrationinsupernatantofculturesolution/(mg·L-1)培养液pHpHofculturesolutionN⁃1798 6±0 86 10±0 26对照Control6 6±0 17 25±0 13
表3 菌株N-17处理对土壤中镉存在形态的影响
Table 3 Effects of N-17 treatments on cadmium speciation in soils (mg·kg-1)

2.7 菌株N-17对印度芥菜镉吸收的影响
由表4可以看出,菌株N-17处理下印度芥菜生物量较对照提高了9.41%,株高增加了20.2%,且差异显著(P<0.05)。这可能是因为接种微生物后,活化了土壤矿物中的磷、钾等营养元素,促进了植物的生长。
与对照相比,接种菌株N-17后,印度芥菜地上部和地下部镉含量分别比对照提高了49%和67%,整株印度芥菜的镉积累量比对照增加55%,且差异均达显著水平(P<0.05)(表5)。
表4 菌株N-17处理对印度芥菜生长发育的影响
Table 4 Effects of N-17 treatment on growth ofBrassicajuncea
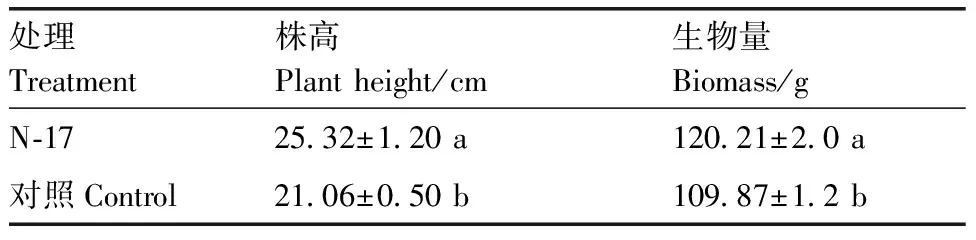
处理Treatment株高Plantheight/cm生物量Biomass/gN⁃1725 32±1 20a120 21±2 0a对照Control21 06±0 50b109 87±1 2b
同列数据后无相同小写字母的表示差异显著(P<0.05)。下同。
Data followed by no same letters indicated significant difference atP<0.05. The same as below.
表5 菌株N-17处理对印度芥菜镉吸收量的影响
Table 5 Effects of N-17 treatment on cadmium contents ofBrassicajuncea

处理Treatment地上部镉含量Cdcontentinabovegroundpart/(mg·kg-1)地下部镉含量Cdcontentinundergroundpart/(mg·kg-1)整株镉积累量Cdaccumulationamountinwholeplant/(mg·kg-1)N⁃173 52±0 01a1 87±0 30a5 39±0 04a对照Control2 36±0 01b1 12±0 06b3 48±0 07b
3 讨论
植物修复技术作为一种生物修复技术,因其原位、经济、绿色等优点,越来越受到重金属污染土壤修复领域的关注。土壤中微生物种类多,繁殖快,比表面积大,代谢活动旺盛,对土壤微生态环境具有重要影响。杨卓等[16]以印度芥菜作为超富集植物,研究了巨大芽孢杆菌和胶质芽孢杆菌的混合微生物制剂对植物修复重金属污染土壤的作用。结果表明,混合微生物制剂可以促进植物的生长,增强印度芥菜对重金属的吸收,大幅提高植物修复效率,可使印度芥菜对外源添加的Cd、Pb和Zn的提取量分别提高1.18、1.54和0.85倍。
针对当前耕地重金属污染的长期性和复杂性,以及现有修复措施的局限性,本研究从镉污染的稻田土壤中筛选到1株兼具活化碳酸镉、分泌铁载体和固氮能力的镉耐性菌株N-17,结合菌体形态、生理生化及16S rDNA分析,该菌株初步鉴定为伯克氏菌属。将该菌株与印度芥菜联合开展土壤Cd污染修复。盆栽试验结果表明,菌株N-17不仅促进了印度芥菜的生长,还促进了其地上部和地下部对镉的积累,可使印度芥菜整株的镉积累量增加55%。
细菌铁载体(siderophore)是由细菌分泌的一种对Fe3+具有高度特异性结合能力的小分子蛋白质,微生物分泌的铁载体可在植物根际复杂的土壤环境中,通过协同作用促进植物对土壤中矿质营养元素的吸收(如铁、磷和钾等元素),增加土壤中重金属镉的可溶出性。本试验所分离的N-17菌株具有分泌植物铁载体的能力,这无疑有助于印度芥菜从土壤中富集更多的镉。试验显示,菌株N-17可降低培养基的pH值,这可能是因为其代谢产物中含有一定量的易降解的低分子有机酸,如柠檬酸、果酸、丙二酸、酒石酸等,这些酸性物质释放到土壤中,亦具有活化土壤中重金属镉的能力。这些代谢产物还可通过络合、氧化还原等作用,改变土壤中重金属镉的存在形态,从而提高重金属的生物可利用性。本试验结果显示,接种菌株N-17可使土壤中的铁锰结合态和残渣态Cd向更易被植物吸收的可交换态和碳酸盐结合态转化。此外,N-17菌株还具有显著的固氮活性,印度芥菜生物量的增加也可能与该菌株的固氮活性有关。
[1] 杨卓, 陈婧, 李术娜. 土壤中产酸菌的筛选及其对重金属生物有效性影响[J]. 环境科学与技术, 2014, 37(12):78-84. YANG Z, CHEN J, LI S N. Screening of organic acids producing microbes and their effects on the phytoremediation of soils contaminated with heavy metals[J].EnvironmentalScience&Technology, 2014, 37(12):78-84. (in Chinese with English abstract)
[2] 林凡华, 陈海博, 白军. 土壤环境中重金属污染危害的研究[J]. 环境科学与管理, 2007, 32(7):74-76. LIN F H, CHEN H B, BAI J. In soil environment heavy metal pollution harm research[J].EnvironmentalScienceandManagement, 2007, 32(7): 74-76. (in Chinese with English abstract)
[3] 刘家女, 王文静. 微生物促进植物修复重金属污染土壤机制研究进展[J]. 安全与环境学报, 2016, 16(5): 290-297. ZHANG J N, WANG W J. Research progress on microbial promoting mechanism of phytoremediation of heavy metal contaminated soil[J].JournalofSafetyandEnvironment, 2016, 16(5): 290-297. (in Chinese with English abstract)
[4] CAMESELLE C, CHIRAKKARA R A, REDDY K R. Electrokinetic-enhanced phytoremediation of soils: status and opportunities[J].Chemosphere, 2013, 93(4): 626-636.
[5] 芦小军, 李博文, 杨卓, 等. 微生物对土壤Cd Pb和Zn生物有效性的影响研究[J]. 农业环境科学学报, 2010, 29(7): 1315-1319. LU X J, LI B W, YANG Z, et al. Effects of microorganisms on the bioavailability of cadmium, lead and zinc in soil[J].JournalofAgro-EnvironmentScience, 2010, 29(7): 1315-1319. (in Chinese with English abstract)
[6] 王京文, 李丹, 柳俊, 等. 耐镉菌株对土壤镉形态及土壤微生物群落结构的影响[J]. 农业环境科学学报, 2015, 34(9):1693-1699. WANG J W, LI D, LIU J, et al. Effects of cadmium tolerant bacteria on soil cadmium forms and microbial community structure[J].JournalofAgro-EnvironmentScience, 2015, 34(9): 1693-1699. (in Chinese with English abstract)
[7] 郭照辉, 单世平, 张德元, 等. 1株高耐镉菌株的分离与鉴定及16S rDNA序列分析[J]. 湖南农业大学学报(自然科学版),2014, 40(2): 207-210. GUO Z H, SHAN S P, ZHANG D Y, et al. Isolation, identification and 16S rDNA sequences analysis of a high Cd-resistance bacterial strain[J].JournalofHunanAgriculturalUniversity(NaturalSciences), 2014, 40(2): 207-210. (in Chinese with English abstract)
[8] HAN F, SHAN X, ZHANG S, et al. Enhanced cadmium accumulation in maize roots-the impact of organic acids[J].PlantandSoil, 2006, 289(1):355-368.
[9] DIMKPA C, SVATOA, MERTEN D, et al. Hydroxamate siderophores produced byStreptomycesacidiscabiesE13 bind nickel and promote growth in cowpea (VignaunguiculataL.) under nickel stress[J].CanadianJournalofMicrobiology, 2008, 54(3): 163-172.
[10] 吴秉奇, 刘淑杰, 张淼, 等. 接种耐镉细菌对青葙吸收积累土壤中镉的影响[J]. 生态学杂志, 2014, 33(12): 3409-3415. WU B Q, LIU S J, ZHANG M, et al. Effect of Cd-tolerance bacterium inoculation on Cd uptake in soil byCelosiaargentea[J].ChineseJournalofEcology, 2014, 33(12): 3409-3415. (in Chinese with English abstract)
[11] XIE G H, CAI M Y, TAO G C, et al. Cultivable heterotrophic N2-fixing bacterial diversity in rice fields in the Yangtze River Plain[J].BiologyandFertilityofSoils, 2003, 37(1): 29-38.
[12] 陈绍兴, 赵翔, 沈萍, 等. 高灵敏假单胞菌铁载体的平板检测方法[J]. 微生物学通报, 2006, 33(3): 122-127. CHEN S X, ZHAO X, SHEN P, et al. High-sensitive detection method for siderophores fromPseudomonas[J].Microbiology, 2006, 33(3): 122-127. (in Chinese with English abstract)
[13] 潘园园, 陈雯莉, 黄巧云. 一株抗重金属铜镉细菌的分离、鉴定及其16S rDNA的序列分析[J]. 微生物学通报, 2005, 32(3):68-72. PAN Y Y, CHEN W L, HUANG Q Y. Isolation, identification and 16S rDNA sequences analysis of a bacterial strain resistant to copper and cadmium[J].Microbiology, 2005, 32(3): 68-72. (in Chinese with English abstract)
[14] 奥斯伯 F, 布伦特 R, 金斯敦 R E, 等. 精编分子生物学实验指南[M]. 金由辛, 译. 北京: 科学出版社, 2001: 16-34.
[15] ALTSCHUL S F, KOONIN E V. Iterated profile searches with PSI-BLAST-a tool for discovery in protein databases[J].TrendsinBiochemicalSciences, 1998, 23(11): 444-447.
[16] 杨卓, 王占利, 李博文, 等. 微生物对植物修复重金属污染土壤的促进效果[J]. 应用生态学报, 2009, 20(8):2025-2031. YANG Z, WANG Z L, LI B W, et al. Promotion effects of microorganisms on phytoremediation of heavy metals-contaminated soil[J].ChineseJournalofAppliedEcology, 2009, 20(8): 2025-2031. (in Chinese with English abstract)
(责任编辑 高 峻)
Isolation, identification of a Cd-resistant strain N-17 and its potential in enhancing cadmium accumulation byBrassicajuncea
DU Dongxia, DU Yu, XU Jun, YIN Hongmei, HE Yuelin*
(HunanAcademyofMicrobiology,Changsha410009,China)
A Cd-resistant strain N-17, with siderophore-producing, nitrogen-fixing and CdCO3-solubilizing capacity, was isolated from paddy soil with Cd pollution. Combined with the colony morphology, physiological and biochemical characteristics and 16S rDNA sequence analysis, N-17 was identified asBurkholderiasp. A pot experiment was done to investigate the effect of N-17 on phytoremediation of Cd polluted soil byBrassicajuncea. It was shown that this strain could significantly increase the content of exchangeable cadmium in contaminated soil. Compared with control, the biomass and plant height ofBrassicajunceainoculated with N-17 was increased by 9.41% and 20.2%, respectively. The cadmium content in aboveground and root ofBrassicajunceainoculated with N-17 was increased by 49% and 67%, respectively.
siderophore; nitrogen-fixing capacity;Burkholderiasp.; phytoremediation
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.05.18
2017-01-09
基金专项:湖南省自然科学基金项目 (13JJ2035);农业部、财政部“长株潭”耕地重金属污染修复及农作物种植结构调整子项目(农办财函〔2016〕6号)
杜东霞(1980—),女,山东荷泽人,硕士,助理研究员,主要从事农牧废弃物处理及农田土壤污染防控等方面的研究。E-mail: xiaxia414@126.com
*通信作者,贺月林,E-mail: 719641546@qq.com
X172
A
1004-1524(2017)05-0812-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(5): 812-817
杜东霞,杜宇,许隽,等. 耐镉菌株N-17的分离、鉴定及其强化印度芥菜富集土壤镉的潜力[J]. 浙江农业学报,2017,29(5): 812-817.
