CD4+T细胞中IL-18激活的NF-κB信号通路与PBC发病机制的相关性研究*
2017-06-05赵二川李红梅任智晶何宇晴王明珠叶震旋周雯婧
赵二川,李红梅,任智晶,何宇晴,王明珠,叶震旋,周雯婧,张 华△
(1.贵州医科大学临检教研室,贵阳 550004;2.贵州省人民医院检验科,贵阳 550002;3.贵阳护理职业学院检验系,贵阳 550081)
CD4+T细胞中IL-18激活的NF-κB信号通路与PBC发病机制的相关性研究*
赵二川1,李红梅2,任智晶2,何宇晴2,王明珠3,叶震旋2,周雯婧2,张 华2△
(1.贵州医科大学临检教研室,贵阳 550004;2.贵州省人民医院检验科,贵阳 550002;3.贵阳护理职业学院检验系,贵阳 550081)
目的 探讨白细胞介素(IL)-18及其活化的CD4+T细胞中核转录因子kappa B(NF-κB)信号通路与原发性胆汁性肝硬化(PBC)发病机制的相关性。方法 采用荧光定量PCR、酶联免疫吸附试验(ELISA)、流式细胞术、免疫磁珠分选及细胞培养、Western bolt等方法,分别检测贵州省人民医院32例PBC患者(PBC组)及32名健康人(健康对照组)外周血单个核细胞IL-18 mRNA、血浆IL-18、CD4+T细胞表面IL-18Rα、CD4+T细胞增殖率及其NF-κB信号通路中IκBα及NF-κB p65蛋白。结果 PBC组血浆中IL-18水平明显高于健康对照组(P<0.05);PBC组IL-18 mRNA的相对表达量较健康对照组差异有统计学意义(P<0.05)。PBC组表达IL-18R的CD4+T细胞百分率高于健康对照组(P<0.05)。经IL-18刺激PBC组CD4+T细胞增殖率明显高于健康对照组(P<0.01)。给予IL-18刺激后,各组中IκBα蛋白相对表达量相均有所下降、NF-κB p65蛋白相对表达量均有所上调,且PBC组更加明显(P<0.01)。结论 IL-18通过激活CD4+T细胞中NF-κB信号通路参与PBC的发病。
肝硬化,胆汁性;T淋巴细胞;抗原,CD4;白细胞介素18;原发性胆汁性肝硬化;NF-κB信号通路
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是自身免疫性肝病(autoimmune liver diseases,AILD)中最常见的一种,以肝脏门脉周围淋巴细胞浸润、胆管上皮细胞特异性损伤及血清中出现高滴度抗线粒体抗体(anti-mitochondrial antibody,AMA)为特征。其病因及发病机制尚不完全清楚,可能与遗传易感性及环境等因素有关[1]。熊去氧胆酸(ursodeoxycholic acid,UDCA)是惟一被美国肝病学会、食品药品监督管理局(FDA)批准的用以治疗PBC的药物,可以延长疾病早期患者的生存期,但仍有约40%的患者对其应答欠佳[2],最终需要肝移植。白细胞介素(IL)-18是一种来源于单核巨噬细胞的细胞因子,为IL-1家族成员,通过与IL-18受体(IL-18R)结合发挥其生物学功能[3],IL-18Rα亚单位在应答中起关键作用。研究表明,IL-18参与系统性红斑狼疮、类风湿性关节炎、原发性干燥综合征等自身免疫病的发病,但IL-18与PBC发病机制的研究国内尚鲜见报道[4-5]。IL-18在体内可激活多条细胞信号转导途径,核转录因子kappa B(NF-κB)信号通路就是其中之一。NF-κB信号通路被报道证实与多种自身免疫病的发病机制相关,但其是否与PBC的发病机制有关联目前暂未见报道。本课题拟通过检测PBC患者外周血IL-18相关指标,并通过检测IL-18刺激PBC患者CD4+T细胞的增殖变化及NF-κB信号通路的激活状态,探讨IL-18介导的免疫炎症反应及其相关NF-κB信号通路在PBC发病中的作用。
1 资料与方法
1.1 一般资料 选择2014年11月至2016年3月贵州省人民医院门诊及住院PBC患者32例为PBC组,其中男9例,女23例,符合美国肝病学会(AASLD)于2009年推荐的诊断标准[6]。选择2014年11月至2016年3月期间该院体检健康人32例为健康对照组,其中男8例,女24例。年龄、性别与PBC组相匹配。排除标准:肝内外局灶性病变或梗阻,原发性硬化性胆管炎(PSC)或自身免疫性肝炎(AIH),病毒性、酒精性、药物性或妊娠相关性肝病,合并其他自身免疫性、系统性疾病致肝脏受累等疾病。所有患者均知情同意。
1.2 材料与试剂 逆转录试剂盒及Tiangen SYBR GreenⅠ染料试剂盒购自北京天根公司;PCR引物由上海生工合成;Anti-Human CD4-FITC购自美国BD公司;IL-18Rα及IgG1κ抗体购自eBsicence公司;IL-18 酶联免疫吸附试验(ELISA)试剂盒购自联科生物技术有限公司;抗人CD4T细胞磁珠、磁珠分选(MACS)分选柱及缓冲液购自德国Miltenyi Biotec公司;胎牛血清及IL-18重组蛋白购自美国Gibco公司;细胞培养试剂盒(CCK-8) 购自日本Dojindo公司细胞,核蛋白/浆蛋白抽提试剂盒购自上海生物工程公司;Tubulin抗体购自江苏碧云天公司;兔抗人多克隆IkBa蛋白抗体及鼠抗人NF-κB p65单克隆抗体购自美国Santa Cruz公司。
1.3 方法
1.3.1 收集外周血血浆及单个核细胞 取患者乙二胺四乙酸(EDTA)抗凝外周血2 mL,3 500 r/min离心5 min,每管500 μL,收集两管离心分离的血浆;其余全血采用人外周血淋巴细胞分离液,并用Ficoll法分离外周血单个核细胞(PBMC)。
1.3.2 荧光定量PCR检测IL-18 mRNA相对表达量 采用Trizol法提取细胞RNA,紫外分光光度计检测其纯度及浓度,取1 μg逆转录为cDNA进行PCR反应。根据GeneBank中人IL-18序列(Gene ID:3606)设计引物,IL-18(153 bp):上游引物5′-TCA AGA CCA GCC TGA CCA ACA T-3′;下游引物5′-GCT CAC CAC AAC CTC TAC CTC C-3′。以β-actin作为内参,β-actin(185 bp):上游引物5′-GCC AAC ACA GTG CTG TCT-3′;下游引物5′-CAC ATC TGC TGG AAG GTG-3′。采用SYBR Green染料,通过2-ΔΔCT法分析IL-18 mRNA相对表达量。每个样本做3个复孔,扩增条件:95 ℃ 15 min;95 ℃ 10 s,60 ℃ 30 s,40 cycle。
1.3.3 流式细胞术检测IL-18R 每份标本设置同型对照管和检测管,均加入乙二胺四乙酸二钾(EDTA-K2)抗凝外周静脉血50.0 μL;两管同时加入CD4-FITC抗体5.0 μL,漩涡混合器充分混匀,室温避光孵育15 min;两管同时加入红细胞裂解液1 000.0 μL,充分混匀,室温避光孵育10 min,至全血透亮;两管均加入磷酸盐缓冲液(PBS)1 000.0 μL,充分混匀,1 000 r/min离心5 min,弃去上清液,重复本次操作1次。检测管加入IL-18Rα抗体5.0 μL,同型对照管加入IgG1κ抗体2.5 μL,充分混匀,室温避光孵育15 min。两管均加入PBS 1 mL,充分混匀,1 000 r/min离心5 min,弃去上清液,重复本次操作1次。弃去上清液,加入PBS 2 mL,充分混匀,上机检测。
1.3.4 ELISA法检测血浆IL-18 严格按照IL-18 ELISA试剂盒说明书进行检测,酶标仪450 nm/630 nm波长测定光密度(OD)值。
1.3.5 CD4+T细胞分选、培养及增殖试验 分离出PBMC后,利用人工磁性分选方法及抗人CD4+T细胞磁珠进一步分选出人外周血CD4+T细胞,并通过流式细胞术检测细胞分选纯度。以细胞数1×105/孔接种于96孔板,每组设3个复孔,每孔100 μL。设置空白组:不含细胞的RPMI 1640培养液+PHA(5.00 μg/mL)+IL-2(0.01 μg/mL);对照组:含有细胞的RPMI 1640培养液+PHA(5.00 μg/mL)+IL-2(0.01 μg/mL);试验组:含有细胞的RPMI 1640培养液+PHA(5.00 μg/mL)+IL-2(0.01 μg/mL)+IL-18(100 ng/mL)进行细胞增殖,试验组在加入IL-18前,37 ℃,5%CO2预培养1 d;加入IL-18后,37 ℃,5%CO2培养3 d;其余组相同条件下培养4 d,加入CCK-8试剂孵育4 h后用酶标仪检测各组OD值。
1.3.6 Western blot检测 按上1.3.5所示进行分组细胞培养,试验组在加入IL-18前,37 ℃,5%CO2预培养1 d;试验组加入IL-18后,37 ℃,5%CO2培养30 min,收集各组细胞。以核蛋白/浆蛋白抽提试剂盒分别提取细胞胞质蛋白及细胞核蛋白,以二喹啉甲酸法(BCA)蛋白浓度测定试剂盒(增强型)检测蛋白浓度,每个样本选取等量蛋白(35 μg),依次进行电泳、转膜、封闭、抗体孵育等步骤,最终利用电化学发光(ECL)发光液显色,采用Image J软件对图像进行分析,检测IκBα和NF-κB p65蛋白表达情况。

2 结 果
2.1 IL-18及IL-18 mRNA的检测结果 PBC组血浆中IL-18的水平明显高于健康对照组(P<0.05);PBC组IL-18 mRNA的相对表达量较健康对照组比较差异有统计学意义(P<0.05),见图1A~B。
2.2 CD4+T细胞纯度及百分率并行细胞计数的结果 PBC组表达IL-18Rα的CD4+T细胞百分率高于健康对照组(P<0.05,图1C)。经流式细胞术检测,可以看出经磁珠分选后的细胞纯度高且分选完全(图2)。经磁珠分选后细胞计数,1 mL全血中CD4+T细胞计数,PBC组中的CD4+T细胞量与健康对照组相比明显升高(P<0.05),见图1D。

A:两组血浆中IL-18表达水平;B:两组PBMC中IL-18 mRNA的表达情况;C:表达IL-18Rα的CD4+T细胞百分率;D:磁珠分选后,1 mL全血中CD4+T细胞计数。
图1 两组IL-18和CD4+细胞检测结果

A:磁珠分选前PBMC中CD4+T细胞百分数;B:磁珠分选后细胞滤液中CD4+T细胞百分数;C:磁珠分选CD4+T细胞纯度。
图2 流式细胞术检测结果

A:IL-18刺激前PBC组CD4+T 细胞;B:IL-18刺激后PBC组CD4+T 细胞。
图3 镜下IL-18刺激前后CD4+T细胞的增殖(×200)
2.3 CD4+T细胞增殖率 磁珠分选并培养CD4+T细胞,经IL-18刺激后PBC组CD4+T细胞均被刺激增殖,PBC组增殖率明显高于健康对照组,差异有统计学意义(P<0.01),见表1、图3。
2.4 Western blot检测IκBα、NF-κB p65蛋白表达水平 未给予IL-18刺激时,PBC组IκBα蛋白表达量明显低于健康对照组,NF-κB p65蛋白表达量明显高于健康对照组(P<0.01)。给予IL-18刺激后,各组中IκBα蛋白相对表达量相均有所下降、NF-κB p65蛋白相对表达量均有所上调,且PBC组更加明显(P<0.01),见表2,图4。

表1 IL-18对CD4+T细胞增殖的影响
IL-18(-):未经IL-18刺激;IL-18(+):经IL-18刺激后;a:P<0.01,与健康对照组比较。

表2 各组蛋白经IL-18刺激前后表达相对灰度值
IL-18(-):未经IL-18刺激;IL-18(+):经IL-18刺激后;a:P<0.05,与健康对照组比较。
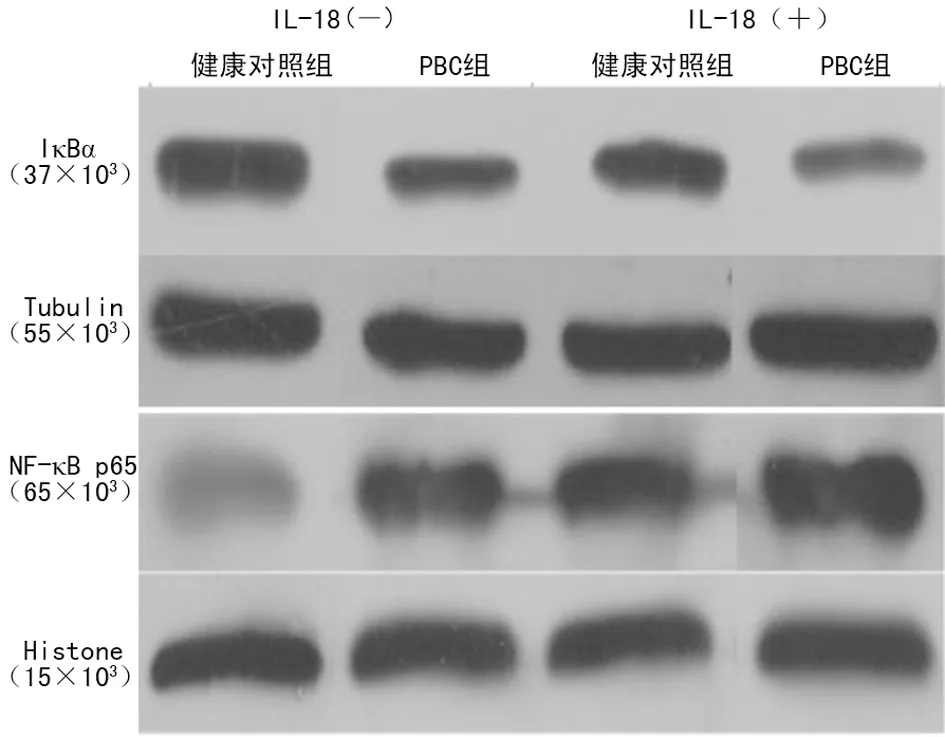
图4 两组Western blot条带
3 讨 论
PBC是一种以肝内小胆管渐进性破坏导致慢性胆汁淤积、汇管区炎症、纤维化并可能导致肝硬化最终发展为肝衰竭为特征的AID[7]。其可能是环境因素与遗传因素相互作用的结果[1,8]。UDCA作为唯一被美国FDA批准的用以治疗PBC的药物可以防止门脉高压、食管静脉曲张并延迟需要肝移植的时间[9],对于处于第1或第2阶段的患者,经UDCA治疗,其生存率与年龄相一致的健康者相接近[10],但并非对所有的患者都有效[11],最终需要肝移植。需要指出的是,经国内外专家取得共识,如经早期诊断及规范化治疗,大部分患者不一定会发展至肝硬化,然而“肝硬化”的名字会给患者在工作及生活上带来较大精神压力,建议将“原发性胆汁性肝硬化”更名为“原发性胆汁性胆管炎”[12]。
本研究分别检测了PBC组PBMC中IL-18 mRNA相对表达量、表达IL-18Rα的CD4+T细胞百分率及血浆中IL-18水平,结果显示其各项指标表达水平较健康对照组均明显升高,提示IL-18与PBC的发病相关且其可能通过CD4+T细胞介导PBC的发病。IL-18是1995年发现的具有诱导干扰素γ(IFN-γ)高水平表达作用的细胞因子,其可通过多种途径促进Th1型免疫反应,如诱导Th1细胞和NK细胞产生IFN-γ,与IL-12具有协同作用,诱导Th1细胞产生IFN-γ[13-14]。IL-18还可促进新生CD4+T细胞的增殖,并诱导CD4+T细胞极化为Th1细胞,进一步分泌IFN-γ。研究表明,PBC患者血清中的细胞因子以Th1细胞分泌的IL-2、IFN-γ、肿瘤坏死因子α(TNF-α)升高为主,而作为炎性细胞因子的IFN-γ介导的炎症反应是PBC肝脏病理损伤的原因之一。而IL-18能诱导CD4+T细胞增殖、极化为Th1细胞并分泌IFN-γ。因此,IL-18在增强Th1型免疫应答上起着重要调节作用。另据Joshi等[15]的研究,浸润于肝组织汇管区的T淋巴细胞以CD4+T细胞居多,且原位杂交分析PBC患者汇管区表达IFN-γ mRNA明显增加,并总结了PBC肝浸润淋巴细胞中以Th1为主。而有关IL-18在PBC中的研究却很少报道。Yamano等[16]虽然对PBC患者血清中的IL-18做了相关研究,本研究结果与其相符合,但其并没有深入到基因水平,也没有对其相关信号通路进行研究,而本研究恰好弥补了这方面的不足,更加全面。IL-18R可表达于Th1细胞表面而Th2细胞不表达,由α、β两个亚单位组成。研究报道,IL-18R的α-亚单位缺失的小鼠不能与IL-18产生反应,表明受体α-亚单位在应答反应中起关键作用[17-18]。结合PBC患者CD4+T细胞中以Th1型细胞占主导作用的免疫学特点及IL-18在T细胞免疫中的生物学作用,提示IL-18与CD4+T细胞表面IL-18Rα结合,从而发挥其增殖T细胞功能并促进其极化为Th1细胞,介导Th1型细胞免疫,从而攻击胆管上皮细胞发生炎症坏死,并导致肝内胆汁淤积,造成肝脏的病理损伤。
在细胞增殖实验中,运用免疫磁珠分选法对外周血PBMC中的CD4+T细胞进行分离,用流式细胞术对分选后的细胞进行纯度测定,结果显示磁珠分选的细胞纯度高并且分选完全,为后续实验奠定基础。运用CCK-8法进行预实验时,在未添加IL-2和植物血凝素(PHA)的情况下,细胞不仅不增殖而且存活率低、病死率高,在细胞培养基内加入PHA及IL-2可有效促进细胞的增殖、分化。使用PHA和IL-2诱导T淋巴细胞增殖是科研实验中最常用的免疫学方法。目前研究表明,IL-2信号转导依靠Janus激酶-信号转导子和转录激活子(JAK-STAT)信号转导途径。IL-2与其受体结合后,通过活化蛋白酪氨酸激酶JAK1及JAK3激活信号转导及转录激活因子STAT5,活化的STAT5进入细胞核后可促使细胞进入分裂周期[19]。IL-2信号转导途径与本实验研究IL-18激活CD4+T细胞NF-κB信号途径并不一致,未对本实验造成干扰。以IL-18重组蛋白对经IL-2及PHA作用后的CD4+T细胞进行体外刺激实验,结果表明,相对于未经IL-18刺激而言,PBC组与健康对照组CD4+T细胞均增殖,提示IL-18可以促进CD4+T细胞的增殖。PBC组增殖更为明显,且前期实验证实PBC患者外周血中表达IL-18Rα的CD4+T细胞增多,进一步证实PBC患者外周血中存在大量增殖能力强、对IL-18刺激敏感度高的CD4+T细胞。
IL-18可以通过NF-κB通路、JAK/STAT通路、C-Jun氨基末端激酶(JNK)通路等多条信号转导通路发挥其促炎作用。其中NF-κB是机体内重要的核转录因子,参与多种生理病理过程,由p50和p65两个多肽链单位组成异源二聚体,其中p65是抑制蛋白IκB的结合部位,参与转录的起始调节。在细胞的细胞质中,p65与IκB稳定结合,被外来因素刺激后,IκB磷酸化降解,NF-κB随即被活化进入细胞核内。IκB家族为NF-κB抑制蛋白,IκBα作为IκB家族9个成员中最为经典的成员[20],在NF-κB活化过程中是作用最强的负反馈因子。静息状态下,其能够与NF-κB p65稳定结合,接受刺激冲动时能快速活化与之解离,故IκBα是研究NF-κB信号通路激活状态的最佳指标。因此,本试验选择与IκB可以稳定结合的NF-κB p65及IκBα作为NF-κB信号通路是否活化的检测指标。对未经IL-18刺激的各研究组细胞质蛋白IκBα和核蛋白NF-κB p65进行Western blot检测,结果显示PBC组细胞质蛋白IκBα明显低于健康组、核蛋白NF-κB p65明显高于健康组,提示PBC患者CD4+T细胞中NF-κB信号通路处于相对较高的激活状态。外源性给予IL-18刺激后,PBC组CD4+T细胞胞质蛋白IκBα表达进一步降低,胞核蛋白NF-κB p65表达进一步增高,证实在PBC患者CD4+T细胞中NF-κB信号通路可以被IL-18高度激活。因此,本研究推测在PBC患者体内,由于IL-18的增高导致CD4+T细胞中NF-κB信号通路的高度激活,产生大量炎性因子,这些因子共同作用引起肝内胆管上皮细胞的损伤,肝内胆汁淤积症状逐渐加重,最终引起PBC的发生。
总的来说,本研究进一步证实了IL-18与PBC发病的相关性,并表明其可以通过介导CD4+T细胞的NF-κB信号通路的激活参与PBC的细胞免疫炎症反应,这提示IL-18的干预有可能成为PBC有效治疗新的靶点。介于其发病机制的复杂性且仍有约1/3患者对UDCA应答欠佳而最终需要进行肝移植[21],对PBC研究十分必要,有关其与信号传导通路及天然免疫的关系,需进一步研究。
[1]Corpechot C,Chretien Y,Chazouilleres OA.Demographic,lifestyle,medical and familial factors associated with primary biliary cirrhosis[J].J Hepatol,2010,53(1):162-169.
[2]Carey EJ,Ali AH,Lindor KD.Primary biliary cirrhosis[J].Lancet,2015,386(10003):1565-1575.
[3]Gracie JA,Robertson SE,McInnes IB.Interleukin-18[J].J Leukoc Biol,2003,73(2):213-224.
[4]Nakamura K,Asano Y,Taniguchi TA,et al.Serum levels of interleukin-18-binding protein isoform a:clinical association with inflammation and pulmonary hypertension in systemic sclerosis[J].J Dermatol,2016,43(8):912-918.
[5]Kuwano K,Maeyama T,Inoshima I,et al.Increased circulating levels of soluble Fas ligand are correlated with disease activity in patients with fibrosing lung diseases[J].Respirology,2002,7(1):15-21.
[6]Carey EJ,Ali AH,Lindor KD.Primary biliary cirrhosis[J].Hepatology,2015,50(1):291-308.
[7]Bowlus CL,Gershwin ME.The diagnosis of primary biliary cirrhosis[J].Autoimmun Rev,2014,13(4/5):441-444.
[8]Juran BD,Lazaridis KN.Environmental factors in primary biliary cirrhosis[J].Semin Liver Dis,2014,34(3):265-272.
[9]Huet PM,Vincent C,Deslaurier JA,et al.Portal hypertension and primary biliary cirrhosis:effect of long-term ursodeoxycholic acid treatment[J].Gastroenterology,2008,135(5):1552-1560.
[10]Corpechot C,Carrat F,Bahr A,et al.The effect of ursodeoxycholic acid therapy on the natural course of primary biliary cirrhosis[J].Gastroenterology,2005,128(2):297-303.
[11]Huet PM,Vincent C,Deslauriers J,et al.Portal hypertension in primary biliary cirrhosis (PBC):a reversible condition? Yes,but not in all UDCA treated patients[J].Hepatol Res,2009,39(10):1032-1038.
[12]Beuers U,Gershwin ME,Gish RG,et al.Changing nomenclature for PBC:From 'cirrhosis' to 'cholangitis'[J].Clin Res Hepatol Gastroenterol,2015,39(5):57-59.
[13]Jacques A,Bleau C,Turbide C,et al.A synergistic interferon-gamma production is induced by mouse hepatitis virus in interleukin-12 (IL-12)/IL-18-activated natural killer cells and modulated by carcinoembryonic antigen-related cell adhesion molecules (CEACAM) 1a receptor[J].Immunology,2009,128 Suppl 1:S551-561.
[14]Pintaric M,Gerner W,Saalmueller A.Synergistic effects of IL-2,IL-12 and IL-18 on cytolytic activity,perforin expression and IFN-gamma production of porcine natural killer cells[J].Vet Immunol Immunopathol,2008,121(1/2):68-82.
[15]Joshi S,Cauch-Dudek K,Wanless IR,et al.Primary biliary cirrhosis with additional features of autoimmune hepatitis:response to therapy with ursodeoxycholic acid[J].Hepatology,2002,35(2):409-413.
[16]Yamano T,Higashi T,Nouso K,et al.Serum interferon-gamma-inducing factor/IL-18 levels in primary biliary cirrhosis[J].Clin Exp Immunol,2000,122(2):227-231.
[17]Debets R,Timans JC,Churakowa T,et al.IL-18 receptors,their role in ligand binding and function:anti-IL-1RAcPL antibody,a potent antagonist of IL-18[J].J Immunol,2000,165(9):4950-4956.
[18]Kinoshita K,Yamagata T,Nozaki Y,et al.Blockade of IL-18 receptor signaling delays the onset of autoimmune disease in MRL-faslpr mice[J].J Immunol,2004,173(8):5312-5318.
[19]Haddad JJ,Saade NE,Safieh-Garabedian B.Interleukin-10 and the regulation of mitogen-activated protein kinases:are these signalling modules targets for the anti-inflammatory action of this cytokine[J].Cell Signal,2003,15(3):255-267.
[20]Manavalan B,Basith S,Choi YM,et al.Structure-function relationship of cytoplasmic and nuclear IkappaB proteins:an in silico analysis[J].PLoS One,2010,5(12):e15782.
[21]Trivedi PJ,Hirschfield GM.Treatment of autoimmune liver disease:current and future therapeutic options[J].Ther Adv Chronic Dis,2013,4(3):119-141.
Correlation analysis of NF-κB signaling pathway activated by IL-18 in CD4+T cells and the pathogenesis of PBC*
ZhaoErchuan1,LiHongmei2,RenZhijing2,HeYuqing2,WangMingzhu3,YeZhenxuan2,ZhouWenjing2,Zhanghua2△
(1.ClinicalLaboratory,GuizhouMedicalUniversityGuiyang,Guizhou550004,China;2.DepartmentofMedicalLaboratory,GuizhouProvincialPeople′sHospital,Guiyang,Guizhou550002,China; 3.DepartmentofMedicalLaboratory,GuiyangNursingVocationalCollege,Guiyang,Guizhou550081,China)
Objective To explore the correlation between NF-κB signaling pathways activated by IL-18 in CD4+T cells and the pathogenesis of PBC.Methods We detected the expression of IL-18 mRNA in PBMCs,IL-18 level in plasma,receptor IL-18R on surface of CD4+T cell,proliferation rate of CD4+T cell and its NF-κB signaling pathway protein IκBα and NF-κB p65 by qRT-PCR,ELISA,flow cytometry,MACS and Western blot on 32 cases of patients with PBC (PBC group) and 32 healthy people (control group) in Guizhou provincial people′s hospital.Results The level of IL-18 in PBC group was significantly higher than that in control group (P<0.05). The relative expression of IL-18 mRNA in PBC group was significantly higher than that in control group (P<0.05). The percentage of CD4+T cells expressing IL-18Rα in PBC group was higher than that in control group (P<0.05). The proliferation rate of CD4+T cells stimulated by IL-18 in PBC group was significantly higher than that in healthy control group (P<0.01). The relative expression levels of NF-κB p65 protein were up-regulated in IL-18,and the expression of IκBα protein in each group was significantly increased,especially in PBC group (P<0.01).Conclusion IL-18 can activate NF-κB signal pathway in CD4+T cells and participate in the pathogenesis of primary biliary cirrhosis.
liver cirrhosis,biliary;T-lymphocytes;antigens,CD4;interleukin-18;primary biliary cirrhosis;nuclear factor-kappa signaling pathway
10.3969/j.issn.1671-8348.2017.14.007
贵州省科学技术厅项目(黔科合LH字[2014]7008号)。 作者简介:赵二川(1989-),在读硕士,主要从事临床检验诊断学方面研究。△
,E-mail:780837482@qq.com。
R446.6
A
1671-8348(2017)14-1892-05
2016-11-26
2017-01-16)
